В основе патогенеза тяжёлого сепсиса и септического шока лежит регионарный тканевой дистресс, вызванный микроциркуляторной дисфункцией и митохондриальной депрессией. Несмотря на восстановление системной гемодинамики и общей доставки кислорода, тканевая гипоксия и сниженная экстракция кислорода сохраняются. Это состояние определяется в настоящее время, как микроциркуляторно-митохондриальный дистресс-синдром (ММДС). Множественные патогенетические факторы, которые наблюдаются при сепсисе, воздействуют на каждый клеточный компонент микроциркуляции, включая эндотелиальные и гладкомышечные клетки, лейкоциты, эритроциты и тканевые клетки. Микрососудистые нарушения приводят к клеточно-респираторному дистрессу и в каскаде патогенетических механизмов к органной недостаточности. Микроциркуляторный дистресс, сохраняющийся более 24 часов, представляется, как независимый фактор неблагоприятного исхода и рассматривается, как водитель патогенетических нарушений, приводящих к органной недостаточности.
Нарушение тканевой экстракции кислорода у больных с сепсисом выявлено более 40 лет назад, но лишь современные исследования рассматривают микроваскулярную дисфункцию, как центральный механизм патофизиологии при сепсисе, приводящей к развитию органных нарушений. Разработка новых методов прямой визуализации микроциркуляторных сосудов, как прижизненная вазомикроскопия, ортогональная поляризационная спектроскопия позволяют исследовать микроциркуляторное русло как в экспериментальных моделях, так и непосредственно у постели больного.
Мириады возможных патогенетических механизмов при сепсисе, приводящих к микроциркуляторной дисфункции, включают: 1) общую тканевую гипоксию; 2) распространённое эндотелиально-клеточное повреждение; 3) активацию коагуляционного каскада и угнетение фибринолиза; 4) микроциркуляторно-митохондриальный дистресс-синдром. Эти факторы как в отдельности, так и в различных сочетаниях, являются определяющими в развитии острой органной дисфункции при сепсисе [1-5].
Эта новая парадигма полиорганной недостаточности (ПОН) определяет микроциркуляторно-митохондриальную дисфункцию, как универсальное звено поражения всех органов и тканей, включая головной мозг, почки, печень, кишечник, когда ПОН не является просто суммой недостаточности различных органов человека, а представляет собой совершенно новый тяжёлый вид патологии с временным преобладанием симптомов той или иной органной недостаточности (рис. 1).
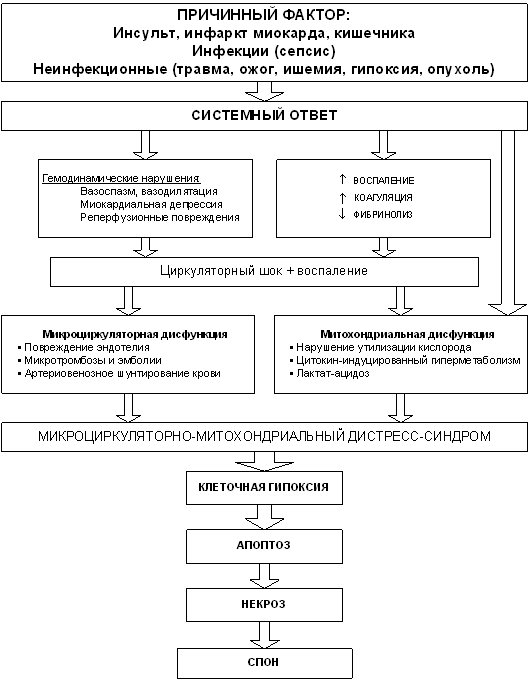
Рис. 1. Схема патогенеза полиорганной дисфункции-недостаточности (Ince C. 2005).
Продолжая цикл публикаций по проблемам сепсиса, коллектив авторов считает своим долгом информировать медицинскую общественность о современных представлениях по данной теме и новых достижениях медицинской науки, включая собственный опыт, в лечении тяжёлого сепсиса и септического шока.
Микроциркуляторная
дисфункция
при сепсисе
Основной функцией микроциркуляторной системы является обеспечение адекватной тканевой оксигенации и клеточного метаболизма путём транспорта кислорода и нутриентов в ткани и обратного транспорта метаболитов, обеспечение иммунной защиты, а также доставки лекарственных препаратов во время болезни.
Микроциркуляторное русло состоит из мелких кровяных сосудов (менее 100 мкм в диаметре), где осуществляется диффузия кислорода в ткани, представляя комплекс из артериол, капилляров и венул. Микроциркуляторный коллектор представляют эндотелиальные, гладкомышечные клетки, эритроциты, лейкоциты, тромбоциты и компоненты плазмы крови. Структура и функции микроциркуляции в различных органах и тканях отличаются, но определяющими характеристиками периферического кровообращения являются кровяное давление, тонус артериол и венул, эластичность эритроцитов, капиллярная проницаемость, коллоидно-онкотическое давление плазмы и вязкость крови.
Регуляторные механизмы, контролирующие микроциркуляторную перфузию, определяются, как миогенные, нейрогуморальные и метаболические (зависящие от концентраций О2, СО2 и Н+). Эта система контроля использует аутокринные и паракринные механизмы для регуляции микроциркуляторного кровотока в зависимости от реальных потребностей тканевых клеток.
Эндотелиальные клетки играют центральную роль в этой системе контроля, откликаясь на гемодинамические, метаболические и другие регулирующие сигналы для управления артериальным гладкомышечным тонусом и капиллярным наполнением. Эндотелиальные межклеточные сигналы передают информацию о состоянии микроциркуляторной гемодинамики в центральные регуляторные системы. Эндотелий контролирует также коагуляцию и иммунную функцию, влияющих на микроциркуляцию.
Повреждение эндотелиальных клеток лежит в основе нарушений микроциркуляторного кровотока. Активация эндотелия циркулирующими воспалительными цитокинами ведёт к повышенной экспрессии эндотелиальных адгезивных молекул, включая р-селектин и внутриклеточные адгезивные молекулы-1 (ICAM-1). Активированные лейкоциты имеют повышенную адгезивную способность к эндотелию, что приводит к нарушению ламинарного кровотока и активации воспаления с высвобождением провоспалительных цитокинов, свободных радикалов, протеаз и других медиаторов воспаления. Повышается продукция оксида азота и нарушается функция свёртывающей системы крови, включая нарушение выделения тромбомодулина и повреждение эндотелиальных рецепторов протеина-С, нарушение сигнальной связи между активирующим протеиназу рецептором-1 и другими механизмами. Повреждение барьерной функции эндотелия с повышением капиллярной проницаемости ведёт к тканевому отёку и нарушению экстракции кислорода вследствие снижения парциального давления кислорода и капиллярно-венозного градиента О2 в результате функционального шунтирования крови.
Взаимосвязь между
общими
гемодинамическими параметрами
и тканевой перфузией
при тяжёлом сепсисе
Шок обычно определяется, как неспособность кардиоваскулярной системы обеспечить эффективную тканевую перфузию, что приводит к респираторно-метаболическому дистрессу паренхиматозных клеток и органной дисфункции.
Септический шок может нарушать эффективную тканевую перфузию вследствие расстройств кровообращения (несмотря на нормальный или повышенный сердечный выброс) в результате микроциркуляторной дисфункции или путём снижения потребления субстратов при дефектах клеточной утилизации кислорода.
При шоках другой этиологии коррекция общих гемодинамических параметров обычно приводит к восстановлению адекватной перфузии и оксигенации тканей, но при септическом шоке регионарные гипоперфузионные нарушения персистируют даже после оптимизации общих гемодинамических и кислород-транспортных параметров.
В клинических условиях признаки гипоперфузии определяются при наличии артериальной гипотензии, тахикардии, олигурии, энцефалопатии, снижения температуры конечностей, исчезновения кожного капиллярного рельефа и метаболического (лактатного) ацидоза.
Артериальное давление само по себе является нечувствительным индикатором тканевой гипоперфузии при сепсисе. В экспериментальных и клинических исследованиях многократно документировано, что локальное перфузионное давление при тяжёлом сепсисе не зависит прямо от системного артериального давления. Степень разобщения между макро- и микроциркуляцией определяет перспективы восстановления адекватной регионарной перфузии при использовании терапевтических стратегий, направленных на поддержание системного артериального давления.
Диагностика шока
при септическом синдроме
Одной из наиболее важных задач при лечении больных с тяжёлым сепсисом является ранняя диагностика нарушений тканевой перфузии. Артериальное давление (АД) не является чувствительным индикатором для проведения агрессивной кардиоваскулярной поддержки, нередко улучшение тканевой перфузии наблюдается при поддержании субоптимального уровня АД. В исследовании Rivers E. et al (2001) установлено, что у пациентов с тяжёлым сепсисом и исходными показателями: САД > 100 мм рт ст и лактат сыворотки >4 ммоль/л наблюдалось существенное повышение летальности по сравнению с пациентами, поступающими с гипотензией (САД < 70 мм рт ст).
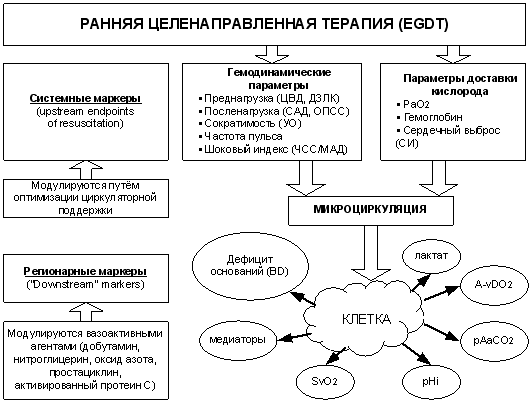
Рис. 2. Системные и регионарные маркеры эффективности EGDT
(Trzeciak S., Rivers E.P., 2005)
Ключевые рекомендации по лечению тяжёлого сепсиса и септического шока включают определение сывороточного лактата для выявления пациентов с нормотензией в состоянии шока (cryptic shock), требующих проведения интенсивной терапии. Лактат не является специфическим маркером анаэробного метаболизма, нарушение микроциркуляции представляется одним из возможных механизмов гиперлактатемии при тяжёлом сепсисе. Выраженное и продолжительное повышение уровня лактата является маркером неблагоприятного исхода и должно побуждать к проведению ранней целенаправленной гемодинамической терапии (Early Goal-directed Therapy – EGDT).
Надёжными маркерами тканевой перфузии и эффективности EGDT являются показатели регионарной капнометрии (гастральный интрамукозный рН, сублингвальное рСО2), сатурация смешанной венозной крови (SvO2). Системные и регионарные маркеры эффективности EGDT представлены на рис. 2.
В 2004 году Spronk P.E. et al. [5] предложили рейтинговую систему для выявления больных в состоянии шока (табл. 1).
Таблица 1. Интегральная клиническая шкала
для определения состояния
шока
(Spronk P.E. et al., 2005)
|
Параметры для оценки |
Баллы |
|
Гемодинамические переменные Частота пульса >100 уд/мин или САД<50 мм рт. ст. |
2 |
|
Периферическое кровообращение «Пятнистая» кожа или tс-tр разница > 5 °С или Pfi<0,3 или сглаженность периферического капиллярного рельефа |
2 |
|
Микрососудистые переменные Повышение тонометрической разницы СО2 или повышение сублингвальной разницы СО2 или нарушение подъязычной микрососудистой перфузии |
1 |
|
Системные маркеры тканевой оксигенации лактат>4ммоль/л или SvO2<60% |
1 |
|
Органная дисфункция диурез <0,5 мл/кг/ч нарушенный ментальный статус |
1 1 |
По мнению авторов, состояние шока имеет место при наличии 2 и более баллов, что требует проведения целенаправленной интенсивной терапии.
Митохондриальная дисфункция
Современные исследования подтверждают, что нарушения клеточного метаболизма вследствие цитопатической гипоксии представляются критическим компонентом в развитии органной дисфункции при сепсисе [2, 4].
Генераторами энергетического запаса организма являются митохондрии, которые запасают внутриклеточную энергию в виде АТФ, окисляют жирные кислоты, деградируют пируват и ацетил-СоА в цикле трикарбоновых кислот. На митохондриях протекают процессы окислительного фосфорилирования и обновления в дыхательной цепи. Для участия в энергетическом обмене мотохондрии обеспечиваются более чем 50 ферментами и ферментными комплексами.
Множественные механизмы в отдельности или в различных сочетаниях способны приводить к развитию цитопатической гипоксии при сепсисе. Они включают следующие: 1) дисфункция пируват-дегидрогеназного комплекса, состоящего из компонентов Е1 (декарбоксилаза-альфа), Е2 (ацетилтрансфераза), Е3 (липоамид-дегидрогеназа), белка Х и кофакторов – тиаминпирофосфата, α-липоевой кислоты, ФАД, НАД и СоА, дефицит которых приводит к снижению образования ацетил-СоА, поступающего в цикл Кребса; 2) угнетение митохондриальных ферментов в цикле трикарбоновых кислот или в цепи транспорта кислорода активными формами кислорода; 3) активация ядерного энзима – поли-АДФ-рибосилполимеразы (PARP), вызывающего истощение никотинамиддинуклеотида (НАД); 4) разобщение окисления и фосфорилирования вследствие нарушения протонного градиента на внутренних мембранах митохондрий.
В экспериментальных и клинических условиях [1-4] установлено, что митохондриальное окислительное фосфорилирование грубо нарушено в условиях эндотоксемии и воспалительного медиатоза и функциональные нарушения коррелируют с ультраструктурными повредждениями клеточных митохондрий.
Положительные ркзультаты после применения активированного протеина С показывают, что митохондриальная дисфункция является лишь одним из механизмов развития ПОН.
Улучшают митохондриальную функцию и тканевое дыхание ингибиторы индуцибельной NO-синтетазы (аминогуанидин), антиоксиданты препятствуют деструкции ядерной ДНК и угнетают активность ядерного энзима PARP, способствуя накоплению НАД и восстановлению аэробного метаболизма. Аналогичное действие оказывают фармакологические агенты, ингибирующие PARP. Продолжаются исследования по разработке новых технологий для предупреждения митохондриальной дисфункции и ПОН.
Терапевтические стратегии
для восстановления микроциркуляции
при сепсисе
Многочисленные экспериментальные и клинические исследования и практический опыт показали, что любой из предложенных методов по восстановлению циркуляции сам по себе недостаточный для обеспечения положительного результата. В настоящее время установлено, что сочетание адекватной инфузионной терапии, использование вазопрессоров для поддержания адекватного уровня АД и дополнительное применение трансфузии эритроцитарной массы, инотропных препаратов и вазодилататоров для обеспечения адекватной общей доставки кислорода является эффективным. Такая комбинированная терапия улучшает микроциркуляцию и органную функцию и повышает выживаемость [6].
Rivers E. et al. разработали протокол ранней целенаправленной терапии (EGDT) и установили, что инфузионная терапия до достижения ЦВД 8-12 мм рт ст, включение вазопрессорных агентов для поддержания САД>65 мм рт ст, измерение сатурации смешанной венозной крови, использование трансфузии эритроцитарной массы и инотропных агентов для обеспечения SvO2>70% снижают летальность при септическом шоке с 46,5% до 30,5% (р=0,009). Включение в протокол EGDT нитроглицерина при САД>90 мм. рт. ст. и добутамина при SvO2<70% (после коррекции ЦВД, САД и гематокрита) снижают микроциркуляторное шунтирование крови и улучшают тканевую оксигенацию.
Клинические исследования эффективности простациклина (PGL2) показали значительное повышение общей доставки и потребления кислорода и гастрального интрамукозного рН, однако, применение простациклина ограничено из-за опасности рецидива артериальной гипотонии.
Ингибиторы индуцибельной NO-синтетазы улучшают ауторегуляторную функцию микроциркуляторного коллектора в эксперименте. Вазопрессин повышает гломерулярное перфузионное давление и усиливает диурез по сравнению с норадреналином, рекомендованным для лечения рефрактерного септического шока.
Модуляция воспалительного ответа имеет важное значение для микроциркуляторной ресусцитации. Доказана эффективность применения низких доз гидрокортизона, протеина С.
Антицитокиновая терапия не рекомендована после проведения ІІІ фазы рандомизированных контролируемых исследований, но современный мета-анализ показал, что эта стратегия может быть полезной для восстановления микроциркуляции и функции эндотелия.
Для коррекции митохондриальной дисфункции чрезвычайно важное значение приобретает стратегия жесткого контроля гликемии и ранняя нутритивная поддержка [7].
Терапевтические стратегии, эффективность которых доказана в мультицентровых контролируемых исследованиях, включены в итоговое международное руководство Surviving Sepsis Campaign for management of severe sepsis and septic shock [8].
Для оптимизации стратегии ранней целенаправленной терапии с целью модуляции ММДС нами предложено включение двух препаратов полифункционального действия – перфторана и реамберина. Возможные механизмы действия и ожидаемые положительные эффекты данных препаратов представлены на рисунке 3.

Рис. 3. Механизмы действия перфторана и реамберина
в стратегии ранней целенаправленной терапии септического шока
Безопасность и эффективность каждого из данных препаратов в отдельности изучена нами ранее [9,10], поэтому совместное их применение представляет интерес, поскольку оба ингридиента имеют направленное воздействие на универсальное звено генерации органной дисфункции – ММДС.
Подробные сведения о перфторане и реамберине и способы их применения широко представлены нами в предыдущих работах [9,10].
Цель данного исследования – определить эффективность и безопасность включения препаратов полифункционального действия перфторана и реамберина в стратегию ранней целенаправленной терапии для модуляции микроциркуляторно-митохондриальной дисфункции у больных с тяжёлым сепсисом и септическим шоком.
Материалы и методы исследования
На базе отделения интенсивной терапии сепсиса клиники анестезиологии и интенсивной терапии Днепропетровской государственной медицинской академии в исследование включены 36 больных с тяжёлым сепсисом и септическим шоком, соответствующих определениям 2001 SCCM / ESICM / ACCP / ATS / SIS International Sepsis Definition Conference [8].
Все больные рандомизированы (1:1) для проведения ранней целенаправленной терапии (РЦТ) согласно ключевым рекомендациям по лечению тяжёлого сепсиса и септического шока [8] – группа 1, (n = 18) и дополнительного включения в схему лечения EGDT перфторана 1,2 мл/кг однократно и реамберина из расчёта 12–14 мл/кг/сутки в течении 3 дней (группа 2, n = 18).
Основные демографические и клинические характеристики больных представлены в табл. 2.
Интегральную оценку тяжести состояния больных после первичного обследования проводили по шкале APACHE II на основе 12 рутинных клинических и биохимических показателей, состояние шока выявляли по шкале Spronk (табл. 1).
Для оценки регионарной тканевой перфузии и оксигенации использовали клинические и лабораторные маркеры:
- Анализ амплитуды плетизмограммы (ΔРОР); максимальные значения (РОРмакс) и минимальные (РОРмин) в миллиметрах определялись в процессе мониторинга пульсоксиметрии (монитор Ютас-300), изменения плетизмограммы после проведения ранней целенаправленной терапии рассчитывали по формуле:
- Температурный градиент (ΔТ) в °С определяли, как разницу между температурой ядра тела и ногтевой фаланги указательного пальца кисти (монитор Ютас-300);
- Гастрально-альвеолярный градиент СО2 в мм рт ст. определяли методом гастральной тонометрии и конечной порции выдыхаемого газа (газоанализатор для СО2 «Сигма Л» );
- Анионную разницу (АР) в моль/л рассчитывали, как градиент между концентрацией Na+ и суммой ионов гидрокарбоната и хлора:
- Концентрации лактата и глюкозы в сыворотке крови определяли на биохимическом анализаторе “Doctor Muller” (Германия).
ΔРОР(%) = 100Ч([РОРмакс-РОРмин]/[РОРмакс+РОРмин)/2];
АР = Na+ -(HCO3-+ CL-);
Таблица 2. Основные демографические и клинические
характеристики больных
|
Показатели |
Группы больных |
|
|
Группа 1 |
Группа 2 |
|
|
Количество больных |
18 |
18 |
|
Возраст больных |
49,3±(21-74) |
48,7 ±(19-72) |
|
Пол, мужчин/женщин |
9/9 |
8/10 |
|
Заболевание |
||
|
Инфекции мягких тканей |
4 |
3 |
|
Абдоминальных сепсис |
6 |
6 |
|
Инфицированный панкреонекроз |
3 |
3 |
|
Политравма с септическими осложнениями |
3 |
3 |
|
Гнойный менингит |
2 |
3 |
|
Тяжесть состояния |
||
|
APACHE II, баллы |
16,8 ±(12-21) |
17,1 ±(12-23) |
|
SOFA, баллы |
2,6 ±(0-4) |
2,7 ±(0-4) |
|
Состояние шока по шкале Spronk, баллы |
6,1 ±(2-8) |
6,3 ±(2-8) |
Для оценки метаболического ответа и митохондриального редокси-статуса определяли динамику концентраций глюкозы в моль/л; лактат-пируватный индекс, как соотношение концентраций лактата и пирувата (ед); дозу инсулина для поддержания уровня гликемии в пределах 4,8-6,1 ммоль/л; активность трансаминаз АлТ и АсТ, α-гидроксибутиратдегидрогеназы (α-HBDH) в ЕД кинетическим методом с реактивами «Нuмаn» на полуавтоматическом биохимическом анализаторе РА:50 Bayer Diagnostics (США). Актуальный расход энергии (АРЭ) определяли методом непрямой калориметрии по потреблению кислорода (VO2).
Концентрацию фибриногена и активность системы протеина С (нормированное отношение, НО) определяли на коагулометре “Amelung KC-4A) (Германия). Концентрацию С-реактивного белка в мг/л определяли с помощью теста “Humatex CRP” фирмы “Human” (Германия).
Конечными гемодинамическими точками для оценки эффективности РЦТ служили: центральное венозное давление (ЦВД) в пределах 8 – 12 мм. рт. ст.; САД e 70 мм. рт. ст., диурезe 0,5 мл/кг/час; SvO2>70%.
Частоту развития органных нарушений через 72 часа регистрировали с использованием шкалы SOFA.
Конечными точками для оценки эффективности проводимого лечения являлись: длительность лечения в ОИТ, дни; летальность, %; выздоровление до 28-го дня болезни, %; наличие признаков персистирующей органной дисфункции, %; восстановление качества жизни до 36-го дня болезни по критериям European quality of life questionnaire (EQ-5D).
Статистическая обработка полученных данных проведена с использованием методов вариационной статистики. Для сравнения частотных характеристик использовали функцию распределения Лапласа.
Результаты и их обсуждение
После проведенной РЦТ в первые 12 часов конечные гемодинамические точки достигнуты в большинстве случаев у больных обеих групп (табл. 3), но существенные различия в средствах обеспечения заданных пунктов заключались в уменьшении потребности вазопрессорной терапии и применение малых доз кортикостероидов, общего объёма инфузионно-трансфузионных средств в группе больных, получавших перфторан и реамберин.
Таблица 3. Результаты достижения конечных точек
ранней целенаправленной терапии (через 12 часов).
|
Показатели |
Группа 1 |
Группа 2 |
|
1) ЦВД 8 – 12 мм. рт. ст., количество больных, % |
16 (88,8) |
12 (66,6) |
|
2) САДe70 мм рт ст, количество больных, % |
15 (83,3) |
17 (94,4) |
|
3) SvO2>70%, количество больных, % |
14 (77,4) |
17 (94,4) |
|
4) Сердечный индекс, л/мин/м2 |
4,32 |
3,66 |
|
5) Доставка кислорода, мл/мин/м2 |
548 |
577 |
|
6) Потребление кислорода, мл/мин/м2 |
158 |
134 |
|
7) Количество больных на ИВЛ, % |
8 (44,4) |
6 (33,3) |
|
8) Продолжающаяся вазопрессорная терапия, количество больных, % |
12 (66,6) |
7 (38,8)* |
|
9) Применение кортикостероидов, количество больных, % |
12 (66,6) |
7 (38,8)* |
|
10) Общий объём инфузионной терапии, мл |
4886 |
3716 |
|
11) Количество трансфузий, % |
6 (33,3) |
5 (27,7) |
|
12) Состояние шока по шкале Spronk, баллы |
3,8 (1-5) |
1,7 (0-3)* |
Примечание: * - р<0,05
Таблица 4. Регионарные маркеры тканевой перфузии
(через 24 часа от начала лечения)
|
Показатели |
Группы больных |
|
|
Группа 1 |
Группа 2 |
|
|
ΔРОР (анализ амплитуды плетизмограммы) |
8,7% |
24,3%* |
|
ΔТ (температурный градиент), С0 |
3,4 ± 0,9 |
2,3 ± 0,7 |
|
Гастрально-альвеолярный градиент СО2, |
5,1 ± 0,7 |
2,2 ± 0,3* |
|
Анионная разница (АР), ммоль/л |
21,3 ± 3,3 |
7,1 ± 1,1* |
|
Лактат крови, ммоль/л |
4,8 ± 1,1 |
1,7 ± 0,8* |
Примечание: * - р<0,05
Несмотря на то, что глобальные маркеры оксигенации, такие как сердечный индекс, DO2, VO2 в контрольной группе приближалась к супранормальным значениям, признаки шока по шкале Spronk сохранялись, о чём свидетельствуют показатели тканевой перфузии и оксигенации (табл. 4), особенно динамика амплитуды плетизмограммы, гастрально-альвеолярный градиент СО2, анионная разница и концентрация лактата в сыворотке крови по сравнению с группой больных, получавших перфторан и реамберин.
Участие данных препаратов в формировании метаболического ответа ассоциировалось с существенным снижением потребности в инсулине для поддержания оптимальных значений гликемии, восстановлении соотношения лактата и пирувата, нормализацией активности маркеров митохондриальеой функции – аминотрансфераз и α-HBDH, существенным снижением актуального расхода энергии до нормометаболического уровня (табл. 5).
Таблица 5. Динамика маркеров метаболического ответа
и митохондриального редокси-статуса
(через 48 часов от начала лечения)
|
Показатели |
Группы больных |
|
|
Группа 1 |
Группа 2 |
|
|
Глюкоза крови, ммоль/л |
4,93 ±0,91 |
6,11 ±0,73 |
|
Дозы инсулина, ЕД/сут |
33,8 ±4,3 |
18,6 ±3,3* |
|
Лактат-пируватный индекс, ед |
16,4 ±2,7 |
9,6 ±1,9* |
|
АлТ, ЕД |
46,8 ±3,1 |
44,6 ±2,9 |
|
АсТ, ЕД |
64,3 ±4,1 |
40,1 ±2,7* |
|
α-гидроксибутиратдегидрогеназа (HBDH), ЕД |
198 ±9,7 |
90,6 ±4,9* |
|
Актуальный расход энергии (АЕЕ), ккал/сут |
1968 ±173 |
1461 ±139* |
Примечание: * - р<0,05
Достоверные различия в концентрации маркеров острофазового ответа печени (табл. 6) фибриногена и С-реактивного белка и одновременное повышение активности системы протеина С у больных в группе 2 указывает на снижение активности воспалительного ответа и восстановление механизмов ауторегуляции гомеостаза, что сопровождалось снижением частоты органных нарушений в исследуемой группе (рис. 4), а также заметным сокращение сроков лечения больных в ОИТ, уменьшением летальности с 22,2% до 16,6% и частоты развития признаков персистирующей органной дисфункции, повышением выживаемости больных с 55,5% до 72,2% (р<0,05) до 28-го дня болезни и улучшением показателей качества жизни (рис. 5).
Таблица 6. Динамика показателей острофазового ответа печени
(через 72 часа от начала лечения)
|
Показатели |
Группы больных |
|
|
Группа 1 |
Группа 2 |
|
|
Фибриноген, г/л |
4,63 ±0,93 |
2,16 ±0,78* |
|
С-реактивный белок, мг/л |
148 ±9,6 |
64 ±6,1* |
|
Активность системы протеина С, н.о. |
0,38 ±0,07 |
0,79 ±0,1* |
Примечание: * - р<0,05
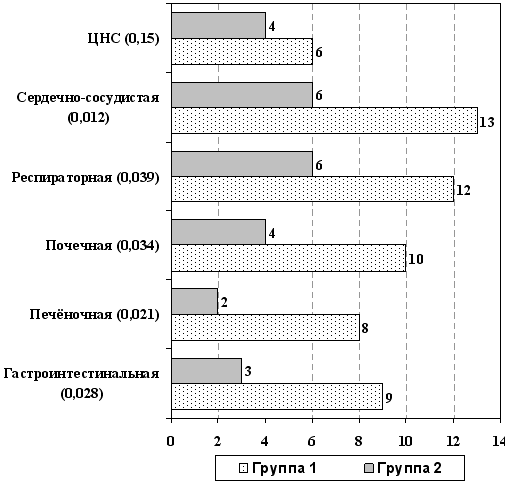
Рис. 4. Частота развития органных нарушений
(через 72 часа от начала лечения)
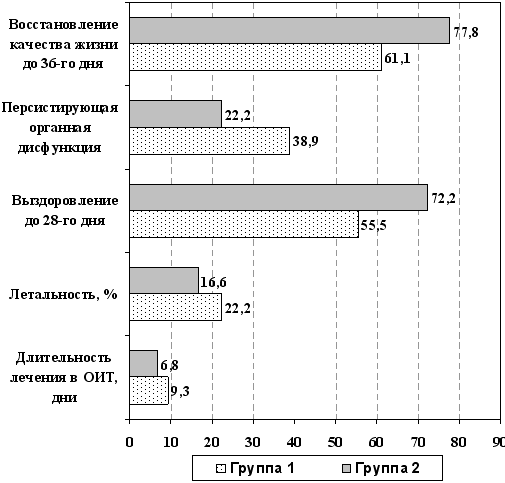
Рис. 5. Оценка эффективности лечения по конечным точкам
Полученные данные свидетельствуют о том, что дополнение РЦТ препаратами полифункционального действия перфтораном и реамберином позволяет повысить качество данной стратегии путём целенаправленного воздействия на ключевые звенья патогенеза сепсиса – микроциркуляторную и митохондриальную дисфункцию.