Источник:
Клиническая медицина, 2012.-N 9.-С.63-68
Санкт-Петербургская государственная
химико-фармацевтическая академия1
Северо-Западный государственный медицинский университет
им. И.И.Мечникова 2
ООО "НТФФ "ПОЛИСАН"3
Антигипоксанты в современной клинической практике
С.В.Оковитый1, Д.С.Суханов2, В.А.Заплутанов3
Гипоксия представляет собой универсальный патологический процесс, сопровождающий и определяющий развитие самой разнообразной патологии. В наиболее общем виде гипоксию можно определить как несоответствие энергопотребности клетки энергопродукции в системе митохондриального окислительного фосфорилирования. Для улучшения энергетического статуса клетки могут быть использованы фармакологические препараты – антигипосанты, представленные основными пятью группами (ингибиторы окисления жирных кислот, сукцинатсодержащие и сукцинатобразующие средства, естественные компоненты дыхательной цепи, искусственные редокс-системы, макроэргические соединения). В статье приведены сведения о механизмах действия, основных эффектах и результатах клинических исследований препаратов, для которых антигипоксическое действие является главным или клинически значимым. Обращено внимание на сукцинатсодержащие препараты, сочетающие свойства сбалансированного полиионного раствора и антигипоксанта (реамберин, цитофлавин, ремаксол), эффективно реализующие свое лечебное действие при самой разнообразной патологии (ишемический инсульт, токсическая, гипоксическая и дисциркуляторная энцефалопатия, инфекционные заболевания, постгипоксические повреждения ЦНС у новорожденных, различные интоксикации и др.).
Гипоксия представляет собой универсальный патологический
процесс, сопровождающий и определяющий развитие самой разнообразной
патологии. В наиболее общем виде гипоксию можно определить как
несоответствие энергопотребности клетки энергопродукции в системе
митохондриального окислительного фосфорилирования. Причины
нарушения продукции энергии в гипоксической клетке неоднозначны:
расстройства внешнего дыхания, кровообращения в легких,
кислородтранспортной функции крови, нарушения системного,
регионарного кровообращения и микроциркуляции, эндотоксемия. Вместе
с тем в основе характерных для всех форм гипоксии нарушений лежит
недостаточность ведущей клеточной энергопродуцирующей системы –
митохондриального окислительного фосфорилирования. Непосредственной
же причиной этой недостаточности при подаляющем большинстве
патологических состояний является снижение поступления кислорода в
митохондрии. В результате развивается угнетение митохондриального
окисления. В первую очередь подавляется активность NAD-зависимых
оксидаз (дегидрогеназ) цикла Кребса при начальном сохранении
активности FAD-зависимой сукцинат-оксидазы, ингибирующейся при
более выраженной гипоксии.
Нарушение митохондриального окисления приводит к угнетению
сопряженного с ним фосфорилирования и, следовательно, вызывает
прогрессирующий дефицит АТФ – универсального источника энергии в
клетке. Дефицит энергии составляет суть любой формы гипоксии и
обусловливает качественно однотипные метаболические и структурные
сдвиги в различных органах и тканях. Уменьшение концентрации АТФ в
клетке приводит к ослаблению ее ингибирующего влияния на один из
ключевых ферметнов гликолиза – фосфофруктокиназу. Активирующийся
при гипоксии гликолиз частично компенсирует недостаток АТФ, однако
быстро вызывает накопление лактата и развитие ацидоза с
результирующим аутоингибированием гликолиза.
Гипоксия приводит к комплексной модификации функций
биологических мембран, затрагивающей как липидный бислой, так и
мембранные ферменты. Повреждаются или модифицируются главные
функции мембран: барьерная, рецепторная, каталитическая. Основными
причинами этого явления служат энергодефицит и активация на его
фоне фосфолиполиза и перекисного окисления липидов (ПОЛ). Распад
фосфолипидов и ингибирование их синтеза ведут к повышению
концентрации ненасыщенных жирных кислот, усилению их перекисного
окисления. Последнее стимулируется в результате подавления
активности антиоксидантных систем из-за распада и торможения
синтеза их белковых компонентов, и в первую очередь,
супероксиддисмутазы (СОД), каталазы (КТ), глутатионпероксидазы
(ГП), глутатионредуктазы (ГР) и др.
Энергодефицит при гипоксии способствует накоплению
Са2+ в цитоплазме клетки, поскольку блокируются
энергозависимые насосы, выкачивающие ионы Са2+ из клетки
или закачивающие его в цистерны эндоплазматического ретикулума, а
накопление Са2+ активирует Са2+-зависимые
фосфолипазы. Один из защитных механизмов, препятствующий накоплению
Са2+ в цитоплазме, заключается в захвате Са2+
митохондриями. При этом повышается метаболическая активность
митохондрий, направленная на поддержание постоянства
внутримитохондриального заряда и перекачку протонов, что
сопровождается увеличением расхода АТФ. Замыкается порочный круг:
недостаток кислорода нарушает энергетический обмен и стимулирует
свободнорадикальное окисление, а активация свободнорадикальных
процессов, повреждая мембраны митохондрий и лизосом, усугубляет
энергодефицит, что, в итоге, может вызвать необратимые повреждения
и гибель клетки.
В отсутствии гипоксии некоторые клетки (например, кардиомиоциты)
получают АТФ за счет расщепления ацетил-КоА в цикле Кребса, и
основными источниками энергии выступают глюкоза и свободные жирные
кислоты (СЖК). При адекватном кровоснабжении 60-90% ацетил-КоА
образуется за счет окисления свободных жирных кислот, а остальные
10-40% - за счет декарбоксилирования пировиноградной кислоты (ПВК).
Примерно половина ПВК внутри клетки образуется за счет гликолиза, а
вторая половина – из лактата, поступающего в клетку из крови.
Катаболизм СЖК по сравнению с гликолизом требует большего
количества кислорода для синтеза эквивалентного числа АТФ. При
достаточном поступлении кислорода в клетку глюкозная и
жирнокислотная системы энергообеспечения находятся в состоянии
динамического равновесия. В условиях гипоксии количество
поступающего кислорода недостаточно для окисления жирных кислот. В
результате в митохондриях происходит накопление недоокисленных
активированных форм жирных кислот (ацилкарнитин, ацил-КоА), которые
способны блокировать адениннуклеотидтранслоказу, что сопровождается
подавлением транспорта произведенного в митохондриях АТФ в цитозоль
и повреждать мембаны клеток, оказываю детергентное действие.
Для улучшения энергетического статуса клетки могут быть
использованы несколько подходов:
-
повышение эффективности использования митохондриями
дефицитного кислорода вследствие предупреждения разобщения
окисления и фосфорилирования, стабилизации мембран митохондрий
-
ослабление ингибирования реакций цикла Кребса,
особенно поддержание активности сукцинатоксидазного звена
-
возмещение утраченых компонентов дыхательной
цепи
-
формирование искусственных редокс-систем,
шунтирующих перегруженную электронами дыхательную цепь
-
экономизация использования кислорода и снижение
кислородного запроса тканей, либо ингибирование путей его
потребления, не являющихся необходимыми для экстренного
поддержания жизнедеятельности в критических состояниях
(нефосфорилирующее ферментативное окисление – терморегуляторное,
микросомальное и др., неферментативное окисление липидов)
-
увеличение образования АТФ в ходе гликолиза без
увеличения продукции лактата
-
снижение расходования АТФ на процессы, не
определяющие экстренное поддержание жизнедеятельности в
критических ситуациях (различные синтетические востановительные
реакции, функционирование энергозависимых транспортных систем и
т.д.)
- введение извне высокоэнергетических соединений
В настоящее время одним из путей реализации этих подходов
является применение препаратов – антигипоксантов.
Классификация антигипоксантов
(Оковитый С.В., Смирнов А.В., 2005)
- Ингибиторы окисления жирных кислот
-
Сукцинатсодержащие и сукцинатобразующие средства
-
Естественные компоненты дыхательной цепи
-
Искусственные редокс-системы
-
Макроэргические соединения
Пионером в разработке антигипоксантов в нашей стране была
кафедра фармакологии Военно-медицинской академии. Еще в 60-х годах
на ней под руководством профессора В.М. Виноградова были созданы
первые антигипоксанты с поливалентным действием: гутимин, а затем
амтизол, активно изучавшиеся впоследствие под руководством
профессоров Л.В. Пастушенкова, А.Е. Александровой, А.В. Смирнова.
Эти препараты показали высокую эффективность, но, к сожалению, в
настоящее время они не производятся и не применяются в медицинской
практике.
1. Ингибиторы окисления жирных кислот
Средствами, близкими по фармакологическим эффектам (но не по
строению) к гутимину и амтизолу, являются препараты – ингибиторы
окисления жирных кислот, использующиеся в настоящее время
преимущественно в комплексной терапии ишемической болезни сердца.
Среди них выделяют прямые ингибиторы
карнитин-пальмитоилтрансферазы-I (пергекселин, этомоксир),
парциальные ингибиторы окисления жирных кислот (ранолазин,
триметазидин, мельдоний), и непрямые ингибиторы окисления жирных
кислот (карнитин).
Пергекселин и этомоксир способны угнетать
активность карнитин-пальмитоилтрансферазы-I, нарушая таким образом
перенос длинноцепочечных ацильных групп на карнитин, что приводит к
блокаде образования ацилкарнитина. Вследствие этого падает
внутримитохондриальный уровень ацил-КоА и уменьшается
NADЧН2/NAD соотношение, что сопровождается повышением
активности пируватдегидрогеназы и фосфофруктокиназы, а
следовательно стимуляцией окисления глюкозы, что яввляется более
энергетически выгодным по сравнению с окислением жирных кислот.
Пергекселин назначается перорально в дозах 200-400 мг в сут
длительностью до 3-х месяцев. Препарат может комбинироваться с
антиангинальными препаратами, однако, его клиническое применение
ограничивается неблагоприятными эффектами – развитием нейропатии
и гепатотоксичностью. Этомоксир используют в дозе 80 мг в сут
длительностью до 3-х мес, однако, вопрос о безопасности препарата
окончательно не решен, учитывая тот факт, что он является
необратимым ингибитором карнитин-пальмитоилтрансферазы-I.
Триметазидин, ранолазин и мельдоний относят к парциальным
ингибиторам окисления жирных кислот. Триметазидин
(Предуктал) блокирует 3-кетоацилтиолазу, один из ключевых ферментов
окисления жирных кислот. В результате тормозится окисление в
митохондриях всех жирных кислот - как длинноцепочечных (количество
атомов углерода больше 8), так и короткоцепочечных (количество
атомов углерода меньше 8), однако, никаким образом не изменяется
накопление активированных жирных кислот в митохондриях. Под
влиянием триметазидина увеличивается окисление пирувата и
гликолитическая продукция АТФ, уменьшается концентрация АМФ и АДФ,
тормозится накопление лактата и развитие ацидоза, подавляется
свободнорадикальное окисление.
В настоящее время препарат применяется при ишемической болезни
сердца, а также других заболеваниях, в основе которых лежит ишемия
(например, при вестибулокохлеарной и хориоретинальной патологии).
Получены свидетельства эффективности препарата при рефрактерной
стенокардии. В комплексном лечении ИБС препарат назначается в виде
лекарственной формы с замедленным высвобождением в разовой дозе 35
мг 2 раза в день, продолжительность курса может достигать 3
мес.
В европейском рандомизированном клиническом исследовании (РКИ)
триметазидина (TEMS) у больных со стабильной стенокардией
применение препарата способствовало уменьшению частоты и
продолжительности эпизодов ишемии миокарда на 25%, что
сопровождалось повышением толерантности больных к физической
нагрузке. Назначение препарата в сочетании с І-адреноблокаторами
(БАБ), нитратами и блокаторами кальциевых каналов (БКК)
способствовует повышению эффективности антиангинальной терапии.
Раннее включение триметазидина в комплексную терапию острого
периода инфаркта миокарда (ИМ) способствует ограничению размера
некроза миокарда, предотвращает развитие ранней постинфарктной
дилатации левого желудочка, увеличивает электрическую стабильность
сердца, не влияя на параметры ЭКГ и вариабельность сердечного
ритма. В то же время, в рамках крупного РКИ EMIР–FR, не
подтвердилось ожидаемое положительное влияние короткого курса
внутривенного введения препарата на долгосрочную, госпитальную
смертность и частоту комбинированной конечной точки у больных с ИМ.
Однако, триметазидин достоверно снижал частоту затяжных ангинозных
приступов и рецидивов ИМ у больных, перенесших тромболизис.
У пациентов, перенесших ИМ, дополнительное включение
триметазидина с модифицированным высвобождением в стандартную
терапию позволяет достичь уменьшения числа приступов стенокардии,
сокращения применения короткодействующих нитратов и повысить
качество жизни (исследование ПРИМА).
В небольшом РКИ получены первые данные об эффективности
триметазидина у больных с ХСН. Показано, что длительный прием
препарата (20 мг 3 раза в сутки на протяжении примерно13 мес)
улучшает функциональный класс и сократительную функцию левого
желудочка у больных сердечной недостаточностью. В российском
исследовании ПРЕАМБУЛА у больных с сочетанной патологией (ИБС+ХСН
II-III ФК) триметазидин (35 мг 2 раза в сут) продемонстрировал
способность несколько уменьшать ФК ХСН, улучшать клиническую
симптоматику и переносимость физической нагрузки у таких больных.
Однако, для окончательного определения места триметазидина для
лечения больных с ХСН требуются дополнительные исследования.
Побочные эффекты при приеме препарата редки (дискомфорт в
области желудка, тошнота, головная боль, головокружения,
бессонница).
Ранолазин (Ранекса) также является ингибитором окисления
жирных кислот, хотя, его биохимическая мишень пока не установлена.
Он оказывает антиишемический эффект вследствие ограничения
использования в качестве энергетического субстрата СЖК и повышения
использования глюкозы. Это приводит к образованию большего
количества АТФ на единицу потребленного кислорода.
Ранолазин обычно используется в комбинированной терапии больных
ИБС вместе с антиангинальными препаратами. Так, в РКИ ERICA
показана антиангинальная эффективность ранолазина у больных со
стабильной стенокардией, имевших приступы, несмотря на прием
максимально рекомендуемой дозы амлодипина. У женщин влияние
ранолазина на тяжесть симптомов стенокардии и толерантность к
нагрузке ниже, чем у мужчин.
Результаты РКИ MERLIN-TIMI 36, проводившегося для уточнения
влияния ранолазина (внутривенно, затем перорально 1 г в сут) на
частоту сердечно-сосудистых событий у больных с острым коронарным
синдромом продемонстрировали, что ранолазин уменьшает выраженность
клинических симптомов, однако не влияет на долгосрочный риск смерти
и ИМ у пациентов с ИБС.
В этом же исследовании была обнаружена антиаритмическая
активность ранолазина у больных ОКС без подъема сегмента ST в
течение первой недели после их госпитализации (уменьшение числа
эпизодов желудочковой и суправентрикулярной тахикардии).
Предполагается, что этот эффект ранолазина связан с его
способностью ингибировать позднюю фазу натриевого потока внутрь
клетки во время реполяризации (поздний ток INa), что
вызывает снижение концентрации внутриклеточного Na+ и
перегрузки кардиомиоцитов Ca2+, предотвращая развитие
как механической дисфункции миокарда, сопровождающей ишемию, так и
к его электрической нестабильности.
Ранолазин обычно не вызывает выраженных побочных эффектов и не
оказывает существенного влияния на ЧСС и АД, однако при применении
относительно высоких доз и при комбинировании с БАБ или БКК каналов
могут наблюдаются умеренно выраженные головные боли,
головокружения, астенические явления. Кроме того, возможность
увеличения препаратом интервала QT, накладывает определенные
ограничения на его клиническое использование.
Мельдоний (Милдронат) обратимо ограничивает скорость
биосинтеза карнитина из его предшественника – γ-бутиробетаина.
Вследствие этого нарушается карнитин-опосредованный транспорт
длинноцепочечных жирных кислот через мембраны митохондрий без
воздействия на метаболизм короткоцепочечных жирных кислот. Это
означает, что мельдоний практически не способен оказывать
токсического действия на дыхание митохондрий, так как не может
полностью блокировать окисления всех жирных кислот. Частичная
блокада окисления жирных кислот включает альтернативную систему
производства энергии - окисление глюкозы, которая значительно
эффективнее (на 12%) использует кислород для синтеза АТФ. Кроме
того, под влиянием мельдония повышается концентрация
γ-бутиробетаина, способного индуцировать образование NO, что
приводит к уменьшению общего периферического сопротивления сосудов
(ОПСС).
Мельдоний, так и триметазидин, при стабильной стенокардии
уменьшает частоту приступов стенокардии, повышает толерантность
больных к физической нагрузке и снижает потребление
короткодействующего нитроглицерина. Препарат малотоксичен, не
вызывает существенных побочных эффектов, однако, при его
использовании могут отмечаться кожный зуд, высыпания, тахикардия,
диспепсические явления, психомоторное возбуждение, снижение АД.
Карнитин (витамин Вт) является эндогенным
соединением и образуется из лизина и метионина в печени и почках.
Он играет важную роль в переносе длинноцепочечных жирных кислот
через внутреннюю мембрану митохондрий, в то время как активация и
проникновение низших жирных кислот происходит без картинитина.
Кроме того, карнитин играет ключевую роль в образовании и регуляции
уровня ацетил-КоА.
Физиологические концентрации карнитина обладают насыщающим
действием на карнитин-пальмитоилтрансферазу I, а увеличение дозы
препарата не повышает транспорт ацильных групп жирных кислот в
митохондрии при участии данного фермента. Однако, это приводит к
активации карнитин-ацилкарнитинтранслоказы (которая не насыщается
физиологическими концентрациями карнитина) и падению
внутримитохондриальной концентрации ацетил-КоА, который
транспортируется в цитозоль (через образование ацетилкарнитина). В
цитозоле избыток ацетил-КоА подвергается воздействию
ацетил-КоА-карбоксилазы с образованием малонил-КоА, который
обладает свойствами непрямого ингибитора
карнитин-пальмитоилтрансферазы I. Уменьшение же
интрамитохондриального ацетил-КоА коррелирует с повышением уровня
пируватдегидрогеназы, которая обеспечивает окисление пирувата и
ограничивает продукцию лактата. Таким образом, антигипоксическое
действие карнитина связано с блокадой транспорта жирных кислот в
митохондрии, является дозозависимым и проявляется при назначении
высоких доз препарата, в то время как низкие дозы обладают лишь
специфическим витаминным действием.
Одно из самых больших РКИ с применением карнитина – CEDIM. При
проведении его было показано, что длительная терапия карнитином в
достаточно высоких дозах (9 г. 1 раз в сут 5 дней с последующим
переходом на пероральный прием 2 г 3 раза в сут 12 мес) у больных с
ИМ ограничивает дилатацию левого желудочка. Кроме того
положительный эффект от применения препарата получен при тяжелых
черепно-мозговых травмах, гипоксии плода, отравлении угарным газом
и т.д., однако большая вариабельность курсов применения и не всегда
адекватная дозовая политика затрудняют интерпретацию результатов
таких исследований.
2. Сукцинатсодержащие и сукцинатобразующие средства
2.1. Сукцинатсодержащие средства
Практическое использование в качестве антигипоксантов находят
препараты, поддерживающие при гипоксии активность
сукцинатоксидазного звена. Это FAD-зависимое звено цикла Кребса,
позднее угнетающееся при гипоксии по сравнению с NAD-зависимыми
оксидазами, может определенное время подерживать энергопродукцию в
клетке при условии наличия в митохондриях субстрата окисления в
данном звене – сукцината (янтарной кислоты). Сравнительный состав
препаратов приведен в табл.1.
В последние годы установлено, что янтарная кислота реализует
свои эффекты не только как интермедиант различных биохимических
циклов, но и как лиганд орфанных рецепторов (SUCNR1, GPR91),
расположенных на цитоплазматической мембране клеток и сопряженных с
G-белками (Gi/Go и Gq). Эти
рецепторы обнаружены во многих тканях, впервую очередь в почках
(эпителий проксимальных канальцев, клетки юкстагломерулярного
аппарата), а также в печени, селезенке, сосудах. Активация этих
рецепторов сукцинатом, присутствующем в сосудистом русле,
увеличивает реабсорбцию фосфата и глюкозы, стимулирует
глюконеогенез, повышает артериальное давление (через непрямое
увеличеие образования ренина). Некоторые эффекты янтарной кислоты
представлены на рис.1.
Таблица 1. Сравнительный состав
сукцинатсодержащих препаратов
|
Компонент препарата
|
Реамберин (400 мл)
|
Ремаксол (400 мл)
|
Цитофлавин (10 мл)
|
Оксиметилэтилпиридина сукцинат (5 мл)
|
|
ПАРЕНТЕРАЛЬНЫЕ ФОРМЫ
|
|
Янтарная кислота
|
2112 мг
|
2112 мг
|
1000 мг
|
-
|
|
Оксиметилэтилпиридина сукцинат
|
-
|
-
|
-
|
250 мг
|
|
N-метилглюкамин
|
3490 мг
|
3490 мг
|
1650 мг
|
-
|
|
Никотинамид
|
-
|
100 мг
|
100 мг
|
-
|
|
Инозин
|
-
|
800 мг
|
200 мг
|
-
|
|
Рибофлавина мононуклеотид
|
-
|
-
|
20 мг
|
-
|
|
Метионин
|
-
|
300 мг
|
-
|
-
|
|
NaCl
|
2400 мг
|
2400 мг
|
-
|
-
|
|
KCl
|
120 мг
|
120 мг
|
-
|
-
|
|
MgCl
|
48 мг
|
48 мг
|
-
|
-
|
|
ПЕРОРАЛЬНЫЕ ФОРМЫ
|
|
Янтарная кислота
|
-
|
-
|
300 мг
|
100-150 мг
|
|
Оксиметилэтилпиридина сукцинат
|
-
|
-
|
-
|
-
|
|
Никотинамид
|
-
|
-
|
25 мг
|
-
|
|
Инозин
|
-
|
-
|
50 мг
|
-
|
|
Рибофлавина мононуклеотид
|
-
|
-
|
5 мг
|
-
|
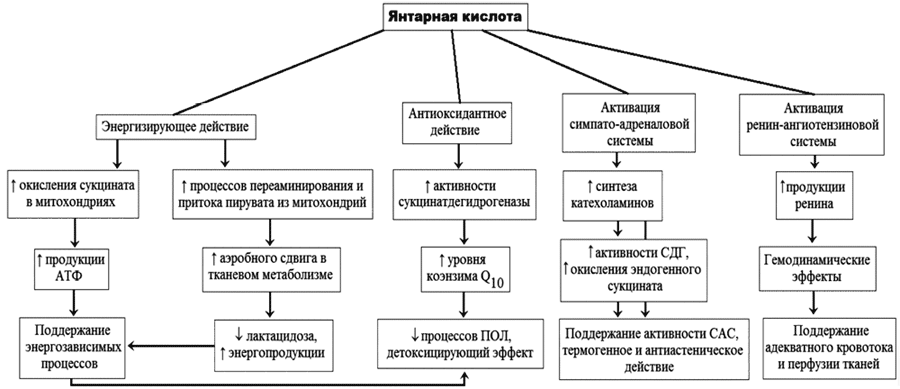
Рис.1. Некоторые эффекты экзогенно вводимой янтарной кислоты
Одним из препаратов, созданных на основе янтарной кислоты
является реамберин – представляющий собой сбалансированный
полиионный раствор с добавлением смешанной натрий
N-метилглюкаминовой соли янтарной кислоты (до 15 г/л).
Инфузия реамберина сопровождается повышением рН и буферной
емкости крови, а также ощелачиванием мочи. В дополнение к
антигипоксантной активности, реамберин обладает
дезинтоксикационным (при различных интоксикациях, в частности,
алкоголем, противотуберкулезными препаратами) и антиоксидантным (за
счет активации ферментативного звена антиоксидантной системы)
действием. Прерат используется при разлитом перитоните с синдромом
полиорганной недостаточности, тяжелой сочетанной травме, острых
нарушениях мозгового кровообращения (по ишемическому и
геморрагическому типу), операциях прямой реваскуляризации на
сердце.
Применение реамберина у больных с многососудистым поражением
коронарных артерий при аорто-маммарно-коронарном шунтировании с
пластикой левого желудочка и/или протезированием клапанов и
использованием экстракорпорального кровообращения в
интраоперационом периоде позволяет снизить частоту различных
осложнений в раннем послеоперационном периоде (в том числе
реинфарктов, инсультов, энцефалопатии).
Использование реамберина на этапе выведения из анестезии
приводит к укорочению периода пробуждения пациентов, сокращению
времени восстановления двигательной активности и адекватного
дыхания, ускорению восстановления функций головного мозга.
Показана эффективность реамберина (сокращение длительности и
тяжести основных клинических проявлений заболевания) при
инфекционных заболеваниях (грипп и ОРВИ, осложненные пневмонией,
острые кишечные инфекции), обусловленная его высоким
детоксицирующим и непрямым антиоксидантным действием.
Побочных эффектов у препарата немного, в основном это
кратковременное чувство жара и покраснение верхней части тела.
Противопоказан реамберин при состояниях после черепно-мозговых
травм, сопровождающихся отеком мозга.
Комбинированным антигипоксическим действием обладает препарат
цитофлавин (янтарная кислота, 1000 мг + никотинамид, 100 мг
+ рибофлавина мононуклеотид, 20 мг + инозин, 200 мг). Основное
антигипоксическое действие янтарной кислоты в данной рецептуре
дополняется рибофлавином, способным за счет своих коферментных
свойств увеичивать активность сукцинатдегидрогеназы и обладающим
непрямым антиоксидантным действием (за счет восстановления
окисленного глутатиона). Предполагается, что входящий в состав
никотинамид активирует NAD-зависимые ферментые системы, однако этот
эффект менее выражен, чем у NAD. За счет инозина достигается
увеличение содержания общего пула пуриновых нуклеотидов,
необходимых не только для ресинтеза макроэргов (АТФ и ГТФ), но и
вторичных мессенджеров (цАМФ и цГМФ), а также нуклеиновых кислот.
Определенную роль может играть способность инозина несколько
подавлять активность ксантиноксидазы, уменьшая тем самым продукцию
высокоактивных форм и соединений кислорода. Однако, по сравнению с
другими компонентами препарата, эффекты инозина отсрочены во
времени.
Основное применение цитофлавин нашел при гипоксических и
ишемических повреждениях ЦНС (ишемический инсульт, токсическая,
гипоксическая и дисциркуляторная энцефалопатия), а также в терапии
различных патологических состояний, в том числе в комплексном
лечении больных, находящихся в критическом состоянии. Так,
применение препарата обеспечивает снижение летальности у пациентов
с острым нарушением мозгового кровообращения до 4,8-9,6%, против
11,7-17,1% у больных, не получавших препарат.
В достаточно крупном РКИ, включавшем 600 пациентов с хронической
ишемией головного мозга, цитофлавин продемонстрировал способность
уменьшать когнитивно-мнестические расстройства и неврологические
нарушения; восстанавливать качество сна и повышать качество
жизни.
Клиническое применение цитофлавина для профилактики и лечения
постгипоксических поражений ЦНС у недоношенных новорожденных,
перенесших церебральную гипоксию/ишемию, позволяет снизить частоту
и выраженность неврологических осложнений (тяжелые формы
перивентрикулярных и внутрижелудочковых кровоизлияний,
перивентрикулярные лейкомаляции). Использование цитофлавина в
остром периоде перинатального поражения ЦНС позволяет достичь более
высоких индексов психического и моторного развития детей на первом
году жизни. Показана эффективность препарата у детей при
бактериальных гнойных менингитах и вирусных энцефалитах.
Побочные эфекты цитофлавина включают гипогликемию,
гиперурикемию, гипертензивные реакции, инфузионные реакции при
быстром струйном введении (чувство жара, сухость во рту).
Ремаксол – оригинальный препарат, сочетающий свойства
сбалансированного полиионного раствора (в состав которого
дополнительно введены метионин, рибоксин, никотинамид и янтарная
кислота), антигипоксанта и гепатоторопного средства.
Антгипоксический эффект ремаксола сходен с таковым реамберина.
Янтарная кислота оказывает антигипоксическое действие (поддержание
активности сукцинатоксидазного звена) и непрямое антиоксидантное
(сохраниение пула восстановленного глутатиона), а никотинамид
активирует NAD-зависимые ферментые системы. Благодаря этому
происходит как активация синтетических процессов в гепатоцитах, так
и поддержание их энергетического обеспечения. Кроме того,
предполагается, что янтарная кислота может выступать как
паракринный агент, выделяемый поврежденными гепатоцитами (например,
при ишемии), оказывающий воздействие на перициты (клетки Ито) в
печени через SUCNR1 рецепторы. Это обусловливает активацию
перицитов, обеспечивающих синтез компонентов внеклеточного
матрикса, участвующих в метаболизме и регенерации клеток печеночной
паренхимы.
Метионин активно включается всинтез холина, лецитина и других
фосфолипидов. Кроме того, под влиянием метионин аденозилтрансферазы
из метионина и АТФ образуется в организме S-аденозилметионин
(SAM).
Эффект инозина был рассмотрен выше, однако, стоит упомянуть о
том, что он обладает и свойствами нестероидного анаболика,
ускоряющего репаративную регенерацию гепатоцитов.
Наиболее заметное действие ремаксол оказывает на проявления
токсемии, а также цитолиза и холестаза, что позволяет его
использовать в качестве универсального гепатотропного препарата при
различных поражениях печени как в лечебных, так и в
лечебно-профилактических схемах. Эффективность препарата
установлена при вирусных (ХВГС), лекарственных
(противотуберкулезными агентами) и токсических (этанолом)
поражениях печени.
Подобно экзогенно вводимому SAM, ремаксол обладает мягким
антидепрессивным и антиастеническим эффектом. Кроме того, при
острых алкогольных интоксикациях препарат снижает частоту развития
и длительность алкогольного делирия, сокращает сроки пребывания
больных в ОРИТ и общую продолжительность лечения.
В качестве комбинированного сукцинатсодержащего препарата может
рассматриваться оксиметилэтилпиридина сукцинат (мексидол,
мексикор) - представляющий собой комплекс сукцината с
антиоксидантом эмоксипином, обладающим относительно слабой
антигипоксической активностью, но увеличивающим транспорт
сукцината через мембраны. Подобно эмоксипину, оксиметилэтилпиридина
сукцинат (ОМЭПС) является ингибитором свободнорадикальных
процессов, но оказывает более выраженное антигипоксическое
действие. Основные фармакологические эффекты ОМЭПС можно
суммировать следующим образом:
-
активно реагирует с перекисными радикалами белков и
липидов, уменьшает вязкость липидного слоя клеточных мембран
-
оптимизирует энергосинтезирующие функции
митохондрий в условиях гипоксии
-
оказывает модулирующее действие на некоторые
мембрансвязанные ферменты (фосфодиэстеразу, аденилатциклазу), ионые
каналы, улучшает синаптическую передачу
-
блокирует синтез некоторых простагландинов,
тромбоксана и лейкотриенов
-
улучшает реологические свойства крови, подавляет
агрегацию тромбоцитов
Основные клинические испытания ОМЭПС были проведены по изучению
его эффективности при расстройствах ишемического генеза: в остром
периоде ИМ, ИБС, острых нарушениях мозгового кровообращения,
дисциркуляторной энцефалопатии, вегетососудистой дистонии,
атеросклеротических нарушениях функций мозга и других состояниях,
сопровождающихся гипоксией тканей.
Максимальная суточная доза не должна превышать 800 мг, разовая –
250 мг. Обычно ОМЭПС хорошо переносится. У некоторых больных
возможно появление тошноты и сухости во рту.
Продолжительность приема и выбор индивидуальной дозы зависят от
тяжести состояния больного и эффективности терапии ОМЭПС. Для
вынесения окончательного суждения об эффективности и безопасности
препарата необходимо проведение крупных РКИ.
2.2. Сукцинатобразующие средства
Со способностью превращаться в сукцинат в цикле Робертса
(g-аминобутиратном шунте) связано и противогипоксическое действие
оксибутирата натрия, хотя оно и не очень выражено.
Трансаминирование g-аминомасляной кислоты (ГАМК) с ±-кетоглутаровой
кислотой является основным путем метаболической деградации ГАМК.
Образующийся по ходу нейрохимической реакции полуальдегид янтарной
кислоты с помощью cукцинатсемиальдегиддегидрогеназы при участии NAD
окисляется в янтарную кислоту, которая включается в цикл
трикарбоновых кислот. Этот процесс протекает преимущественно в
нервной ткани, однако, в условиях гипоксии он может реализовываться
и в других тканях.
Такое дополнительное действие весьма полезно при использовании
оксибутирата натрия (ОН) в качестве общего анестетика. В условиях
тяжелой циркуляторной гипоксии оксибутират (в высоких дозах) в
очень короткие сроки успевает запустить не только клеточные
адаптационные механизмы, но и подкрепить их перестройкой
энергетического обмена в жизненно важных органах. Поэтому не стоит
ожидать сколько-нибудь заметного эффекта от введения малых доз
анестетика.
Благоприятное действие ОН при гипоксии обусловлено тем, что он
активирует энергетически более выгодный пентозный путь обмена
глюкозы с ориентацией его на путь прямого окисления и образования
пентоз, входящих в состав АТФ. Помимо этого, активация пентозного
пути окисления глюкозы создает повышенный уровень NADPЧН, как
необходимого кофактора синтеза гормонов, что особенно важно для
функционирования надпочечников. Изменение гормонального фона при
введении препарата сопровождается повышением в крови содержания
глюкозы, которая дает максимальный выход АТФ на единицу
использованного кислорода и способна поддерживать продукцию энергии
в условиях недостатка кислорода.
Мононаркоз ОН представляет собой минимально токсичный вид общей
анестезии и поэтому имеет наибольшую ценность у больных в состоянии
гипоксии различной этиологии (тяжелая острая легочная
недостаточность, кровопотеря, гипоксические и токсические
повреждения миокарда). Он также показан у пациентов с различными
вариантами эндогенной интоксикации, сопровождающимися оксидативным
стрессом (септические процессы, разлитой перитонит, печеночная и
почечная недостаточность).
Побочные эффекты при применении препаратов редки, в основном при
внутривенном введении (двигательное возбуждение, судорожные
подергивания конечностей, рвота). Эти неблагоприятные явления при
применении оксибутирата могут быть предупреждены во время
премедикации метоклопрамидом или купированы прометазином
(дипразином).
С обменом сукцината частично связан также противогипоксический
эффект полиоксифумарина, представляющего собой коллоидный
раствор для внутривенного введения (полиэтиленгликоль с добавлением
NaCl, MgCl, KI, а также фумарата натрия). Полиоксифумарин содержит
один из компонентов цикла Кребса – фумарат, хорошо проникающий
через мембраны и легко утилизируемый в митохондриях. При наиболее
жесткой гипоксии происходит обращение терминальных реакций цикла
Кребса, то есть они начинают протекать в обратном направлении, и
фумарат превращается в сукцинат с накоплением последнего. При этом
обеспечивается сопряженная регенерация окисленного NAD из его
восстановленной при гипоксии формы, и, следовательно, возможность
энергопродукции в NAD-зависимом звене митохондриального окисления.
При уменьшении глубины гипоксии направление терминальных реакций
цикла Кребса меняется на обычное, при этом накопившийся сукцинат
активно окисляется в качестве эффективного источника энергии. В
этих условиях и фумарат преимущественно окисляется после
превращения в малат.
Введение полиоксифумарина приводит не только к постинфузионной
гемодилюции, в результате которой уменьшается вязкость крови и
улучшаются ее реологические свойства, но и повышению диуреза и
проявлению дезинтоксикационного действия. Входящий в состав фумарат
натрия оказывает антигипоксическое действие.
Кроме того, полиоксифумарин используется в качестве компонента
перфузионной среды для первичного заполнения контура аппарата
искусственного кровообращения (11%-30% объема) при операциях
коррекции пороков сердца. При этом включение препарата состав
перфузата положительно влияет на стабильность гемодинамики в
постперфузионном периоде, снижает потребность в инотропной
поддержке.
Конфумин – 15% раствор фумарата натрия для инфузий,
обладающий заметным антигипоксическим действием. Обладает
определенным кардиотоническим и кардиопротекторным действием.
Используется при различных гипоксических состояниях (гипоксия при
нормоволемии, шок, тяжелые интоксикации), в том числе в тех
случаях, когда противопоказано введение больших объемов жидкости и
другие инфузионные препараты с антигипоксическим действием не могут
быть использованы.
3. Естественные компоненты дыхательной цепи
Практическое применение нашли и антигипоксанты, представляющие
собой естественные для организма компоненты дыхательной цепи
митохондрий, участвующие в переносе электронов. К ним относится
цитохром С (Цитомак) и убихинон (Убинон). Даные
препараты, в сущности, выполняют функцию заместительной терапии,
поскольку при гипоксии из-за структурных нарушений митохондрии
теряют часть своих компонентов, включая переносчики электронов.
В экспериментальных исследованиях доказано, что экзогенный
цитохром С при гипоксии проникает в клетку и митохондрии,
встраивается в дыхательную цепь и способствует нормализации
энергопродуцирующего окислительного фосфорилирования.
Цитохром С может быть полезным средством комбинированной терапии
критических состояний. Показана высокая эффективность препарата при
отравлении снотворными средствами, окисью углерода, токсических,
инфекционных и ишемических повреждениях миокарда, пневмониях,
нарушениях мозгового и периферического кровообращения. Применяют
также при асфиксии новорожденных и инфекционном гепатите. Обычная
доза препарата составляет 10-15 мг внутривенно, внутримышечно или
внутрь (1-2 раза в день).
Комбинированным препаратом, содержащим цитохром С является
энергостим. В его состав помимо цитохрома С (10 мг) входят
никотинамиддинуклеотид (0,5 мг) и инозин (80 мг). Данная
комбинация обладает аддитивным эффектом, где эффекты NAD и инозина
дополняют антигипоксическое действие цитохрома С. При этом
экзогенно вводимый NAD несколько уменьшает дефицит цитозольного NAD
и восстанавливает активность NAD–зависимых дегидрогеназ,
участвующих в синтезе АТФ, способствует интенсификации работы
дыхательной цепи. За счет инозина достигается увеличение содержания
общего пула пуриновых нуклеотидов. Препарат предлагается применять
при ИМ, а также при состояниях, сопровождающихся развитием
гипоксии, однако доказательная база на настоящий момент достаточно
слабая.
Убихинон (кофермент Q10) - кофермент, широко
распространенный в клетках организма, представляющий собой
производное бензохинона. Основная часть внутриклеточного убихинона
сконцентрирована в митохондриях в окисленной (СоQ), восстановленной
(СоН2, QH2) и полувосстановленной формах
(семихинон, СоН, QH). В небольшом количестве он присутствует в
ядрах, эндоплазматическом ретикулуме, лизосомах, аппарате Гольджи.
Как и токоферол, убихинон в наибольших количествах содержится в
органах с высокой интенсивностью метаболизма – сердце, печени,
почках.
Он является переносчиком электронов и протонов от внутренней к
наружной стороне мембраны митохондрий, компонентом дыхательной
цепи, а также способен выполнять роль антиоксиданта.
Убихинон (Убинон) в основном может быть использован в
комплексной терапии больных ишемической болезнью сердца, при ИМ, а
также у пациентов с хронической сердечной недостаточностью
(ХСН).
При использовании препарата у больных с ИБС улучшается
клиническое течение заболевания (преимущественно у больных I-II
функционального класса), снижается частота приступов; увеличивается
толерантность к физической нагрузке; повышается в крови содержание
простациклина и снижается тромбоксана. Однако, необходимо
учитывать, что сам препарат не приводит к увеличению коронарного
кровотока и не способствует уменьшению кислородного запроса
миокарда (хотя и может давать небольшой брадикардитический эффект).
Вследствие этого антиангинальный эффект препарата проявляется через
некоторое, иногда довольно значительное время (до 3-х мес).
В комплексной терапии больных с ИБС убихинон может сочетаться с
БАБ и ингибиторами ангиотензинпревращающего фермента. При этом
снижается риск развития левожелудочковой сердечной недостаточности,
нарушений сердечного ритма. Препарат малоэффективен у больных с
резким снижением толерантности к физической нагрузке, а также при
наличии высокой степени склеротического стенозирования коронарных
артерий.
При ХСН использование убихинона в сочетании с дозированной
физической нагрузкой (особенно в высоких дозах, до 300 мг в сут)
позволяет увеличить мощность сокращений левого желудочка и улучшить
эндотелиальную функцию. Достоверное положительное влияние препарат
оказывает на функциональный класс больных с ХСН и число
госпитализаций.
Следует отметить, что эффективность убихинона при ХСН в
значительной мере зависит от его плазменного уровеня,
определяемого, в свою очередь, метаболическими потребностями
различных тканей. Предполагается, что упомянутые выше положительные
эффекты препарата проявляются только при превышении концентрации
коэнзима Q10 в плазме свыше 2,5 мкг/мл (нормальная
концентрация примерно 0,6-1,0 мкг/мл). Этот уровень достигается при
назначении высоких доз препарата: прием 300 мг в сут коэнзима
Q10 дает 4-х кратное повышение его уровня в крови от
исходного, но не при использовании низких доз (до 100 мг в сут).
Поэтому, хотя ряд исследований при ХСН выполнялся с назначением
пациентам убихинона в дозах 90-120 мг в сут, по-видимому, наиболее
оптимальным при данной патологии следует считать использование
высокодозовой терапии.
Согласно результатам небольшого пилотного исследования лечение
убихиноном редуцирует выраженность миопатических симптомов у
пациентов, получающих статины, уменьшает мышечную боль (на 40%) и
улучшает ежедневную активность (на 38%) в отличие от токоферола,
оказавшегося неэффективным.
Препарат обычно хорошо переносится. Иногда возможны тошнота и
расстройства стула, беспокойство и инсомнии, в этом случае прием
препарата прекращают.
В качестве производного убихинона может рассматриваться
идебенон, который по сравнению с коэнзимом Q10
обладает меньшим размером (в 5 раз), меньшей гидрофобностью и
большей антиоксидантной активностью. Препарат проникает через
гемато-энцефалический барьер и в значительных количествах
распределяется в ткани мозга. Механизм действия идебенона сходен с
таковым убихинона. Наряду с антигипоксическим и антиоксидантным
эффектами он оказывает мнемотропное и ноотропное действие,
развивающееся после 20-25 дней лечения. Основные показания к
применению идебенона – цереброваскулярная недостаточность
различного генеза, органические поражения ЦНС.
Наиболее частым побочным эффектом препарата (до 35%) является
нарушение сна, обусловленное его активирующим действием, в связи с
чем послений прием идебенона должен осуществляться не позднее 17
ч.
4. Искусственные редокс-системы
Создание антигипоксантов с электроноакцепторными свойствами,
образующими искуственные редокс-системы, преследует цель в какой-то
мере компенсировать развивающийся при гипоксии дефицит
естественного акцептора электронов – кислорода. Такие препараты
должны шунтировать звенья дыхательной цепи, перегруженные
электронами в условиях гипоксии, «снимать» электроны с этих звеньев
и тем самым в определенной степени восстанавливать функцию
дыхательной цепи и сопряженного с ней фосфорилирования. Кроме того,
искусственные акцепторы электронов могут обеспечивать окисление
пиридиннуклеотидов (NADН) в цитозоле клетки, предупреждая в
результате ингибирование гликолиза и избыточное накопление
лактата.
Из средств, формирующих искусственные редокс-системы, в
медицинскую практику внедрен полидигидроксифенилентиосульфонат
натрия – олифен (гипоксен), представляющий собой
синтетический полихинон. В межклеточной жидкости препарат,
очевидно, диссоциирует на полихиноновый катион и тиоловый анион.
Антигипоксический эффект препарата связан, в первую очередь, с
наличием в его структуре полифенольного хинонового компонента,
участвующего в шунтирования транспорта электронов в дыхательной
цепи митохондрий (с I-го комплекса на III-й). В постгипоксическом
периоде препарат приводит к быстрому окислению накопленных
восстановленных эквивалентов (NADP�H2, FADН).
Способность легко образовывать семихинон обеспечивает ему заметное
антиоксидантное действие, необходимое для нейтрализации продуктов
ПОЛ.
Применение препарата разрешено при тяжелых травматических
поражениях, шоке, кровопотере, обширных оперативных вмешательствах.
У больных ишемической болезнью сердца он уменьшает ишемические
проявления, нормализует гемодинамику, снижает свертываемость крови
и общее потребление кислорода. Клинические исследования показали,
что при включении олифена в комплекс терапевтических мероприятий
понижается летальность больных с травматическим шоком, отмечается
более быстрая стабилизация гемодинамических показателей в
послеоперационном периоде.
У больных с сердечной недостаточностью на фоне олифена
снижаются проявления тканевой гипоксии, но не происходит особого
улучшения насосной функции сердца, что ограничивает применение
препарата при острой сердечной недостаточности. Отсутствие
положительного влияния на состояние нарушенной центральной и
внутрисердечной гемодинамики при ИМ не позволяет сформировать
однозначного мнения об эффективности препарата при данной
патологии. Кроме того, олифен не дает непосредственного
антиангинального эффекта и не устраняет нарушений ритма,
возникающих при ИМ.
Олифен используется в комплексной терапии острого деструктивного
панкреатита (ОДП). При данной патологии эффективность применения
препарата тем выше, чем раньше начато лечение. При назначении
олифена регионарно (внутриаортально) в раннюю фазу ОДП следует
тщательно определять момент возникновения заболевания, так как по
прошествии периода управляемости и наличии уже сформировавшегося
панкреонекроза применение препарата противопоказано.
Остается открытым вопрос об эффективности олифена в остром
периоде цереброваскулярных заболеваний (декомпенсация
дисциркуляторной энцефалопатии, ишемический инсульт). Показано
отсутствие влияния препарата на состояние магистрального мозгового
и динамику системного кровотока.
Среди побочных эффектов олифена можно отметить нежелательные
вегетативные сдвиги, включая длительное повышение АД или коллапсы у
части больных, аллергические реакции и флебиты; редко
кратковременное чувство сонливости, сухость во рту; при ИМ может
несколько пролонгироваться период синусовой тахикардии. При
длительном курсовом применении олифена преобладают два основных
побочных эффекта – острые флебиты (у 6% больных) и аллергические
реакции в виде гиперемии ладоней и кожного зуда (у 4% больных),
реже отмечаются кишечные расстройства (у 1% людей).
5. Макроэргические соединения
Антигипоксантом, созданным на основе естественного для организма
макроэргического соединения – креатинфосфата , является
препарат Неотон. В миокарде и в скелетной мышце креатинфосфат
выполняет роль резерва химической энергии и используется для
ресинтеза АТФ, гидролиз которой обеспечивает образование энергии,
необходимой в процессе сокращения актомиозина. Действие как
эндогенного, так и экзогенно вводимого креатинфосфата состоит в
непосредственном фосфорилировании АДФ и увеличении тем самым
количества АТФ в клетке. Кроме того, под влиянием препарата
стабилизируется сарколеммальная мембрана ишемизированных
кардиомиоцитов, снижается агрегация тромбоцитов и увеличивается
пластичность мембран эритроцитов. Наиболее изучено нормализующее
влияние неотона на метаболизм и функции миокарда, так как при
повреждении миокарда существует тесная связь между содержанием в
клетке высокоэнергетических фосфорилирующих соединений,
выживаемостью клетки и способностью к восстановлению функции
сокращения.
Основными показаниями к применению креатинфосфата являются ИМ
(острый период), интраоперационная ишемия миокарда или конечностей,
ХСН. При этом следует отметить, что однократная инфузия препарата
не влияет на клинический статус и состояние сократительной функции
левого желудочка.
Показана эффективность препарата у больных с острым нарушением
мозгового кровообращения. Кроме того, препарат может быть
использован и в спортивной медицине для предотвращения
неблагоприятных последствий физического перенапряжения. Включение
неотона в состав комплексной терапии ХСН позволяет, как правило,
уменьшить дозу сердечных гликозидов и диуретиков. Дозы внутривенно
капельно вводимого препарата различаются в зависимости от вида
патологии.
Для вынесения окончательного суждения об эффективности и
безопасности препарата необходимо проведение крупных РКИ. Также
требует дополнительного изучения экономическая целесообразность
применения креатинфосфата, учитывая его высокую стоимость.
Побочные эффекты редки, иногда возможно кратковременное снижение
артериального давления при быстрой внутривенной инъекции в дозе
свыше 1 г.
Иногда в качестве макроэргического антигипоксанта рассматривают
АТФ (кислота аденозинтрифосфорная). Результаты применения АТФ в
качестве антигипоксанта оказались противоречивы а клинические
перспективы сомнительны, что объясняется чрезвычайно плохим
проникновением экзогенной АТФ через неповрежденные мембраны и ее
быстрым дефосфорилированием в крови.
В то же время, определенный терапевтический эффект, не связанный
с прямым антигипоксическим действием препарат все же оказывает, что
обусловлено как его нейромедиаторными свойствами (модулирующее
влияние на адрено-, холино-, пуриновые рецепторы), так и влиянием
на обмен веществ и клеточные мембраны продуктов деградации АТФ –
АМФ, цАМФ, аденозина, инозина. Последний обладает вазодилятаторным,
антиаритмическим, антиангинальным и антиагрегационным эффектом и
реализует свои эффекты через
Р1-Р2-пуринергические (аденозиновые)
рецепторы в различных тканях. Основное показание к применению АТФ в
настоящее время - купирование пароксизмов наджелудочковых
тахикардий.
Завершая характеристику антигипоксантов, необходимо еще раз
подчеркнуть, что применение данных препаратов имеет самые широкие
перспективы, поскольку антигипоксанты нормализуют саму основу
жизнедеятельности клетки – ее энергетику, определяющую все
остальные функции. Поэтому использование антигипоксических средств
в критических состояниях может предотвращать развитие необратимых
изменений в органах и вносить решающий вклад в спасение
больного.
Практическое использование препаратов данного класса должно
основываться на раскрытии их механизмов антигипоксического
действия, учете фармакокинетических особенностей, результатах
крупных рандомизированных клинических исследований и экономической
целесообразности.
Литература
-
Афанасьев В.В. Цитофлавин в интенсивной терапии: пособие для
врачей. СПб, 2006.
-
Биологические и клинические аспекты применения коэнзима
Q10 в кардиологнической практике. М., 2009.
-
Гипоксен. Применение в клинической практике (основные эффекты,
механизм действия, применение). М., 2009.
-
Гуревич К.Г. Применение триметазидина в современной клинической
практике. Фарматека. 2006; 5: 62-65.
-
Калвиньш И.Я. Милдронат. Механизм действия и перспективы его
применения. Рига, 2002.
-
Костюченко А.Л., Семиголовский Н.Ю. Современные реальности
клинического применения антигипоксантов. ФАРМиндекс: ПРАКТИК. 2002;
3: 102-122.
-
Кондрашова М.Н. Гормоноподобное действие янтарной кислоты. Вопр.
Биол. Мед. и Фарм. химии. 2002; 1: 7-12.
-
Лукьянова Л.Д. Молекулярные механизмы гипоксии и современные
подходы фармакологической коррекции гипоксических нарушений //
Фармакотерапия гипоксии и ее последствий при критических состояниях
/ Материалы Всероссийской научной конференции. СПб, 2004.
-
Одинак М.М., Скворцова В.И., Вознюк И.А. и др. Оценка
эффективности цитофлавина при остром ишемическом инсульте
(результаты многоцентрового открытого рандомизированного
контрольно-сравнительного исследования). Журнал неврологии и
психиатрии им. С.С. Корсакова. 2010; 12: 29-37.
-
Оковитый С.В., Смирнов А.В., Шуленин С.Н. Клиническая
фармакология антигипоксантов и антиоксидантов. СПб, 2005.
-
Перепеч Н.Б. Неотон (механизмы действия и клиническое
применение) / 2 издание. СПб, 2001.
-
Проблемы гипоксии: молекулярные, физиологические и медицинские
аспекты / Под ред. Л.Д.Лукьяновой, И.Б.Ушакова. М.-Воронеж,
2004.
-
Реамберин: реальность и перспективы / Сборник научных статей.
СПб, 2002.
-
Рогаткин С.О., Володин Н.Н., Дегтярева М.Г. и др. Современные
подходы к церебропротектороной терапии недоношенных новорожденных в
условиях отделения реанимации и интенсивной терапии. Журнал
неврологии и психиатрии им. С.С. Корсакова. 2011; 1: 37-33.
-
Смирнов А.В., Аксенов И.В., Зайцева К.К. Коррекция гипоксических
и ишемических состояний с помощью антигипоксантов. Воен. Мед. Журн.
1992; 10: 36-40.
-
Смирнов А.В., Криворучко Б.И. Антигипоксанты в неотложной
медицине. Анестезиол. и реаниматол. 1998; 2: 50-55.
-
Суслина З.А., Романцов М.Г., Коваленко А.Л. и др.
Терапевтическая эффективность инфузионного раствора цитофлавина в
клинической практике. Клиническая медицина. 2010; 4: 61-68.
-
Тихомирова О.В., Романцов М.Г., Михайлова Е.В., Говорова Л.В.
Патогенетически обоснованная направленность коррекции нарушений
антиоксидантной системы у детей с острыми кишечными инфекциями.
Эксперим. и клин. фармакол. 2010; 9: 28-34.
-
Chaitman B.R. Efficacy and safety of a metabolic modulator drug
in chronic stable angina: review of evidence from clinical trials.
J. Cardiovasc. Pharmacol. Ther. 2004; 9: S47-S64.
-
Colonna P., Illiceto S. Myocardial infarction and left
ventricular remodeling: results of the CEDIM trial. Am. Heart J.
2000; 139: S.124-S130.
-
He W., Miao F. J.-P., Lin D. C.-H. et al. Citric acid cycle
intermediates as ligands for orphan G-protein-coupled receptors.
Nature. 2004; 429:188-193.
-
Hermann H.P. Energetic stimulation of the heart. Cardiovasc
Drugs Ther. 2001; 15: 405-411.
-
Lopaschuk G.D. Optimizing cardiac energy metabolism: how can
fatty acid and carbohydrate metabolism be manipulated? Coron.
Artery Dis. 2001; 12: S8-S11.
-
Marzilli M. Cardioprotective effects of trimetazidine: a review.
Curr. Med. Res. Opin. 2003; 19: 661-672.
-
Minko T., Wang Y., Pozharov V. Remediation of cellular hypoxic
damage by pharmacological agents. Curr. Pharm. Des. 2005; 11:
3185-3199.
-
Morrow D.A., Scirica B.M., Karwatowska-Prokopczuk E. et al.
Effects of ranolazine on recurrent cardiovascular events in
patients with non–ST-elevation acute coronary syndromes. The
MERLIN-TIMI 36 randomized trial. JAMA. 2007; 297:
1775-1783.
-
Myrmel T., Korvald C. New aspects of myocardial oxygen
consumption. Invited review. Scand. Cardiovasc. J. 2000; 34:
233-241.
-
Sabbah H.H., Stanley W.C. Partial fatty acid oxidation
inhibitors: a potentially new class of drugs for heart failure.
Eur. J. Heart. Fail. 2002; 4: 3-6.
-
Schofield R.S., Hill J.A. Role of metabolically active drugs in
the management of ischemic heart disease. Am. J. Cardiovasc. Drugs.
2001; 1: 23-35.
-
Stanley W.C. Partial fatty acid oxidation inhibitors for stable
angina. Expert Opin. Investig. Drugs. 2002; 11: 615-629.
-
Stanley W.C., Chandler M.P. Energy metabolism in the normal and
failing heart: potential for theraputic interventions? Cardiovasc.
Res. 2002; 7: 115-130.
-
Stone P.H., Gratsiansky N.A., Blokhin A. et al. Antianginal
efficacy of ranolazine when added to treatment with amlodipine. The
ERICA (Efficacy of Ranolazine in Chronic Angina) Trial. J. Am.
Coll. Cardiol. 2006; 48: 566–575.
-
Wolff A.A., Rotmensch H.H., Stanley W.C., Ferrari R. Metabolic
approaches to the treatment of ischemic heart disease: the
clinicans` perspective. Heart Failure Reviews. 2002; 7:
187-203.
