Цель работы – исследование клинической эффективности препарата «Реамберин» для профилактики и терапии постгипоксических поражений ЦНС у новорожденных детей и выявление оптимальных сроков его назначения. Под наблюдением находились 89 недоношенных новорожденных, родившихся в тяжелом состоянии, нуждавшихся в проведении интенсивной терапии после оказания первичной реанимационной помощи. Терапию Реамберином, которая была начата в первые 12 ч жизни, получали 18 детей; 22 ребенка начали получать лекарственное средство после 48 ч жизни; остальные дети составили группу контроля. Для оценки эффективности проводимой терапии, наряду со стандартными клинико-инструментальными методами использовали определение нейроспецифических белков в сыворотке крови (GFAP, NSE и МВР). Полученные результаты продемонстрировали церебропротекторный эффект Реамберина. В группе пациентов с ранним началом терапии данным препаратом были отмечены достоверное сокращение сроков пребывания на ИВЛ, снижение частоты выявления ПВЛ и более низкие уровни сывороточных концентраций нейроспецифических антигенов.
Важнейшей проблемой современной перинатологии является поиск путей снижения перинатальной смертности, заболеваемости и ранней детской инвалидности. Перинатальные факторы обуславливают 70-80% заболеваний нервной системы, приводящих в дальнейшем к инвалидизации и социальной дезадаптации [1, 4, 7]
Гипоксия, являясь фактором повреждения мозга, плода или новорожденного при самых разнообразных патологических состояниях, приводит к нарушению процессов аэробного гликолиза и прогрессирующему снижению уровня макроэргических соединений в клетках нервной ткани [3, 6, 10, 12, 18, 19, 23, 27].
Результаты многочисленных экспериментов по исследованию механизмов постгипоксического поражения ЦНС свидетельствуют о том, что своевременное фармакологическое вмешательство в каскад инициированных гипоксией процессов может в ряде случаев предотвратить повреждение клееток нервной ткани, ограничить очаг поражения и улучшить неврологический исход [3-5, 12, 19, 20, 23, 28]. Промежуток времени – «терапевтическое окно», в течение которого фармакологическое вмешательство с церебропротекторной целью может оказаться эффективным, по данным литературы, колеблется от 6 до 100 ч жизни, а по мнению большинства исследователей, ограничивается первыми 48 ч жизни [3, 23, 27, 28].
В связи с этим чрезвычайно актуальным для неонатальной практики является поиск новых, эффективных препаратов, способных защищать клетки головного мозга новорожденных, как в первые часы жизни, так и в более поздний период. Этим требованиям отвечает отечественный препарат Рееамберин» («Полисан», Россия) [6, 9, 11]. Реамберин – сбалансированный изотонический инфузионный раствор с антигипоксическим действием, содержащий в качестве основного действующего вещества сукцинат натрия (1,5% или 0,05 ммоль/мл). Помимо соли янтарной кислоты, в состав лекарственного средства (ЛС) входит натрия хлорид (0,6%), калия хлорид (0,03%) и магния хлорид 0,012%) [9, 11].
Янтарная кислота, являясь универсальным внутриклеточным метаболитом, позволяет восполнять фонд макроэргических соединений в анаэробных условиях и обладает выраженными антиоксидантными свойствами [2, 6, 8, 10, 11]. В силу того, что янтарная кислота является неспецифическим энергоносителем, все ткани организма могут использовать ее в качестве альтернативного источника энергии, что обуславливает широкий диапазон ее фармакологического действия [2, 8, 10, 14].
Сочетание традиционных клинико-инструментальных и временных нейроиммунохимических (детекция нейроспецифических белков в сыворотке крови) методов обследования является, по нашему мнению, наиболее адекватным способом оценки проводимого нейропротекторного лечения [3-5, 12, 13, 18, 22].
Многочисленные научные исследования продемонстрировали, что параллельное изучение концентрации в сыворотке крови таких нейроспецифических белков, как GFAP, NSЕ и МВР, позволяет адекватно оценивать состояние практически всех основных клеточных популяций нервной ткани и косвенно судить об эффективности проводимой церебропротекторной терапии [3, 4, 12, 13, 15, 20-22, 24, 25]. Целью нашего исследования было изучение церебропротекторных свойств препарата «Реамберин» в комплексной профилактике и терапии гипоксически-ишемических порражений ЦНС у новорожденных детей различного гестационного возраста и выявление оптимальных сроков его значения.
Пациенты и методы
Под нашим наблюдением находились 89 недоношенных детей со сроком гестации от 28 до 35 нед и массой тела при рождении от 910 до 2900 г, оценкой по шкале Апгар на 1-й минуте 5-7 баллов, на 5-й минуте 6-8 баллов, родившихся в городской больнице №8 г. Москвы в 2003-2004 гг.
В исследование были включены младенцы, родившиеся в тяжелом состоянии и нуждавшиеся в проведении реанимации и интенсивной терапии. Дети с пороками развития головного мозга и внутренних органов в данное исследование включены не были.
В основную группу вошли 40 новорожденных, которым проводилась терапия Реамберином. Препарат вводился вместе с раствором 5 или 10% глюкозы внутривенно с помощью инфузионного насоса равномерно в течение суток со скоростью от 3 до 6 мл/ч. Суточная доза составляла 5 мл/кг (75 мг/кг/сут - сукцината натрия). Общая продолжительность курса лечения - 5 сут.
Нами было опробованы две схемы назначения ЛС: 18 новорожденным, вошедшим в IA подгруппу, Реамберин начали вводить в первые 12 ч после рождения, а остальные 22 ребенка, которые составили 1Б подгруппу, стали получать препарат после 48 ч жизни.
В контрольную группу вошли 49 новорожденных, которым проводилась посиндромная интенсивная терапия.
Все группы сравнения были сопоставимы по факторам анте- и интранатального риска, сроку гестации, массе тела при рождении и оценке по шкале Апгар на 1-й и 5-й минуте.
Тяжесть состояния в раннем неонатальном периоде у всех наблюдавшихся новорожденных обусловливалась сочетанием тяжелой дыхательной недостаточности (РДС, внутриутробная пневмония и др.) с нарушениями системной гемодинамики.
В связи с тяжестью состояния и развитием синдромов дезадаптации всем детям, вошедшим в данное исследование, с рождения проводился комплекс мероприятий интенсивной терапии и реанимации, включавший ИВЛ, инфузионную, антибактериальную и симптоматическую терапию. Церебральная ишемия 2-3 степени была отмечена у младенцев во всех обследованных группах. В качестве сопутствующих диагнозов выявлены недостаточность кровообращения, конъюгационная гипербилирубинемия, общий отечный и кожно-геморрагический синдромы.
За всеми пациентами, находившимися в отделении реанимации, проводился круглосуточный мониторный контроль с регистрацией ЧСС, АД, sO2. Оценивались показатели суточного диуреза и динамика весовой кривой.
Динамика неврологического статуса оценивалась с использованием «Классификации перинатальных поражений нервной системы у новорожденных» [7].
Нейросонография осуществлялась на 1, 3, 5 сут, а затем еженедельно или 1 раз в 2 нед по показаниям. Наряду со стандартными клинико-лабораторными исследованиями (КОС, биохимическое и клиническое исследование крови, мочи и др.) проводилось динамическое определение сывороточной концентрации нейроспецифических белков на 1, 7, 14 и 28 сут. жизни (нейроспецифической енолазы – NSE, глиофибриллярного кислого белка – GFAP, основного белка миелина – МВР).
Количественное определение уровней НСБ в венозной крови проводили с помощью иммуноферментного анализа с использованием специфических тест-систем на основе моноклональных антител, разработанных в лаборатории иммунохимии ГНЦССП им. В.П.Сербского [13, 15].
Результаты исследования
При детальном сравнительном анализе динамики клинического состояния детей обследованных групп выяснилось, что продолжительность ИВЛ с использованием высоких концентраций О2 (более 60%) была достоверно меньше в IA подгруппе – у новорожденных, получавших терапию «Реамберином» с первых часов жизни (14±18,9 ч), в то время как в IБ длительность вентиляции в режиме гипероксигенации составила 27,5±34,1 ч, в контроле – 30,6±28,7 ч.
Сравнение по такому показателю, как общая продолжительность ИВЛ, позволило выявить, что необходимость проведения ИВЛ в IA подгруппе была достоверно ниже по сравнению с группой контроля (12,4 и 7,7 сут, соответственно). В IБ подгруппе она также была ниже (9, 3 сут), чем в контрольной группе, однако достоверно не отличалась (рис. 1).
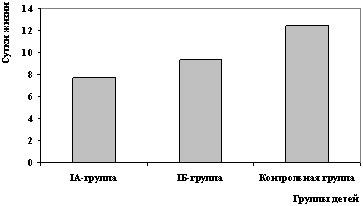
Рис. 1. Длительность проведения ИВЛ
у детей исследованных групп
Церебральная ишемия различной степени тяжести в виде гипоксически-ишемических или гипоксически-геморрагических повреждений диагностировалась у всех наблюдавшихся новорожденных на основании данных анамнеза, оценки динамики неврологического статуса и результатов нейросонографического обследования.
В IA подгруппе в неврологическом статусе преобладал синдромом угнетения с элементами возбуждения (44,5%). У детей IБ и контрольной групп ведущим отмечался синдром угнетения – 50 и 61 % случаев, соответственно.
Частота выявления неонатальных судорог была сопоставима во всех группах сравнения и составила 33,3% в IA подгруппе, 31,8 – в 1Б подгруппе и 26,5% в группе контроля.
При динамическом нейросонографическом исследовании было установлено, что пери- и интравентрикулярные кровоизлияния (ПВК/ИВК) различной степени тяжести регистрировались реже у детей основной группы (IA, IБ), тем не менее достоверной разницы по частоте их развития при сравнении с группой контроля не выявлено. Так, частота ПВК/ИВК в IA и IБ подгруппах составила 39 и 45%, соответственно, а в группе контроля – 54%.
Тяжелые формы ПВК/ИВК (III-IV степени) не были выявлены ни у одного ребенка IA подгруппы. В IБ подгруппе ПВК/ИВК III-IV степени были диагностированы у 4,6% детей, а в контрольной группе в 8,3% случаев (рис. 2).
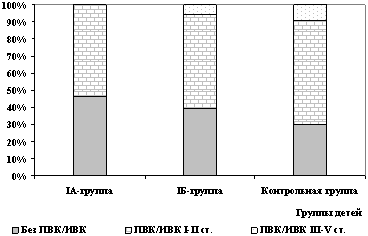
Рис. 2. Частота выявления ПВК/ИВК
у детей исследованных групп
Очаговые ишемические поражения головного мозга в виде перивентрикулярных лейкомаляций (ПВЛ) не обнаружены при НСГ в течение всего периода наблюдения в IA подгруппе.
В IБ подгруппе (получавшей Реамберин после 48 ч жизни) частота выявления ПВЛ была минимальной и составила 4,6%, в то же время в группе контроля ПВЛ диагностировалось достоверно чаще (в 14,3% случаев) по сравнению с IA подгруппой (рис. 3).
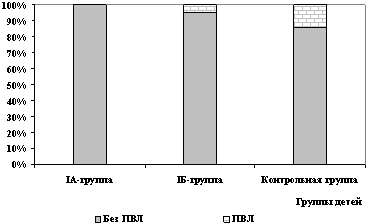
Рис. 3. Частота выявления ПВЛ
у детей исследованных групп
Для более углубленного контроля за состоянием нервной ткани и ее различных клеточных пулов, а также для дополнительной оценки степени тяжести и объема гипоксически-ишемического и гипоксически-геморрагических повреждений нами проанализирована динамика изменений сывороточных концентраций НСБ от момента рождения до 1 мес жизни.
Исходные уровни GFAP были значительно повышены по сравнению с показателями, полученными другими исследователями, у условно здоровых доношенных новорожденных [5, 15, 18].
Уровни GFAP в сыворотке крови у детей первых суток жизни до начала лечения в основной группе и группе контроля достоверно не отличались и составили 32,8 ± 8,3 нг/мл в IA подгруппе, 32,9 ± 8,3 нг/мл в IБ и 32,7 ± 9,8 нг/мл в контрольной группе.
Начиная с 7 сут жизни отмечено снижение уровня данного антигена в сыворотке крови у всех обследованных детей. При этом концентрация GFAP оставалась достоверно ниже (р<0,05) у детей IA подгруппы при сравнении с группой контроля вплоть до 1 мес жизни. При сравнении IБ подгруппы с контрольной группой достоверных различий не выявлено, несмотря на то, что уровни GFAP в период с 7 сут до 1 мес жизни в этой подгруппе также были более низкими, чем в контрольной группе (рис. 4).
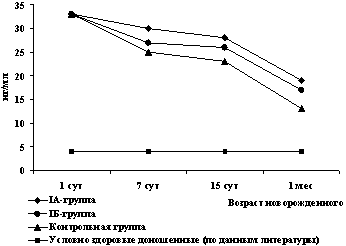
Рис. 4. Динамика сывороточной концентрации GFAP
у обследованных новорожденных
При сопоставлении наших данных с результатами других исследователей [15, 16, 21, 24] установлено, что исходный уровень NSE в сыворотке крови до начала терапии Реамберином был значительно выше нормативных показателей (рис. 5) и не имел достоверных отличий при сравнении всех обследованных детей (29,7±8,9 нг/мл – в IA; 28,4±11 нг/мл – в IБ; 29,6±10,7 нг/мл – в контрольной группе).
При дальнейшем наблюдении отмечено снижение концентрации данного антигена, которое продолжалось до 2-недельного возраста. При этом на 7 и 14 сут в IA подгруппе концентрация NSE в сыворотке крови была достоверно ниже сравнению с контрольной группой (рис. 5).
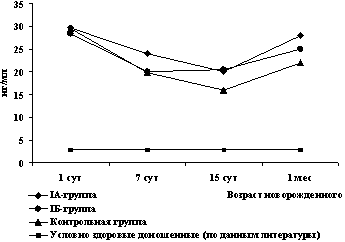
Рис. 5. Динамика сывороточной концентрации NSE
у детей исследованных групп
К месячному возрасту у всех детей зафиксировалось повторное повышение концентрации данного белка, при этом достоверные отличия отмечались только при сопоставлении показателей IA подгруппы и группы контроля.
Базальный уровень МВР в первые 24 ч жизни практически не отличался от показателей, полученных другими авторами [13, 15, 18, 26] для условно здоровых доношенных детей, и не имел достоверных различий среди детей обследованных групп (2,1±1,1 и 1,9±0,6 нг/мл в IA и IБ подгруппах, соответственно; 2,1±1,0 нг/мл в контрольной группе) (рис. 6).
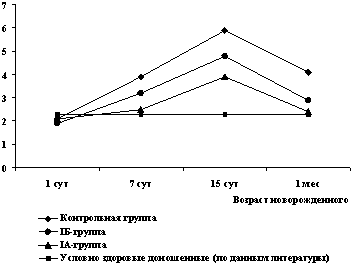
Рис. 6. Динамика сывороточной концентрации МВР
у детей
исследованных групп
Однако в дальнейшем, начиная с 7 сут жизни, во всех группах отмечено увеличение сывороточной концентрации данного белка с максимальными значениями к 14 сут. В течение всего этого периода достоверно более низкие показатели МВР отмечались у детей IA подгруппы по сравнению с группой контроля (р < 0,05). К 1 мес жизни отмечено снижение концентрации МВР у всех детей, но в контрольной группе его уровень по-прежнему оставался достоверно более высоким, чем в IA подгруппе.
Обсуждение
Как упоминалось выше, все обследованные группы детей были сопоставимы по отягощающим факторам материнского анамнеза, сроку гестации, массе тела при рождении и оценкам по шкале Апгар на 1-й и 5-й минутах. Кроме того, все три группы практически не отличались друг от друга по тяжести состояния при рождении и характеру патологических состояний, осложнявших период ранней неонатальной адаптации. Эти условия позволили нам провести достаточно корректное сравнение между группами в зависимости от особенностей проводимого лечения.
В целом у детей основной группы (IA и IБ подгруппы), получавших терапию Реамберином, отмечено сокращение времени пребывания на ИВЛ и длительности проведения респираторной поддержки в режиме гипероксигенации. Данный факт, вероятно, связан с тем, что сукцинат натрия, оказывая системное антигипоксическое действие, приводит к более быстрой нормализации показателей КОС и тканевого кислородного гомеостаза [2, 8, 10].
Кроме того, у новорожденных основной группы (IA, IB подгруппы) отмечено снижение частоты развития ПВК/ИВК (особенно их тяжелых форм). По нашему мнению, это обусловлено достоверно более коротким периодом времени, в течение которого им требовалась интенсивная респираторная поддержка (ИВЛ), являющаяся серьезным фактором риска возникновения и прогрессирования ПВК/ИВК у недоношенных новорожденных [19, 20, 23, 27, 28].
Следует отметить, что у части детей IA и IБ подгрупп уже в первые сутки жизни при НСГ-исследовании были выявлены ПВК/ИВК I-II степени, тем не менее, в подгруппе (IA) не зарегистрирован ни один из случаев прогрессирования ПВК/ИВК от I до III-IV степени.
У детей, которым внутривенное введение Реамберина было начато в первые 12 ч жизни (подгруппа IA), при анализе результатов НСГ-исследований не выявлено ни одного случая развития кистозных форм ПВЛ, в то время как у пациентов в подгруппе IБ с поздним началом терапии (после 48 ч жизни) зарегистрированы, хотя и в значительно меньшем проценте случаев по сравнению с контролем, множественные ПВЛ. Эти клинико-инструментальные данные свидетельствуют о более высокой терапевтической эффективности сукцината натрия в случае его раннего применения после рождения по сравнению с отсроченным началом терапии.
Дополнительным подтверждением изложенной нами точки зрения являются данные, полученные в результате динамического исследования сывороточных концентраций нейроспецифических белков. Исходные сывороточные уровни НСБ у всех обследованных детей до начала терапии Реамберином не имели между собой достоверных различий. Данный факт позволяет предположить, что исходная тяжесть гипоксически-ишемических поражений нервной системы к началу терапии у всех детей была сопоставима. Однако уже к 7 сут жизни и до 1 мес показатели всех трех антигенов были ниже у детей, получавших Реамберин в составе комплексной инфузионной терапии. Это дает нам основание считать, что сукцинат натрия, содержащийся в препарате, обладает антигипоксантными и нейропротек-тивными свойствами.
Согласно современным данным отечественных и зарубежных исследователей, наиболее ранним маркером ишемически-гипоксического повреждения нервной ткани является повышение уровня GFAP, отражающего гибель астроцитов - клеток, формирующих перинейрональное микроокружение и являющихся неотъемлемым компонентом гематоэнцефалического барьера [3, 5, 12, 23, 25, 27].
Подъем сывороточного уровня NSE обычно регистрируется в более позднем периоде и свидетельствует о повреждении нейроцитов [3, 5, 15, 16, 18], что согласуется с данными, полученными нами в более ранних исследованиях [3, 12]. Во всех группах к месячному возрасту зафиксировано повторное нарастание уровня NSE, обусловленное, по-видимому, второй волной нейрональных потерь на фоне различных осложнений, развившихся в период проведения интенсивной терапии (РДС, сердечно-сосудистые, водно-электролитные нарушения, инфекционные и др.) [12, 15, 19, 27]. Тем не менее, не исключено, что этот повторный пик может быть обусловлен развитием аутоиммунных реакций в условиях поврежденного гематоэнцефалическбго барьера (образование аутоантител к NSE) и усилением нейродеструктивных процессов в ЦНС [3, 12, 15, 23, 25].
В группе детей (подгруппа IA), получавших антиоксидантную терапию Реамберином с первых часов жизни, регистрировались достоверно более низкие уровни GFAP и NSE в сравнении с группой контроля в период с 7 по 28 сут. Данный факт позволяет предположить, что церебропротекторное действие препарата проявляется не только непосредственно во время его постоянного парентерального введения, но и продолжается даже после его отмены.
По данным литературы, сывороточная концентрация МБР дает возможность косвенно судить о тяжести деструктивных процессов в белом веществе головного мозга [12, 13, 25, 26]. Анализ полученных нами результатов позволяет говорить о том, что повреждение перивентрикулярного белого вещества отмечалось у всех обследованных новорожденных. Это подтверждается значительным повышением сывороточного уровня МВР по сравнению с исходным к 2-недельному возрасту. Однако на основании динамического НСГ-исследования установлено, что тяжесть поражения белого вещества у них была различной. Несмотря на то, что практически у всех детей в течение первых 2 нед жизни при НСГ-исследовании регистрировалось повышение эхогенности перивентрикулярных зон, только у незначительного их числа из контрольной группы и IБ подгруппы к 3-4-недельному возрасту отмечено развитие кистозных форм ПВЛ. У детей IA подгруппы, которым лечение Реамберином было начато в течение первых 12 ч жизни, уровень МВР в сыворотке крови, начиная с 7 сут жизни и до 28 сут, оставался достоверно более низким по сравнению с контролем, и у них не выявлено ни одного случая развития ПВЛ.
Выводы
- Применение инфузионных растворов на основе сукцината натрия оказывает достоверный церебропротекторный эффект у недоношенных новорожденных, перенесших перинатальную гипоксию.
- Церебропротекторные свойства Реамберина выражены более отчетливо при его раннем назначении недоношенным новорожденным (в первые 12 ч жизни). Положительные эффекты от проведенного лечения сохраняются в течение всего неонатального периода.
- Системное антигипоксическое и антиоксидантное действие Реамберина позволяет сократить продолжительность ИВЛ и снизить частоту осложнений, связанных с ее проведением.
- Применение Реамберина достоверно снижает частоту возникновения перивентрикулярных лейкомаляций у недоношенных новорожденных, нуждающихся в проведении ИВЛ и интенсивной терапии.
Литература
- Барашнев Ю.И. Прогресс перинатальной неврологии и пути снижения детской инвалидности. Педиатрия 1994; (5): 91-108.
- Васильев С.Ц. Эффективность применения янтарной кислоты в комплексном лечении детей с митохондриальными энцефаломиопатиями и с другими заболеваниями с митохондриальной дисфункцией. Автореф. дисс. ... канд. мед. наук. М., 2002; 29.
- Володин Н.Н., Рогаткин C.O., Турина О.И. Перспективы иммунологического определения нейроспецифических белков для диагностики перинатальных поражений ЦНС у новорожденных. Педиатрия 2001; (4): 35-43.
- Володин Н.Н., Рогаткин C.O., Медведев M.l/i. Актуальные проблемы перинатальной неврологии на современном этапе. Неврологии и психиатрии 2001; 101(7): 4-9.
- Турина О.И. Клинико-иммунохимическая оценка нарушений функций гематоэнцефалического барьера у новорожденных детей с перинатальными поражениями ЦНС Автореф. дисс.... канд. мед. наук. 1996; 142.
- Исаков В.А., Сологуб Т.В., Коваленко А.Л., Романцов М.Г. Реамберин в терапии критических состояний. СПб., 2002; 10.
- Классификация перинатальных поражений нервной системы у новорожденных. Методические рекомендации. М.: ВУНМЗ МЗ РФ, 2000; 40.
- Кондрашева М.Н. Механизмы физиологической активности янтарной кислоты и рекомендации к ее применению. Клинические и патогенетические проблемы нарушения клеточной энергетики (митохондриальная патология). М., 1999; 33-4.
- Лазарев В.В., Лекманов А.У., Михельсон В.А. Применение реамберина-1,5% раствора для инфузий при интенсивной терапии и анестезии у детей. Методическое пособие. М., 2003; 17-23.
- Реамберин в терапии критических состояний. Сборник статей. Под ред. М.Г. Романцова. СПб., 2002; 9.
- Регистр лекарственных средств России. Ежегодный сборник; 10 изд. М., 2003; 714.
- Рогаткин C.O., Блинов Д.В., Володин Н.Н. и соавт. «Перспективы применения иммуноферментного анализа нейроспецифических антигенов в перинатальной неврологии». Вопросы гинекологии, акушерства и перинатологии 2003; 2(4): 8-13.
- Семенова А.В. Основной белок миелина (получение моноклональных антител, разработка иммуноферментного анализа и клинико-лабораторное применение). Автореф. дисс.... канд. мед. наук. М., 2002.
- Терапевтическое действие янтарной кислоты. Под ред. М.Н.Кондрашевой. Пущино: Институт Биофизики АН СССР, 1976; 234
- Чехонин В.П., Дмитриева Т.Б., Жирков Ю.А. Иммунохимический анализ нейроспецифических антигенов. М.: Медицина, 2000; 415.
- Blennow M., Savman К., lives P. et al. Brain-specific proteins in the cerebrospinal fluid of severely asphyxiated newborn infants. Acta Paediatr 2001; 90:1171-5.
- Cherkes-Julkowski M. Learning disability, attention-deficit disorder, and language impairment as outcomes of prematurity: a longitudinal descriptive study. J Learn Disabil 1998; 31(3): 294-306.
- Dijkhuizen R.M., Knollema S., Bart van der Worp H. et al. Early Biochemical Indicators of Hypoxic-lschemic Encephalopathy after Birth Asphyxia. Pediatric Res 2001; 49(4).
- Donna M., Feriero M. Medical progress. Neonatal Brain Injury. N Eng J Med 2004; 351:1985-95.
- Du-Plessis A.J., Volpe J.J. Perinatal brain injury in the preterm and term newborn. Curr Opin Neural 2002; 15(2): 151-7.
- Ezgu F.S., Atalay Y., Gucuyener K. et al. Neuron-specific enolase levels and neuroimaging in asphyxiated term newboms. J Child Neural 2002; 17(11): 824-9.
- Herrmann M., Curio N., Jost S, et al. Protein S-100B and neuron specific enolase as early neurobiochemical markers of the seventy of traumatic brain injury. Restor Neural Neurosci 1999; 14:109-14.
- Kermer P., Klocker N., Bahr M. Neuronal death after brain injury (models, mechanisms, and therapeutic strategies in vivo). Cell Tissue Res 1999; 298: 383-95.
- Missler U., Wiesmann M., Friedrich C, Kaps M. S-100 protein and neuron-specific enolase concentrations in blood as indicators of infarction volume and prognosis in acute ischemic stroke. Stroke 1997; 28:1956-60.
- Nagdyman N., Komen W., Ко Н. et al. Early Biochemical Indicators of Hypoxic-lschemic Encephalopathy after Birth Asphyxia. Pediatr Res 2001; 49(4).
- Rezaie P., Dean A. Periventricular leukomalacia, inflammation and white matter lesions within the developing nervous system. Neuropathology 2002; 22(3): 106-32.
- Volpe J.J. Neurology of the Newborn. 4-rd ed. Philadelfia: W.B.Saunders, 2000.
- Yossi Gilgan-Sherki et al. Antioxidant therapy in Acute Central Nervous System Injury: Carrent State. Pharmacol Rev 2002; 54: 271-84.