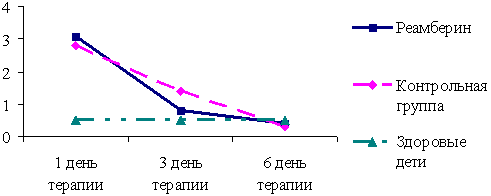Список сокращений
АОЗ – антиоксидантная защита
ВНСММ – вещества низкой и средней молекулярной массы
ЛИИ – лейкоцитарный индекс интоксикации
ОКИ – острые кишечные инфекции
СРО – свободнорадикальное окисление
ХЛ – хемилюминесценция
ЭИ – эндогенная интоксикация
ВВЕДЕНИЕ
Проблема бактериальной дизентерии, по-прежнему, является одной
из наиболее актуальных в педиатрии, что обусловлено ее повсеместным
распространением, высоким уровнем заболеваемости и нередко тяжелым
течением, особенно в детском возрасте [Покровский В.И., 2003; Г.Г.
Онищенко, 2002]. Несмотря на стабилизацию эпидемиологической
ситуации по дизентерии в Санкт-Петербурге и наметившуюся тенденцию
к снижению заболеваемости, в целом по России дизентерия занимает
лидирующую позицию среди расшифрованных острых кишечных инфекций
[В.Ф. Учайкин и соавт., 2002; Ю.В.Лобзин, 2002]. Превалирование в
последние годы в эпидемическом процессе штаммов шигелл Флекснера,
по данным многих авторов, привело к увеличению частоты регистрации
тяжелых форм и осложненного течения дизентерии [Тихомирова О.В. и
соавт., 2002; Е.В.Ставицкая, 1997, Н.В. Воротынцева, Л.Н.
Мазанкова, 2001]. Повреждение, вызванное патогеном, кроме местных
изменений сопровождается развитием общей реакции организма на
инфекционный стресс. У детей шигеллезная инфекция нередко
сопровождается развитием инфекционного токсикоза, дегидратации и
дисметаболических нарушений, что в острый период заболевания
обуславливает особую тяжесть состояния ребенка [Учайкин В.Ф.,
Молочный В.П., 2002; Макаренко В.Д. и соавт, 2004; Жумагалиева
Г.Д., 2001].
Известно, что тяжесть течения и исход инфекционного процесса во
многом зависит от адаптивных возможностей макроорганизма,
качественного состояния клеток крови, их функциональной активности,
что в свою очередь обусловлено метаболическими сдвигами в них [Н.Д.
Ющук и соавт., 2002, Pavlick K.P., et al., 2002; Sies H., 1999].
Повреждение, вызванное патогеном, кроме местных изменений
сопровождается развитием общей реакции организма на инфекционный
стресс. Активация процессов катаболизма, чрезмерное накопление
продуктов промежуточного и конечного обмена при несостоятельности
систем детоксикации, приводит к развитию синдрома эндогенной
интоксикации и изменению метаболизма клеток макроорганизма
[Корякина Е.В., Белова С.В., 2004; Айзенберг В.Л., Загузова Л.И.,
2003]. Выраженность эндотоксикоза при различной патологии
характеризуется избыточным поступлением в кровь эндогенных
продуктов белкового распада, так называемых молекул средней массы
[Мельцер И.М., 2004; Салихова Н.Н., 1996; Мухаммедов Н.Б., 2002;
Нагоев Б.С., 1997]. В настоящее время разработаны различные
модификации определения уровня эндотоксемии, одна из которых
предложена Малаховой М.Я. (1995). Этот метод позволяет оценить не
только количественную характеристику уровня средне- и
низкомолекулярных веществ, но и определить изменения качественного
состава метаболитов, что особенно важно при инфекционной патологии.
Кроме того, параллельное изучение концентрации ВНСММ в плазме крови
и эритроцитах позволяет оценить состоятельность детоксикационных
возможностей макроорганизма, направленных на элиминацию токсических
метаболитов.
Одним из ведущих механизмов развития эндотоксикоза является
активация процессов свободнорадикального окисления (СРО), что с
одной стороны играет роль неспецифической защиты организма, с
другой – способна приводить к существенным повреждениям клеточных
мембран, органов и систем [Е.Е. Дубинина, 1998, Л.В. Говорова,
2002]. Многие исследователи указывают на влияние бактериального
липополисахарида на активацию процессов свободнорадикального
окисления. Однако вопросы взаимосвязи нарушений баланса СРО,
системы антиоксидантной защиты и эндотоксикоза между собой, а также
выраженности метаболических нарушений с этиологией и формой тяжести
дизентерии у детей до настоящего времени остаются открытыми.
Своевременная диагностика выраженности метаболических нарушений
с использованием современных методов позволяет объективно оценить
выраженность интоксикационного синдрома, а также определить тактику
рациональной дезинтоксикационной терапии. К патогенетической
терапии среднетяжелых и тяжелых форм дизентерии относится
обязательная инфузионная терапия, направленная на улучшение
реологии крови, ускорение элиминации токсинов из организма,
регидратацию и поддержание водно-электролитного обмена. В связи с
этим представляется актуальной апробация новых препаратов для
купирования симптомов интоксикации, таких как реамберин. Препарат
представляет собой раствор для инфузий, содержащий активное
вещество – 2-дезокси-d-глюцитол аммония, натрия сукцинат (2%),
магния хлорид (0,012%), калия хлорид (0,3%), натрия хлорид (0,06%),
воды для инъекций до 100%. Препарат представляет собой бесцветную
прозрачную жидкость, без запаха. Основной фармакологический эффект
препарата обусловлен способностью усиливать компенсаторную
активацию аэробного гликолиза, снижать степень угнетения
окислительных процессов в цикле Кребса в дыхательной цепи
митохондрий клеток с увеличением внутриклеточного фонда
макроэнергетических соединений аденозинтрифосфата и
креатинфосфата.
Целью исследования явилось определение эффективности препарата
реамберин (1,5% инфузионный раствор) в терапии среднетяжелых и
тяжелых форм дизентерии у детей путем комплексной оценки оценки
клинических данных, показателей эндогенной интоксикации и процессов
свободнорадикального окисления.
Задачи исследования.
Определить клинические особенности интоксикационного синдрома у
детей, больных бактериальной дизентерией и получавших в комплексе
терапии препарат реамберин.
Изучить воздействие препарата реамберин на выраженность
эндогенной интоксикации по спектру веществ низкой и средней
молекулярной массы (ВНСММ) в эритроцитах и плазме крови у детей,
больных дизентерией.
Установить характер изменения процессов свободнорадикального
окисления в эритроцитах и плазме крови у больных дизентерией детей,
получавших реамберин.
Разработать показания к назначению и рациональные схемы терапии
реамберином у больных дизентерией детей.
Материалы, объем и методы исследования
Проведено комплексное клинико-лабораторное обследование 79 детей
в возрасте от 1-го года до 14 лет, больных бактериальной
дизентерией и находившихся в клинике Научно-исследовательского
института детских инфекций г. Санкт-Петербурга.
Среди госпитализированных больных преобладали пациенты старше
3-х лет (88,0%). Этиология заболевания подтверждалась
бактериологическими и серологическими методами. Дизентерия
Флекснера была зарегистрирована у 76,8% детей, дизентерия Зонне – у
23,2% больных. В структуре шигеллеза Флекснера преобладали
сероварианты 2а и 3а, доля которых составила 40,4% и 46,8%
соответственно. Дизентерия Флекснера, обусловленная другими
серовариантами (2в, 3в, 4, 6), наблюдалась у 6,4% детей.
Для изучения эффективности реамберина методом случайной выборки
больные были распределены на 2 группы: группу получавших реамберин
составили 35 человек, группу сравнения - 44 ребенка. Группы были
репрезентативны по возрасту, полу, структуре и тяжести заболевания,
получали традиционную этиотропную и патогенетическую терапию,
симптоматические средства. Комплекс патогенетических мероприятий у
100% больных включал парентеральное введение жидкости. Показаниями
к назначению инфузионной терапии являлась выраженность симптомов
интоксикации и дегидратации.
Реамберин включался в программу инфузионной терапии в острый
период заболевания с первых дней госпитализации. Доза введения
препарата составляла 10 мл/кг в сутки, продолжительность лечения
зависела от выраженности интоксикационного синдрома и не превышала
2-3 дней. В группе сравнения в эти же сроки применяли
глюкозо-солевые растворы (хлосоль, раствор глюкозы 5%, раствор
Рингера, раствор глюкозы 10% с электролитами).
Лабораторное обследование больных проводилось в динамике
заболевания – при поступлении, на 3-5 день и 7-9 день терапии с
использованием комплекса методов. Уровень веществ низкой и средней
молекулярной массы в эритроцитах и плазме крови исследовали по
методу Габриэлян Н.И., в модификации Малаховой М.Я. (1995). Помимо
расчета суммарного количества веществ низкой и средней молекулярной
массы (ВНСММ) в плазме и эритроцитах крови, строили спектрограмму
на персональном компьютере, а также рассчитывали соотношение ВНСММ
плазмы и эритроцитов – индекс распределения - для оценки
детоксикационных возможностей крови. Исследование концентрации
сывороточного альбумина проводили с помощью сертифицированных
наборов «Клини Тест-АЛ» научно-производственного центра
«ЭКО-СЕРВИС». Лейкоцитарный индекс интоксикации (ЛИИ) рассчитывали
на основании гемограммы по формуле, предложенной Кальф-Калифом
(1947). Для характеристики интенсивности свободнорадикального
окисления (СРО) проводили исследование хемилюминесценции (ХЛ)
плазмы и эритроцитов в присутствии люминола при инициации процессов
добавлением гидроперекиси. Для регистрации свечения в работе
использовали флюорат - 02 М АБЛФ производства Санкт-Петербург.
Интенсивность образования активных форм кислорода и интенсивность
антиоксидантной защиты (АОЗ) оценивали по времени развития (t ХЛ) и
величине пика хемилюминесценции (ХЛмакс), по остаточному значению
хемилюминесценции через 1 мин от начала инициации (ХЛ1), по
светосумме хемилюминесценции за 1 мин (е ХЛ1), по проценту
торможения хемилюминесценции через 1 мин, который рассчитывали по
формуле: ( ХЛ1/ХЛмакс) х100%.
Контрольную группу составили 16 практически здоровых детей в
возрасте от 2-х до 14 лет, не имеющих существенных отличий по
фоновой и сопутствующей патологии с детьми основной группы.
Статистическая обработка полученных данных производилась на ПК
Pentium III с помощью пакета прикладных программ Microsoft Exel
2000, StatSoft Statistica v 6.0 с использованием параметрических
(t-тест) и непараметрических (критерий U Манна-Уитни) методов
вариационной статистики [Юнкеров В.И., Григорьев С.Г., 2002].
Достоверность различий определялась по критерию t Стьюдента,
различия считались достоверными при р<0,05.
Клиническая эффективность
использования раствора реамберина
у больных дизентерией детей
Комплексный анализ клинического течения дизентерии у детей
позволил выявить зависимость продолжительности основных проявлений
заболевания от варианта инфузионной терапии (рис. 1). Так, у
больных, получавших в составе инфузионной программы реамберин,
применение препарата способствовало более быстрому купированию
общеинфекционных симптомов. Длительность анорексии и вялости на
фоне проводимой терапии была достоверно меньше и составила 2,5±0,4
и 2,8±0,3 дней соответственно против 4,3±0,6 и 4,1±0,4 дней у
больных группы сравнения (p<0,05). Отмечена тенденция к
сокращению длительности тахикардии (1,8±0,3 против 2,1±0,4 дней) и
лихорадочного периода (2,2±0,3 против 2,8±0,5 дней) в стационаре
при использовании реамберина (p>0,05). Достоверных отличий
продолжительности местных воспалительных изменений дизентерии в
зависимости от варианта терапии не установлено, однако выявлена
очевидная тенденция к сокращению выявления примеси крови в
испражнениях детей, получавших реамберин (1,7±0,3 против 2,3±0,2
дней).
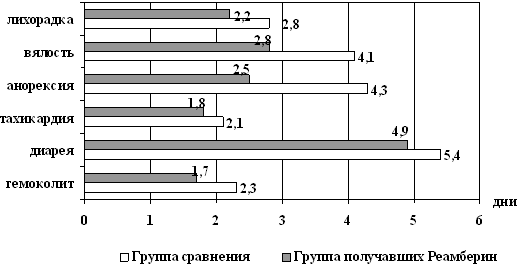
Рис. 1. Длительность клинических проявлений дизентерии у
детей,
получавших реамберин и в группе сравнения.
Отчетливо прослежена клиническая эффективность реамберина в
терапии тяжелых форм дизентерии (табл. 1).
Таблица 1. Продолжительность симптомов дизентерии в
стационаре
в зависимости от формы тяжести и варианта терапии (M±m).
|
Показатели (длительность в днях)
|
Группа сравнения
|
Терапия Реамберином
|
|
Средне-
тяжелая форма (n=29)
|
Тяжелая форма
(n=15)
|
Средне-
тяжелая форма (n=24)
|
Тяжелая форма
(n=11)
|
|
Лихорадка
|
1,9±0,2
|
3,0±0,3
|
1,6±0,1
|
2,4±0,3
|
|
Вялость
|
2,6±0,3
|
4,3±0,5
|
1,6±0,2*
|
2,6±0,4*
|
|
Анорексия
|
2,9±0,3
|
4,6±0,6
|
1,9±0,2#
|
2,3±0,2*
|
|
Тахикардия
|
1,6±0,1
|
2,8±0,2
|
1,3±0,1
|
2,1±0,2#
|
|
Рвота
|
1,8±0,2
|
2,4±0,3
|
1,3±0,1
|
1,5±0,3
|
|
Диарея
|
4,8±0,4
|
6,2±0,5
|
5,1±0,2
|
5,9±0,5
|
|
Гемоколит
|
1,6±0,1
|
2,8±0,3
|
1,5±0,1
|
2,1±0,2#
|
|
Патологические примеси в стуле
|
5,4±0,5
|
6,8±0,6
|
5,2±0,4
|
7,2±0,6
|
*- достоверное отличие от таковых в группе сравнения
(p<0,01);
#- достоверное отличие от таковых в группе сравнения
(p<0,05).
При сопоставлении динамики основных симптомов дизентерии в
зависимости от формы тяжести установлено, что использование
реамберина в терапии среднетяжелых форм заболевания достоверно
сокращает длительность интоксикационного синдрома в среднем на
сутки по сравнению с больными, получающими общепринятую инфузионную
терапию. При тяжелом течении дизентерии отмечается более
стремительная обратная динамика общеинфекционных симптомов,
характеризующаяся уменьшением их проявлений на 2 дня и более в
отличие от группы сравнения.
Изучение показателей эндогенной интоксикации выявило зависимость
тяжести заболевания от уровня маркеров эндотоксикоза. Анализ
показателей эндотоксемии показал, что в острый период дизентерии
(1-3 день болезни) у 23,5% больных имело место незначительное
нарастание концентрация ВНСММ плазмы (до 10 УЕ), у 62,8%
обследованных детей данные показатели находились в пределах 10-19,9
УЕ, а у 13,7% детей отмечалось выраженное повышение ВНСММ плазмы
свыше 19,9 УЕ. Установлена прямая зависимость тяжести основных
клинических проявлений дизентерии и уровня ВНСММ в плазме крови
больных. В группе детей с концентрацией ВНСММ плазмы, превышающей
19,9 УЕ, заболевание протекало наиболее тяжело с преобладанием в
клинической картине выраженных проявлений интоксикации (100% против
31% и 33% в сравниваемых группах).
Сопоставляя течение дизентерии у детей с различной концентрацией
ВНСММ плазмы, было установлено, что использование реамберина
сокращает продолжительность интоксикации во всех группах больных
(рис. 2). Наиболее выраженный эффект применения препарата отмечался
у детей с концентрацией ВНСММ более 19,9 УЕ. В этой группе больных
выявлена отчетливая тенденция к сокращению лихорадочного периода в
стационаре до 2,4±0,3 дней (против 3,1±0,4 дней в группе
сравнения), периода вялости (2,5±0,4 против 3,6±0,5 дней в группе
сравнения), анорексии (2,7±0,4 против 4,0±0,6 дней), тахикардии
(2,0±0,3 против 2,8±0,4 дней).
Уменьшение длительности выявления примеси крови в испражнениях
также отмечалось у данной группы детей и составило 2,0±0,3 дней
против 2,6±0,4 дней в группе сравнения. Аналогичная динамика
интоксикационного синдрома наблюдалась у больных с уровнем ВНСММ
плазмы 10-19,9 УЕ, получавших в составе патогенетической терапии
реамберин. Период вялости и анорексии в этой группе детей составил
1,9±0,3 и 2,1±0,2 дней соответственно в отличие от группы
сравнения, у которых продолжительность этих симптомов была
превышена в 1,5 раза (2,9±0,4 и 2,8±0,3 дней соответственно). При
сопоставлении течения дизентерии у больных с концентрацией ВНСММ
плазмы до 10 УЕ не выявлено значимых клинических отличий в
зависимости от варианта проводимой терапии, хотя по ряду
рассматриваемых показателей отмечена тенденция к сокращению
продолжительности синдрома интоксикации.
Проведенные исследования оксидативных процессов в плазме крови
позволили установить неоднородный характер активации СРО в острый
период шигеллезной инфекции у детей. У большинства обследованных
(69,5%) отмечено нарастание уровня СРО, который более чем в 2,5
раза превышал показатели здоровых детей (табл.2).
Из них у 26,1% детей имела место гиперактивация СРО, с
достоверно значимыми гипервысокими значениями ХЛ плазмы
(p<0,01). В этиологической структуре в этих группах детей
отмечалось преобладание больных дизентерией Флекснера (70,0% и
83,3% соответственно). У 30,4% больных в общей популяции
обследованных детей отмечалось достоверное снижение интенсивности
оксидативных процессов, что может свидетельствовать о быстром
истощении субстратов окисления.
Учитывая полученные данные о неоднородном характере процессов
СРО в плазме крови, проведен сравнительный анализ эффективности
реамберина в группах детей с различной активацией оксидативных
процессов (табл. 3)
Таблица 2. Показатели интенсивности СРО и эндогенной
интоксикации в плазме крови у детей, больных дизентерией (M±m)
|
Биохими-
ческие показатели
|
Здоровые дети (n=15)
|
Группы детей, больных дизентерией
|
|
Сниженная активация СРО (n=14)
|
Средний уровень СРО (n=20)
|
Гипер-
активация СРО (n=12)
|
|
Плазма крови
|
|
ХЛ макс
(имп·10-3)
|
0,7±0,2
|
0,4±0,1
|
1,6±0,1#
|
7,5±2,2* #
|
|
ХЛ1
(имп·10-3)
|
0,4±0,2
|
0,2±0,1
|
0,6±0,1**
|
3,4±1,6*
|
|
Σ
(имп·10-3)
|
106,3±64,0
|
105,5±22,7
|
238,5±
31,3#
|
1386,3±
453,5* #
|
|
% торможения
|
41,5±3,4
|
21,9±6,8
|
38,1±5,5
|
40,7±11,1
|
- показатели, достоверно отличающиеся от таковых в группе детей
со средним уровнем СРО (p<0,01);
# - показатели, достоверно отличающиеся от таковых в группе детей с
низким уровнем СРО (p<0,001);
** - показатели, достоверно отличающиеся от таковых в группе детей
с низким уровнем СРО (p<0,01).
Из представленной таблицы видно, что у больных со средним
уровнем активации свободнорадикальных процессов в плазме
использование реамберина способствовало наиболее быстрому регрессу
интоксикационного синдрома. Период вялости и анорексии в этой
группе детей был короче в 2-2,5 раза в отличие от больных группы
сравнения, достоверно быстрее купировалась тахикардия. Установлена
отчетливая тенденция к уменьшению лихорадочного периода на фоне
терапии реамберином. При изучении динамики местного воспалительного
процесса в кишечнике выявлено статистически достоверное сокращение
длительности гемоколита у больных с комплексной терапией реамберина
в сравнении с детьми, получавших общепринятую инфузионную
терапию.
Применение реамберина в составе патогенетической терапии у детей
с гиперактивацией свободнорадикальных процессов также имело
выраженный положительный эффект. Отмечалась аналогичная тенденция к
сокращению длительности температурной реакции, тахикардии,
анорексии, достоверно меньше регистрировалась вялость в отличие от
больных группы сравнения. У детей с исходно низкими показателями
СРО длительность интоксикационного синдрома и местных проявлений
воспалительного процесса была сопоставима с группой сравнения,
однако по ряду показателей отмечалась тенденция к сокращению
периода интоксикации (табл. 3).
Таблица 3. Эффективность реамберина у больных
с различной интенсивностью СРО
в плазме крови (M±m)
|
Длительность клинических симптомов
(дни)
|
Группа сравнения (n=24)
|
Терапия реамберином
|
|
Сниженная активация СРО
(n=10)
|
Средний уровень активации СРО (n=13)
|
Гиперактивация СРО
(n=9)
|
|
Лихорадка
|
2,8±0,6
|
2,3±0,6
|
1,6±0,4
|
2,1±0,6
|
|
Вялость
|
4,1±0,4
|
2,8±0,8
|
1,9±0,5**
|
2,3±0,7*
|
|
Анорексия
|
4,3±0,7
|
3,2±0,6
|
1,7±0,5**
|
2,6±0,7
|
|
Тахикардия
|
2,1±0,2
|
1,4±0,4
|
1,0±0,4*
|
1,7±0,4
|
|
Диарея
|
5,4±0,8
|
4,6±1,1
|
4,7±0,8
|
5,0±1,2
|
|
Патологичекие примеси в стуле
|
7,4±1,2
|
6,5±1,6
|
5,8±1,3
|
5,3±1,0
|
|
Гемоколит
|
2,3±0,2
|
1,5±0,5
|
1,2±0,4*
|
1,7±0,6
|
*- достоверное отличие с группой сравнения (p<0,05);
**- достоверное отличие с группой сравнения (p<0,01).
Помимо положительного влияния на клинические проявления
интоксикационного синдрома, использование реамберина приводило к
более быстрой ликвидации воспалительных сдвигов лабораторных
показателей периферической крови и копроцитограммы. Изучение
динамики параметров гемограммы выявило, что уже к 3 дню терапии у
больных, получавших инфузии реамберина, отмечалась тенденция к
снижению количества лейкоцитов относительно исходного состояния и
группы сравнения (7,9±0,8·109/л против 10,8±1,3 и 9,0±1,0·109/л
соответственно). Абсолютное и относительное снижение лейкоцитов
происходило за счет уменьшения количества незрелых (палочкоядерных)
форм с 24,5% в первые сутки госпитализации до 5,3% - в период
ранней реконвалесценции. К 6 дню стационарного лечения у 84% (37)
больных количество лейкоцитов не имело достоверных отличий от
показателей здоровых детей, составляя 5,6±0,6·109/л против
5,1±0,3·109/л. В группе сравнения показатели гемограммы сохраняли
умеренную воспалительную реакцию до периода ранней
реконвалесценции, характеризующуюся относительным нейтрофилезом до
63% и палочкоядерным сдвигом лейкоцитарной формулы до 9,4% при
нормальном количестве лейкоцитов (7,8±0,9·109/л).
Определение длительности колитных изменений в испражнениях
больных по данным копроцитограммы не выявило отличительных
особенностей от варианта проводимой терапии. Отмечена лишь
тенденция к сокращению микроскопической визуализации эритроцитов в
группе детей, получавших реамберин (4,6±0,9 против 5,4±1,1 дней в
группе сравнения).
Динамика показателей
эндогенной интоксикации
при
бактериальной дизентерии
у детей в зависимости
от проводимой инфузионной терапии
При оценке показателей, характеризующих синдром эндогенной
интоксикации, выявлена более динамичная нормализация уровня ВНСММ
плазмы в группе детей, получавших реамберин (табл. 4).
Таблица 4. Динамика маркеров эндогенной интоксикации в
зависимости от варианта проводимой инфузионной терапии (M±m)
|
Показатели эндогенной интоксикации
|
Здоровые дети
(n=15)
|
Группа сравнения (n=23)
|
Терапия реамберином (n=28)
|
|
При поступлении
|
|
ВНСММ плазмы (УЕ)
|
6,7±0,8
|
13,2±1,1
|
13,8±0,9
|
|
ВНСММ эритроцитов (УЕ)
|
22,1±1,0
|
23,1±0,9
|
24,0±1,0
|
|
Индекс распределения
|
0,4±0,03
|
0,6±0,02
|
0,6±0,02
|
|
3 день стационарного лечения
|
|
ВНСММ плазмы (УЕ)
|
6,7±0,8
|
10,2±0,7*
|
8,1±0,5* **
|
|
ВНСММ эритроцитов (УЕ)
|
22,1±1,0
|
22,4±0,8
|
23,2±0,9
|
|
Индекс распределения
|
0,4±0,03
|
0,5±0,02#
|
0,4±0,03
|
|
6 день стационарного лечения
|
|
ВНСММ плазмы (УЕ)
|
6,7±0,8
|
8,3±0,6
|
7,3±0,5
|
|
ВНСММ эритроцитов (УЕ)
|
22,1±1,0
|
21,3±1,2
|
21,9±0,9
|
|
Индекс распределения
|
0,4±0,03
|
0,4±0,05
|
0,3±0,02
|
*- достоверное отличие по сравнению с исходным уровнем
(p<0,05);
**- достоверное отличие с группой сравнения (p<0,05);
#- достоверное отличие по сравнению со здоровыми детьми
(p<0,01).
Установлено, что уже к 3 дню стационарного лечения на фоне
терапии реамберином параметры ВНСММ плазмы и индекса распределения
достоверно отличались от исходных и приближались к показателям
здоровых детей. У больных, получавших инфузии глюкозо-солевых
растворов, нормализация маркеров эндотоксикоза происходила
медленнее, и к 3 дню стационарного лечения их уровень был
достоверно выше аналогичных показателей у здоровых и получавших
реамберин детей. Окончательная нормализация величины ВНСММ плазмы
происходила к концу 1-й недели у детей с комплексной терапией
реамберином, тогда как в группе сравнения концентрация ВНСММ плазмы
в эти сроки лишь приближалась к величинам здоровых детей.
Аналогичные изменения отмечались в динамике лейкоцитарного
индекса интоксикации, выражающиеся в его нормализации к 6 дню
терапии во всех группах больных (рис. 3). Однако тенденция к его
снижению к 3 дню терапии была более очевидной у больных, получавших
реамберин (0,8±0,2 против 1,4±0,3 в контрольной группе).
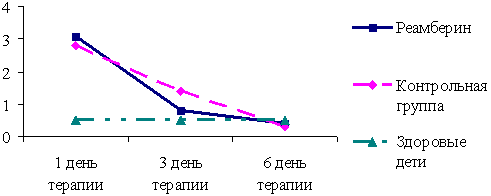
Рис. 3. Динамика лейкоцитарного индекса интоксикации в
зависимости от варианта проводимой терапии.
Проведенные исследования показали зависимость ряда показателей
эндогенной интоксикации от формы тяжести шигеллеза. Сопоставление
динамики уровня ВНСММ плазмы при тяжелой и среднетяжелой форме
заболевания в зависимости от проводимой терапии выявило
существенные различия (Рис. 4). У больных среднетяжелой формой
дизентерии, в составе терапии которых использовался реамберин,
нормализация значений ВНСММ плазмы наступала уже к 3 дню
стационарного лечения (6,7±0,9 УЕ), тогда как в группе сравнения в
эти же сроки аналогичные показатели сохраняли достоверно высокие
значения (10,4±1,2 УЕ, p<0,05). При тяжелой форме дизентерии к 3
дню терапии концентрация ВНСММ плазмы сохранялась на высоком уровне
в сравниваемых группах, однако, при использовании реамберина была
достоверно меньшей в отличие от исходного состояния (11,8±1,2 УЕ
против 18,1±2,1 УЕ до терапии, p<0,05) и группы сравнения
(11,8±1,2 УЕ против 15,3±1,5, p>0,05). Нормализация маркеров
эндотоксикоза на фоне терапии реамберином при тяжелом течении
заболевания происходила только к концу первой недели терапии, тогда
как у детей группы сравнения в эти сроки отмечена лишь тенденция к
их снижению (8,1±0,9 УЕ против 10,8±1,5 УЕ).
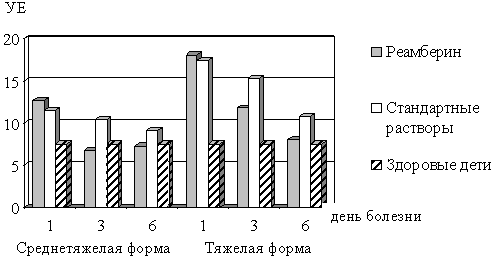
Рис. 4. Динамика показателей ВНСММ плазмы в зависимости
от варианта проводимой терапии.
При изучении характера динамики маркеров эндотоксикоза в
зависимости от сероварианта возбудителя выявлена наиболее быстрая
нормализация величины ВНСММ плазмы и ЛИИ при среднетяжелых формах
дизентерии Зонне, что согласуется с данными клинического
обследования. Так, в группе сравнения уже к 3 дню традиционной
терапии уровень ВНСММ плазмы и ЛИИ приближались к показателям
здоровых детей, составляя 8,1±0,5 УЕ и 0,4±0,04 соответственно. У
детей, в терапии которых использовался реамберин, изучаемые
показатели были сопоставимы с таковыми в группе сравнения и не
имели статистически достоверных различий (7,9±0,5 УЕ и 0,5±0,03
соответственно). Среднетяжелые формы шигеллеза Флекснера
характеризовались постепенным снижением уровня ВНСММ плазмы и ЛИИ,
с тенденцией к нормализации показателей к концу первой недели
терапии (8,8±0,4 УЕ и 0,5±0,03 соответственно). При использовании
реамберина у этой группы больных обратная динамика показателей
эндогенной интоксикации отмечалась наиболее отчетливо, с
нормализацией значений ВНСММ плазмы и ЛИИ к 7 дню заболевания
(7,5±0,5 УЕ и 0,4±0,03 соответственно). Тяжелые формы дизентерии
Флекснера характеризовались максимальным исходным уровнем ВНСММ
плазмы и ЛИИ с постепенным снижением изучаемых показателей в
динамике заболевания. Однако к концу первой недели у обследованных
детей полной нормализации маркеров эндотоксикоза не отмечалось.
Использование реамберина приводило к более выраженному снижению
концентрации ВНСММ плазмы и величины ЛИИ при тяжелой форме
дизентерии Флекснера, значения которых к 7 дню стационарного
лечения составляли 8,3±0,8 УЕ и 0,6±0,06 соответственно, против
10,2±1,0 УЕ и 0,8±0,1 у детей группы сравнения.
При исследовании влияния дезинтоксикационной терапии реамберином
на содержание сывороточного альбумина выявлено, что низкие его
значения у больных дизентерией Флекснера сохранялись до периода
ранней реконвалесценции как в группе сравнения, так и у детей,
получавших реамберин (46,8±3,4 и 48,3±2,6 г/л соответственно).
Только к 7 дню терапии уровень альбумина у больных с комплексной
терапией реамберином был сопоставим со значениями у здоровых детей
(56,3±5,0 и 58,4±2,9 г/л соответственно), превышая показатели детей
группы сравнения (52,7±4,5 г/л, p>0,05).
Динамика показателей СРО
при острой бактериальной
дизентерии
в зависимости от проводимой
инфузионной терапии
Для изучения влияния различных вариантов патогенетической
терапии на процессы СРО проводили исследование показателей
хемилюминесценции плазмы в динамике заболевания с учетом формы
тяжести и интенсивности оксидативных процессов.
Сравнительный анализ показателей ХЛ в популяции детей в
зависимости от варианта терапии показал более динамичное снижение
интенсивности СРО в группе больных, получавших реамберин (рис.
5).

Рис. 5. Интенсивность хемилюминесценции в плазме больных
дизентерией в зависимости от проводимой терапии
При использовании реамберина к 3-5 дню терапии отмечалась
отчетливая тенденция к снижению величины ХЛмакс (1,6±0,7
имп·10-3 против исходной 3,1±1,0 имп·10-3,
p<0,05), тогда как у больных группы сравнения в эти сроки
терапии аналогичные показатели не имели существенных изменений
(2,9±1,1 имп·10-3 против исходной 2,6±1,0
имп·10-3). В период ранней реконвалесценции достоверных
отличий в показателях ХЛ плазмы у здоровых и получавших реамберин
детей не выявлено (0,7±0,2 имп·10-3 и 1,0±0,4
имп·10-3 соответственно). В то же время в группе
сравнения величина ХЛмакс в эти сроки превышала нормальные значения
в 2 раза, составляя 1,9±0,8имп·10-3.
Аналогичная тенденция прослеживается при сопоставлении динамики
показателей ХЛ плазмы у больных с тяжелой и среднетяжелой формой
дизентерии (табл. 5). На представленной таблице показано, что
исходно высокие показатели ХЛ у детей группы сравнения в динамике
заболевания имеют тенденцию к нарастанию, превышая на 3-5 день
терапии нормальные значения в 3 и более раза.
Таблица 5. Динамика показателей ХЛ плазмы в зависимости
от формы тяжести и варианта проводимой терапии (M±m).
|
Показатели ХЛ плазмы
(имп·10-3)
|
Контрольная группа
|
Терапия реамберином
|
|
Тяжелая форма (n=8)
|
Среднетяжелая форма (n=14)
|
Тяжелая форма (n=6)
|
Среднетяжелая форма (n=18)
|
|
1 день терапии
|
|
ХЛ макс
|
3,2±1,1
|
2,0±0,6
|
2,9±0,8
|
2,3±0,4
|
|
ХЛ1
|
1,5±0,5
|
1,0±0,6
|
1,7±0,5
|
1,1±0,5
|
|
Σ
|
585,8±208,9
|
449,1±168,0
|
459,8±182,9
|
504,1±136,4
|
|
% торможения
|
44,3±6,2
|
48,3±4,7
|
56,8±6,2
|
46,2±5,3
|
|
3-5 день терапии
|
|
ХЛ макс
|
3,9±1,3
|
1,9±0,7
|
2,3±0,9
|
1,2±0,7
|
|
ХЛ1
|
2,2±0,7
|
1,4±0,3
|
0,9±0,3
|
0,5±0,2
|
|
Σ
|
896,3±369,5
|
625,5±257,4
|
416,8±127,5
|
185,2±88,3
|
|
% торможения
|
56,3±8,1
|
64,2±7,5
|
39,9±6,4
|
45,5±5,2
|
|
7-9 день терапии
|
|
ХЛ макс
|
1,8±0,6
|
1,3±0,5
|
0,9±0,5
|
0,5±0,2
|
|
ХЛ1
|
0,7±0,4
|
0,3±0,1
|
0,4±0,1
|
0,3±0,1
|
|
Σ
|
219,8±97,3
|
210,2±63,7
|
143,8±46,4
|
101,9±37,2
|
|
% торможения
|
39,1±6,3
|
23,1±3,6
|
44,1±9,1
|
57,6±8,3
|
Сохраняющиеся на высоком уровне значения ХЛ через минуту после
инициации СРО в сочетании с нарастанием светосуммы свидетельствует
о недостаточности системы АОЗ как при тяжелой, так и при
среднетяжелой форме дизентерии. Отсутствие нормализации показателей
ХЛ плазмы в периоде ранней реконвалесценции свидетельствует о
сохраняющейся интенсивности процессов СРО у детей группы сравнения.
Применение реамберина способствовало отчетливому снижению величин
ХЛ при среднетяжелых формах заболевания уже к 3-5 дню терапии, с
достижением нормальных значений к периоду ранней реконвалесценции.
При тяжелых формах шигеллеза нормализация показателей происходила
медленнее, однако, к 7-9 дню терапии значения ХЛ плазмы у здоровых
и больных дизентерией детей были сопоставимы. Использование
реамберина приводило к восстановлению баланса между оксидантными и
антиоксидантными системами к 3-5 дню терапии, что проявлялось
низкими значениями ХЛ через 1 минуту после инициации СРО в
сочетании со снижением показателей светосуммы.
Учитывая неоднородный характер активации СРО у обследуемых
детей, проведен сравнительный анализ динамики характеристик ХЛ в
зависимости от интенсивности оксидативных процессов (рис. 6). У
детей группы сравнения с исходной гиперактивацией СРО в динамике
заболевания наблюдалось снижение величины ХЛмакс плазмы, которая к
3-5 дню терапии составляла 2,4±0,8 имп·10 -3(достоверно
по сравнению с исходной 7,5±2,2 имп·10-3, p<0,05).
Однако после 5 дня терапии дальнейшего снижения интенсивности СРО
не происходило, о чем свидетельствовали сохраняющиеся высокие
значения ХЛмакс (2,6±1,0 имп·10-3) и светосуммы за 1
минуту (290,0±85,5 имп·10-3). Оценка состояния АОЗ в
этой группе детей показала ее несостоятельность до периода ранней
реконвалесценции, что сопровождалось высокими значениями ХЛ1 и
светосуммы на 5 день терапии (1,0±имп·10-3 и
453,5±имп·10-3 соответственно). Использование реамберина
у детей с гиперактивацией СРО приводило к постепенному снижению
максимального пика ХЛ, величина которого к 7-9 дню терапии
приближалась к показателям здоровых детей (1,5±0,5
имп·10-3 против 0,7±0,2 имп·10-3 у здоровых
детей). Значения светосуммы у больных, получавших реамберин, также
имели отчетливую тенденцию к снижению в динамике заболевания,
составляя к периоду реконвалесценции 183,5±68,3
имп·10-3. На фоне терапии реамберином отмечено
устранение дисбаланса между оксидантной и антиоксидантной
системами, характеризующееся снижением величины ХЛ1 с 1,7±0,5
имп·10-3 в первый день терапии до 0,5±0,1
имп·10-3 к 5 дню стационарного лечения (p<0,05).
У больных со средним уровнем активации оксидативных процессов в
динамике заболевания выявлен торпидный характер показателей ХЛ,
характеризующийся стойкими повышенными значениями ХЛ плазмы на
протяжении всего периода заболевания. Так, к 3-5 дню терапии
величины ХЛмакс и светосуммы составляли 1,7±0,5 и 190,0±42,0
имп·10-3 соответственно, не отличаясь от исходного
уровня (1,6±0,1 и 238,5±31,3 имп·10-3) и сохраняя
повышенные значения к периоду ранней реконвалесценции (1,5±0,1 и
247,9±88,0 имп·10-3). При этом значения ХЛ1,
характеризующее состояние антиоксидантной системы в динамике
заболевания были адекватны интенсивности СРО, составляя 0,5±0,1
имп·10-3, что свидетельствовало об эффективности АОЗ.
Назначение Реамберина больным со средним уровнем активации СРО
приводило к постепенному снижению показателей ХЛ, значения которых
к периоду ранней реконвалесценции соответствовали таковым у
здоровых детей (0,9±0,2 против 0,7±0,1 имп·10-3 у
здоровых детей).
При исходно низкой интенсивности СРО у детей группы сравнения к
3-5 дню терапии отмечалось нарастание показателей ХЛмакс и
светосуммы, значения которых превышали таковые у здоровых детей в
2,6 раза, составляя 1,8±0,8 и 358,6±104,7 имп·10-3,
соответственно. К периоду ранней реконвалесценции выявлено их
снижение до нормальных значений (0,7±0,1 и 139,5±57,3
имп·10-3 соответственно). Использование реамберина в
этой группе больных не выявило значимых различий в характеристиках
ХЛ плазмы с группой сравнения. Отмечалось лишь меньшая
интенсивность нарастания пика ХЛ к 5 дню проводимой терапии.
ЗАКЛЮЧЕНИЕ
Рациональная терапия больного предполагает воздействие на все
составляющие инфекционного процесса: возбудитель и его токсины,
реактивность организма и отдельные звенья патогенеза. Проведенные
исследования показали, что острый период дизентерии характеризуется
определенными метаболическими сдвигами, выраженность которых
определяет не только форму тяжести заболевания, но и вероятность
развития осложненного течения заболевания. В связи с этим
приоритетной остается проблема целенаправленной патогенетической
терапии, что позволит обеспечить своевременную коррекцию возникших
нарушений гомеостаза и тем самым улучшить результаты проводимой
терапии.
Нами предложено использование в комплексной терапии острого
периода дизентерии инфузионного препарата реамберин, обладающего
дезинтоксикационным и антиоксидантным. Реамберин 1,5%,
представляет собой нормоосмолярный раствор, содержащий натрия
сукцинат, магния хлорид, калия хлорид, натрия хлорид. Основным
действующим веществом препарата является соль янтарной кислоты,
обеспечивающая основные фармакологические эффекты. Доказано, что
экзогенная янтарная кислота обладает дезинтоксикационным
действием, корригирует метаболический ацидоз, улучшает перфузию
кислорода в ишемизированные ткани. Антиоксидантное действие
янтарной кислоты обеспечивается опосредованно за счет устранения
клеточной гипоксии и стабилизации клеточных мембран.
Проведенный клинико-лабораторный анализ течения дизентерии у
детей свидетельствует о целесообразности применения инфузионного
раствора реамберина в острый период заболевания, что приводит к
статистически достоверному сокращению продолжительности
интоксикационного синдрома, уменьшению длительности местных
воспалительных изменений в кишечнике и способствует более быстрой
ликвидации лабораторных сдвигов воспалительного характера.
Клиническая эффективность реамберина определяется достоверно
значимым снижением показателей эндогенной интоксикации в ранние
сроки заболевания в группе детей, получавших препарат. Кроме того
установлено, что применение реамберина приводит к снижению
интенсивности оксидативных процессов в острый период заболевания.
Устранение дисбаланса между оксидантной и антиоксидантной
системами, особенно при тяжелых формах шигеллеза и у больных с
гиперактивацией СРО способствует уменьшению повреждающего
воздействия активных форм кислорода и устранению метаболических
сдвигов в этих группах детей к периоду ранней реконвалесценции.
Таким образом, в результате проведенных исследований было
установлено, что применение инфузионного раствора реамберин в
терапии острого периода дизентерии у детей является целесообразным
и эффективным, что подтверждается положительным влияние препарата
на клиническое течение заболевания, показатели эндотоксикоза и
свободнорадикального окисления.
ЛИТЕРАТУРА
- Тихомирова О.В. и соавт. Особенности течения дизентерии
Флекснера и рациональная этиотропная терапия у детей на современном
этапе // Рос. вестник перинатологии и педиатрии. – 2002. - № 6. –
с. 46-52.
- Покровский В.И., Малеев В.В. Актуальные вопросы терапии и
профилактики в условиях эволюции инфекционных заболеваний //
Инфекционные болезни. – 2003. – т. 1. - №1. - С.6-8.
- Онищенко Г.Г. Эпидемиологическая обстановка как показатель
биологической безопасности Российской Федерации // Химическая и
биологическая безопасность. - 2002. - №3. – С.3-7.
- Учайкин В.Ф., Молочный В.П. Инфекционные токсикозы у детей. М.,
2002. – 242с.
- Лобзин Ю.В., Винакмен Ю.А., Финогеев Ю.П., Захаренко С.М. Острые
кишечные диарейные инфекции (клинико-патогенетические подходы к
диагностике) // Военно-медицинский журнал. - 1996. – т. 319.- № 8.
– С.18-21.
- Ставицкая Е.Л. клинико-эпидемиологическая и социальная
характеристика современной дизентерии: Автореф. дис…канд.мед.наук.
– СПб, 1997. – 28с.
- Воротынцева Н.В., Мазанкова Л.Н. Острые кишечные инфекции у
детей. М., Медицина. - 2001. – 348с.
- Макаренко В.Д., Рыбалко Г.Н., Волянский А.Ю. и соавт.
Особенности течения шигеллеза Флекснера у детей // Тез. Росс. НПК
«Узловые вопросы борьбы с инфекциями» - СПб, 2004.- С.151.
- Жумагалиева В.Д., Тенизбаева Р.К., Умарова Ж.С и соавт. Влияние
преморбидного фона на течение шигеллеза у детей раннего возраста //
Тез. Всеросс. науч. конф. «Клинические перспективы в инфектологии»
- СПб, 2001.- С.77.
- Ющук Н.Д., Розенблюм А.Ю. и соавт. Клинико-морфологические
особенности шигеллеза Флекснера у больных с отягощенным
преморбидным фоном // Микробиология, эпидемиология и иммунология. –
2002.- № 2. – С.77-79.
- Pavlick K.P., Laroux F.S., Fuseler J. et al. Role of reactive
metabolites of oxygen and nitrogen in inflammatory bowel disease //
Free Radicals Biol. and Med. – 2002. – Vol. 33, N 3. –
P.311-322.
- Карякина Е.В., Белова С.В. Молекулы средней массы как
интегральный показатель метаболических нарушений// Клиническая
лабораторная диагностика. - 2004.- № 3. - С.3-7.
- Айзенберг В.Л., Загузова Л.И. К изучению патогенеза септического
шока при острых кишечных инфекциях у детей // Инфекционные
болезни.- 2003. - т. 1. - №1. – С.39-42.
- Нагоев Б.С., Маржохова М.Ю. состояние некоторых показателей
прооксидантной и антиоксидантной систем крови у больных острой
дизентерией // Эпидемиология и инфекц. болезни. - 2004.- №1. С.
39-41.
- Мухаммедов Н.Б. Эндотоксемия при хроническом вирусном гепатите В
и способы ее снижения // Клиническая лабораторная диагностика. -
2002.- № 3. - С.22-24.
- Салихова Н.Н., Ахмеджанов Р.И., Мухамадиева Ш.Г. Количественный
метод определения среднемолекулярных пептидов в сыворотке крови
больных с хронической почечной недостаточностью // Лаб. дело. –
1989. - №3. – С.48-52.
- Мельцер И.М., Потапов А.Ф., Эверстова Л.В. и соавт. Показатели
эндотоксикоза и неспецифической адаптивной реакции при
распространенном перитоните в условиях Крайнего Севера //
Анестезиология и реаниматология. - 2004. - №2.- С.49-51.
- Дубинина Е.Е. Активные формы кислорода и их роль в развитии
оксидативного стресса// Фундаментальные и прикладные аспекты
современной биохимии. Труды научной конф., посв. 100-летию каф.
Биохимии СПбГМУ. СПб., 1998. – Т.2. – С.386-398.
- Говорова Л.В. и соавт. Оценка интенсивности свободнорадикального
окисления в клетках и плазме крови для дифференцированного подхода
к назначению антиоксидантной терапии / пособие для врачей. –
СПб.-2002.-31с.
- Малахова М.Я. Метод регистрации эндогенной интоксикации: Пособие
для врачей. - СПб, 1995. - 28 с.