Биологическая активность экзогеннного сукцината зависит от дозы, режима введения препарата, его химической формы (кислота, соль, сложный эфир) и функционального состояния организма.
При применении физиологических доз янтарной кислоты можно выделить две группы эффектов:
- прямое действие ЯК на клеточный метаболизм,
- влияние ЯК на транспорт свободного кислорода в ткани.
Добавление небольших количеств фумарата, малата или сукцината к суспензии измельченной мышечной ткани приводит к приросту потребления тканью кислорода, многократно большему, чем можно было бы объяснить только окислением добавленных субстратов до диоксида углерода и воды.
Процесс носит каталитический характер, поскольку одна молекула добавленной к ткани дикарбоновой кислоты обеспечивает окисление многих эндогенных субстратов. Однако, стимулирующее действие какой-либо из названных карбоновых кислот на потребление кислорода отменяется ингибитором сукцинат дегидрогеназы (СДГ) – малонатом. Иными словами, окисление сукцината является необходимым условием каталитического действия любой другой из карбоновых кислот на усвоение тканью кислорода.
Этот феномен был объяснен Кребсом, который показал, что последовательность реакции окисления ряда три- и дикарбоновых кислот замкнуто в цикл, позже названный его именем (рис. 2). Для поддержания нормального тканевого дыхания теоретически достаточно лишь активированной уксусной кислоты (ацетил-КоА), а другие субстраты не расходуются.
Однако в действительности ди- и трикарбоновые кислоты постоянно отвлекаются из цикла Кребса в качестве субстратов анаболических реакций.
Потеря интермедиатов цикла возрастает при острых и хронических отравлениях аммиаком. Пополнение пула кислот цикла Кребса нарушается при алкоголизме, гиповитаминозе В6 и при отравлениях ингибиторами пиридоксальфосфат зависимых ферментов. Поэтому пополнение пула интермедиатов цикла Кребса, в том числе и из пищевых источников, является необходимым. Для пополнения пула всех органических кислот цикла Кребса оказалось достаточным экзогенное введение лишь одного сукцината.
Сукцинат является стимулятором синтеза восстановительных эквивалентов в клетке. Феномен быстрого окисления сукцината в цитоплазме клеток, сопровождающийся восстановлением пула динуклеотидов, отмечаемый при внесении избытка ЯК, получил название – "монополизация дыхательной цепи сукцинатом". Биологическое значение данного явления заключается в быстром ресинтезе клетками АТФ и в повышении их антиоксидантной резистентности.
Кроме того, сукцинат положительно влияет на оксигенацию внутренней среды, стабилизирует структуру и функциональную активность митохондрий, является индуктором синтеза некоторых белков, влияет на ионный обмен в клетке.
Введение здоровым людям или лабораторным животным сукцината натрия приводит к снижению уровня органических кислот в крови и экскреции кислых продуктов обмена из организма (частично – в виде аммонийных солей), что указывает на нормализацию аэробной фазы тканевого дыхания.
Преимущества сукцината в скорости окисления перед другими субстратами клеточного дыхания наиболее выражено в условиях гипоксии, когда НАД-зависимый транспорт электронов в дыхательной цепи тормозится, а активность СД Г и продукции эндогенного сукцината возрастает.
Способность экзогенной янтарной кислоты существенно интенсифицировать диффузию кислорода в клетке различных тканей in vitro свидетельствует о возможном повышении сукцинатом трансмембранного градиента концентрации кислорода и, соответственно, снижения оксигенации ядра и цитоплазмы.
Исследования показали наличие у янтарной кислоты биологической активности с уникальным сочетанием проявлений: по отношению к здоровому организму сукцинаты выступают в роли адаптагенов и актопротекторов, а при наличии патологических проявлений проявляют нетипично высокий для адаптагенов терапевтический эффект. Особенно перспективно лечебное применение сукцинатов при заболеваниях сердечно-сосудистой (острая и хроническая ишемическая болезнь сердца), дыхательной, эндокринной систем, при желудочно-секреторной недостаточности и поражениях печени различной этиологии, онкологических, психических заболеваниях, в качестве стимуляторов посттравматической регенерации. С профилактической целью янтарная кислота используется в спортивной медицине, для профилактики состояния пониженной иммунологической реактивности и для повышения устойчивости к неэлектролитному действию алкоголя. Перспективно ее применение для формирования статуса повышенной резистентности организма к ионизирующим излучениям, алкилирующим ядам и биологическим агентам.
В основе лечебно-профилактических свойств янтарной кислоты и ее соединений лежит модифицирующее влияние на процессы тканевого метаболизма – клеточное дыхание, ионный транспорт, синтез белков. При этом амплитуда и направленность модификаций зависят от функционального исходного состояния тканей, а ее конечный результат выражается в оптимизации параметров их функционирования.
Такие свойства позволяют отнести сукцинаты к лечебно-профилактическим препаратам нового поколения – так называемым "умным лекарствам".
Учитывая уникальную разносторонность проявлений биологической активности ЯК, сфера ее применения в медицинской практике является пока еще чрезмерно узкой. Поэтому направление по созданию препаратов на основе ЯК является весьма перспективным.
ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ
ЯНТАРНОЙ КИСЛОТЫ
ЯНТАРНОЙ КИСЛОТЫ
Янтарная кислота (рис. 1) и её соли и эфиры-сукцинаты представляют собой универсальный внутриклеточный метаболит, широко участвующий в обменных реакциях в организме, являясь малотоксичным соединением и не обладает мутагенным и тератогенным действием [19, 31, 94, 102, 104].
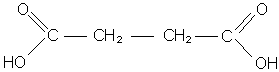
Рис. 1. Янтарная кислота
Содержание ЯК в тканях организма человека и животных, составляет 0.2-0.8 ммоль/кг, а ее концентрация в плазме крови значительно меньше и не превышает 0.04 ммоль/л [11, 21, 105]. ЯК, содержащаяся в органах и тканях организма, является продуктом пятой реакции и субстратом шестой цикла трикарбоновых кислот, (рис. 2) Кребса [109].
Окисление ЯК в шестой реакции цикла Кребса осуществляется с помощью специфического фермента – сукцинатдегидрогеназы [4, 131],характерной особенностью которой является локализация на внутренней мембране митохондрий и независимость её активности от концентраций окисленной и восстановленной форм НАД/ НАДН+[44], что позволяет сохранить энергосинтезирующую функцию митохондрий в условиях гипоксии при нарушении НАД-зависимого дыхания клеток; выполняя каталитическую функцию по отношению к циклу Кребса [107, 109] ЯК снижает концентрацию в крови других интермедиатов цикла – лактата, пирувата и цитрата [32], накапливающихся в клетках на ранних стадиях гипоксии.
Феномен быстрого окисления ЯК сукцинатдегидрогеназой, сопровождающийся АТФ-зависимым восстановлением пула пиримидиновых динуклеотидов получил название "монополизация дыхательной цепи", биологическое значение которого заключается в быстром ресинтезе АТФ клетками [94, 110].
В нервной ткани функционирует так называемый g–аминобутирантный шунт (цикл Робертса), в ходе которого ЯК образуется из g–аминомаслянной кислоты через промежуточную стадию янтарного альдегида [82, 121]. Следует заметить, что в условиях стресса и гипоксии органов и тканей образование ЯК возможно в реакции окислительного дезаминирования a–кетоглутаровой кислоты в печени [46].
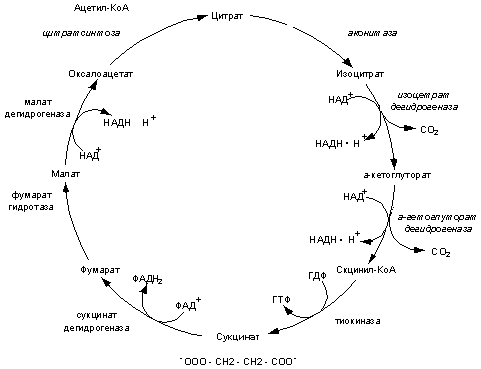
Рис. 2. Цикл Кребса
Антистрессорное действие ЯК обусловлено её антигипоксическим действием, за счет влияния на транспорт медиаторных аминокислот [38], так и увеличения содержания в мозге g–аминомаслянной кислоты (ГАМК) через шунт Робертса [3,46, 94].
ЯК в организме нормализует содержание гистамина и серотонина в крови и повышает микро циркуляцию в органах и тканях, не оказывая, влияния на артериальное давление и показатели работы сердца |93]. Экспериментально показано при остром инфаркте миокарда в крови, вытекающей из зоны ишемии, происходит резкое уменьшение содержания ЯК [89], усугубляя гипоксию миокарда. Экзогенное поступление в организм ЯК нормализует активность сукцинатдегидрогеназы, ограничивает зону некроза в миокарде [86], при этом усиливается биоэлектрическая активность сердца (под действием ЯК), улучшается геодинамика и увеличивается толерантность сердца к физическим нагрузкам [3, 16, 45, 98].
Противоишемический эффект ЯК связан не только с активацией сукцинатдегидрогеназного окисления, но и с восстановлением активности ключевого окислительно-восстановительного фермента дыхательной цепи митохондрий клеток – цитохромоксидазы [84, 103].
Антиаритмическое действие ЯК обусловлено улучшением метаболических процессов в миокарде, подавлением процессов перекисного окисления липоидов в кровотоке [63] и стабилизацией коронарного кровоснабжения [1, 2, 6, 7, 90, 117]. Потенцирующее действие ЯК на противоаритмическую эффективность новокаинамида обусловлено, помимо влияния на метаболические процессы в миокарде, влиянием на калиевый/кальциевый обмен в кардиомиоцитах [87, 91, 112]. Кардиопротекторное действие ЯК связано с активацией сукцинатдегидрогеназного пути окислительного ресинтеза АТФ в кардиомиоцитах, с одновременным снижением уровня жирных кислот и НАД-зависимых субстратов цикла Кребса в зоне ишемии [94,110,125].
В условиях экспериментального шока, вызванного 10-минутной остановкой сердца, ЯК снижала уровень свободно радикальных процессов в мозге и сыворотке крови, ослабляла деструкцию мембранных элементов нейронов и способствовала полному восстановлению функций и структуры мозга [24, 57]. В пост реанимационном периоде ЯК способствовала нормализации функций центральной нервной системы, снижала чувствительность животных к стрессу, накопление свободно-радикальных продуктов и восстанавливала морфологические изменения в крови [85] и головном мозге [108]. Избирательное действие ЯК на гипоталамические структуры мозга позволяет усиливать действие эстрогенов на гормонозависимые органы и ткани [99].
При экспериментальном шоке, вызванном массивной кровопотерей ЯК повышала выживаемость животных и восстанавливала функциональную активность почек [41, 42, 53]; способствовала растворению камней при экспериментальном уролитиазе, подавляя синтез оксалатов [58, 129].
При острой экспериментальной гипоксии мозга ЯК ограничивала объем ишемических повреждений, уменьшала количество продуктов перекисного окисления липидов и увеличивала выживаемость животных [14].
Повышение трансмембранного градиента концентрации кислорода и снижение оксигенации ядра и цитоплазмы кислорода свидетельствует о способности ЯК интенсифицировать диффузию кислорода в различные ткани и органы, стимулируя при этом клеточное дыхание[4, 32]: так, прирост скорости потребления кислорода клетками печени при добавлении ЯК увеличивается в 60 раз [107, 123]. Способность ЯК интенсифицировать утилизацию кислорода тканями и восстановление НАД-зависимого клеточного дыхания [4, 14, 32, 45] характеризуют её антигипоксическое действие.
Восстановление пула пиримидиновых динуклеотидов приводит к увеличению концентрации восстановленного глутатиона и усилению устойчивости митохондрий к перекисной деградации, стимулированной ксенобиотиками [81, 94, 126], при этом, ЯК под действием сублетальных доз активного генератора радикальных частиц – нитрита натрия полностью нивелирует блокирование дыхательной цепи митохондрий [124].
Антигипоксическое действие ЯК позволяет использовать ее для стимуляции регенерации роговицы глаз, профилактики пневмопатий и некротических осложнений при кожно-пластических операциях [28, 64, 65].
Инсулинотропный эффект ЯК, связанный с существенным увеличением активности сукцинатдегидрогеназы, показан на модели экспериментального сахарного диабета [5, 134], при этом установлено, что синтез инсулина под действием ЯК обусловлен усилением метаболических процессов в островковой ткани поджелудочной железы, а стимуляция секреции инсулина І-клетками обеспечивается за счет активации фермента Na(+) К(+)-аминотрансферазы, которые не зависят от концентрации глюкозы во внеклеточной среде [112, 113, 115].
В литературе имеются данные о стимулирующем действии ЯК на синтез белка [25, 32], гемоглобина [101], порфиринов [22], гликогена в печени [133].
Гепатотропное действие ЯК обусловлено повышением соотношения НАДН+/ НАД, стимуляцией синтеза мочевины и энергетического обмена в гепатоцитах [52, 83, 116]. Активация сукцинатдегидрогеназы в митохондриях гепатоцитов под действием ЯК нормализует печеночный холестаз [33, 34] и препятствует жировой дистрофии печени и образованию коллагенозной ткани [62]. При поражении печени ксенобиотиками ЯК стимулирует ее метаболизирующую функцию с одновременным повышением устойчивости мембран гепатоцитов к радикальному окислению [26, 38, 81, 94, 120, 126,].
Радиозащитное действие ЯК, невысоко и обусловлено преимущественно влиянием на метаболические процессы в клетках (снижение оксигенации ядра и цитоплазмы, активация клеточного дыхания, стимуляция синтеза белка и АТФ, ингибирование процессов перекисного окисления липидов) [4, 13, 23, 29, 30, 37, 40, 122].
Описано адаптогенное действие ЯК, проявляющееся при тяжелых физических нагрузках [46, 54, 106], на моделях экспериментального иммобилизированного стресса [80, 97, 132] и стресса, вызванного вибрацией [80], ожогом [60], электрическим шоком [24] и острым охлаждением [9, 12].
Несмотря на известные фармакологические эффекты ЯК, зарегистрированных лекарственных форм, содержащих в качестве основного компонента ЯК, немного.
В составе комплексных лекарственных препаратов, ЯК потенциирует фармакологические эффекты многих активных субстанций (антигипоксическую активность 1,2,4-тиадиазола) [79]. Высокая алкопротекторная активность ЯК реализована в таблетках "Лимонтар", содержащих комбинацию янтарной и лимонной кислот [39, 66, 100] и в антиоксидантом препарате "Мексидол" [114].
В качестве лекарственного средства с улучшенным всасыванием сульфат двухвалентного железа ЯК комбинируют с аскорбиновой кислотой [119], а натриевая соль ЯК входит в состав противоанемического препарата "Конферон" [22, 56].
В качестве антигипоксического и антиоксидантного компонента, натриевая соль ЯК, входит в состав противокатарактальных глазных капель "Офтан-Катахром" и "Витафакол" [56] и препарата "Кератоник", для лечения эрозий роговицы [92].
На основе литиевой соли ЯК предложено лекарственное средство для стимуляции лейкопоэза [71, 118], а на основе аммонийной соли – актопротектора для лечения ишемии мозга [78]
Для купирования абстинетного синдрома предложены тонизирующие растворы ЯК с сахаром [67] и мелассой [68]. Для улучшения обмена веществ разработаны лекарственные композиций ЯК с сахарами [69] и различными аминокислотами [70].
Комбинация ЯК с ацетилсалициловой кислотой предложена в качестве противовоспалительного [72], а сорбитом (ксилитом) в качестве противодиабетического лекарственного средства [73]. В качестве противоастматического средства и бронходилататора разработана комбинация ЯК с сальбутамолом [76, 77].
Исследователями (Галенко-Ярошевский с соавт., 1998; Малюк В.И. с соавт., 1981; Морозова К.И., 1990) [15, 52, 58] показана стимуляция мерцательного эпителия бронхов, нормализация состава бронхолегочного лаважа и функциональной активности альвеолярных макрофагов, под воздействием ЯК, при бронхолегочной патологии.
Соль янтарной кислоты с двухвалентным железом является активной субстанцией [20] для ряда выпускаемых за рубежом противоанемических препаратов Ceveron и Ferromyn S (Wellcom, Англия), Ferrlecit 2 (Natterman, Германия).
ЯК, проявляя антиоксидантные свойства ингибирует, индуцируемые ионами Fe2+, процессы перекисного окисления липидов. В присутствии ЯК отмечается повышение усвояемости железа за счет образования хорошо растворимых в воде комплексов, которые быстро всасываются в тонком кишечнике, не разрушаясь и не образовывая не усваиваемых гидратов трехвалентной окиси железа [61,101].
В качестве адаптогенного и алкопротекторного средства ЯК используется в пищевых добавках "Янтарная кислота в таблетках", "ЯНА", "Янтовит", "Бизон", "Янтарный эликсир".
Таким образом, ЯК являясь фармакологически высоко активным соединением может быть использована для получения новых лекарственных препаратов с улучшенными фармакологическими свойствами.
Высокая актигипоксическая и антиоксидантная активность ЯК нашла применение в дезинтоксикационном растворе "Реамберин 1.5% для инфузий" [79], в состав которого входят: активное вещество - смешанная натрий N - метил-глюкаминовая соль янтарной кислоты, микроэлементы в оптимальных концентрациях.
Препарат разрешен ФГКМЗ РФ к клиническому применению и показан при экзо- и эндогенных интоксикациях.
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ
1,5% РАСТВОРА РЕАМБЕРИНА
1,5% РАСТВОРА РЕАМБЕРИНА
Как показали экспериментальные исследования на животных при изучении обще токсического действия на доклиническом этапе изучения препарата Реамберин в остром, подостром и хроническом эксперименте продемонстрировано, что во всех исследуемых дозах не выявлено патологических сдвигов со стороны основных жизненно важных функций органов и систем; также установлено, что препарат не вызывает дистрофических, деструктивных, очаговых склеротических изменений в паренхиме и строме изучаемых органов; не отмечено местно-раздражающего действия препарата при внутривенном способе введения.
При изучении подострой и хронической токсичности показано, что препарат не оказывает токсического воздействия на функционирование сердечно сосудистой системы, на морфологический состав и биохимические показатели периферической крови и костного мозга, на функциональное состояние печени, почек, а также на белковый, углеводный, жировой и электролитный виды обмена веществ.
Результаты доклинического исследования, проведенного в соответствии с утвержденным Фармакологическим Комитетом МЗ РФ протоколом изучения обще токсического действия препарата Реамберин, позволяют заключить, что он относится к 5 классу практически нетоксичных лекарственных средств, является безопасным и безвредным препаратом, что позволило разрешить его применение в клинической практике.
Основанием для проведения клинических исследований явилось решение ФГК МЗ РФ № 211-15-1301 о разрешении проведения клинических исследований в качестве дезинтоксикационного средства на здоровых добровольцах (волонтерах).
На основании полученных данных можно заключить, что препарат Реамберин удовлетворительно переносится и не приводит к развитию осложнений и побочных эффектов при его пролонгированном использовании.
При введении Реамберина внутривенно в объеме 400 мл капельно в дозе 3-4 мл/мин в среднем в течение 2-х часов не отмечено токсического воздействия на основные жизненно-важные системы организма: сердечно-сосудистую, дыхательную, выделительную, а также на показатели гомеостаза.
Исследования проводились на основании решения ГФК МЗ РФ "О разрешений клинических испытаний Реамберина 1,5% для инфузий" в качестве метаболического средства для коррекции гипоксического состояния при интоксикациях различного генеза (протокол № 3 от 04.03.99).
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ РЕАМБЕРИНА
ПРИ ТЯЖЕЛЫХ И ОСЛОЖНЕННЫХ ФОРМАХ
ГРИППОЗНОЙ ИНФЕКЦИИ
ПРИ ТЯЖЕЛЫХ И ОСЛОЖНЕННЫХ ФОРМАХ
ГРИППОЗНОЙ ИНФЕКЦИИ
Грипп и другие ОРЗ по-прежнему остаются самыми массовыми инфекциями. Вирусы гриппа, поражая различные органы и системы, в среднем у 5% вызывают тяжелые гипертоксические формы. Наиболее часто грипп и ОРЗ осложняются пневмонией, которая регистрируется у 2-17% всех больных гриппом и у 15-46% среди госпитализированных больных (Иванников Ю.Г. и др., 1994; Исаков В.А. и др., 1994; 1996; Коровина О.В., 1998).
При гриппе и ОРЗ поражаются различные органы и системы, в т.ч. нервная система у 3-28% больных (Исаков В.А. и др., 1993; 1996; Ладодо К.С., 1972; Мартынов Ю.С., 1970). Нервную систему поражают и другие вирусы: герпесвирусы, лимфоцитарного хориоменингита, арбовирусы и пр. Однако ряд механизмов развития неврологических расстройств требует уточнения и дальнейшего изучения, ибо поражение нервной системы при вирусных инфекциях нередко определяет тяжесть и исход заболевания (Ващенко М.А., Тринус Е.К., 1977; Осетров Б.А., 1981).
В качестве патогенетических факторов, способствующих развитию тяжелых и осложненных форм гриппа и ОРЗ рассматриваются нарушения различных звеньев специфического иммунитета и неспецифической резистентности (Нагоев Б.С., 1988; Пикуза О.И и др., 1989; Харитонова А.М. и др., 1990). В то же время вирус индуцированная дисфункция системы фагоцитоза может иметь самостоятельное патогенетическое значение, особенно когда речь идет о развитии бактериальных осложнений гриппа и ОРЗ (Исаков В.А, 1996; Каримова Д.Ю., 1972; Чепик Е.Б. и др., 1989).
Воспалительная реакция развивается при обязательном участии фагоцитов, прежде всего полиморфно-ядерных лейкоцитов (ПМЯЛ) и моноцитов (Маянский А.Н. и др., 1984; Маянский Д.Н., 1984). Важно отметить, что вирусное поражение моноцитов является одной из причин нарушения их функциональной активности, что в свою очередь, может привести к неполноценности зрелых альвеолярных макрофагов, хронизации воспалительного процесса трахео-бронхиального дерева, нарушению бронхиальной проходимости. С другой стороны, нарушения оксидазной активности и, следовательно, переваривающей способности моноцитов способствуют персистированию вирусной инфекции, аллергизации организма (Волчек ИЛ 1997; 1998; Жибурт Е.Б. и др., 1991; Abramson I.S. et al., 1982). Важное значение в противовирусной защите имеет цитотоксическое действие фагоцитов на инфицированные клетки-мишени (Маянский А.Н. и др., 1989).
Процессы усиления фагоцитарной активности нейтрофилов сопровождаются метаболической перестройкой, которая называется "дыхательным взрывом" (Зенков Н.К.и др., 1990; Юшук Н.Д. и др., 1991; Clark R.A. et al., 1990). Сущность этого процесса в том, что вследствие привлечения в очаг воспаления большого числа нейтрофилов последние способствуют образованию высоких концентраций свободных радикалов, в частности, активных форм кислорода (АФК-супероксиданион, перекись водорода, гидроксильный радикал, гипохлорид), с которыми связывается мутагенез, протеолитическая активация вируса гриппа, цитотоксичес-кий эффект вирусной инфекции, деструкция капиллярных стенок, нарушение микроциркуляции (Дубинина Е.Е. 1989; Дубинина Е.Е. и др., 1992; Исаков В.А. и др., 1993; Киселев О.И. и др., 1994).
Метаболический взрыв сопровождается выделением большого количества свободной энергии. Кислородные метаболиты вместе с миелопероксидазой и галоидными кофакторами, безусловно, являются ведущими элементами в инактивации вирусов гриппа и ОРЗ фагоцитами (Киселев О.И. и др., 1989; Abram-sonl.S. etal., 1982).
Следует отметить, что образующиеся в процессе генерации АФК гидроперекиси взаимодействуют с фосфолипидами клеточных мембран, что приводит к инициированию перекисного окисления липидов (ПОЛ) в мембранах. Активация системы ПОЛ показана при экспериментальной гриппозной инфекции у мышей. Показано, что максимум образования продуктов ПОЛ совпадал с началом массовой гибели экспериментальных животных (Камышенцев М.В. и др., 1992). Известно, что липидная пероксидация, активируемая вирусом гриппа в клетках органа-мишени (легочная ткань), наряду с генерацией АФК является одним из узловых метаболических процессов, определяющих тяжесть инфекционного процесса.
Исследования последних лет убеждают в том, что внутриклеточная активация кислорода может рассматриваться, с одной стороны, как необходимая стадия биоэнергетического обмена, а с другой, является универсальным механизмом повреждения клетки (Владимиров ЮА. и др., 1991; Gross A.R. etal., 1991). Для инактивации негативного воздействия АФК на клетки и ткани организма в последнем имеется система антиоксидантной защиты (АОЗ), состоящая из не ферментных и ферментных систем. (Говорова Н.Ю. и др., 1989; Kimbel P., 1984; Jenkinson S.G., 1984). Компонентами не ферментной АОЗ являются как низкомолекулярные соединения (аскорбиновая кислота, мочевая кислота, токоферол и др.), таки высокомолекулярные соединения (белки плазмы крови) (Говорова Н.Ю. и др., 1989; Halliwell B. etal., 1986).
Основным ферментом специфической АОЗ является супероксиддисмутаза (СОД). Наряду с СОД активными компонентами ферментной системы являются церулоплазмин (ЦП), селеносодержащий фермент глютатионпероксидаза, каталаза, а также метионинсульфоксиредуктаза, восстанавливающая метиониновый остаток в активном центре al-ингибитора протеиназ (Kimbel P.,1984; Jenkinson S.G., 1984). При таких патологических состояниях, как гипоксия, воспаление и гипероксия изменения активности СОД носят специфический характер. Интенсивная генерация АФК может приводить к истощению АОЗ, несмотря на синергизм действия ее отдельных компонентов. Поэтому, при глубоком оксидативном стрессе включается ферментативная АОЗ, активность, которой в норме незначительная (Дубинина Е.Е. и др., 1989; 1998).
Основная роль трансферрина (ТФ) и лактоферрина (ЛФ) в организме заключается в акцептировании свободного железа, что препятствует развитию реакций образования гидроксильных радикалов, катализируемых ионами железа (Туркин В.В., 1994; Halliwell В. etal., 1985). В окислительных реакциях с участием ионов двухвалентного железа церулоплазмин оказывается основным антиоксидантом плазмы, своеобразной "ловушкой" для АФК (Логинов А. С. и др., 1994; Gutteridge J.M.C. etal. ,1979).
Антиоксиданты (АО) используются при лечении различных заболеваний, однако применению АО в комплексной терапии гриппа и ОРЗ посвящены немногочисленные сообщения (Аненков А.А. и др., 1989; Исаков В.А., 1996; 1998; Исаков В.А. и др., 1993; 1997; 1998; Oda T. etal., 1989). Природные и синтетические АО предупреждают активацию свободнорадикальных реакций, играют существенную роль в активации эффекторных клеток, опосредующих иммунные реакции, поэтому АО могут обладать иммуномодулирующими свойствами (Дубинина Е.Е., 1998; Смирнова Л.Д. и др., 1989). Показано, что основные металлоферменты обеспечивают защиту организма от вирусных и бактериальных инфекций (Дробот И.В., 1992; Туркин В.В., 1994).
В последние годы в клинической практике используются биологически активные вещества с широким спектром фармакологического действия – соединения янтарной кислоты (ЯК) (Ивницкий Ю.Ю. и др., 1998; Кондрашова М.Н., 1996). Производные ЯК обладают антиоксидантными (АО) и цитопротекторными свойствами (Малюк В.И. и др., 1979; Косенко Е.А. и др., 1994). В качестве АО производные ЯК (сукцинат натрия, янтарный эликсир и др.) используются при лечении и профилактике заболеваний сердечно-сосудистой и эндокринной систем, органов дыхания при экзогенных интоксикациях (Гуляева Н.В., 1996; Джарвис Д.С., 1981; Ивницкий Ю.Ю. и др., 1998; Domingo J.L. etal., 1988; Zhang T.M. etal., 1994).
Показано что экзогенная ЯК корригирует метаболический ацидоз и интенсифицирует утилизацию кислорода тканями, что позволяет характеризовать действие производных ЯК при циркуляторной гипоксии как антигипоксическое (Ваизов X.В. и др., 1994; Гуляева Н. В., 1986). В эксперименте на молодых крысах ЯК увеличивала сопротивляемость животных комбинированному заражению вирусом и пневмококком. Защитный эффект выражался в уменьшении отставания животных от интактных по привесам (Кондрашова М.Н., 1976).
Показан положительный терапевтический эффект препаратов ЯК (сукцинат натрия) при включении их в схему лечения больных туберкулезом легких, бронхиальной астмой (Деркач B.C., 1986; Комиссар O.K., 1976).
Показана целесообразность включения в комплексную терапию гипоксического синдрома ингибиторов патологической активности эндогенных фосфолипаз, блокаторов повышенной активности лизосомальных эндопептидаз, антиоксидантов, стимуляторов мембранорепаративных процессов, ингибиторов трансмембранного тока Са2+ в клетку (Абрамченко В.В. и др., 1995; Антоненко Т.В., 1993; Дубинина Е.Е.и др., 1992; Исаков В.А. и др., 1993; Шаменев С.Ш. и др., 1990).
Цель исследования – изучить переносимость и терапевтическую эффективность инфузий 1,5% реамберина в комплексной терапии гриппа и ОРЗ, осложненных пневмонией, а также вирусных инфекций с поражением нервной системы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования были больные гриппом и ОРЗ, осложненными пневмонией в возрасте от 18 до 60 лет, госпитализированные в специализированное отделение респираторных вирусных инфекций взрослых НИИ гриппа на базе 23 отделения (зав. – Г.Л. Днепровская) городской инфекционной больницы им. С.П. Боткина (главврач – д.м.н. А.А. Яковлев), а также амбулаторные больные СПб медакадемии им. И.И. Мечникова. Всего обследовано 123 больных: 96 больных гриппом, осложненным пневмонией, 27 – нейроинфекциями и 35 доноров. Обследовано 96 больных, получавших различную терапию: 21 больной получал по 2 мл 7% раствора олифена внутривенно капельно 3-5 дней подряд; 37 – внутривенно капельно инфузий 15% раствора реамберина в течение 3-5 дней; 20 – витамин Е (α-токоферол) по 1 капсуле (100 мг препарата) 3 раза в день в течение 8-10 дней; 18 – находились только на базисной терапии (клинический контроль). Кроме того, обследованы 16 больных серозным (СМ) и 11 больных с гнойным менингитом (ГМ). Больные основных групп получали антиоксиданты дополнительно к базисному лечению.
Всем больным проводилось стандартное рентгенологическое обследование органов грудной клетки в двух или в трех проекциях, ЭКГ-обследование, клиническое лабораторное исследование мочи, крови.
Изучение сократительной способности левого желудочка сердца проводилось методом поликардиографии (ПКГ) по Блюмбергеру в модификации В.Л. Карпмана (1960). Для оценки деятельности правого желудочка сердца применялась реография легочной артерии (РЛГ) по Ю.Т. Пушкарю (1961), которая производилась на отечественном реографе РГ2-01. По длительности периода напряжения (ПН) правого желудочка с помощью формулы, предложенной Н.С. Чебышевым (1966), вычислялось среднегемодинамическое давление (СГД) в легочной артерии у этих больных. Определялось систолическое давление (СД) в легочной артерии по правожелудочковой кардиограмме и номограмме 3. Берстина. Запись ПКГ и правожелудочковой кардиограммы производилась на пятиканальном полифизиографе "Биокомб-5".
Функцию внешнего дыхания (ФВД) исследовали методом спирографии на спирографе СГ-1 в условиях полуосновного обмена, а также на аппарате "Этон-01". При оценке вентиляционной способности легких использовались как основные показатели (жизненная емкость легких – ЖЕЛ, объем форсированного выдоха за 1 сек. – ОФВ, максимальная вентиляция легких – МВЛ), так и производные (проба Тиффно, показатель скорости движения воздуха). Полученные результаты сравнивались с данными по таблицам в зависимости от пола, возраста и роста больного и оценивались по отношению к данным в процентах.
Насыщение артериализированной капиллярной крови определяли на аппарате "Оксипульс-М".
Серологическое исследование включало постановку по общепринятой методике в динамике РСК и РТГА с антигенами вирусов гриппа А и В, аденовирусным, РС-вирусным, микоплазменным и герпетическими антигенами. Диагностической считалась 4-х кратная и более сероконверсия.
Содержание металлопротеидов (трансферрина – ТФ, лактоферрина – ЛФ, церулоплазмина – ЦП) в сыворотке крови больных изучали методом радиальной иммунодиффузии в агаровом геле по Манчини (1965). Использовали антицерулоплазминовые, антилактоферриновые (полученные В.В. Туркиным) и стандартные (Sevac, Прага) антитрансферриновые сыворотки. Активность супероксиддисмутазы (СОД) плазмы определяли по методу снижения скорости восстановления нитросинего тетразолия в присутствии НАДН и феназинметасульфата и выражали в условных единицах на 1 мин., рассчитанных на 1 мл исследуемого биологического материала (кровь, плазма) или на мг белка при работе с плазмой (сывороткой) (Туркин В.В., 1994).
Определяли вторичные продукты ПОЛ (малоновый диальдегид – МДА) так называемым ТБК-тестом (Каган В.Е. и др., 1986; Погосян Е.Ш. и др., 1988).
Больные нейроинфекциями обследованы клинико-лабораторно: консультация невропатолога, окулиста, ЛОР-врача, сделаны рентгеновские снимки черепа и придаточных пазух лба и носа. Обследован ликвор: цитоз, белок, биохимическое исследование.
Статистический анализ полученных результатов проводили с помощью оценки критериев Стьюдента, а также методом углового преобразования Фишера (Сепетлев Д., 1968). Расчеты проводились на микро-ЭВМ СМ-1800.
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ РЕАМБЕРИНА
Всего обследовано и пролечено 96 больных. Впервые в эпидемический подъем по гриппу в 1998-1999 гг. применялся реамберин при лечении 37 больных гриппом и ОРЗ, осложненными пневмонией в дозе 300 мл внутривенно капельно медленно 1 раз в день, 3-5 дней подряд. При этом, 84% больных перенесли заболевание в среднетяжелой форме и только 16% – в тяжелой форме. Патологический процесс у больных локализовался в правом легком в 64%, в левом – в 23%, двусторонние поражения отмечены в 13% причем только у тяжелых больных. 21 больной получали кроме базисной терапии (БТ) олифен, а 20 человек – витамин Е. В группе клинического контроля на базисной терапии было 18 человек с аналогичной патологией.
Препарат РБ назначался в остром периоде в первые 2-3 дня госпитализации. Все больные переносили препарат хорошо, кроме двух пациентов (5,4%), у которых отмечалось легкое головокружение и чувство тепла, которые вскоре проходили. У одного из этих больных был отягощенный аллергологический анамнез. Клинико-лабораторные показатели оценки функции печени и почек (определение сывороточных АлаТ, АсаТ, билирубина, щелочной фосфатазы, креатинина, мочевины) были практически сопоставимы с аналогичными показателями в группе клинического контроля и не указывали на функциональные нарушения данных органов и систем. До применения препарата больные жаловались на лихорадку 37.3-38°С, слабость, головную боль, осиплость голоса, насморк, кашель с мокротой и без, у двоих наблюдались явления дыхательной и сосудистой недостаточности (больные с тяжелой формой). После 5 дней курсового применения препарата РБ большинство больных жалоб не предъявляли, самочувствие улучшалось, синдромы интоксикации и катаральных явлений прошли. Однако у 5 больных сохранялась слабость, катаральные явления, субфебрилитет, сниженный аппетит. Аускультативно у части больных выслушивались сухие хрипы на фоне жесткого дыхания, у троих – единичные влажные хрипы. На основании полученных данных можно сказать, что применение РБ способствовало уменьшению лихорадка до 7,6 дня, головной боли, в целом – симптомы интоксикации до 9,8 дня (таблица 1). Однако применение данного препарата достоверно не уменьшило продолжительность менингеального синдрома, рентгенологических изменений в легких (по сравнению с больными на БТ).
Таблица 1. Продолжительность клинических симптомов
у больных гриппом, осложненным пневмонией
|
Симптомы и синдромы |
Вид терапии |
|
|
Реамберин |
Базисная терапия (n=18) |
|
|
Лихорадка |
7,6 |
9,7* |
|
Интоксикация |
9,8 |
13,2* |
|
Головные боли |
3,3 |
5,0 |
|
Менингеальный синдром |
2,5 |
2,9 |
|
Катаральный синдром |
10,8 |
12,7 |
|
Продолжительность болезни |
23,6 |
25,4 |
Обозначения: * – р < 0,05
Преимущественная генерация при гриппе гипохлорида, который является мощным и неспецифическим окислителем, способным окислять не только липиды, но и белки, требует переоценки стратегии антиоксидантной (АО) терапии при гриппе. Классические АО (а-токоферол и другие) уже применялись ранее, и показан положительный, но умеренный эффект от их использования. Очевидно, относительно слабый эффект этих АО обусловлен тем, что они ингибируют терминальный этап процессов окисления - процессы ПОЛ, и не могут снизить интенсивность окислительного процесса в целом, который определяется, в основном, нейтрофилами.
Таким образом, отмечена хорошая клиническая переносимость и безвредность, а также высокая терапевтическая эффективность нового отечественного препарата Реамберина при лечении гриппа и ОРЗ, осложненных пневмонией.
Влияние Реамберина и других антиоксидантов
на функциональные изменения миокарда и легких
В І группе из 17 человек свыше 50% имели трофические изменения миокарда (58.8%, 10 человек). Нормальные показатели во время болезни были у 5 человек (29.4%). Изолированно изменения ритма наблюдались в одном случае, они сохранились и к периоду ранней реконвалесценции. Ухудшение измененных показателей было у 1 человека (5.8%). Восстановление функции отмечено у 10 человек (58.8%) от общего числа больных.
Во II группе, получавших реамберин (37 человек) мышечные изменения имелись у 15 человек (40%), нарушения ритма – у 8 человек (20%), сочетанные нарушения у 3 человек (6.6%),. Ухудшение показателей наблюдалось у 3 человек (8,5 %), без динамики – 16 человека (43.5%). Восстановление измененных функций отмечено у 18 человек (48% от всех обследованных). Показано, что РБ способствовал достоверно более частой положительной динамике и реже отмечалась негативная тенденция при анализе изученных показателей (таблица 2).
В III группе (9 человек) у 2 человек (22.2%) были изначально нормальные показатели. Почти у половины (4 человека) были изменения трофики миокарда, а у 2 – стабильные изменения. В трех случаях (33.3%) изменения ухудшились к периоду ранней реконвалесценции, а у 4 больных (41,7%) – остались без динамики. Восстановление функций произошло у 2 человек (25%) из обследованных больных этой группы. Резюмируя вышесказанное, следует, что:
- почти у 50% больных (во всех группах) имеются изменения трофических функций миокарда, а нарушения ритма встречаются значительно реже;
- самый высокий процент восстановления функций миокарда встречается в I и II группах, где больные получали олифен и реамберин. Эти данные свидетельствуют о положительном влиянии антиоксидантов на восстановление функций миокарда;
- вирус гриппа не всегда вызывает изменения в сердечной деятельности, т.к. во всех группах почти у трети больных показатели были нормальными и не менялись в течение болезни.
В таблице 3 показано, что в 1 группе (17 человек) в 2 случаях (11.7%) были изначально нормальные показатели, у 14 человек (82.3%) было снижение вентиляционной способности легких (ВСЛ), а 9 человек (52.9%) имели еще и нарушения со стороны бронхов. Изолированные нарушения бронхиальной проводимости не встречались. У 3 человек снижение ВСЛ сочеталось с генерализованной обструкцией. Несмотря на большое число изменений, значительное улучшение или нормализация наблюдались у 14 человек (82.3%) и только в 1 случае (5.8%) отмечали отрицательную динамику.
В П группе (37 человек – получали реамберин) у 12 пациентов (33.3%) имели место изначально нормальные показатели, 19 человек (53.3%) – снижение ВСЛ, 12 человек (33.3%) – нарушение проходимости бронхов. Эти изменения, как правило, были сочетанными, причем генерализованной обструкции не наблюдалось. К периоду ранней реконвалесценции ВСЛ восстановилась у 22 человек (60%) от обследованных. Лишь у 2 человек (6.6%) имелась отрицательная динамика.
В III группе (клинический контроль) из 9 человек у 5 (55.5%) были нормальные показатели. В 1 случае нормальные показатели ухудшились (изменение ВСЛ), у 1 больного (11.1%) — нарушение проходимости бронхов остались без изменений. У остальных 3 пациентов (33.3%) восстановились показатели ВСЛ и бронхиальной проходимости к периоду реконвалесценции.
Следовательно, можно отметить положительное влияние олифена и Реамберина на восстановление ВСЛ и бронхиальной проходимости (более короткие сроки) по сравнению с группой клинического контроля (р<0,05).
Изучались показатели оксигенации на фоне различных антиоксидантов (таблица 4). В I группе (олифен) нормальные показатели оксигенации за счет тахикардии были у 11 человек (64.7%), нормальные величины пульса к выписке были у 7 человек (41%), у 4 человек (23.8%) – без динамики, а у 6 (35.2%) – отмечалось усиление тахикардии для достижения нормальных показатели оксигенации (отрицательная динамика).
Во II группе (реамберин) нормальные показатели оксигенации отмечались за счет тахикардии у 25 человек (66%), а нормализация показателей пульса к выписке отмечена у 12 человек (33%), у 8 человек (20,8%) отмечена отрицательная динамика, у 17 (49,2%) - без динамики.
В III группе (клинический контроль) у 6 человек (66.6%) имелась нормальная оксигенация за счет тахикардии, к выписке 2 человек (20%) восстановили нормальные показатели пульса, остальные 4 (46,7%) - без динамики.
Таким образом, следует, что антиоксиданты (олифен и реамберин) оказывали ограниченное влияние на нормализацию показателей оксигенации.
Оценка специфической эффективности новых антиоксидантов
в лечении больных гриппом и ОРЗ, осложненными пневмонией
Мы, впервые в России и СНГ для изучения состояния АОС у больных гриппом и ОРЗ предложили (1989 г) определять содержание основных металлопротеидов в сыворотке крови – трансферрина (ТФ), церулоплазмина (ЦП), лактоферрина (ЛФ) и СОД. Эти же показатели были использованы для оценки эффективности проводимой специфической АО терапии при лечении гриппа.
В таблице 5 представлены результаты сравнительного изучения содержания сывороточных металлопротеидов у больных гриппом и ОРЗ, осложненными пневмонией с учетом проводимого лечения. Мы выделили 4 группы пациентов (см. раздел "Материалы и методы"). I группа – это больные, получавшие в комплексной терапии олифен, II – реамберин, III – витамин Е и IV – базисную терапию (антибиотики, отхаркивающие, симптоматические средства – группа клинического контроля).
Следует напомнить, что металлопротеиды ЦП, ТФ и ЛФ являются белками острой фазы воспаления. Основной признак белков этой группы — быстрое и значительное изменение концентрации в результате нарушения гомеостаза независимо от природы и места приложения вызвавшего его стимула. Как известно, механизм острофазной реакции заключается в следующем: под воздействием повреждающего фактора выделяются биологически активные вещества, способствующие увеличению синтеза ИЛ-1. Стимулируются защитные реакции организма, и увеличивается синтез печенью "белков острой фазы" воспаления, в частности, церулоплазмина. Поэтому при выраженной воспалительной реакции наблюдается более высокая концентрация медь связывающего белка в крови.
И.В. Дробот (1992), В.В. Туркин (1994) показали, что у детей, больных псевдотуберкулёзном и инфекционным мононуклеозом, увеличивался уровень не только иммунореактивной формы ЦП, значительно возрастало содержание в крови ферментативно-активной фракции этого белка. Последнее позволяет предполагать важную защитную роль именно этой формы церулоплазмина, что, по-видимому, обусловлено способностью медьоксидазы инактивировать свободные радикалы, в избытке имеющиеся в очаге воспаления. Кроме этого, ЦП способствует усилению продукции антител, улучшает выработку ИЛ-1 активированными макрофагами, повышает пролиферацию цитотоксических Т-клеток, цитотоксических лимфоцитов и К-клеток.
Принято считать, что железосодержащий белок относится к "отрицательным острофазным белкам", концентрация которых падает в начале болезни. Более низкое содержание ТФ у больных не осложненным и, особенно, осложненным гриппом в остром периоде болезни подтверждает это положение. Причем, чем легче течение гриппа, тем менее значимо снижение показателей ТФ, чем тяжелее клиническое течение осложненных форм инфекции, тем существеннее снижаются значения ТФ в сыворотке крови (таблица 5).
Механизм снижения ТФ тот же – развитие острой фазы воспалительного ответа. Увеличение уровня ИЛ-1 способствует освобождению ЛФ нейтрофилами, именно ЛФ захватывает железо и ведет к гипосидеремии. Можно предположить, что снижение уровня сывороточного железа, сопровождающее развитие многих воспалительных заболеваний, и приводит к уменьшению концентрации трансферрина. Возможно, и медь связывающий белок участвует в этом процессе, так как обладает выраженными ферроксидазными свойствами: он окисляет Fe2+ -» Fe3+, которое и встраивается в молекулу апотрансферрина (Дробот И.В., 1992).
В наших исследованиях показатели ТФ были снижены во всех группах больных (1,384-1,401 г/л, таблица 5). Наиболее высокая амплитуда повышения ТФ отмечена после применения реамберина и олифена (45,6% и 37,8% соответственно), нежели после витамина Е и БТ (26,3% и 24,2%, соответственно), причем эти различия достоверны (р< 0,05).
Лактоферрин играет важную роль в межклеточной кооперации фагоцитирующих клеток. Рецепторы к ЛФ обнаружены на моноцитах, макрофагах, нейтрофилах, активированных Т-лимфоцитах, а также В-лимфоцитах (Naidu A., 1991). Поглощение ЛФ мононуклеарными фагоцитами угнетает их способность к образованию гидроксильного радикала и защищает клетки от аутопероксидации мембраны. Повышение уровня ЛФ в сыворотке крови больных можно в данном контексте рассматривать как антиоксидантную защиту (АОЗ) и благоприятный прогностический признак. ЛФ является маркером специфических гранул нейтрофилов, на внутренней мембране которых находится набор рецепторов этих клеток (Кокряков В.Н., 1988). Секреция ЛФ из специфических гранул сопровождается активацией рецепторного поля клетки за счет встраивания белков-рецепторов в наружную мембрану нейтрофильных гранулоцитов. В то же время нарушение бактерицидной функции нейтрофилов связывают со снижением активности ЛФ.
Недостаток железа и железо-связывающих белков (ТФ, ЛФ) затрудняет иммунный ответ и функции лимфоцитов.
Таким образом, исследованные нами металлопротеиды (ЦП, ТФ и ЛФ) обладают не только антиоксидантными свойствами, но и являются важными компонентами системы неспецифической резистентности, обеспечивая устойчивость организма к бактериальным и вирусным инфекциям.
В наших исследованиях отмечено умеренное повышение уровня ЛФ в сыворотках крови больных II-IV групп, обследованных до лечения. Повышение концентрации ЛФ, который секретируется в основном нейтрофилами, обусловлено воздействием гидролаз на макрофаги, частичной их гибелью и высвобождением ЛФ из гранул нейтрофилов. Это, как отмечалось выше, способствует акцепции свободного Fe21 и связыванию его с белком. Применение реамберина и олифена способствовало достоверному снижению ЛФ до нормы. Меньшую АО активность проявляла базисная терапия (БТ) (группа ТУ), а также витамин Е.
В остром периоде инфекции показатели ЦП были повышены у всех больных. Назначение антиоксидантов, в частности олифена и РБ сопровождалось достоверным и более существенным снижением ЦП в сыворотках этих больных (р<0,05). Однако, несмотря на положительное влияние АО на уровень ЦП, последний оставался повышенным и после лечения, особенно у больных III-IV групп, что характеризует продолжающееся "напряжение" системы АОЗ (таблица 5). Следует подчеркнуть, что показатели ЦП после терапии олифеном и РБ были незначительно выше нормы (0,420 и 0,415 г/л, соответственно) по сравнению с показателями в III-IV группах (0,481 и 0,445 г/л, соответственно).
Показатели СОД были повышены во всех группах больных (54,39-56,2 нг/мл). Повышение уровней ЦП и СОД в остром периоде болезни указывает на серьезный оксидативный стресс, потребовавший компенсаторного включения ферментативной АОС, ключевым компонентом которой является СОД.
Повторное обследование больных после лечения зарегистрировало снижение показателей СОД у всех пациентов.
Более существенная амплитуда снижения СОД отмечена при лечении олифеном, РБ и витамином Е (5,7%-4%). Менее значительной амплитуда снижения СОД оказалась у больных, получавших базисную терапию (2,2%). Получавшие БТ имели более высокое содержание сывороточной СОД (53,6%) в фазе реконвалесценции, чем пациенты I-III групп (таблица 5).
Включение реамберина и олифена в комплексную терапию гриппа, осложненного пневмонией (1-й группы), способствовало достоверному и более значительному по сравнению с III-IV группами повышению ТФ, снижению ЛФ, ЦП и СОД. Иными словами, реамберин и олифен (внутривенно капельно) оказывали выраженное корригирующее влияние на содержание металлопротеидов, способствовали более выраженной стабилизации антиоксидантного потенциала сыворотки крови (по сравнению с витамином Е и БТ), что сопровождалось улучшением клинического статуса больных.
Активность процессов ПОЛ регистрировали по образованию вторичных продуктов ПОЛ - малинового диальдегида (МДА). Показано, что в остром периоде болезни активность процессов ПОЛ была достаточно высокой, что совпадает с литературными данными. Показатели МДА были в 2-3 раза выше нормы (таблица 6).
Применение антиоксидантов способствовало снижению показателей МДА, однако в периоде реконвалесценции они еще оставались повышенными. При использовании олифена амплитуда снижения показателей МДА была наибольшей (-0,27), несколько ниже амплитуда снижения значений МДА была после назначения РБ (-0,21). Меньше всего показатели МДА реагировали снижением на терапию витамином Е (-0,16). Необходимо подчеркнуть, что на фоне БТ отмечалось повышение значений МДА (+0,18), что указывает на негативную лабораторную динамику у этой группы лиц. Повышенные значения МДА в сыворотках крови больных после АО терапии в фазе ранней реконвалесценции указывают на сохраняющуюся умеренную активность процессов ПОЛ при наличии общей позитивной клинико-лабораторной динамике (таблица 6).
Таким образом, использование в терапии АО олифена и реамберина способствует значительному снижению активности процессов ПОЛ, менее существенно показатели МДА снижались после терапии витамином Е. Низкая активность витамина Е, по-видимому, обусловлена тем, что ±-токоферол подавляет терминальный этап процесса окисления - ПОЛ и не может снизить интенсивность окислительного стресса в целом.
Таблица 6. Показатели малонового диальдегида
с учетом вида антиоксидантной терапии
|
Группы больных, |
Показатели МДА (нг/мл) |
||
|
До |
После |
Разница между |
|
|
Грипп. пневмония + БТ |
2.94±0.2 |
3.12±0.5 |
+0.18* |
Примечание: норма = 1.1 нг/мл;
* (+) – увеличение и (–) – понижение значений МДА
Использование реамберина в терапии вирусных инфекций,
протекающих с поражением нервной системы
Говоря о воспалительном процессе, следует напомнить, что металлопротеиды ЦП, ТФ и ЛФ являются белками острой фазы воспаления, основной признак которых – быстрое и значительное изменение концентраций в результате нарушения гомеостаза независимо от природы и места приложения вызвавшего его стимула. Исследованные нами металлопротеиды обладают антиоксидантными свойствами, а также являются важными компонентами системы неспецифической резистентности, обеспечивая устойчивость организма к бактериальным и вирусным инфекциям.
Впервые нами выполнены исследования по определению уровней основных металлопротеидов (ТФ, ЛФ, ЦП и СОД плазмы) в сыворотках и ЦСЖ 16 больных серозными (СМ) и 11 пациентов с гнойными менингитами (ГМ). Больных обследовали на 2-й, 12-й и 24-й дни болезни (1-е, 2-е, 3-е обследование – табл. 1). Оказалось, что при СМ уровень сывороточных металлопротеидов был: ТФ -1,846 г/л, ЛФ - 0,448 мкг/мл, ЦП - 0,470 г/л, для плазменной СОД - 52,5 нг/мл в 1-м исследовании. Содержание ТФ во 2-м и 3-м обследовании повышалось (2,136 и 2,234 г/л соответственно) и приближалось к норме (2,344 ± 0,048 г/л), а остальных металлсвязывающих белков наоборот снижалось (0,426 и 0,415 мкг/мл ЛФ; 0,438 и 0,419 г/л ЦП; СОД плазмы - 52,0 и 51,3 нг/мл при норме указанных белков 0,405 ± 0,032 мкг/мл, 0.398 ±0,015 г/л и 49,6 ±0,1 нг/мл соответственно).
Обследование сывороток больных ГМ выявило разнонаправленные изменения концентрации основных металлопротеидов. При исследовании ЦСЖ у больных СМ уровень ТФ при 1-2-3-м обследовании был 1,883-2,156-2,356 г/л; ЛФ – 0,426-0,443-0,425 мкг/мл; ЦП – 0,473-0,446-0,399 г/л и СОД плазмы – 53,3-52,8-52,5 нг/мл (таблица 7). Больные ГМ имели достоверно более высокие показатели металлосвязывающих белков, чем при СМ. Следует отметить, что средний уровень изученных металлопротеидов в ЦСЖ был значительно выше, чем в сыворотках крови.
Предложенный комплекс лабораторных показателей не только характеризует состояние системы антиоксидантной защиты организма, но и позволяет объективно оценить результаты проводимой специфической антиоксидантной терапии.
Этиология нейроинфекций установлена вирусологически и серологически у 27 больных. Диагностика проводилась путем обнаружения вирусных антигенов методом ИФА в ликворе, выделяли вирусы из фекалий и серологически обследовали больных.
Инфузии 1,5% реамберина проводили в остром периоде болезни ежедневно в течение 3-5 дней подряд на фоне комплексной терапии больных серозными менингитами (СМ). Оказалось, что РБ более всего способствовал повышению уровня ТФ в сыворотке и ликворе (18% и 225% соответственно) по сравнению с контрольной группой больных (таблица 8). Существенное снижение показателей ЛФ отмечено в цереброспинальной жидкости (ЦСЖ) на фоне приема РМ, в то время как в контрольной группе в сыворотке крови повышалось значение ЛФ и снижалось содержание ТФ. Значительным оказалось снижение ЦП в ЦСЖ под влиянием реамберина, что указывает на антиоксидантную активность препарата. На показатели СОД инфузии РБ не влияли (таблица 8).
В таблице 9 приведены сведения по влиянию РБ на показатели крови и ЦСЖ у больных серозным менингитом. Видно, что реамберин способствовал более существенной нормализации цитоза и белка в ЦСЖ по сравнению с группой больных на БТ.
Выявлено положительное влияние реамберина на клинические показатели. Так, на фоне РБ лихорадка продолжалась 6,5 дня, интоксикация 6,4, цитоз нормализовался на 38 день, койко-день составил 46,5 дня. Аналогичные показатели в группе на БТ были - 8, 9 дня, 7, 5, 46 дней и 56 дней соответственно.
Таким образом, включение в комплексную терапию СМ реамберина целесообразно и сопровождается отчетливым клинико-лабораторным эффектом.
ВЫВОДЫ
Реамберин хорошо переносится больными, сочетается при назначении с основными лекарственными формами. Препарат оказывает положительный терапевтический эффект (уменьшается продолжительность синдромов интоксикации и, в меньшей степени, менингеального, отмечен кардиопротекторный эффект, улучшается функция внешнего дыхания).
Назначение инфузий 1,5% раствора реамберина сопровождается разнонаправленными изменениями содержания основных сывороточных металлоферментов (ТФ, ЛФ, ЦП и СОД) и повышением антиоксидантного потенциала сыворотки крови больных гриппом и ОРЗ, осложненными пневмонией, а также при нейроинфекциях.
На основании проведенных клинико-лабораторных исследований рекомендуется включение инфузий 1,5% раствора реамберина в комплексную терапию не осложненных и осложненных пневмонией форм гриппа и ОРЗ у взрослых, а также в периоде реабилитации данных групп больных.
Реамберин может быть использован как патогенетическое средство при лечении больных вирусными инфекциями с поражением нервной системы (серозные менингиты, менингоэнцефалиты).
ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ РЕАМБЕРИНА
ПРИ ЖЕЛТУШНЫХ ФОРМАХ ВИРУСНОГО ГЕПАТИТА
ПРИ ЖЕЛТУШНЫХ ФОРМАХ ВИРУСНОГО ГЕПАТИТА
Вирусные гепатиты - группа неоднородных антропонозных заболеваний с множественными механизмами передачи, проявляющихся общетоксическим, диспептическим синдромом, желтухой (Рахманова А.Г. с соавт., 1995).
Несмотря на медико-социальную значимость, до настоящего времени нет общепринятой классификации вирусных гепатитов (Соринсон С.Н., 1996). На наш взгляд, существующая классификация вирусных гепатитов, применяемая в Нижегородском гепатологическом центре, отвечает целям и задачам клинической практики (рис. 3).
Согласно инструктивным материалам все больные с желтушными формами вирусных гепатитов подлежат госпитализации в инфекционное отделение. Программа лечения желтушных вирусных гепатитов. А ограничивается методами патогенетической терапии; программа лечения вирусных гепатитов В включает комплекс противовирусных препаратов, рекомбинантных интерферонов, альтернативным является применение в комплексном лечении индукторов эндогенного интерферона (Соринсон С.Н., 1995; Виноградова Е.Н., 1997; Романцов М.Г. с соавт., 1998).
Согласно данным ВОЗ, в различных странах вирусными гепатитами инфицировано более 1 млрд. человек, ежегодно заражаются до 50 млн. человек.
В структуре распространения вирусных гепатитов в Санкт-Петербурге острые желтушные формы вирусных гепатитов А и В регистрируются соответственно у 57 и 25% населения, причем острый микст-гепатит А+В встречается у 47%, а А+С - у 15%, что свидетельствует о необходимости разработки новых отечественных эффективных средств патогенетической терапии для купирования интоксикационного синдрома при желтушных формах вирусного гепатита.
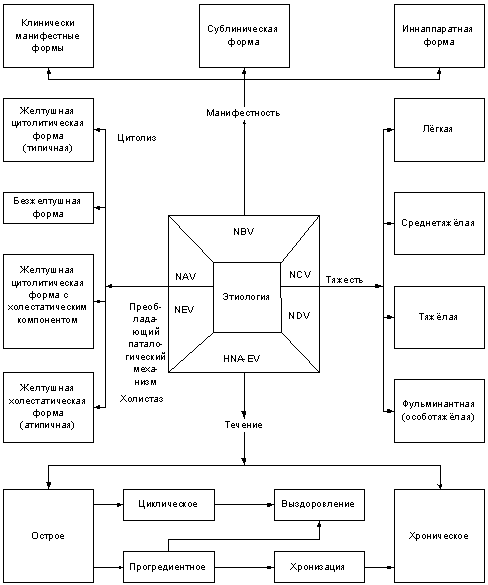
Рис. З. Классификация вирусных гепатитов
Средства дезинтоксикационной терапии, как правило, применяют преимущественно в первые дни госпитализации на высоте интоксикации, в этих целях применяют внутривенно капельно инфузий 5% раствора глюкозы, гемодеза, полиионных буферных растворов, необходимо при этом обеспечить именно капельную инфузию не подменяя ее струйным введением (Соринсон С.М., 1996).
Целью настоящего клинического исследования явилось определение эффективности применения препарата Реамберин в комплексной терапии больных желтушными вирусными гепатитами.
Больные, поступающие в гепатологическое отделение с проявлениями желтушного варианта вирусного гепатита с явлениями интоксикации и/или холестаза получали реамберин внутривенно капельно в суточной дозе 200-400 мл раствора в течение 7-11 дней в зависимости от выраженности интоксикации и тяжести заболевания.
Диагноз вирусного гепатита ставился на основании клинических, эпидемиологических данных и подтверждался определением маркеров вирусной инфекции. У всех больных производилось определение билирубина в сыворотке крови методом Иендрашика, АлАТ, коллоидных проб печени, холестерина, щелочной фосфатазы. В ходе работы, до лечения, на фоне терапии, а также после проведения курса Реамберина и базисной терапии производилось определение уровня SH-; SS-групп и коэффициента SH-SS для выяснения уровня антиоксидантной защиты и влияния на нее исследуемого препарата. Уровень сульфгидрильных групп определялся методом амперометрического титрования нитратом серебра в модификации В.В. Соколовского (1979). Для определения уровня SH-групп у здоровых лиц обследовано 40 доноров крови, у которых этот показатель составил 500,0 ± 44,8 мкмоль/л.
Для проведения настоящего исследования больные были разделены на 2 группы: опытная (65 человек) и контрольная (29 человек). Пациентам опытной группы методом случайной выборки назначался реамберин в суточной дозе 200-400 мл раствора в течение 7-11 дней в зависимости от формы и тяжести заболевания. Больные контрольной группы получали базисную терапию. Пациенты обеих групп были идентичны по полу, возрасту и наличию сопутствующих заболеваний.
В таблице 10 представлены основные синдромы желтушных вариантов вирусных гепатитов; синдром интоксикации документирован у 47,0% больных, поступивших в стационар; диспептический синдром регистрировался у 48,5% больных; артралгический и астеновегетативный выявлен соответственно у 23,5 и 26,5% больных. По окончании курса инфузионной терапии Реамберином диспептический синдром сохранился у 8,9%, а интоксикационный – у 11,8% больных; на фоне гепатомегалии (более 1,5 см), которая документирована у 41,2% больных. Следует заметить, что это были больные с тяжелым течением вирусного гепатита.
Таблица 10. Частота выявления основных клинических
симптомов
у больных желтушным вариантом ВГ
|
Симптом, признак |
Частота выявления |
|
|
До лечения реамберином |
После лечения реамберином |
|
|
Головная боль |
17,6 |
|
|
Головокружение |
11,8 |
|
|
Слабость |
41.2 |
17,6 |
|
Снижение аппетита |
52,9 |
|
|
Тошнота |
64,7 |
5,9 |
|
Рвота |
23,5 |
|
|
Боль в правом подреберье |
52,9 |
11,8 |
|
Зуд кожи |
41.2 |
- |
|
Гепатомегалия > 4 см |
64,7 |
41,2 > 1,5см |
|
Артралгия |
23,5 |
5,9 |
В таблице 11 представлена динамика биохимических изменений у больных, получавших курс инфузионной терапии Реамберином в динамике лечения, а также представлена группа сравнения – больные с желтушной формой вирусного гепатита, получавшие 5% раствор глюкозы в качестве дезинтоксикационного средства. Как видно их представленных данных к окончанию курса введения инфузионного раствора наблюдалось: снижение уровня билирубина в 4,3 раза; ферментемии – в 6,8 раза; показателей интоксикации и цитолиза у больных, получавших Реамберин, соответственно в 1,8 и 2,7 раза.
Таблица 11. Динамика биохимических показателей
у больных желтушным вариантом вирусного гепатита
в динамике лечения, получавших Реамберин
|
Показатели |
Контроль |
Получавшие реамберин |
Группа |
||
|
А |
Б |
В |
После |
||
|
Билирубин, |
до 19,0 |
159,2 |
95,8 |
37,3 |
65,7 |
|
АлАТ, |
до 30,0 |
373,8 |
198,6 |
54,9 |
241,7 |
|
Щелочная |
до 30 |
158,1 |
117,1 |
49,3 |
134,2 |
|
Холестерин, |
до 7,2 |
5,6 |
3,1 |
6,4 |
12,1- |
|
Тимоловая |
до 2,5 |
5,9 |
5,0 |
4,1 |
5,3 |
Обозначения:
А - исходный фон;
Б - на фоне лечения;
В - после окончания введения реамберина.
Таблица 12. Клеточные элементы (абсолютное количество) периферической крови в динамике наблюдения у больных, получавших Реамберин
|
Период обследо- |
СОЭ |
Показатели клеточных элементов |
||||
|
Лейко- |
Гранулоциты |
Мононуклеары |
||||
|
А |
Б |
В |
Г |
|||
|
1-ое, до начала проведения инфузионной терапии |
28,6 |
7,1 |
4,5 |
0,04 |
2,0 |
0,33 |
|
2-е, по окончании проведения инфузионной терапии |
13,3 |
6,2 |
3,4 |
0,13 |
2,3 |
0,33 |
Обозначения:
А - нейтрофилы;
Б - эозинофилы;
В - лимфоциты;
Г - моноциты.
Как видно из представленных в таблице 12 данных отмечалось снижение скорости оседания эритроцитов с 28,6 до 13,3 мм/ч (в 2,2 раза); тенденция к увеличению абсолютного числа лимфоцитов и тенденция к нормализации гранулоцитов (нейтрофилов). Следует отметить, что инфузионное введение раствора Реамберина в предполагаемых дозах не вызывает аллергизации организма, что документировано определением эозинофилов в периферической крови (абсолютное количество эозинофилов укладывалось в уровень нормы здоровых лиц).
У всех обследованных больных, поступивших на лечение в гепатологическое отделение, определение SH- SS-групп проводилось в динамике лечения: до начала терапии, через сутки после 6-й инфузии и после 10-11 инфузий, т.е. по окончании дезинтоксикационной терапии.
В таблице 13 представлены показатели изменения тиолдисульфидного равновесия в процессе лечения препаратом, а в таблице 14 приведены показатели до начала терапии и по окончании терапии.
Таблица 13. Динамика изменения тиолдисульфидного равновесия в процессе лечения инфузионным раствором реамберина 1,5%
|
Показатели равновесия |
Исходный уровень обследо- |
Через сутки после 1 - й инфузии |
Через сутки после 6 - й инфузии |
Окончание инфузии 10-11 день |
|
SH- |
290 |
340 |
360 |
480 |
Исследования показали, что более чем у 80% больных наблюдалось увеличение SH-групп в сыворотке крови в среднем на 44-46%, лишь у 7-9% больных отмечено снижение SH-фупп на 8-10%, а у 4% обследованных показатели не менялись.
Как видно из представленных показателей тиолдисульфидное равновесие числа SH-групп и К SH/SS в процессе лечения больных вирусными желтушными гепатитами увеличивается, что согласуется в положительной динамикой состояния больных (таблицу 14).
Следует заметить, что определение SH-групп может быть использовано для контроля эффективности препаратов, причем реакция системы антиоксидантной защиты может быть как кратковременной, так и отдаленной.
Таблица 14. Динамика изменения тиол-дисульфидного равновесия у больных, получавших Реамберин на этапе инфузионного лечения
|
Показатели |
Группа больных |
||
|
SH- |
SS- |
К SH-/SS |
|
|
Больные вирусным желтушным |
272 |
170 |
16 |
|
Контоольная группа больных |
257 |
144 |
10 |
Обозначения:
в числителе – до начала терапии;
в знаменателе – по окончании инфузионной терапии.
Современные сведения, полученные исследователями, позволяют говорить о прогностическом значении указанных параметров. В таблице 15 представлены показатели иммунологической реактивности больных, переносящих желтушную форму вирусного гепатита. Как видно из представленных данных, отмечается нормализация и/или тенденция к ней исследуемых показателей.
Рисунок 4 иллюстрирует динамику биохимических сдвигов у больных, получавших Реамберин в комплексной терапии интоксикации эндогенного генеза при желтушных формах вирусного гепатита.
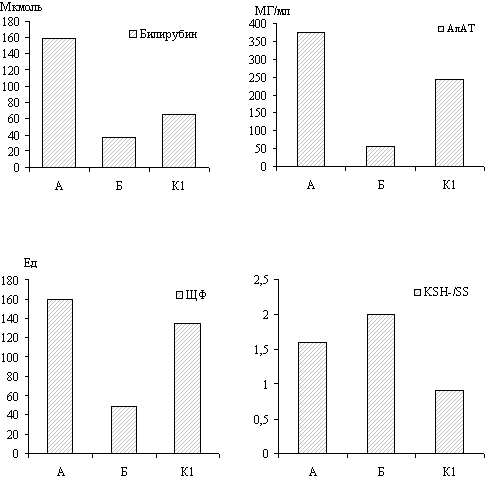
Рис. 4. Динамика биохимических сдвигов
у больных желтушной формой вирусных гепатитов
Обозначения:
А - до лечения,
Б - после лечения,
К1 - группа сравнения после инфузии 5% раствора
глюкозы.
Таким образом, на основании проведенного клинического исследования препарата 1,5% Реамберина для инфузии целесообразно рекомендовать препарат для применения в качестве средства для снятия интоксикации при желтушных Формах вирусных гепатитов.
Рекомендуемая схема введения препарата – по 400 мл раствора в течение 7-11 дней в зависимости от тяжести заболевания и выраженности интоксикационного синдрома.
Реамберин целесообразно применять в качестве дезинтоксикационного средства перед назначением противовирусной и иммунокорригирующей терапии при желтушных формах вирусных гепатитов с парентеральным механизмом инфицирования (В, С и микст. В+С).
У подавляющего числа больных желтушной формой гепатита отмечено исчезновение диспепсического синдрома, холестатического компонента, интоксикационного синдрома, наблюдалась у 58,8% больных нормализация размеров печени.
Препарат не обладает побочными (негативными) эффектами, отсутствует аллергизирующее воздействие раствора.
ЭФФЕКТИВНОСТЬ РЕАМБЕРИНА
ПРИ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
У БОЛЬНЫХ С "МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ"
ПРИ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
У БОЛЬНЫХ С "МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ"
История изучения диагностики и лечения заболеваний желчных протоков, осложненных механической желтухой и холангитом насчитывает более столетия (Гальперин Э.И (1979; 1983); Мирошников Б.И. (1995)). Механическая желтуха занимает одно из ведущих мест в структуре хирургической патологии, и лечение этого осложнения относится к числу наиболее актуальных и нерешенных проблем в медицине (Сазонов А.М. (1986); Шабунин А.В. (1998); Шалимов А.А. (1993)).
Наиболее тяжело при механической желтухе страдают печень, почки, мозг и сердце (Шиманко И.И. (1993); Непомнящих В.А. (1998)). При механической желтухе нарушения в системе перекисного окисле 11 и я липидов в мембранах митохондрий приводят к нарушению проницаемости мембран и гибели клеток, помимо этого происходит нарушение окислительного фосфорилирования, уменьшение синтеза АТФ и креатин фосфата (Brass C.A. et al. (1995)).
В последние десятилетия кроме фундаментальных работ по механической желтухе (Гальперин Э.И. (1979); Гальперин Э.И. (1983); Гостищев В.К. (1991); Roy С." (1992)), в основном ориентированных на оперативное лечение, появились работы, посвященные этиопатогенетическому лечению желтух в пост операционном периоде (Недоборский К.В. (1995); Юльметов Н.Ш. (1993); (1998); Епишин А.В. (1997); Шерстюк П.Я. (1997); Шабунин А.В. (1998)). Это объясняется необходимостью комплексного подхода в лечении тяжелой категории больных с учетом состояния реактивности организма больного и токсических реакций, вызываемых желтухой. В связи с этим появилась потребность в новых препаратах для внутривенных инфузии, сочетающих в себе дезинтоксикационные, антиоксидантные, антигипоксантные и гепато-нефропротекторные свойства.
В медицинской литературе имеются многочисленные данные о гепатопротек-торных и антиоксидантных свойствах солей янтарной кислоты - сукцинатов (Малюк В.И. (1979); Косенко Е.А. (1994)). О цитопротекторном и антиоксидантном действии янтарной кислоты известно давно (Кондрашева М.Н. (1996)).
Препараты, содержащие янтарную кислоту, применяются в лечении деструктивных форм острого холецистита (Ковалев М.М. (1980); Рой В.П. (1979)).
Представляемый препарат Реамберин 1,5% для инфузии является в этом отношении крайне удачным, а его применение при механической желтухе представляется необходимым и обоснованным.
ЦЕЛЬ РАБОТЫ заключалась в изучении клинической эффективности препарата Реамберин 1,5% для инфузии в качестве дезинтоксикационного, антиоксидантного и гепато-нефропротекторного средства в комплексном лечении больных с механической желтухой.
ЗАДАЧИ ИССЛЕДОВАНИЯ:
- Проведение сравнительной оценки эффектвности дезинтокционной, анти-оксидантной, антигипоксантной и гепато-нефропротекторной активности Реамберина 1,5% для инфузии у больных с механической желтухой с базовыми средствами ("Гемодез")
- Определение влияния Реамберина 1,5% для инфузии на динамику клинико-лабораторных показателей у больных с механической желтухой.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Клинические показатели, как-то: болевой синдром, желтушность кожных покровов, потемнение мочи и т.д. в исследование не включены из-за их субъективности. В то же время, необходимо отметить субъективное улучшение самочувствия, сна, более быстрое снятие кожного зуда и болевого синдрома у больных в основной группе.
В результаты лабораторного исследования включены только показатели, динамика изменений которых в сравнении контрольной и основной групп была достоверной (р< 0,05; р<0,01).
В биохимических показателях при применении препарата Реамберин 1,5% для инфузии выявлена явная положительная динамика, сопоставимая с одним из основных дезинтоксицирующих препаратов, применяемых в хирургии - "Гемодезом".
Положительная динамика внутриклеточных ферментов печени <АсАТ, АлАТ) и наиболее показательного при механических желтухах – щелочной фосфатазы), более выражена в основной группе, свидетельствуя об улучшении функции печени, уменьшении повреждения мембран гепатоцитов, то есть о гепатопротекторных свойствах препарата Реамберин 1,5% для инфузии, подтверждается положительной динамикой уровня билирубина в послеоперационном периоде у больных с механической желтухой.
У больных с острой почечной недостаточностью применение препарата Реамберин 1,5% для инфузий имело также положительный эффект, что подтверждается исследованиями креатинина, а также более быстрым переходом острой почечной недостаточности из стадии олигоурии в полиурию с увеличением суточного диуреза, то есть более быстрым разрешением острой почечной недостаточности (в среднем на 2-3 дня). Таблица 16.
Со стороны периферической крови положительная динамика отчетливо видна на примере лейкоцитоза, сопоставимая с такой же динамикой в контрольной группе, что говорит о более быстром разрешении воспалительных процессов в желчных протоках, а значит и более быстром разрешении одного из компонентов механической желтухи — холангита.
Таблица 17. Уровень лейкоцитоза у наблюдаемых больных
|
Показа- |
Норма |
Основная |
Контрольная |
||
|
А |
Б |
А |
Б |
||
|
Лейкоциты |
4-9 |
15,7±13,2 |
10,2±1,4 |
16,1±4,1 |
21,9±3,7 |
Обозначения:
А - до лечения;
Б - 8 сутки лечения.
Таблица 18. Показатели эндогенной интоксикации
у больных в динамике наблюдения
|
Показатель интоксикации |
Группы больных |
|||
|
Основное обследование |
Контрольное обследование |
|||
|
1-е |
2-е |
1-е |
2-е |
|
|
ВНиСММ. у.e. |
41.0 |
27.0* |
39.3 |
31.0* |
Обозначения:
ВНиСММ - вещества низкой и средней молекулярной массы;
Индекс интоксикации рассчитывался по формуле
ИИплазмы= ВНСММплазмы х ОПплазмы
* – р < 0,05 в сравниваемых показателях.
В основной группе наблюдался более низкий уровень ВНиСММ в плазме крови, как во время операции, так и после операции с тенденцией к нормализации в первую неделю после операции. Олигопептиды в плазме крови во время операции сопоставимы, в послеоперационном периоде в основной группе несколько меньше, менее высок и уровень индекса интоксикации плазмы. Более низкий уровень катаболического пула и более быстрый приход спектрограмм к норме также характерен для больных данной группы.
ИЗУЧЕНИЕ ИММУНОЛОГИЧЕСКОЙ РЕАКТИВНОСТИ
У БОЛЬНЫХ С "МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ"
Вторичный иммунодефицит, связанный с эндотоксикозом, вследствие механической желтухи, у больных оценивался с помощью иммунологических тестов, характеризующих иммунный ответ организма. Показатели иммунологической реактивности больных с механической желтухой и влияние Реамберина на эти показатели представлены в таблицах 19-21.
Таблица 19. Показатели неспецифической резистентности
больных
механической желтухой в динамике наблюдения
|
Показатель |
Уровень нормы |
Группы больных* |
|
|
1-я "К" |
2-я "Р" |
||
|
ФЧ |
60-90% |
53.2/68.6* |
63.3/85,4* |
|
ФИ |
4-9 |
18.3/5.8* |
3,4/1,4* |
|
НСТ-тест |
8-12% |
13,2/7,2 |
12,8/15,2* |
|
РТМЛс |
2-4 ед. |
2,2/1,2 |
1,6*/1,9 |
Обозначения:
В числителе – показатели больных при исходном уровне
обследования;
в знаменателе – за сутки наблюдения;
ФЧ – фагоцитарное число;
ФИ – фагоцитарный индекс;
РТМЛ – реакция торможения миграции лейкоцитов;
* – р <0,05 - 0,01 в сравниваемых показателях.
Таблица 20. Показатели иммунологической реактивности
больных
механической желтухой в динамике наблюдения
|
Показа- |
Уровень нормы |
Группы больных* |
|||
|
1-я "К" |
** |
2-я "Р" |
** |
||
|
Лимфоциты |
1,5-2,4 х 109/л |
1,1 |
-0,10 |
1,1/1,8 |
+0,7 |
|
Т-лимфоциты |
0,7-1,4 x 109/л |
0,37 |
-0,02 |
0,53/0,32 |
-0,21 |
|
РТМЛсФГА |
30-75% |
52,1 |
-0,40 |
32,6/82,5 |
+49,9 |
Обозначения:
* – в числителе – показатели при исходном уровне
обследования;
в знаменателе – обследование на 8-е сутки;
** – показатель прироста/снижения.
Под влиянием Реамберина отмечена нормализация уровня лимфоцитов периферичекой крови (1,8 против 1,1х109/л) за счет фракции Т-активных лимфоцитов (+0,2 против 0,02 – уровень прироста), а также увеличение РТМЛ с ФГА с 32,6 до 82,5% (+49,9%), свидетельствуя о повышении иммунологической реактивности организма (Таблица 20).
Под влиянием Реамберина наиболее значимая динамика отмечена по уровню иммуноглобулина А и G, отмечен прирост обоих показателей, несмотря на то, что уровень показателей иммуноглобулинов соответствовал уровню нормы здоровых лиц.
Таблица 21. Показатели гуморального иммунного ответа
больных механической желтухой в динамике наблюдения
|
Показатель |
Уровень нормы |
Группы больных** |
|
|
1-я "К" |
2-я "Р" |
||
|
В-лимфоциты |
0,3-0,8 х 109/л |
0,16/0,11 |
0,22/0,11 |
|
ЦИК |
50-80 ед. |
176/189* |
117/118* |
|
ИГ-М |
0,7-0,9 г/л |
2,17/1,96* |
1,79/2,40* |
|
ИГ-G |
7,2- 16,8 г/л |
13,5/8,3* |
9,8/11,4* |
Обозначения:
* – р< 0,05 – 0,01 в сравниваемых показателях;
** - обозначения аналогичны таковым в таблицах 24, 25.
При механической желтухе образование кислородных радикалов в клетках и тканях резко усиливается. Вследствие высокой агрессивности свободных радикалов окислению могут подвергаться самые разнообразные по химическому строению, свойствам, биологической активности субстраты. В результате свойства этих веществ резко меняются, что делает свободные радикалы потенциально опасными и требует применения в терапии механической желтухи специфических антиоксидантных препаратов. Наиболее показательными с точки зрения оценки антиоксидантного действия являются тиолдисульфидные соотношения. Общая буферная емкость антиоксидантной системы тем выше, чем больше смещена влево (в, сторону восстановительных эквивалентов) окислительно-восстановительное равновесие в тиолдисульфидной системе (SH/SS). Анализ данных тиолдисульфидных соотношений, приведенных как для общих, так и для белковых и небелковых показателей антиоксидантной системы больных с механической желтухой убедительно доказывает нормализацию буферных свойств этой системы при применении препарата Реамберин 1,5% для инфузий в послеоперационном периоде по сравнению с больными контрольной группы.
У одного больного на введение однократно препарата Реамберин 1,5% для инфузий было отмечено появление уртикарных высыпаний на внутренней поверхности обоих предплечий (без зуда), не потребовавшее применения антигистаминных и гормональных препаратов, и прошедшее самостоятельно через 3 дня.
Таблица 22. Эффект применения реамберина
|
1. Препарат Реамберин 1,5% для инфузий проявил высокий клинический эффект в качестве дезинтоксикацнонного средства у больных с тяжелыми формами эндогенной интоксикации (больные с механической желтухой). |
|
2. Препарат Реамберин 1,5% для инфузий улучшает функциональную активность печени, что подтверждено динамикой показателей внутриклеточных ферментов печени – щелочной фосфатазы, АсАТ и АлАТ. |
|
3. У препарата Реамберин 1,5% для инфузий установлено наличие антиоксидантных и антигипоксантных свойств. |
|
4. Применение препарата Реамберин 1,5% для инфузий показало хорошую переносимость и отсутствие аллергических и сосудистых реакций на его введение. |
|
5. Препарат, Реамберин 1,5% для инфузий может быть рекомендован в качестве этиотропного средства в терапии эндогенной интоксикации больных с механической желтухой. |
ЭФФЕКТИВНОСТЬ РЕАМБЕРИНА ПРИ ОСТРЫХ
И ХРОНИЧЕСКИХ ВИРУСНЫХ ПОРАЖЕНИЯХ ПЕЧЕНИ
И ХРОНИЧЕСКИХ ВИРУСНЫХ ПОРАЖЕНИЯХ ПЕЧЕНИ
Проблема вирусных поражений печени, получивших широкое распространение во второй половине нашего столетия в индустриально развитых странах, позволяет трансформировать ее из чисто Медицинской в социально-экономическую проблему. Этому способствует не только высокая частота возникновения острых случаев заболевания, но и ее неблагоприятные исходы в виде хронического гепатита, цирроза печени и гепатоцеллюлярной карциномы.
Более 1/3 населения мира поданным ВОЗ, инфицированы вирусным гепатитом, связанным с вирусом гепатита В, ежегодно умирают около 2 млн. человек.
Около 500 млн. человек в мире страдают хронической HCV-инфекцией.
В настоящее время хорошо изучено строение вируса С, появилась возможность идентифицировать его генотипы и субгенотипы, широко стала использоваться полимеразная цепная реакция (ПЦР) для непосредственного обнаружения вирусной РНК в сыворотке крови больного.
Изучая распространенность вирусного гепатита С среди различных слоев населения, установлено, что значительному риску инфицирования ВГС подвергаются пациенты, страдающие гемофилией и получающие препараты крови, которые собираются у большого пула доноров, а, следовательно, не могут быть подвергнуты должному вирусологическому контролю. Более того, абсолютное большинство исследователей выявляют полную коррелятивную зависимость между количеством полученных трансфузий и частотой инфицирования пациентов.
К группе высокого риска инфицирования справедливо относят больных отделений хронического гемодиализа. Отмечено, что у больных, находящихся на гемодиализе более 3-х лет, инфицированность ВГС достигает 100%. Вместе с тем, не найдена зависимость между частотой инфицирований ВГС и продолжительностью лечения. Авторы высказывают предположение, что случай ВГС в отделениях гемодиализа могут рассматриваться как внутри госпитальная инфекция.
В 1995 году выявлен из переливаемой крови вирус, обозначенный как вирус G, вызывающий парентеральный гепатит, ранее описанный как посттрансфузионный гепатит X. Генетический анализ показал, что это флавивирус, содержащий РНК. Вирус имеет нуклеиновые последовательности, характерные для НСV (на 25%), однако HGV — это самостоятельный генетический клон из группы флавивирусов. J. Simons et al. (1995), K. Masuko et al. (1996) показали, что вирус HGV имеет 3 клона — А, В и С. Первые 2 клона выявлены в различных регионах, GBV-C ассоциируется с хроническим гепатитом. HGV широко распространен в мире. Передача происходит парентерально. В Западной Европе уровень HG виремии колеблется в пределах 18-33% у лиц с насыщенным парентеральным анамнезом, при этом показано, что HGV может вызвать конфекцию у больных с хроническим гепатитом В (10%) или С (21%).
Изучение эволюции флавивирусов (Leary T.P. et al., 1996) позволило отнести их в общую кластерную группу HCV генотипов. В таблице 23 представлена этиологическая структура вирусных гепатитов за 1995-1997гг. по Санкт-Петербургу.
Таблица 23. Этиологическая структура вирусных гепатитов
(Виноградова Е.Н., 1998)
|
Этиология |
% выявления |
|
|
Острые вирусные гепатиты |
||
|
Гепатит В |
25 |
|
|
Гепатит С |
5,4 |
|
|
Микст-гепатиты (А, В, С) |
12,4 |
|
|
Хронические вирусные гепатиты |
||
|
Гепатит В |
20 |
|
|
Гепатит С |
21 |
|
|
Гепатит ВЧ-С |
23 |
|
Среди острых ВГ сохраняет свою актуальность вирусный гепатит В, составляя 25%, на долю ВГС приходится лишь 5,4%, но особое внимание привлекают микст формы вирусных гепатитов, частота их выявления составляет 12,4%. Следует заметить, что ОГВ на фоне ХГС регистрируются в 28%, а ОГС на фоне ХГВ – выявляется в 80% случаев.
Вирус гепатита В (HBV) представляет ДНК содержащий гепадновирус малых размеров с циркулярной двунитевой ДНК. К особенностям этого вируса относят механизм репликации, наличие в вирионе фермента, обладающего свойствами обратной транскриптазы. R. Miller и W. Robinson (1986) указывают на общность ретровирусов и HBV, их единое происхождение и наличие общих активирующих генов. Оболочка вириона имеет поверхностный антиген HBsAg, ядерный антиген HBcAg, е-антиген (HBeAg), вирусную ДНК и ДНК-полимеразу. Существенно, что НВV способен вызывать персистирующую многолетнюю инфекцию с высокой концентрацией, вирусов (Aragonf M. et. al, 1987).
Геном HBV имеет 4 открытых рамки считывания: ген С кодирует полипептид нуклеокапсида со специфичностью HBcAg, ген S — с пре-Sl, пpe-S2 и S регионами, которые кодируют поверхностные полипептиды. Ген Р составляет 3/4 генома и перекрывает участок С-гена, весь ген Б и участок Х-гена, кодируя полипептид, содержащий ДНК-полимеразу. Существует корреляция между наличием HBeAg в сыворотке крови и высокой концентрацией вирионов HBV и инфекционностью сыворотки (Hollinder P. et al., 1990).
При заражении HBV идет одновременно и/или последовательно два процесса: репликация HBV и интеграция. С репликацией связаны острая и хроническая формы болезни, с интеграцией – "хроническое носительство" HBsAg, eгo высокая концентрация в сыворотке крови, свидетельствуя о возможности продукции HBsAg при отсутствии репликации HBV (Robinson J., 1995). HBV инфекция, как правило, протекает в виде безжелтушных или субклинических форм болезни и выявляется на этапе ХГ у лиц, не имевших в анамнезе острого гепатита (Hoofnage J. et al., 1980), реже имеет место острый циклически протекающий гепатит. При этом к маркерам репликации HBV относят HBeAg, ДНК вируса и ДНК-полимеразу (Hoofnage J., 1980). У части больных с хроническим гепатитом В не определяется HBeAg или же HBsAg при наличии активно текущего гепатита, подтверждаемого вирусной репликацией по ДНК HBV в крови (Соринсон С.Н., 1996; Hoofnage J. et al., 1987). В этих случаях остро стоит вопрос о возможности наличия у этих больных либо дефектного, либо особого штамма вируса гепатита.
HBV инфекции свойственны системные множественные поражения не столько аутоиммунного, сколько специфического вирусного генеза, и в таких ситуациях особо необходима комплексная диагностика и комбинированная адекватная терапия больных.
Вирус гепатита С (HCV) содержит однонитевую РНК и по структуре своего генома относится к флавивирусам (Brillfnti S. et al., 1991). Геном BГC имеет две нетранслируемые области (5 NTR и 3 NTR) и ряд регионов, кодирующих вирус специфическую протезу, несколько структурных протеинов, включающих нуклеотиды ядра (core) и 2 оболочечных гликопротеида (El, E2/NS1). Последние выявляются в эндоплазматическом ретикулуме. Возможно, когда идет процессе протеолитической дезинтеграции во время репликации вируса, гликопротеиды Е1 и Е2 липидной оболочки ВГС накапливаются в аппарате Гольджи. Остальные неструктурные протеины также участвуют в репликации вируса (Cristiano К. et al., 1991), при этом включаются две вирусные протеазы (NS2 и NS3), а также хеликаза (NS3) и РНК-полимераза (NS5).
На основании различий нуклеозидных последовательностей в области NS5P Simmonds (1993) в своей классификации выделяет 76 различных штаммов вируса, которые составляют б больших групп с 40 подгруппами. Okamoto Y. et al. (1992) также выделяет 6 основных генотипов, но на основании различий нуклеотидных последовательностей в области ядра вируса. Клиническая значимость этих штаммов пока недостаточно изучена, но для отдельных регионов мира характерна циркуляция различных генотипов вируса (таблица 24).
Таблица 24. Географическое распостранение генотипов вируса гепатита С
|
Регион |
Генотип вируса С по классификации |
|
|
Европа, США |
la, 1b |
I, II |
|
Япония, Европа |
2a, 2b |
III, IV |
|
Россия, Санкт-Петербург |
I, II |
|
|
Египет, Йемен |
4 |
|
|
Южная Африка |
5 |
|
|
Гонконг |
6 |
|
|
Бангладеш и Таиланд |
3a, 3b |
V, VI |
В исследованиях, проведенных в России, антитела к этому вирусу обнаружены в 3,4 и 1,1% случаев (Мукомолов С.Л., 1994). Среди групп высокого риска – больных гемофилией и инъекционных наркоманов – антитела к HCV выявились в 60-70% (Mendenhall С. et al, 1991).
Поданным М. Alter, 1992 (СDC) ожидается ежегодно появление 150000 новых случаев гепатита С. Из них 37500 составят манифестные формы, приблизительно у 93000 инфицированных заболевание может прогрессировать до хронического гепатита, а у 30700 - сформируется цирроз печени.
Парентеральный путь передачи при вирусном гепатите С, по данным исследователей, в 90% случаев связан с переливанием крови (Seeff L.B. et al., 1992). Примерно 7% лиц, получавших переливание крови, приобретают HСV. После внедрения скрининга на антитела к HVC частота посттрансфузионного гепатита С снизилась до 0,03%.
Общность данных эпидемиологической характеристики, актуальность практически всех путей передачи определяют значительную частоту сочетанного развития HCV- и HBV-инфекции. Сочетанная инфекция чаще регистрируется у лиц, употребляющих наркотики внутривенно. Значительная распространенность вирусных гепатитов В и С, высокая степень хронизации процесса, особенно обусловленного вирусом гепатита С, большой риск развития гепатоклеточной карциномы обуславливает проведение противовирусной терапии в максимально ранние сроки.
Среди иммунных механизмов в патогенезе вирусных гепатитов важное значение имеет дефицит продукции альфа-интерферона, что приводит к снижению противовирусной защиты и активации вирусной репликации. В соответствии с общими принципами лечения инфекционных болезней программа комплексной терапии вирусных гепатитов включает два основных направления.
Первое, включает в себя назначение специфических противовирусных препаратов, среди которых широко используются препараты интерферонов. Вместе с тем показано, что применение этих препаратов дает временный терапевтический эффект даже при длительном их применении, а у 50-70% больных отмечается отсутствие эффекта на введение препаратов интерферона.
При этом многолетние исследования эффективности применения экзогенного ИФН выявили некоторые недостатки и ограничения, лимитирующие в ряде случаев использование этих препаратов в клинике (таблица 25).
Таблица 25. Побочные эффекты интерферонотерапии*
(по Okanue Т., 1996; Fattovich G... 1996)
|
*(Встречаемость синдромов до 1,5%, большинство носят обратимый характер)
При длительно протекающих заболеваниях, когда ИФН вводится в организм многократно и в больших концентрациях, образуются АНТИИНТЕРФЕРОНОВЫЕ АНТИТЕЛА, нейтрализующие экзогенный интерферон, кроме того, на сегодняшний день лечение препаратами ИФН остается достаточно дорогим и не всем доступным средством (Ершов Ф.И., 1996, 1998).
В единичных публикациях последних лет приводятся данные об использовании противовирусных препаратов, направленных на подавление репликации вирусов синтетических аналогов нуклеотидов при гепатите В (ретровир) и С (рибавирин). Перспективным также представляется использование препаратов ингибиторов протеаз. Второе направление соответствует патогенетической терапии, которая является корригирующей, и в процессе ее проведения необходим динамический контроль над больными.
РЕАМБЕРИН для инфузий обладает дезинтоксикационным, антигипоксическим,антиоксидантным и гепатопротекторным действием. Препарат улучшает дезинтоксикационную функцию печени, способствуя процессам репаративной регенерации гепатоцитов.
РЕАМБЕРИН активирует антиоксидантную систему ферментативного звена, снижая при этом процессы перекисного окисления липидов, обладая мембраностабилизирующим действием.
Спектр применения препарата в клинической практике довольно широк. Наряду с использованием его в гепатологической практике в комплексной терапии различных клинических форм вирусных гепатитов, возможно также применение его с дезинтоксикационной целью и с целью коррекции гипоксических состояний различного генеза.
РЕАМБЕРИН улучшает микроциркуляцию и реологические свойства крови: за счет повышения осмотического давления крови, наблюдается отток жидкости и токсинов из тканей в кровь; при этом наблюдается усиление обмена веществ, стимуляция диуреза, выведение токсинов из организма. Препарат оказывает мембраностабилизирующее действие на клетки печени.
Целью настоящего исследования явилась оценка клинико-лабораторной эффективности использования препарата РЕАМБЕРИН в комплексной терапии больных различными клиническими формами вирусных гепатитов с гемоконтактным механизмом передачи (ОГС, ХГС, ОГВ, ХГВ и микст-гепатитов).
В контролируемых условиях гепатологического отделения (клиническое отделение кафедры инфекционных болезней Санкт-Петербургской медицинской академии им. И.И. Мечникова) проводилось лечение больных с различными формами вирусных гепатитов.
Из них: больных острым вирусным гепатитом С было 38 человек, хроническим вирусным гепатитом С — 32 человека, острой формой микст гепатита В+С — 27 человек, вирусным гепатитом В+С — 23 человека, а также больных, переносящих острую форму вирусного гепатита В — 25 человек. Из числа обследованных больных были мужчины в возрасте от 16 до 40 лет, а женщины в возрасте 30-37 лет; 17 человек употребляли наркотики в инъекционной форме и имели стаж наркомании от 6 месяцев до 3-х и более лет.
Все пациенты, регулярно и длительно употребляющие наркотики, имели симптомы психической и физической зависимости, а так как практически все вводили технический героин, то поражение печени было вызвано не только вирусами, но и токсическим агентом.
Хронического алкоголизма не было выявлено ни у одного из обследованных. Пятеро больных имели различные сопутствующие заболевания: хронический холецистит и дискинезию ЖВП, также наблюдались больные с заболеваниями сердечно-сосудистой и дыхательной систем.
Обследование работали на промышленных предприятиях или являлись учащимися техникумов и ВУЗов, а 10 - не имели постоянной работы, однако в качестве официальных безработных зарегистрированы не были.
Для проведения настоящего исследования больные разделены на 2 группы : опытная (145 человек) и контрольная (19 человек). Пациентам опытной группы методом случайной выборки назначался РЕАМБЕРИН в суточной дозе 200-400 мл. раствора в течение 7-10 дней в зависимости от формы и тяжести заболевания. Больные контрольной группы получали базисную терапию по общепринятой схеме. Пациенты обеих групп были идентичны по полу, возрасту и наличию сопутствующих заболеваний. Больные поступали в стационар в среднем на 5-6-й день от начала заболевания.
Лечение больных опытной группы начиналось на 2-4-й день от момента поступления в стационар после получения результатов вирусологического обследования и уточнения этиологического вида гепатита и его клинической формы.
Все больные кроме терапии и диеты N5 получали препарата РЕАМБЕРИН внутривенно в суточной дозе 200-400 мл раствора в течение 7-10 дней.
Больные, поступающие в гепатологическое отделение, обследовались по общепринятой методике. Диагноз вирусного гепатита ставился на основе клинических, эпидемиологических данных и подтверждался определением маркеров НВ- и НС-вирусной инфекции. Для индикации HCV-РНК использовался метод полимеразной цепной реакции. У всех больных производилось определение билирубина в сыворотке крови методом Иендрашика, АлАТ и АсАТ, коллоидных проб печени, отдельных фракций белка, холестерина, щелочной фосфатазы. В ходе работы: до лечения, на фоне терапии, а также после проведения курса Реамберина и базисной терапии производилось определение уровня SH-SS и коэффициента SH/SS для выяснения уровня антиоксидантной защиты и влияния на нее изучаемого препарата. Уровень сульфгидрильных групп определялся методом амперометрического титрования нитратом серебра в модификации В. В. Соколовского (1979). Для определения уровня SH-групп у здоровых лиц обследовано 40 доноров крови, у которых этот показатель составил 500,0±44,8 мкмоль/л. Таблица 26.
Клинические проявления периода разгара заболевания соответствовали варианту течения гепатита. Так, преджелтушный период у абсолютного большинства больных ОГС протекал по бессимптомному типу, а период разгара характеризовался умеренно выраженной интоксикацией, оцененной в 1-2 балла. Пациенты ХГС, как правило, не указывали на перенесение вирусного гепатита, и диагноз хронического вирусного гепатита был установлен впервые. Лица с микст инфекцией в 45% случаев отмечали наличие вирусного гепатита в анамнезе, а 5 человек перенесли, по-видимому, клинически бессимптомную форму острого вирусного гепатита В и С.
При изучении данных биохимического исследования установлено, что ОВГС у 75% больных протекал с желтухой, уровень билирубина колебался от 231 мкмоль/ л до 160 мкмоль/л. Два пациента переносили безжелтушную форму заболевания. Уровень АлАТ значительно превышал показатель здоровых лиц и находился в пределах 3992 ЕД/л - 1189 ЕД/л. Ни у одного пациента не было изменений коллоидных проб печени (таблица 27).
Таблица 28. Максимальные значения биохимических
показателей
у больных хроническим гепатитом
|
Диагноз |
Били- |
Суле- |
Тимо- |
АлАТ |
АсАТ |
ПЦР "+" |
|
ХВГС |
50,0 |
2,36 |
4,95 |
220,0 |
106,5 |
+ |
В течение всего периода наблюдения в опытной группе больных учитывалась динамика объективных признаков заболевания, проводились общие клинические анализы крови, мочи, анализы крови на ВИЧ-инфекцию, RW.
В качестве критериев оценки функциональной способности печени использовались показатели содержания в крови общего билирубина и его фракций, активность АлАТ, АсАТ, протеинограмма сыворотки крови. Кроме того, электрохимическим методом определялась активность тиоловых антиоксидантов, характеризующих уровень неспецифической резистентности организма. Исследования показали, что у 85% обследованных больных, принимавших РЕАМБЕРИН, наблюдалось достоверное увеличение количества SH-групп в сыворотке крови в среднем на 40%, а у 10% обследованных больных наблюдалось снижение количества SH-групп на 8-10%. Современные представления о роли тиоловых антиоксидантов в системе неспецифической защиты организма позволяют говорить о прогностическом значений состояния тиолсульфидного обмена.
Таким образом, определение SH-групп может быть использовано для изучения эффективности препаратов, направленных на повышение неспецифической защиты организма. Более того, опыт показывает, что реакция системы антиоксидантной защиты может быть как кратковременной, так и отдаленной.
Примером этому могут служить результаты, полученные при исследования тиол-дисульфидного обмена у больных вирусным гепатитом, получавших внутривенно РЕАМБЕРИН. Таблица 29.
Как видно из таблицы значения показателей тиол-дисульфидного равновесия количества SH- групп и "К SH/SS" в процессе терапии препаратом Реамберин достоверно повышаются, что полностью согласуется с положительной динамикой состояния больного.
В процессе проведения клинических исследований осуществлялось повседневное наблюдение за больными с определением характера изменений клинических показателей и учетом переносимости больным препаратов. Следует отметить, что у части больных отмечались индивидуальные реакции на введение Реамберина в виде тошноты, тахикардии, гиперемии лица и головокружения. Однако при уменьшении концентрации раствора путем разбавления препарата 0,9% раствором NaCl и при уменьшении скорости внутривенного введения указанные явления исчезали полностью.
На фоне лечения Реамберином отмечалось улучшение общего самочувствия больных, снижались интоксикационные проявления и у 80% больных к 5-6 дню от начала лечения улучшалось настроение, повышалось качество жизни и исчезали диспептические расстройства.
У больных вирусным гепатитом С, получавших Реамберин
внутривенно к 8-10 дню от начала приема практически исчезала
желтуха (значения общего билирубина составили 52,2+1,2 мкм/л по
сравнению с исходными значениями 231,0+1,4 мкм/л), а также
наблюдалась положительная динамика в нормализации размеров печени
(у 87,6% против 60%). Нарушение пигментного обмена
восстанавливалось быстрее при введении Реамберина (р<0,01) в
сравнении с группой больных, находящихся на симптоматической
терапия. При изучении влияния Реамберина на биохимические
показатели в процессе терапии у больных вирусным гепатитом С
обращает внимание достаточно выраженная положительная динамика
параметров АлАТ, билирубина, а также SH-, SS-групп.
Следует
отметить, что у больных с микст вирусной инфекцией нормализация
уровня АлАТ наступала несколько медленнее, клинические показатели
сохранились на исходном уровне несколько дольше по сравнению с
острой формой вирусного гепатита.
Таким образом, при НСV-инфекции в группе леченных Реамберином быстрее происходила нормализация клинических показателей и была более отчетливая положительная динамика биохимических показателей по сравнению с больными, переносившими микст-инфекцию. Таблица 30. Таблица 31. Таблица 32. Таблица 33.
В таблице 34 представлены показатели щелочной фосфатазы в динамике наблюдений; щелочная фосфатаза – основной внутриклеточный фермент печени, характеризующий гепатопротекторные свойства препарата.
Показатели изменения креатинина в динамике лечения Реамберином свидетельствуют о достаточно четком дезинтоксикационном эффекте препарата.
Показатели неспецифического иммунного ответа у больных, получавших РЕАМБЕРИН представлены в таблице 35
Под влиянием Реамберина у больных, переносящих вирусный гепатит, отмечалась положительная динамика, проявляющаяся в нарастании сниженных показателей и нормализация высоких показателей (ФИ – в опытной группе составил 7,1 против 21,0, а в контрольной группе показатель составил 17,3 и 14,3). НСТ-тест у больных, получавших Реамберин, в динамике наблюдения составил 17,0 и 9,2%, а в контроле - 14,0 и 16,2%.
Таблица 36. Показатели эндогенной интоксикации
|
Показатели |
Исходный фон |
Группа больных |
|
|
Основная |
Контрольная |
||
|
Индекс интоксикации плазмы |
84,6 |
21,4 |
29,7 |
|
Катаболический пул (у.е.) |
19,7 |
12,4 |
16,3 |
|
Олигопептиды |
1749 |
860 |
1534 |
Как видно из представленных в таблицах 30-36 данных отмечена положительная динамика в изменениях изучаемых показателей больных, получавших Реамберин.
В результате проведенного исследования установлена эффективность препарата в качестве дезинтоксикационного, антиоксидативного средства; отсутствие побочных эффектов и аллергических реакций делают применение препарата при вирусных поражениях печени перспективным.
Таким образом, у подавляющего числа больных (более 80%) на 5-6 день от начала лечения препаратом Реамберин отмечалось улучшение самочувствия, повышение общего тонуса, исчезновение диспептических явлений, улучшение настроения. У 12% обследованных больных введение Реамберина не оказало существенного влияния на динамику клинических показателей; у больных опытной группы достоверно чаще, чем в контрольной, наблюдались положительная динамика уменьшения размеров печени и купирование желтухи. К моменту выписки больного из стационара нормализация размеров печени наступала у 45% обследованных. Все пациенты, получавшие базисную терапию, выписаны с явлениями гепатомегалии: среди биохимических показателей отмечена наиболее существенная положительная динамика под влиянием лечения Реамберином в отношении уровня общего билирубина, АлАТ и SH-групп в сыворотке крови, показатели которых снижались более выражено по сравнению с контролем.
На основании результатов изучения препарата Реамберин можно придти к заключению, что этот препарат целесообразно рекомендовать для применения с лечебной целью при:
- острых вирусных гепатитах В и С, протекающих на фоне токсического поражения печени;
- хронических вирусных гепатитах В и С;
- сочетанных формах НВ и НС-вирусной инфекции;
- на фоне сопутствующей патологии почек и сердечно-сосудистой системы.
Рекомендуемая суточная доза препарата Реамберин – 200-400 мл в течение 2-10дней в зависимости от формы заболевания.
Реамберин может быть использован в качестве дезинтоксикационного средства перед назначением специфической противовирусной терапии больным с различными клиническими формами вирусных гепатитов, включая микст формы.
- Реамберин проявляет гепатопротекторные свойства, что подтверждено динамикой внутриклеточного фермента печени – щелочной фосфатазы
- Антиоксидантная активность препарата доказана изменением показателей антиоксидантной системы (общими, небелковыми, белковыми).
- Дезинтоксикационные свойства препарата подтверждены показателями эндогенной интоксикации.
Понятие интоксикации при хроническом вирусном гепатите - сугубо клиническое. Оно соответствует клиническим проявлениям организма на накопление и циркуляцию токсинов. В отличие, например, от желтухи, интенсивность которой в значительной мере соответствует уровню гипербилирубинемии, степень выраженности токсикоза при безжелтушных формах можно оценить только клинически. В инфекционной клинике учет синдрома интоксикации традиционно служит важнейшим критерием характеристики состояния больных и оценки тяжести болезни.
Наличие и степень выраженности синдрома интоксикации обосновывают детальным анализом жалоб больных (слабость, потливость, повышенная утомляемость, отсутствие аппетита, подташнивание, рвота, головные боли, головокружение, "мушки" перед глазами, нарушение сна). Информативны угнетенное состояние, вялость, адинамия, лабильность настроения. Такая практика способствовала более объективному разграничению тяжелых и среднетяжелых и легких форм гепатита. Интоксикация достигает наибольшей степени выраженности при фульминантной форме вирусных гепатитов. При тяжелом течении одновременно с синдромом интоксикации наблюдаются мелкие единичные кровоизлияния в кожу и конъюнктиву, кровоточивость десен, необильные носовые, маточные кровотечения, макрогематурия. Их выявление всегда требует расспроса больных и детального осмотра кожи и слизистых оболочек, исследования мочи. Редко отмечаются признаки диапедезного кишечного кровотечения. В диагностике синдрома интоксикации важны также результаты эндотелиальных функциональных проб (симптомы "щипка", "жгута"). При легкой форме гепатита любые клинические признаки синдрома интоксикации, как правило, отсутствуют.
Определенные факторы (злоупотребление алкоголем, наркоманией; беременность, сопутствующие заболевания) потенциально могут способствовать более тяжелому течению синдрома интоксикации при вирусных гепатитах.
В настоящее, время для эффективной терапии синдрома интоксикации при вирусных гепатитах ведется поиск препаратов, обладающих помимо дезинтоксицирующего также антигипоксическим, антиоксидантным и гепатопротективным действием. Дезинтоксицирующая терапия при хронических вирусных гепатитах является важным этапом лечения, направленным на подготовку к интенсивной противовирусной терапии, а при циррозе, к интенсивной гепатопротекторной терапии.
Материалы и методы
Под наблюдением находилось 44 больных, страдающих хроническим заболеванием печени с синдромом интоксикации; средний возраст составил 49±9 лет. Группы больных: 1-я группа: n=11 – больные хроническим вирусным гепатитом (ХВГ) с минимальной степенью активности; 2-я группа: n=11 – больные ХВГ с умеренно выраженной активностью; 3-я группа: n=11 – больные ХВГ на стадии формирования цирроза печени; 4-я группа: n=11 – больные первичным билиарным циррозом печени.
В контрольные группы были подобраны пациенты с близкими клинико-лабораторными показателями.
Диагноз верифицировался вирусологически: определялись HBsAg, анти-HBeAb, HBeAg, анти-НВсоrАВ, анти-НСVАв проводилась гепатобиопсия. Перед назначением препарата и в динамике оценивались: общее состояние пациента и ряд клинически значимых лабораторных показателей – ионный состав и биохимические показатели крови, клинический анализ крови, иммунограмма (оценивалось количество лимфоцитов и их субпопуляции методом моноклональных антител), показатели интерферонового статуса (сывороточный интерферон (ИНФ), индуцированная продукция ИНФ-±/І, ИНФ-і), определялась функциональная активность моноцитов в (НСТ-тесте), коагулограмма, определялся индекс эндогенной интоксикации.
Схема введения препарата: реамберин 1,5% 400 мл использовался в инфузионной терапии больных хроническими вирусными гепатитами (ХВГ) В и С на разных стадиях заболевания, включая цирротичеcкую стадию ХВГ, а также у больных жировым гепатозом, первичным билиарным циррозом печени. Препарат вводился один раз в сутки по 400 мл внутривенно капельно ежедневно, 10 флаконов на курс.
Базисная терапия (БТ) в группах сравнения включала: 400 мл. 0,9% раствора натрия хлорида в сутки, гепатопротекторы, витамины группы В в течение 10 дней.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ РЕАМБЕРИНА
Применение Реамберина в инфузионной терапии интоксикации больных хроническими заболеваниями печени приводило к более быстрому уменьшению проявлений астеновегетативного синдрома. Уже после первого дня инфузионной терапии у подавляющего большинства пациентов улучшалось самочувствие, прекращалась тошнота, головокружение и головные боли, появлялся аппетит. Дальнейшая инфузионная терапия Реамберином улучшила субъективные показатели самочувствия пациентов – больные чувствовали бодрость и прилив сил, нормализовался сон.
При проведении дезинтоксикационной терапии раствором натрия хлорида в группе сравнения субъективные признаки отсутствия явной интоксикации больные отмечали значительно позже – только на 3-4 день лечения.
В дальнейшем детальному обсуждению будут подвергаться лабораторные показатели со значимой динамикой в процессе инфузионной дезинтоксикационной терапии при хронических заболеваниях печени.
Применение препарата благоприятно отразилось на показателях периферической крови: наблюдалось повышение абсолютного количества лимфоцитов (НСТ-тест) (рис. 6).
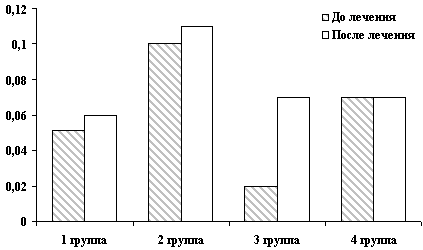
Рис. 5. Значения абсолютного количества лимфоцитов
в динамике в исследуемых групп больных
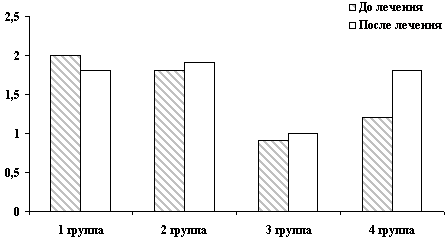
Рис. 6. Изменение функциональной активности моноцитов
в исследуемых группах больных.
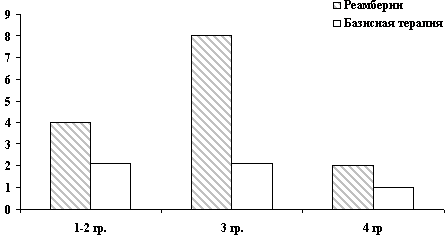
Рис. 7. Активность АлАТ
при инфузионной терапии
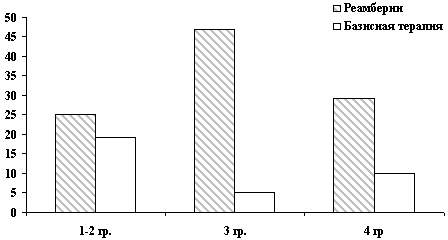
Рис. 8. Активность АсАТ
при инфузионной терапии
Уменьшение активности аминотрансфераз в группе больных ХВГ с умеренной и выраженной активностью было более существенным у больных, в схему лечения которых входил Реамберин. В группе больных ХВГ на стадии цирроза печени и больных первичным билиарным циррозом печени также наблюдалась положительная динамика АлАТ, АсАТ по сравнению с группой больных, получавших базисную терапию (Таблица 37). Изменения реологических свойств крови на фоне терапии Реамберином имеют неоднозначный характер: у больных ХВГ с минимальной активностью и больных билиарным циррозом печени не наблюдалось изменений, у больных с ХВГ с умеренной и выраженной активностью, фиброзированием и у больных ХВГ на стадии цирроза печени наблюдалась тенденция к гипокоагуляции, выражающаяся снижением протромбинового индекса с 84,3 до 72,6% (р<0,05), удлинением протромбинового времени с 15,6 с до 17,2 с (р<0,05); увеличением времени образования сгустка крови с 5 мин 41 с до 6 мин 9 с (р<0,05), повышением фибринолитической активности. Наблюдаемая гипокоагуляция устранялась изменением схемы лечения Реамберином: препарат назначался через день в той же дозе. Использование Реамберина через день в терапии больных ХВГ с умеренной активностью приводило к повышению показателей протромбинового индекса, уменьшению протромбинового времени, времени образования сгустка крови.
Приведенные данные свидетельствуют о дисбалансе системы ИФН при всех формах ХЗП (таблица 38): отмечается повышение сывороточного ИФН и снижение индуцированной in vitro продукции ИФН-α/β и ИФН-γl; по сравнению с нормой, свидетельствуя о высоком уровне интоксикации. Наиболее существенный дисбаланс системы ИФН наблюдался у больных ХВГ на стадии цирроза печени. На фоне проводимой терапии Реамберином в 47% случаев наблюдалось достоверное снижение сывороточного ИФН с (27,3±1,02 до 18,1±0,83) МЕ/мл, р<0,05, сопровождающееся тенденцией к повышению продукции ИФН- α/β, что свидетельствует о снижении уровня интоксикации организма. У 34% больных (ХВГ минимальной, выраженной степенью активности, больных первичнымбилиарным циррозом печени) на фоне терапии повышались показатели CD3+, CD4+, CD8+ЛФ, хотя исходно эти показатели находились на нижней границе нормы (рис. 9).
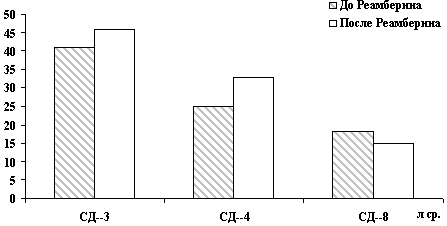
Рис. 9. Изменение иммунологических показателей у больных ХВГ минимальной и умеренной активности после терапии Реамберином
В группе больных с хроническим вирусным гепатитом (таблицы 39, 40) минимальной и умеренной активности при интоксикации до инфузионной терапии Реамберином наблюдался высокий уровень молекул средней массы и олигопептидов в плазме крови. После инфузий Реамберина нормализация индекса интоксикации плазмы наблюдалась к 10 дню терапии. В группе с базисной терапией динамика снижения уровня индекса интоксикации организма была меньше. Этот эффект на фоне лечения Реамберином, очевидно, связан как с усилением выведения токсинов засчет увеличения ОЦК и стимуляции диуреза, так и за счет активации метаболизирующей активности печени под действием янтарной кислоты. Характерно, что в группах с интоксикацией на фоне цирроза печени динамика снижения молекул средней массы, олигопептидов и самого индекса эндогенной интоксикации имела сопоставимый уровень, что, очевидно, связано с уменьшением метаболизирующей функции печени за счет разрастания фиброзной ткани при циррозе и получения детоксицирующего эффекта в большей степени за счет стимуляции диуреза.
Таблица 39. Показатели эндогенной интоксикации в группах ХВГ
|
Показатели интоксикации |
Группы больных |
|||
|
Группа с Реамберином, (n=22) |
Группа с базисной терапией, (n=22) |
|||
|
А |
Б |
А |
Б |
|
|
Молекулы средней массы, у.е. |
31,8±4,3 |
24,9±1,9* |
34,5±8,3 |
32,7±1,2 |
|
Олегопептиды, мг/л |
1510±87 |
345±10* |
1640±160 |
1080±110 |
|
Индекс эндогенной интоксикации по Малаховой |
51,2±0,3 |
20,1±0,1 |
58,6±0,4 |
38,2±0,7 |
Обозначения:
А - до исследования;
Б - 10-е сутки.
Таблица 40. Показатели эндогенной интоксикации в группе
с предциррозной формой ХВГ и циррозом печени
|
Показатели |
Группы больных |
|||
|
Группа с Реамберином |
Группа с базисной терапией, (n=22) |
|||
|
А |
Б |
А |
Б |
|
|
Молекулы средней массы, у.е. |
45,8±5,1 |
39,6±1,9* |
54,5±9,1 |
4б,7±1,2 |
|
Олегопептиды, мг/л |
1671±96 |
v1545±12* |
1640±123 |
1610±110 |
|
Индекс эндогенной интоксикации по Малаховой |
66,9±0,3 |
40,8±0,1 |
68,6±0,4 |
45,2±0,7 |
Обозначения:
А - до исследования;
Б - 10-е сутки.
Примечание: * – достоверно Р<0,05
Таким образом, Реамберин, обладая дезинтоксикационным действием при хронических заболеваниях печени, способствует снижению цитолиза и эндогенной интоксикации.
ЭФФЕКТ РЕАМБЕРИНА ПРИ ПОРАЖЕНИИ ПЕЧЕНИ
У НАРКОЗАВИСИМЫХ ЛИЦ
У НАРКОЗАВИСИМЫХ ЛИЦ
Всемирная Организация Здравоохранения (ВОЗ) на протяжении десятилетии принимает активное участие в исследованиях по вирусным гепатитам, а также в борьбе по профилактике этих заболеваний. Это связано с тем, что вирусный гепатит В (ВГВ) и ВГС остаются серьезной проблемой здравоохранения и могут вызвать не только острые, но и хронические формы заболевания с переходом в цирроз и гепатоцеллюлярную карциному с летальным исходом (Львов Д.К., 1995; Соринсон С.Н., 1996; Яковлев А.А. и др., 1997).
Важным аспектом является токсическое поражение печени и, в первую очередь связанное с парентеральным употреблением наркотиков (Власов Н.Н. и др. 1997; Пригожина В.К. и др., 1997; Соринсон С.Н., 1995). Если наркоманию рассматривать сугубо с медицинской точки зрения, то поражение печени, включая ВГ и ВИЧ-инфекцию, относятся к главным ее "осложнениям" (Власов Н.Н. и др., 1997) Потребление наркотиков сопровождается поражением печени, почек, иммунной системы и других органов и тканей. Кроме того, ряд факторов сопутствуют наркомании и одновременно, таким образом, становятся кофакторами поражения печени. В первую очередь это относится к алкоголю, злоупотребление которым сочетается с наркоманией в 80% случаев, по данным зарубежных авторов, а также плохое питание и токсические примеси кустарных наркотиков (Власов Н.Н. и др. 1997) Общеизвестно, что именно среди наркоманов с парентеральным путем введения наркотиков, резко возросла частота заболеваемости ВГ и СПИДом.
Показано, что маркеры ВГВ среди наркоманов обнаруживаются в 44,4-77,4% случаев, острых и хронических форм ВГС - 38-52% (Власов Н.Н. и др. 1977; Пригожина В.К. и др., 1977). Вирусный гепатит D часто встречается (Швеция, Испания) почти исключительно среди наркоманов. Клинически такие ВГ протекают крайне тяжело с поражением различных органов, нередко с развитием ОПН. Недостаточность печеночного кровотока, обусловленная интоксикацией и сопутствующими заболеваниями сердечно-сосудистой системы вместе с нарушениями микроциркуляции и снижением кислородной емкости приводит к гипоксии гепатоцитов. При ВГ, в сочетании с эндогенными интоксикациями (ЭЙ) наркотиками, активация ПОЛ в мембранах митохондрий приводит к нарушению проницаемости и гибели клеток. Кроме того нарушается окислительное фосфорилирование, уменьшается синтез АТФ и креатинфосфата (Brass С.A. et al., 1995).
Частота возникновения и тяжесть клинических проявлений синдрома полиорганной недостаточности, возникающего как фунционально-морфологический результат многокомпонентных каскадов постгипоксических расстройств тканевого метаболизма при критических состояниях, зависят от неспецифической резистентности организма и в первую очередь – от резистентности к гипоксии. В связи с этим необходимо использование в комплексной терапии таких больных препаратов с антиоксидантной, антигипоксантной активности, гепато- и нефропротекторными свойствами.
В настоящее время в клинической практике в качестве биологически активных веществ с широким фармакологическим спектром действия применяют соединения янтарной кислоты (Ивницкий Ю.Ю. и др., 1998; Кондрашова М.Н., 1996; Maлюк В.И. и др., 1979; Косенко Е.А., 1994).
Цель исследования – изучение переносимости и клинической эффективности реамберина при тяжелых формах вирусных гепатитов и экзоэндогенных интоксикациях, обусловленных употреблением наркотиков.
МАТЕРИАЛЫ И МЕТОДЫ
Работа проводилась в отделениях для больных вирусными гепатитами и peaнимации инфекционной больницы г.Великий Новгород, которые являются клинической базой кафедры микробиологии, иммунологии и инфекционных болезней НовГУ (зав. кафедрой - профессор Г.С. Архипов).
Под наблюдением находились 51 больной различной формы ВГВ и ВГС в возрасте от 18 до 25 лет. Больные распределены на три группы: 1 группа – 24 больных ВГ, получавшими реамберин (Р); 2 группа – 12 больных сходными формами ВГ на фоне БТ; 3 группа – 12 больных, получавших Р в комплексной терапии тяжелых и крайне тяжелых форм ВТ, протекавших у наркоманов (наличие экзоэндогенной интоксикации).
Все больные обследованы клинически, биохимически (определяли содержание билирубина, АлАТ и АсАТ, показатели тимоловой пробы, холестерина, желчных кислот).
Содержание металлоферментов (трансферрина – ТФ и церулоплазмина – ЦП) в сыворотке крови больных определяли методом радиальной иммунодиффузии в агаровом геле по Манчини (1965).
Ниже приведен анализ результатов обследования больных 1 и 2 групп. Приводим клиническую характеристику больных 1 группы: 5 – имели ОВГВ желтушный вариант, среднетяжелое течение. 3 – ОВГВ желтушный вариант с холестатическим синдромом, среднетяжелое течение. 1 – случай ОВГВ желтушный вариант, тяжелое течение; 9 – ОВГВ на фоне хронического ВГС, в т.ч. 7 – среднетяжелое и 2 – тяжелое течение. 3 случая хронического ВГВ (1 – в стадии цирроза с портальной гипертензией, 1 – осложненный хроническим панкреатитом, 1 – на фоне токсического гепатита). 2 больных с ВГ неутонченной этимологии, в т.ч. 1 – среднетяжелого и 1 – тяжелого течения, 1 случай хронического аутоиммунного гепатита с высокой степенью активности и фиброза. На момент начала терапии Р у 12 больных ВГ отмечалось нарастание клинической симптоматики заболевания, состояние 6 пациентов было стабильно, у 6 наметилось некоторое улучшение.
300-400 мл 1.5% раствора реамберина применяли внутривенно капельно (медленно) один раз в день на фоне базисной терапии у 18 больных ВГ в 1 -10 дни желтушного периода (или обострения), 6 больным - в период 14-20 дней желтухи. Курс лечения составил 3-5 дней, 3 больным реамберин вводили 7-9 дней подряд. Все пациенты переносили инфузии Р хорошо, аллергических реакций не было.
На фоне Р быстрее проходили основные симптомы интоксикации (анорексия, тошнота, слабость, нарушение сна), менее продолжительной была желтуха, проходили боли в правом подреберье и уменьшались размеры печени. Положительная клиническая динамика на фоне применения Р отмечена у 50-82% больных.
Отмечена более ранняя положительная динамика биохимических показателей. Так, после Р уровень билирубина понизился ниже 100 мкмоль/л у 12 человек, а высокие уровни билирубина остались лишь у 6 больных (18 - до начала лечения Р). Существенно снизились значения АлАТ у 12 из 18 больных (63%), показатели тимоловой пробы у 40% лиц.
При изучении содержания сывороточных металлопротеидов в динамике отмечено достоверное нарастание трансферрина после Р по сравнению с контрольной группой больных. Известно, что снижение уровня ТФ (наряду с лактоферрином) характеризуют состояние неспецифической резистентности организма. В тоже время регистрировалось более значительное снижение медьсодержащего белка ЦП (р<0,05), что указывает на уменьшение напряжения ферментативного звена антиоксидантной системы, которое включается в работу при значительном оксидативном стрессе. Таким образом применение Р при лечении ВГВ и ВГС повышает антиоксидантный потенциал крови, что говорит о специфическом антиоксидантном действии препарата.
Важно отметить, что после курса Р применение глюкокортикоидов потребовалось у 6 больных тяжелыми формами ВГ (24%), в то время как во 2 группе (клинического контроля) глюкокортикоиды использовались в 30% случаев. Этим подчеркивается выраженное дезинтоксикационное действие Р. Средняя продолжительность пребывания в стационаре была достоверно короче в группе 1 (лечение Р), чем во 2 группе больных, получавших только БТ (33,6 дня и 40 дней соответственно, р<0,05).
Таблица 41. Динамика основных клинических симптомов
больных вирусными гепатитами, получавших реамберин
|
Синдромы |
Число больных с наличием симптомов |
Положительная динамика, (%) симптомов после терапии |
|
|
до лечения |
после лечения |
||
|
Желтуха |
67% |
||
|
- не наблюдалась |
2 |
||
|
- субъиктеричность |
1 |
9 |
|
|
- умеренная |
12 |
10 |
|
|
- выраженная |
11 |
3 |
|
|
Анорексия |
68% |
||
|
- не наблюдалась |
16 |
19 |
|
|
- невыраженная |
3 |
3 |
|
|
- выраженная |
5 |
2 |
|
|
Тошнота, рвота |
82% |
||
|
- не было |
15 |
22 |
|
|
- невыраженная |
4 |
||
|
- выраженная |
5 |
2 |
|
|
Боль в правом подреберье |
13 |
21 |
62% |
|
- не было |
7 |
2 |
|
|
- невыраженная |
3 |
1 |
|
|
- выраженная |
1 |
- |
|
|
Гепатомегалия |
67% |
||
|
- не было |
3 |
9 |
|
|
- не выраженная |
6 |
8 |
|
|
- выраженная |
11 |
6 |
|
|
- значительная |
4 |
1 |
|
|
Слабость |
67% |
||
|
- не было |
15 |
20 |
|
|
- невыраженная |
7 |
3 |
|
|
- выраженная |
2 |
I |
|
|
Нарушение сна |
50% |
||
|
-не было |
20 |
22 |
|
|
- не значительное |
3 |
2 |
|
|
- выраженное |
1 |
- |
|
Таблица 42. Динамика биохимических показателей у больных
вирусными гепатитами при лечении реамберином
|
Показатели |
Число больных |
Положительная |
|
|
А |
Б |
||
|
Билирубин (n=19) |
|
|
60% |
|
АлАТ (n=18) |
|
|
63% |
|
Тимоловая проба |
|
|
40% |
Обозначения:
А - до лечения;
Б - после лечения.
Таблица 43. Уровень трансферрина и церулоплазмина
в сыворотках крови больных гепатитами, получавших реамберин
|
Содержание металлопротеидов |
Вид терапии и число больных |
||
|
Реамберин |
базисная терапия (n=15) |
||
|
Трансферрин |
до лечения (1) |
1,200±0,020 |
1,243±0,024 |
|
после лечения (2) |
2,000±0,010 |
1,684+0,022 |
|
|
2-1 (%)** |
↑ на 40%* |
↑ на 26,1% |
|
|
Церулоплазмин |
до лечения (1) |
0,522±0,011 |
0,523±0,020 |
|
после лечения (2) |
0,41610,006 |
0,475±0,022 |
|
|
(1-2) (%) |
↓ на 20,3% |
↓ на 9,1% |
|
Обозначения:
* – р<0,05 в группе сравнения;
** – разница между показателями двух обследований;
↑(↓)- увеличение (уменьшение) показателя.
Таким образом, применение Р в комплексной терапии острых и хронических форм ВГВ и В ГС способствовало более быстрой положительной клинико-лабораториой динамике по сравнению с больными контрольной группы, что обосновывает необходимость использования инфузий 1,5% раствора реамберина при лечении данных групп больных.
Известно, что тяжелые формы ВГ на фоне длительного применения наркотиков сопровождаются полиорганными нарушениями, имеющими различную клиническую картину. Такие больные нередко требуют интенсивных методов ведения в специализированных отделениях реанимации с использованием пдакокортикостероидов. Несмотря на интенсивную терапию в полном объеме летальность среди таких тяжелых больных и сегодня значительная.
В настоящем разделе приводятся материалы по лечению 12 тяжелых больных ВГ с токсическим поражением печени, обусловленным парентеральным употреблением некачественного героина и его суррогатов. Клиническая характеристика больных: 2 больных ВГВ+С, осложненных токсическим поражением печени, крайне тяжелое течение, печеночная энцефалопатия 3-4 степени, 4 больных ВГВ+С, осложненных токсическим поражением печени, тяжелое течение, 5 – ВГВ тяже течение, в 3 случаях осложненных токсическим поражением печени. Один случай хронического аутоиммунного гепатита, высокой степени активности и фиброза, синдром "малой печеночной недостаточности". Курс 1,5% раствора реамберина составлял от 3 до 12 дней (в среднем 5 дней). Препарат назначался внутривенно капельно на фоне базисной терапии при нарастании симптомов эндотоксикоза, всех случаях состояние больных требовало применения гормонов.
В 2 случаях печеночной комы курс терапии начинался в острейшей период заболевания и продолжался от 8 до Г2 дней. Отменяли реамберин на фоне стабилизации клинического состояния. Продолжительность комы была 3 и 7 суток. Реамберин входил в состав полномасштабной интенсивной терапии (основным методом детоксикации было частичное заменное переливание крови, соответственно Зибраз).
В остальных случаях клиническими симптомами оценки эффективности Р служили классические признаки интоксикации (анорексия, тошнота, рвота, слабость, нарушение сна). Динамика выраженности симптомов интоксикации на фоне лечения Р представлена в таблице 44. Видно, что интенсивность интоксикации значительно уменьшилась под влиянием терапии реамберином. Следует отметить, после курса лечения состояние тяжелых больных значительно улучшилось. Та аппетит нормализовался у 70% (улучшился у 30%), тошнота и рвота исчезли у 88% (стали менее выражены у 12%) больных. Слабость исчезла у 75% (менее выражена у 25%), сон нормализовался у всех больных.
Таблица 44. Влияние реамберина на выраженность синдрома интоксикации
|
Симптомы интокси- |
Выраженность симптомов и число больных |
|||||||
|
до лечения |
после лечения |
|||||||
|
+++ |
++ |
+ |
- |
++4- |
+4- |
+ |
- |
|
|
Анорексия |
1 |
4 |
2 |
3 |
- |
2 |
8 |
|
|
Тошнота, рвота |
1 |
5 |
2 |
2 |
- |
- |
2 |
8 |
|
Слабость |
1 |
3 |
4 |
2 |
- |
- |
1 |
9 |
|
Нарушение сна |
- |
2 |
2 |
6 |
- |
- |
10 |
|
Достоверным было снижение уровня билирубина после курса реамберина. Как известно, высокие концентрации билирубина (особенно свободной фракции) обуславливают выраженность токсического поражения различных органов у больных ВГ. Под влиянием инфузий Р гипербилирубинемия имела положительную динамику снижения у 82 % больных, повышение билирубина было у 9% и без динамики показатели билирубина сохранялись у 9% лиц.
Таблица 45. Влияние реамберина на уровень билирубина
больных с тяжелыми токсикозами
|
Уровень билирубина сывороток крови (мкмоль/л) |
Число обследованных больных |
|
|
До лечения (n=12) |
После лечения (n=12) |
|
|
более 400 |
2 |
1 |
|
300-400 |
3 |
1 |
|
200-300 |
7 |
3 |
|
100-200 |
_ |
3 |
|
менее 100 |
– |
4 |
Таким образом, на фоне применения реамберина достоверно улучшались клинические и биохимические показатели у больных ВГ с тяжелым проявлением экзо-, эндотоксикоза, обусловленного употреблением героина и его суррогатов.
ВЫВОДЫ
Инфузий 1,5% раствора реамберина хорошо переносятся больными с различными формами вирусных гепатитов В и С (аллергических реакций не было). Отмечена высокая терапевтическая эффективность реамберина в комплексной терапии тяжелых больных ВГ: препарат обладает выраженными дезинтоксикационными, антиоксидантными, гепато- и нефропротекторными свойствами. Выявлено сокращение сроков госпитализации и уменьшение числа случаев использования гормонов у пролеченных больных по сравнению с группой клинического контроля.
Реамберин способствовал быстрой нормализации основных биохимических показателей у больных ВГ. Достоверно повышался антиоксидантный потенциал сыворотки крови, возрастала неспецифическая резистентность организма.
Использование реамберина в комплексной терапии тяжелых больных ВГ наркоманов сопровождалось отчетливым дезинтоксикационным эффектом с благоприятным исходом крайне тяжелых состояний (печеночной комы).
Реамберин рекомендуется включать как обязательное патогенетическое средство в комплексную терапию тяжелых больных различными формами ВГВ и ВГС, а также больных с признаками полиорганных поражений вследствие экзо-, эндогенного токсикоза.
ТЕРАПЕВТИЧЕСКАЯ ЭФФЕКТИВНОСТЬ
ПРЕПАРАТА РЕАМБЕРИН
У БОЛЬНЫХ ОСТРЫМИ ВИРУСНЫМИ ГЕПАТИТАМИ
С ВЫРАЖЕННЫМИ СИМПТОМАМИ ИНТОКСИКАЦИИ
ПРЕПАРАТА РЕАМБЕРИН
У БОЛЬНЫХ ОСТРЫМИ ВИРУСНЫМИ ГЕПАТИТАМИ
С ВЫРАЖЕННЫМИ СИМПТОМАМИ ИНТОКСИКАЦИИ
Для решения вопроса об эффективности инфузионного раствора препарата Реамберин в лечении больных острыми вирусными гепатитами в клиническом отделе НИИ вирусологии им. Д.И. Ивановского РАМН, на базе инфекционной клинической больницы № 1 г.Москвы в течение 1999 г. были проведены контролируемых рандомизированные исследования.
Под наблюдением находился 71 пациент с острым вирусным гепатитом. Диагноз устанавливали на основании клинико-эпидемиологических, биохимических и специфических серологических данных.
Все больные были разделены по случайному признаку (использовался принцип алфавита) на две группы. Испытуемую группу составили 40 больных, получивших Реамберин. Из них у 16 человек был диагностирован гепатит В, у 3 – гепатит С, у 4 – гепатит В+С, у 1 – гепатит А+В+С, у 1 – гепатит А+С, у 2 - В+Д, у 3 – вирусный гепатит недифференцированный. Группу сравнения составил 31 пациент. Больным этой группы вводился физиологический раствор. В группе сравнения гепатит А был диагностирован у 4 человек, гепатит В – у 16, гепатит С – у 2 гепатит В+С – у 5, гепатит В+С+Д- у 3 и вирусный гепатит недифференцированный – у 1 больного. Больные в обеих группах были сопоставимы по полу, возрасту формам тяжести гепатита и сопутствующим заболеваниям. В испытуемой группе были мужчины в возрасте от 17 до 35 лет, средний возраст составил 24,2±2,41. В группе сравнения - мужчины в возрасте от 16 до 41 года, средний возраст – 23,4+1 года. У всех пациентов в анамнезе имело место употребление наркотических средств (в 85% случаев герроин) в среднем в течение 24,6+7,4 месяцев.
По выраженности симптомов интоксикации у больных была диагностирована среднетяжелая форма острого вирусного гепатита (желтушный вариант), как в испытуемой группе, так и в группе сравнения.
Методика назначения препарата. Реамберин назначался больным внутривенно, вводился капельно в количестве 400 мл один раз в сутки в течение 5 дней; в отдельных случаях до 10 дней (в зависимости от выраженности интоксикационного синдрома и характера заболевания).
Пациенты группы сравнения получили симптоматическую терапию, включая физиологический раствор (0,9% раствор хлорида натрия) в количестве 400 мл внутривенно. Схема применения физиологического раствора была аналогичной Реамберину.
Больные подвергались обследованию по единой программе: клинически оценивалась выраженность синдрома интоксикации, определялись специфические маркеры вирусных гепатитов А, В, С и Д. Проводились общепринятые биохимические тесты: количественное определение билирубина, активность АсАТ и АлАТ (кинетическим методом), тимоловая проба, холестерин, щелочная фосфатаза, гаммаглутамилтранспентидаза, протромбиновый индекс, общий белок, калий и натрий в сыворотке крови. У всех больных определяли гематологические показатели, общий анализ мочи. Комплексное клинико-лабораторное обследование проводилось до начала лечения, на следующий день после окончания курса лечения и перед выпиской из стационара.
Основными критериями клинической оценки лечебной эффективности препарата явились сроки сокращения длительности основных симптомов интоксикации, а также темпы снижения в сторону нормализации биохимических показателей за период лечения Реамберином.
Одновременно учитывалась возможность появления побочных реакций.
В испытуемую группу вошли 27 пациентов, которым вводился внутривенно Реамберин в количестве 400 мл ежесуточно в течение 5 дней в отдельных случаях в течение 10 дней (в зависимости от состояния больных и динамики обратного развития симптомов). Группу сравнения составил 31 пациент. Больным этой группы ежедневно вводили 400 мл 0,9% раствора хлорида натрия по той же схеме, что и Реамберин.
Результаты клинических наблюдений, биохимических и гематологических исследований в испытуемой группе больных и соответствующей группе сравнения представлены в таблицах 46, 47, 48.
В результате проведенных испытаний установлено, что такие симптомы интоксикации как слабость и анорексия существенно быстрее исчезали у больных, получавших реамберин и держались на 1,7-2,7 дней короче, чем в группе сравнения. Так, слабость регистрировалась в течение 2,5±0,3 дня в испытуемой группе против 5,2±0,6 дня в группе сравнения (р < 0.001), анорексия – 2,5±0,3 дня и 4,2+0,7 дня, соответственно (р < 0.05). Улучшение наступило у всех больных, и синдром интоксикации был ликвидирован.
Биохимические показатели у больных, которым вводился Реамберин, имели благоприятную тенденцию к нормализации, хотя статистически существенных различий с группой сравнения непосредственно после окончания лечения не установлено.
Благоприятная динамика клинико-биохимических показателей у больных, леченных реамберином, привела к более быстрому выздоровлению и достоверному снижению длительности койко/дня в испытуемой группе по сравнению с группой сравнения (18,8±1,8 и 27,6±1,7, соответственно, р < 0,001). Каких-либо отклонений в клинических анализах периферической крови, общих анализах мочи как во время лечения реамберином, так и после его окончания, не установлено. Уровень калия и натрия в сыворотке крови находился в нормальных пределах и не претерпевал существенных изменений.
Переносимость Реамберина была хорошей. Только в одном случае у пациента появились высыпания на кожных покровах по типу крапивницы, сопровождавшиеся выраженным зудом кожи. Эти явления купировались после отмены реамберина на фоне приема антигистаминного препарата.
Заключение.
Проведенные исследования позволяют сделать вывод, что внутривенное капельное введение Реамберина в количестве 400 мл в течение 5 дней больным с желтушным вариантом острым вирусным гепатитом с явлениями интоксикации, независимо от этиологии, выявило дезинтоксикационный эффект, что привело к достоверному уменьшению продолжительности симптомов интоксикации по сравнению с группой сравнения, и обеспечивало благоприятное течение болезни со снижением уровней билирубинемии и гиперферментемии и способствовало ускорению выздоровления.
Переносимость Реамберина хорошая, он не вызывает токсических реакций местного и общего характера. Однако в отдельных случаях (3,7%) возможно возникновение пятнисто-папулезных высыпаний на кожных покровах, которые носили переходящий характер и купировались антигистаминными препаратами.
Инфузионный раствор Реамберина может быть рекомендован для лечения больных острыми вирусными гепатитами с выраженными признаками интоксикации в качестве дезинтоксикационного средства.
Практические рекомендации.
Показанием к применению инфузионной терапии Реамберином у больных с желтушным вариантом острого вирусного гепатита, независимо от этиологии, являются выраженные признаки интоксикации.
Инфузионный раствор Реамберина применяется внутривенно капельно (50-60 капель в минуту) в количестве 400 мл ежедневно в течение 5 дней. Сроки применения могут быть сокращены или удлинены в зависимости от состояния больного и динамики изменений в синдроме интоксикации.
Эффективность лечения, контролируемая по клинико-биохимическим показателям, проявляется в сокращении длительности интоксикационного синдрома и благоприятной динамике биохимических показателей (Билирубин, Ал ТА, АсАТ, протромбнновый индекс).
Противопоказанием к применению Реамберина является непереносимость препарата, у беременных женщин эффективность Реамберина не изучалась.
КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ РЕАМБЕРИНА
У БОЛЬНЫХ С КРИТИЧЕСКИМИ СОСТОЯНИЯМИ
РАЗЛИЧНОГО ГЕНЕЗА
У БОЛЬНЫХ С КРИТИЧЕСКИМИ СОСТОЯНИЯМИ
РАЗЛИЧНОГО ГЕНЕЗА
Частота возникновения и тяжесть клинических проявлений синдрома полиорганной недостаточности, возникающего как функционально-морфологический результат многокомпонентных каскадов постгипоксических расстройств тканевого метаболизма при любом критическом состоянии, напрямую зависит от неспецифической резистентности организма, в частности, и прежде всего от резистентности к гипоксии.
Уровень повреждения и саногенеза окислительно-восстановительных систем тканевого дыхания различных органов и систем в условиях критического состояния можно корригировать различными методами фармакологической защиты, применяя антигипоксанты и антиоксиданты различных групп. Высокая чувствительность к химико-фармакологической агрессии при лечении критических состояний делает применение препаратов разнонаправленного действия опасными для пациентов и ведет к полипрагмазии.
Использование препарата Реамберин, обладающего многокомпонентным антигипоксическим, антиоксидантным, дезинтоксикационным, гепато-, нефро- и кардиопротекторным действием становится особенно целесообразным в условиях высокой вероятности полиорганных тканевых постгипоксических расстройств.
Цель и задачи исследования
Целью клинического изучения препарата Реамберин при критических состояниях различного генеза, прежде всего при шоках, гипоксии и интоксикациях, являлось выявление его влияния как антигипоксанта, антиоксиданта и гепатопротектора на возникновение, развитие и прогрессирование различных клинических проявлений синдрома полиорганной недостаточности, развивающегося у большей части больных в результате перенесенного терминального состояния. Основной задачей было выявление клинико-параклинических критериев целесообразнсть применения препарата и последующая разработка оптимальных схем его использования у больных, перенесших критические состояния.
Группы больных
Исследование проведено у 22 больных, разделенных на три группы: 1-я – больные с постгипоксическими состояниями различной этиологии; 2-я – больные с распространенными перитонитами; 3-я – больные с тяжелыми сочетанными травмами, которым в комплекс терапии был включен реамберин. Контрольная группа – 30 человек, которым проводилась общепринятая интенсивная фармакотерапия.
Метод лечения
В комплексе терапии критических состояний 1,5% раствор Реамберина использовали в суточной дозе 400 мл раствора со скоростью 20-30 капель в минуту в течение первых двух-трех суток от момента развития критического состояния.
В ходе клинического изучения препарата реамберин было выявлено несомненное положительное его влияние на течение заболеваний у больных, перенесших критическое состояние.
Данное положительное влияние было выявлено у 80% больных. Оно проявлялось, прежде всего, в активации состояния сознания у всех больных с явлениями постгипоксической энцефалопатии, у 50% больных с сочетанной травмой и перитонитом.
При этом необходимо отметить, что динамика состояния сознания выявлялась даже при исходно глубоком его угнетении (до 5-6 баллов по шкале комы Глазго).
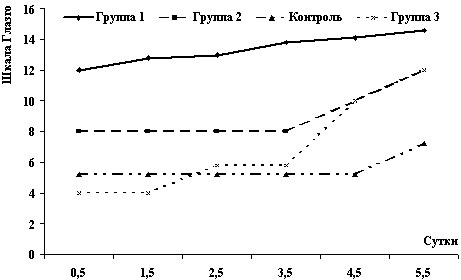
Рис. 10. Динамика состояния сознания на фоне лечения реамберином
Подобные клинические наблюдения (2 случая) довольно быстрой (на 2-3 сутки) динамики состояния сознания у больных с постгипоксической энцефалопатией с фоновым уровнем расстройств сознания до 5-6 баллов по шкале комы Глазго являются чрезвычайно важными для оценки результатов данного исследования. Они убедительно говорят о целесообразности и необходимости применения Реамберина в качестве антигипоксанта и антиоксиданта в ранние сроки постгипоксического поражения мозга у больных с терминальными состояниями.
Отмечена была также активация функциональной активности головного мозга по данным мониторинга электроэнцефалограммы. Отмечено нарастание быстроволновой части спектра ЭЭГ по сравнению с медленноволновой, что, несомненно, является благоприятным электрофизиологическим признаком. Однако, отмечается и увеличение суммарной мощности спектра ЭЭГ после применения Реамберина составляет до 24-28% от фонового.
Увеличение суммарной мощности спектра ЭЭГ наряду с активацией состояния сознания говорит о значимой активации окислительно-восстановительных процессов в тканях мозга под действием Реамберина.
Максимальный клинический и электрофизиологический эффект Реамберина проявлялся у больных с фоново низким уровнем суммарной мощности спектра.
Рис. 11. Корковая активность головного мозга (по данным ЭЭГ)
до и после лечения
Рис. 12. Корковая активность головного мозга (по данным ЭЭГ) до и после применения препаратов, содержащих янтарную кислоту
Другие параклинические параметры, прежде всего, динамика кислотно-щелочного состояния крови больных на фоне применения реамберина также были положительными (рисунок 13).
Аллергических реакций на фоне применения препарата ни в одном случае отмечено не было. Препарат всегда хорошо переносился и не имел побочных эффектов.
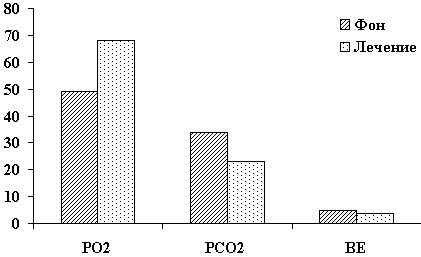
Рис. 13. Динамика КОС на фоне лечения Реамберином
Таким образом, включение реамберина в комплексную терапию постгипоксических расстройств у больных, перенесших критическое состояние, несомненно способствует повышению резистентности к гипоксии и снижению выраженности клинических проявлений синдрома полиорганной недостаточности, в частности, энцефалопатии.
Основной фармакологический эффект препарата обусловлен способностью усиливать компенсаторную активность аэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, Реамберин активируетантиоксидантную систему ферментов и тормозит процессы перекисного окисления липидов в ишемизированных органах, оказывая мембраностабилизирующее действие.
СИНДРОМ ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ
У БОЛЬНЫХ ПЕРИТОНИТОМ
Перитонит - воспаление брюшины, сопровождающееся нарушениями функций жизненно важных органов и систем. При разлитом перитоните наблюдаются выраженные нарушения гомеостаза с развитием полиорганной недостаточности. (ПОН).
Несмотря на современные достижения медицины: индивидуальный выбор метода оперативного вмешательства, применение комплексной антибактериальной терапии, применение эфферентных методов лечения и т.д., летальность при разлитом перитоните колеблется от 22 до 45%. При запущенном Перитоните с уже выраженными явлениями эндотоксикоза летальность достигает более 80 процентов.
ПОН — это поражение всех органов и тканей агрессивными медиаторами критического состояния с временным преобладанием той или иной органной недостаточности — легочной, сердечной, почечной и т.д.
Выделяют несколько механизмов развития полиорганной недостаточности:
- медиаторных, при котором рассматривают ПОН как аутоиммунное поражение;
- микроциркуляторный и связанный с ним реперфузионный механизм;
- инфекционно-септический механизм, с которым связывают гипотезу "кишечник как не дренированный абсцесс".
В последние годы неоспоримым считается, что эндотоксикоз (ЭТ) и энцефалопатия являются наиболее яркими и информативными симптомами в проявлении ПОН. Снижение уровня эндогенной интоксикации и нормализация высшей нервной деятельности носят прогностический характер.
Однако оценка степени эндотоксикоза до сих пор представляет определенные трудности, несмотря на множество предложенных методов (Шимкевич Л.Л., (1982); Николайчик В.В., (1985); Кузнецов В.А., Анисимов А.Ю., (1995)).
Наиболее серьезные нарушения ЭТ наблюдаются в показателях белкового обмена, что связано с угнетением синтеза белков и усилением их катаболизм. Важным звеном является альбумин-белок, выполняющий пластические и транспортные функции. Снижение содержания этого белка служит важнейшим прогностическим признаком интоксикации и выживаемости (Чегер С.Н., (1975)). При тяжелом ЭТ в организме создаются условия для образования форм альбумина с измененными физико-химическими характеристиками, "перегруженного" лигандами, что препятствует обмену между тканями и сосудистым руслом и транспортом токсинов к органам детоксикации-биотрансформации. Поэтому особый интерес вызывают методы, позволяющие судить не только о количестве, но и о структуре и функциональной активности альбумина.
Был создан и внедрен в клиническую практику флуориметр АКЛ-01 и наборы реактивов "ЗОНД-Альбумин", позволяющие контролировать общую концентрацию альбумина (ОКА) в крови, эффективную концентрацию альбумина (ЭКА), его связывающую способность (РСА – резерв связывания альбумина), и рассчитывать "индекс токсичности" (Т=ОКА/ЭКА - 1).
Использование этих показателей наряду с общеизвестными клиническими тестами (клинический анализ крови, Билирубин, уровень трансаминаз и фосфатаз в крови, уровень молекул средней массы, уровень электролитов в плазме крови, протеинограмма) позволяют оценить уровень ЭТ, а также по их изменениям оценить эффективность лечения.
Другим важным критерием эндотоксемии является степень выраженности энцефалопатии. Критерием оценки энцефалопатии всегда являлась оценка уровня сознания. В последние годы появились приборы, позволяющие объективно оценивать функциональную активность головного мозга в динамике. Энцефалографический монитор фирмы Drager (Германия) позволяет проводить длительное динамическое наблюдение всех стандартных параметров энцефалограммы по двум полушариям. При этом на экран монитора выводится нативная энцефалограмма по двум отведениям. Одновременно производится компрессированный спектральный анализ энцефалограммы с выведением на экран монитора трендов спектра ЭЭГ по обоим полушариям в двух стандартных режимах (частоты и амплитуды составляющих спектра ЭЭГ). Динамика ЭЭГ при визуальной оценке нативной ЭЭГ и особенно при количественном подсчете спектральных составляющих по амплитуде и частотам является одним из наиболее аргументированных и достоверных методов оценки функциональной активности головного мозга.
Энцефалограмма, как конечная результирующая электрогенеза мозга отражает как некоторые очаговые изменения, так и выраженность поражения мозга в целом. Как показано многочисленными исследованиями (Safar, (1976); Revers, (1990); Sidi, (1990); Dick, (1992)) параметры ЭЭГ и их динамика коррелирует с уровнем мозгового кровотока и определяется как состоянием кровотока, так и газовым составом крови, притекающей к мозгу.
Таким образом, анализ ЭЭГ может служить объективным критерием состояния кислородного баланса и уровнем метаболитов (эндотоксинов) в мозге при различных патологических воздействиях.
ЦЕЛЬ РАБОТЫ заключалась в изучении клинической эффективности препарата Реамберин 1,5% для инфузий в качестве дезинтоксирующего средства у больных с перитонитом при развитии у них синдрома полиорганной недостаточности.
ЗАДАЧИ ИССЛЕДОВАНИЯ:
- Определить влияние препарата Реамберин 1,5% для инфузий на динамику клинико-лабораторных показателей у больных перитонитом при развитии синдрома ПОН;
- Определить влияние препарата Реамберин 1,5% для инфузий на уровень эндотоксикоза у больных перитонитом при развитии синдрома ПОН;
- Определить влияние препарата Реамберин 1,5% для инфузий на динамику ЭЭГ у больных перитонитом при развитии синдрома ПОН.
КРИТЕРИИ ВКЛЮЧЕНИЯ В ИССЛЕДОВАНИЕ:
Пациенты с перитонитом при развитии у них синдрома ПОН, удовлетворяющие следующим требованиям: возраст от 20 до 70 лет.
1) наличие перитонита и синдрома ПОН;
2) оперированные по поводу разлитого перитонита по однотипным
методикам:
3) имеющие органные нарушения ЦНС в начальных сроках
заболевания.
Письменное информированное согласие больного или родственников на исследование.
ГРАФИК КЛИНИЧЕСКОГО ОБСЛЕДОВАНИЯ БОЛЬНЫХ:
Комплексное клинико-лабораторное и инструментальное обследование проводилось в 2-х группах:
- контрольной – без применения препарата;
- опытной – с применением препарата.
В обеих группах больным проводилась комплексная, принятая в отделении реанимации ГКБ № 15 корригирующая терапия, направленная на лечение перитонита и проявлений синдрома ПОН.
Обследование больных осуществляли в следующих точках:
- До начала лечения, в момент поступления больного в отделение реанимации;
- На следующий день после введения препарата;
- На 3-й, 5-й и 8-й дни от начала лечения препаратом Реамберин 1,5% инфузий.
ОЦЕНКА ЭФФЕКТИВНОСТИ
ПРЕПАРАТА РЕАМБЕРИН 1,5% ДЛЯ ИНФУЗИЙ
Эффективность лечения препаратом определялась по следующим показателям:
- клиническое состояние больного до и после лечения;
- динамика стандартных клинико-лабораторных показателей в процессе лечения;
- динамика уровня ЭТ в процессе лечения;
- динамика спектра ЭЭГ в процессе лечения;
- сравнение полученных данных с аналогичными показателями у больных ко трольной группы.
Схема введения препарата Реамберин 1,5% для инфузий:
Препарат Реамберин вводился внутривенно капельно в количестве 400 мл. и фузионного раствора в сутки согласно инструкции по клиническому изучению в течение 7 дней, начиная со 2-го дня от поступления больного в отделение реанимации.
Клинические исследования проводились по методу мультицентрового испытания по единой программе при эндогенной интоксикации, обусловленной ПОН. Исследование открытое, контролируемое, рандомизированное.
Для проведения исследования были сформированы следующие группы больных:
- больные разлитым перитонитом с клиническим проявлениями и лабораторными показателями синдрома полиорганной недостаточности 25 человек - 1-я группа больных, основная;
- больные разлитым перитонитом с клиническими проявлениями и лабораторными показателями синдрома полиорганной недостаточности 10 человек – 2-я группа больных, контрольная.
Среди пациентов мужчин было 19, женщин — 14.
Средний возраст больных составлял 53±3,1 года.
Клиническая оценка была основана на осмотре врача при поступлении больного в отделение реанимации, оценке уровня сознания по шкале Глазго, оценке общего состояния пациента по шкале SAPS. Биохимические исследования включали в себя определение уровня калия и натрия в плазме, уровней билирубина, мочевины, креатинина, общего белка и альбумина, щелочной фосфатазы, трансаминаз, гаммаглютаматтрансфераз, сахара крови на биохимическом анализаторе Express 550, уровня МСМ по способу Малаховой М.Я. (Малахова М.Я, (1995)), калия и натрия в эритроцитах методом плазменной фотометрии; осмолярность плазмы и мочи на осмометре производства ГДР; КОС на анализаторе Corning, уровни ОКА, ЭКА, РСА И Т определяли на отечественном приборе "ЗОНД" по методике, предложенной НИИ ФХМ РАМН (Е.Е. Добрецов); ЭЭГ-контроль осуществляли прикроватным электроэнцефалографом фирмы Drager (Германия).
Клинические исследования показали, что на фоне применения Реамберина отмечено снижение уровня тяжести состояния пациентов по шкале SAPS (таблица 49).
Таблица 49. Тяжесть состояния пациентов по шкале SAPS
|
Группы |
До |
1 |
3 |
5 |
8 |
|
Основная Контрольная |
13.8 |
10.4 |
9.3 |
6.8 |
5.5 |
Как видно из приведенной таблицы тяжесть состояния больных оценена как тяжелая. Согласно правилам пользования системой SAPS к тяжелым относятся пациенты, Набравшие более 12 баллов. В процессе лечения больные, получавшие Реамберин были склонны к более быстрому восстановлению, что выражалось в уменьшении числа баллов по шкале SAPS.
Анализ основных лабораторных тестов показал, что у больных обеих групп, на фоне введения препарата Реамберин отмечается четкая тенденция к более быстрому купированию метаболического ацидоза, нормализации клеточного и плазменного калия, уменьшению, уровней креатинина, билирубина, щелочной фосфатазы и ACT, МСМ уже на следующий день после введения препарата.
Анализ уровня токсемии по "альбуминовому тесту" выявил достоверные различия в основной и контрольной группах. В таблице 50 представлены изменения "альбуминовых тестов" на фоне введения Реамберина у больных разлитым перитонитом.
Из приведенных в таблице данных видно, что у всех больных в момент поступления в отделение реанимации имел место высокий уровень эндотоксемии, введение препарата Реамберин позволяет быстрее, чем в контрольной группе снизить уровень эндотоксикоза.
ЭНЦЕФАЛОГРАФИЧЕСКИЙ МОНИТОРИНГ
У БОЛЬНЫХ ПРИ ПРИМЕНЕНИИ РЕАМБЕРИНА
У 15% больных на фоне применения реамберина (непосредственно в ходе внутривенного капельного введения препарата и после окончания введения препарарата) было отмечено нарастание амплитуды электроэнцефалограммы. Всем больным указанной группы на фоне применения Реамберина проводился длительный энцефалографический мониторинг.
Исследования проведены с помощью энцефалографического монитора pEEG фирмы Dreger (Германия) со специально разработанным фирменным программным обеспечением. Энцефалографический монитор позволяет проводить длительное динамическое наблюдение всех стандартных параметров энцефалограммы двум отведениям, т.е. запись энцефалограммы по двум полушариям. При этом на экран монитора выводится нативная Энцефалограмма по двум отведениям. Одновременно производится компрессированный спектральный анализ энцефалограммы с выведением на экран монитора трендов спектра ЭЭГ по обоим полушариям в двух стандартных режимах (частоты и амплитуды составляющих спектра ЭЭГ).
Специально разработанное фирменное программное обеспечение позволяет длительно хранить и проводить анализ спектров ЭЭГ, полученных в режиме реального времени. Динамика электроэнцефалограммы, при визуальной оценке нативной ЭЭГ и особенно при количественном подсчете спектральных составляющих по амплитуде и частотам, является одним из наиболее аргументированных и достоверных методов оценки функциональной активности головного мозга. Энцефалограмма, как конечная результирующая электрогенеза мозга, отражает как некоторые очаговые изменения, так и выраженность поражения мозга в целом при различных патологических влияниях на него.
Как показано многочисленным исследователями (Safar, 1976; Reves, 1990; Sidi, 1990; White, 1989; Scott, 1985; Dick, 1992) параметры ЭЭГ и их динамика коррелируют с уровнем мозгового кровотока и определяются как состоянием кровотока, так и газовым составом притекающей к мозгу крови.
Таким образом, анализ ЭЭГ может служить объективным критерием состояния кислородного баланса и уровня метаболитов в мозге при различных патологических воздействиях.
Всем больным энцефалографический церебральный мониторинг проводили в динамике наблюдения в следующие сроки:
- При поступлении в отделение реанимации;
- На первые сутки, на 3-и и 7-е сутки применения препарата.
У части больных при длительном пребывании в отделении реанимации исследования проводились на 10-е, 15-е, 20-е, 42-е и даже 45-е сутки от момента поступления в отделение.
ОСОБЕННОСТИ СПЕКТРА ЭЭГ У БОЛЬНЫХ
С ТОКСИЧЕСКИМИ ЭНЦЕФАЛОПАТИЯМИ
НА ФОНЕ ПЕРИТОНИТА
Характерными особенностями спектра ЭЭГ и нативной электроэнцефалограммы больных с токсическими энцефалопатиями при фоновом исследовании было снижение амплитуды спектра (до 50-60% мощности) от стандартных параметров амплитуды здоровых исследуемых. Характерным было также значительное нарастание частот в медленно волновом диапазоне с преимущественной выраженностью дельта волн, которые составляли от 50 до 60% общей мощности спектра (в стандартных условиях у здоровых лиц выраженность дельта активности составляет не более 15% суммарной мощности спектра). На фоне депрессии суммарной мощности спектра со сдвигом частот в медленно волновую его часть у больных с расстройствами сознания до комы 1 (3 больных) выявлены участки более грубой депрессии нативной ЭЭГ и ее спектра с последующим появлением нарастающих по амплитуде медленных волн. Частоты альфа диапазона были представлены в среднем в объеме до 17% мощности, частоты бета диапазона – до 5% мощности.
Особенности состояния спектра ЭЭГ с постепенной депрессией его по амплитуде и увеличением представленности медленноволновой части спектра практически не зависели от генеза поражения мозга, поскольку конечным пусковым механизмом повреждения всегда была гипоксия с фоновой глубиной расстройств сознания. Наиболее грубые нарушения амплитуды и частоты имели место у больных с расстройствами сознания до комы 1-2, у больных с фоновым уровнем сознания до глубокого сопора, выраженность депрессии амплитуды была меньшей, хотя медленно волновой сдвиг прослеживался практически во всех случаях.
В ходе клинического исследования выявлены следующие особенности состояния электроэнцефалографической активности по данным нативной ЭЭГ и при мониторинге ее спектра:
- до 20% суммарной мощности от фоновой за счет преимущественной активации частот дельта- и тетта-диапазона;
- у 5% больных отмечено нарастание суммарной мощности спектра ЭЭГ на 20% за счет активации частот альфа-диапазона.
У больных данной группы нарастание мощности спектра ЭЭГ сопровождалось активацией состояния сознания до более высокого уровня (практически во всех случаях от глубокого сопора до сопора или сонливости) на фоне применения Реамберина или через 2-3 часа после окончания инфузии.
У больных с фоновым уровнем сознания кома 1 (6%) и наиболее грубой степенью депрессии энергетического метаболизма по данным спектрограмм ЭЭГ - (снижение вольтажа ниже 60% от стандартного, наличие только медленно волновой части спектра, наличие участков биоэлектрического молчания) динамики изменений на фоне применения Реамберина не было, активации состояния сознания не происходило.
Положительная динамика у 8% больных по данным ЭЭГ и уровню состояния сознания была отмечена в отсроченный период – через 5-10 суток после окончания первого курса применения препарата. У остальных больных четкой коррелятивной устойчивой связи динамики негативной ЭЭГ и спектра ЭЭГ с применением Peaмберина отмечено не было.
Отрицательной динамики на уровень расстройств сознания препарат не оказывал.
Активация состояния сознания на фоне применения Реамберина у больных с токсической энцефалопатией имела место в 20% случаев (учитывая фоновую глубину расстройств сознания у больных данной группы, это может считаться хорошим показателем).
Положительная динамика по данным спектрограмм при проведении мониторинга ЭЭГ у больных с тяжелыми энцефалопатиями, активация состояния у части больных, увеличение сроков жизни у больных с тяжелейшими поражениями головного мозга, снижение летальности у больных указанных групп позволяют рекомендовать использование препарата Реамберин в клинической реанимационной и нейрореанимационной практике в качестве инфузионного нейрометаболического корректора.)
Таким образом, препарат Реамберин 1,5% для инфузий может быть использован в терапии больных разлитым перитонитом при развитии у больных данной группы синдрома полиорганной недостаточности. Применение данного препарата может быть использована как для предоперационной подготовки больных с литым перитонитом, так н интенсивной терапии в послеоперационный период.
Препарат может быть использован в качестве корректора характерных для больных перитонитом и при развитии синдрома ПОН, расстройств энергометаболизма, способствуя уменьшению выраженности эндотоксикоза как по клинико-лабораторным, так и по энцефалографическим параметрам.
Применение препарата позволяет увеличить период жизни пациентов и снизить уровень летальности больных перитонитом даже при развитии синдрома полиорганной недостаточности.
Применение препарата не вызывает аллергических реакций и побочных эффектов, препарат может быть использован как комплексный энергометаболит и корректор инфузионных расстройств у больных разлитым перитонитом.
СОСУДИСТЫЕ ПОРАЖЕНИЯ МОЗГА
ПРИ СИНДРОМЕ ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ
Лечение больных с сосудистыми поражениями головного мозга, прежде всего с нарушениями мозгового кровообращения, особенно в остром периоде заболевания, в частности, выбор адекватных фармакологических препаратов представляет собой сложную задачу. Прежде всего, имеет значение тяжесть состояния больного, определяемая многообразными расстройствами функций в результате церебрального поражения, а также развивающимися в результате поражения мозга соматическими осложнениями. Определенную роль при этом играет разнонаправленный характер изменения функционального состояния как мозга, так и его сосудистых бассейнов в результате тяжелых, прежде всего, метаболических расстройств.
На одно из первых мест при как ишемическом, так и при геморрагическом инсульте выступает не сопряженность сдвигов гемодинамики и метаболизма, провоцирующая прогрессирование вторичных церебральных ишемий и пост ишемических отеков головного мозга. Ишемические и геморрагические инсульты даже при самых современных, в том числе и хирургических, методах лечения остаются заболеваниями с одной из самых высоких летальностей (до 45-60%) именно из-за развития вторичных церебральных метаболически обусловленных ишемий. Эти церебральные расстройства достаточно часто приводят к утрате центральной нервной системой своих регуляторно-трофических функций и быстрому прогрессированию вторичных соматических осложнений, которые следует рассматривать как церебрально обусловленный синдром полиорганной недостаточности. Причем, вследствие утраты регуляторно-трофических влияний ЦНС данный синдром у больных с церебральными заболеваниями развивается гораздо быстрее, чем у больных с эндотоксикозами другой этиологии.
Клинические исследования проводились по методу мультицентрового испытания по единой программе при сосудистых поражениях мозга и эндогенной интоксикации, обусловленной полиорганной недостаточностью.
Исследование открытое, контролируемое, рандомизорованное.
Для проведения исследования были сформированы следующие группы:
Больные разлитым перитонитом с сосудистыми заболеваниями головного мозга, осложнившимися развитием ПОН (по клиническим и лабораторным показателям) 23 человека – основная группа;
Больные с сосудистыми поражениями головного мозга с клиническими проявлениями и лабораторными показателями синдрома полиорганной недостаточности 15 человек — контрольная группа.
Среди пациентов мужчин было 18, женщин – 20.
Средний возраст больных составлял 52±3,1 года.
В таблице 51 представлены основные причины сосудистых заболеваний головного мозга.
Таблица 51. Причины органных нарушений ЦНС
|
Причина нарушений |
Контрольная группа |
% |
Основная группа |
% |
|
ОНМК по ишеми- |
8 |
53,3 |
12 |
52,1 |
|
ОНМК по гемор- |
7 |
46,6 |
11 |
47,9 |
|
Всего |
15 |
100 |
23 |
100 |
Клиническая оценка основывалась на осмотре больного при его поступлении в отделение реанимации, оценке уровня сознания по шкале Глазго, оценке общего состояния пациента по шкале SAPS.
Биохимические исследования включали определение уровня калия и натрия в плазме, уровней билирубина, мочевины, креатинина, общего белка и альбумина, щелочной фосфатази, трансаминаз, гаммаглютаматтрансфераз, сахара крови на биохимическом анализаторе Express 550, уровня МСМ по способу М.Я. Малаховой (Малахова М.Л., (1995)), калия и натрия в эритроцитах – методом пламенной фотометрии; осмолярность плазмы и мочи – на осмометре производства ГДР; КОС – на анализаторе Corning, уровни ОКА, ЭКА, РСА и Т определяли на отечественном приборе "ЗОН-Д" по методике, предложенной НИИ ФХМ РАМН (Т.Е. Добрецов); ЭЭГ-контроль осуществляли прикроватным электроэнцефалографом фирмы Drager (Германія).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Клинические исследования показали, что на фоне применения Реамберина отмечено снижение уровня тяжести состояния пациентов по шкале SAPS (таблица 52).
У всех наблюдаемых больных состояние расценено как тяжелое. Согласно правилам пользования системой SAPS к тяжелым относятся пациенты, набравшие более 12 баллов. В процессе лечения больные, получавшие Реамберин, были склонные к более быстрому восстановлению, что выражалось в уменьшении числа баллов по шкале SAPS.
Анализ основных лабораторный тестов показал, что у больных обеих групп на фоне введения препарата, Реамберин отмечается четкая тенденция к более быстрому купированию метаболического ацидоза, нормализации клеточного и плазменного калия, уменьшению уровней креатинина, билирубина, щелочной фосфатазы уже на следующий день после введения препарата.
Отсутствие четкой статистической корреляции может быть объяснено не очень большим количеством больных и большим разбросом данных биохимических обследований у больных с тяжелыми формами сосудистых поражений головного мозга на фоне прогрессирования ПОН.
Анализ уровня токсемии по "альбуминовому тесту" выявил достоверные различия в основной и контрольной группах. В таблице 53 представлены изменения "альбуминовых тестов" на фоне введения Реамберина у больных с сосудистыми поражениями головного мозга.
Как видно из данной таблицы, у больных отмечается нарастание явлений эндотоксикоза в ходе развития заболевания, что согласуется с клиническими данными. У больных с органическими поражениям ЦНС острым периодом считается период до 3-х недель от начала заболевания, когда возможно прогрессирование симптоматики. Вместе с тем из таблицы видно, что у больных получавших Реамберин, отмечено более медленное нарастание эндотоксикоза.
Анализ летальности показал, что у больных с заболеваниями ЦНС летальность в среднем составляет 67,3% в контрольной группе и 46,5% в основной.
Значимое снижение летальности говорит о несомненно благоприятном влиянии применения Реамберина у больных с сосудистыми поражениями головного мозга.
Таким образом, из приведенных данных видно, что у всех больных в момент поступления в отделение реанимации имел место высокий уровень эндотоксемии, введение препарата Реамберин позволяет быстрее, чем в контрольной группе снизить уровень эндотоксикоза у больных с сосудистыми поражениями головного мозга.
Как показано многочисленными исследователями (Safar, (1976); Reves, (1990); Sidi, (1990); White, (1989); Scott, (1985); Dick, (1992)) параметры ЭЭГ и их динамика коррелируют с уровнем мозгового кровотока и определяются как состоянием кровотока, так и газовым составом притекающей к мозгу крови, следовательно, анализ ЭЭГ служит объективным критерием состояния кислородного баланса и уровня метаболитов в мозге при различных патологических воздействиях.
ДИНАМИКА СПЕКТРА ЭЭГ У БОЛЬНЫХ
С СОСУДИСТЫМИ ПОРАЖЕНИЯМИ ГОЛОВНОГО МОЗГА
(ПОСТИШЕМИЧЕСКИМИ
ЭНЦЕФАЛОПАТИЯМИ)
НА ФОНЕ ПРИМЕНЕНИЯ РЕАМБЕРИНА
В ходе клинического исследования выявлены некоторые особенности состояния энцефалографический активности по данным нативной ЭЭГ и при мониторировании ее спектра :
- У 22% больных на фоне применения Реамберина непосредственно в ходе внутривенного капельного введения препарата и после окончания введения препарата было отмечено нарастание амплитуды энцефалограммы до 28% суммарной мощности от фоновой за счет преимущественной активации частот дельта и тетта-диапазона;
- У 8% больных отмечено нарастание суммарной мощности спектра ЭЭГ за счет активации частот альфа-диапазона, при этом нарастание мощности спектра ЭЭГ сопровождалось активацией состояния сознания до более высокого уровня (практически во всех случаях от глубокого сопора до сопора или сонливости) на фоне применения Реамберина или через 2-3 часа после окончания инфузии;
- У больных с фоновым уровнем сознания кома 3-4 и наиболее грубой степенью депрессии энергетического метаболизма по данным спектрограмм ЭЭГ (снижение вольтажа ниже 70-80% от стандартного) выявлено наличие только медленно волновой части спектра и наличие участков биоэлектрического молчания. Динамики спектрограмм на фоне применения Реамберина не было, активации состояния сознания не происходило, все больные погибли в ближайший период;
- Положительная динамика у 8% больных по данным КСА ЭЭГ и уровню состояния сознания была отмечена в отсроченный период — через 5-10 суток после окончания первого курса применения препарата;
- Отрицательной динамики поданным КСА ЭЭГ, связанной с применением Реамберина у больных ни в одном случае отмечено не было;
- Отрицательной динамики на уровень расстройств сознания препарат не оказал ни в одном случае;
- Активация состояния сознания на фоне применения Реамберина у больных с постгипоксической энцефалопатией имела место в 15% случаев, что, учитывая фоновую глубину расстройств сознания, у больных данной группы может считаться хорошим показателем;
- У 5% больных с тяжелыми поражениями мозга было отмечено значительное увеличение сроков переживания (до 60 суток) по сравнению с больными аналогичной тяжести, не получавшими нейрометаболическую терапию Реамберином.
Положительная динамика, поданным спектрограмм при проведении мониторинга ЭЭГ у больных с тяжелыми энцефалопатиями, активация состояния сознания у части больных, увеличение сроков жизни больных с тяжелейшими поражениями головного мозга, снижение летальности больных указанных групп позволяют рекомендовать использование препарата Реамберин в клинической реанимационной и нейрореанимационной практике в качестве инфузионного нейрометаболического корректора.
Таким образом, препарат Реамберин 1,5% для инфузнн может быть рекомендован для терапии больных с сосудистыми поражениями головного мозга при развитии синдрома полиорганной недостаточности.
Применение Реамберина показано как для предоперационной подготовки больных с сосудистыми поражениями головного мозга (при геморрагическом инсульте, когда планируется хирургическое вмешательство), так и для проведения интенсивной терапии в послеоперационный период.
Препарат может быть использован в качестве корректора характерных для больных с ишемическими и вторичными ишемическими поражениями головного мозга при развитии синдрома полиорганной недостаточности, расстройств энергометаболизма, что способствует уменьшению выраженности эндотоксикоза, посгишемических поражений как по клинико-лабораторным, так и по энцефалографическим параметрам.
Применение препарата позволяет увеличить период жизни пациентов и снизить уровень летальности больных с сосудистыми поражениями голоного мозга даже при развитии синдрома полиорганной недостаточности.
Применение препарата не вызывает аллергических реакций и побочных действий.
Препарат может быть использован как комплексный энергометаболит и корректор инфузионных расстройств у больных с сосудистыми поражениями головного мозга как ишемического, так и геморрагического характера в качестве средства выбора для недифференцированной патогенетически обусловленной терапии.
ВЛИЯНИЕ РЕАМБЕРИНА НА ТЕЧЕНИЕ
ОСТРЫХ ТЯЖЕЛЫХ ОТРАВЛЕНИЙ
НЕЙРОТРОПНЫМИ ЯДАМИ
ОСТРЫХ ТЯЖЕЛЫХ ОТРАВЛЕНИЙ
НЕЙРОТРОПНЫМИ ЯДАМИ
ВВЕДЕНИЕ
В современной медицинской литературе систематически публикуются данные о широком распространении острых отравлений различными веществами во всех странах мира. Например, в США в отделения неотложной терапии госпитализируют около 600 000 больных с острыми отравлениями, в основном, так называемыми бытовыми нейротоксическими ядами (Garella S., Lorch J.A., 1993). В РФ больные с острыми отравлениями бытовыми, нейротоксическими ядами составляют 65-75% всех поступающих 4 в токсикологические центры (Лужников Е.А., 1995). Увеличение количества отравлений нейротоксическими ядами, значительное количество больных доставляемых в стационары критическом состоянии, стойкие расстройства здоровья у значительной части выписавшихся из стационаров и сохраняющаяся высокая летальность этой группы больных диктует о необходимости разработки новых путей диагностики и лечения этих интоксикаций (Ливанов Г.А. с соавт., 1995).
С целью выявления общих закономерностей формирования гипоксии и эндогенной интоксикации и поиска путей коррекции нарушений исследования проведены у больных с тяжелыми формами острых отравлений нейротропнымй ядами. Тяжесть состояния больных при острых отравлениях данными ксенобиотиками обусловлена специфическим действием ядов, проявляющееся в токсической и гипоксической энцефалопатии и развитием коматозного состояния, поражениями дыхательной и сердечно-сосудистой систем, выраженными нарушениями метаболизма, развитием синдрома эндогенной интоксикации с последовательно формирующимся синдромом полиорганной недостаточности (Лужников Е.А., Костомарова Л.Г., 1989; Савина А.С., 1992; КалмансонМ.Д., 1993; Строкова В.А., Дагаев В.Н., Зимина Л.Н., 1994). В последние годы отмечается увеличение числа больных с острыми отравлениями ядами нейротропного действия, растет и летальность (Николайчик В.В., 1986; Мусселиус С.Г, 1988; Лужников Е.А., Гольдфарб Ю.С.1995). Во многих работах отечественных и зарубежных авторов, таких как Е.А. Лужников (1989,1994), К.К. Ильяшенко (1995,1997), приведенные данные о механизмах формирования гипоксии, поражений дыхательной системы, циркуляторных нарушениях, нарушениях тканиевого метаболизма. Не менее важным моментом интенсивной терапии острых отравлений является и патогенетические обоснованная терапия эндотоксикоза с учетом специфического действия токсиканта (Ливанов Г.А. с соавт.,1998), так как компонент эндотоксикоза присоединяется к специфическим клинико-патофизиологическим моментам интоксикации буквально в первые часы с момента острого отравления (Сосюкин А.Е. с соавт., 1997). Наиболее важными задачами в этой связи по мнению ряда авторов, является устранение тканевой гипоксии и реабилитация естественных де-токсицирующих систем и биологических барьеров (Ерюхин И.А., Шашков Б.В., 1995). В связи с вышеизложенным, использование препаратов обладающих антигипоксантными, антиоксидантными, гепато- и нефропротекторными свойствами в интенсивной терапии острых отравлений для коррекции вызванных нарушений было бы, на наш взгляд, наиболее эффективным.
Препарат Реамберин представляет собой солевой плазмозамещающий
раствор из 0,5% раствора натрий-метилглюкаминовой соли янтарной
кислоты и сбалансированного набора микроэлементов – натрия, калия
и магния. Препарат обладает антигипоксантными, антиоксидантними,
дезинтоксикационными,
гепато-, нефро-и кардиопротекторными 1 и 2 свойствами, прошел
доклинические исследования и фазу клинических испытаний, хорошо
переносился добровольцами. В связи с этим использование Реамберина
в интенсивной терапии острых отравлений наиболее целесообразно в
условиях развития токсических, гипоксических нарушений и
эндотоксикоза в условиях крайнего напряжения систем
детоксикации.
Исходя из выше изложенного целью настоящей работы клиническое исследование использования Реамберина в программе интенсивной терапии острых тяжелых отравлений, сопровождающихся токсической и гипоксической энцефалопатией, нарушениями транспорта кислорода и развитием синдрома эндогенной интоксикации.
КРИТЕРИИ ВКЛЮЧЕНИЯ И ИСКЛЮЧЕНИЯ
В программу исследования в опытную группу включены больные (35 человек), мужчины и женщины, 17-61 лет, госпитализированные в реанимационное отделение Межобластного Центра по лечению острых отравлений ГНИИ СП им. И.И. Джанелидзе с острыми тяжелыми отравлениями нейротропными ядами: этанол и его спиртсодержащие суррогаты, снотворные, нейролептики, наркотические вещества, с развившейся токсической и постгипоксической энцефалопатией находящиеся в тяжелом и крайне тяжелом состоянии. Контрольную группу (по 31 человек) составляют больные со сходной патологией, не получавшие на госпитальном этапе метаболической терапии.
Рандомизацию исследования предполагается осуществит методом случайной выборки.
Из исследования исключались больные с закрытыми и открытыми черепно-мозговыми травмами, с наличием хронической неврологической патологии, с наличием искусственного водителя ритма, с гиперчувствительностью к исследуемому препарату.
Контингент больных
Работа выполнена в ходе обследования и лечения 66 больных: из них мужчин -41; женщин - 25. Все больные находились в отделении реанимации в связи с нарушением витальных функций: угнетение сознания до комы II-III степени и нарушения функции внешнего дыхания, в связи, с чем всем больным проводилась ИВЛ. у 26 больньис отмечены нарушения центральной гемодинамики. Все обследованные были в возрасте от 17 до 61 лет.
Контрольную группу при исследовании показателей транспорта кислорода и эндотоксемии составили 31 больных с аналогичной патологией без включения в программу интенсивной терапии метаболических антигипоксантов в возрасте от 17 до 58 лет, мужчин – 23, женщин – 8.
Клинические исследования в процессе выполнения работы было изучено 66 случаев отравлений тяжелой и крайне тяжелой степени тяжести, в 35 случаях проводилось изучение влияния препарата "Реамберин" на нарушения транспорта кислорода и течение эндогенной интоксикации при острых отравлениях нейротоксическими ядами. Больные были госпитализированы в отделение реанимации и интенсивной терапии МО ЦЛОО НИИ СП им. И.И.Джанелидзе.
Производные барбитуровой кислоты и производные карбамазепина определялись качественно методом тонкослойной хроматографии после экстракции органическими растворителями, количественно в крови - спектрофотометрическим методом (1974). Этанол и его суррогаты определяли методом газожидкостной хроматографии (1976). Параметры кислородного баланса определяли на 1-е, через 12 часов после инфузии "Реамберина" и на 3-й сутки нахождения больных в стационаре. Для этих исследований проводились анализы РЕСО2 и РЕСО2 выдыхаемого воздуха, определяли CtO2, StO2, РО, РС02, рН артериальной и смешанной венозной крови. Забор крови проводился из бедренной артерии и правого желудочка сердца. Катетеризацию правого желудочка осуществляли через подключичную вену с рентгенологическим контролем. Забор выдыхаемого воздуха проводился с помощью нереверсированного клапана в резиновый мешок. Определение газов крови и выдыхаемого воздуха производились с помощью газоанализатора (BMS3 Mk2 blood micro system; Radiometer, Дания). МОД определяли с помощью волюметра (ГДР). Расчет параметров кислородного баланса проводили по формулам, которые приведены в монографиях Рябова Г.А. (1988).
1. Соотношение функционального мертвого пространства к дыхательному
объему – VD физиол./Vт,
VD/Vт = (РаС02 - РЕС02)
/ РаС02.
РЕС02 – парциальное напряжение
С02 в выдыхаемом воздухе.
2. Альвеолярное напряжение кислорода
РА02.
РА02 = Р02 во вдыхаемом
воздухе – PaCO2/R.
3. Дыхательный коэффициент – R.
R = С02 мл/мин/02 мл/мин.
4. Лёгочный шунт – Qs/QT,
QS/QT=(PA02-Pa02)*0,0031/(PA-Д0
2+(PA02-Pa02)*0,0031),
Qs – кровоток через шунт.
QT – сердечный выброс.
5. Потребление кислорода – V02.
V02 =
(V1*F1)-(VE*FE).
V1 и VE – объем вдоха и выдоха за 1
минуту.
F1 и FЕ – фракция
02 во вдыхаемом и выдыхаемом воздухе.
6. Минутная альвеолярная вентиляция – VA.
VA=(VT – VD) * f,
f – частота дыхания.
Основным методом изучения состояния сердечно-сосудистой системы явились стандартные методы по принципу A.Fick, с определением содержания кислорода в артериальной и венозной крови по Ван-Слайку на 10 аппарате Radiometer, Дания.
Рассчитывали следующие показатели: сердечный индекс, ударный индекс, общее периферическое сосудистое сопротивление, минутный объем кровообращения.
1. Ударный индекс (УИ) – показатель, определяемый отношением ударного объема левого желудочка к поверхности тела исследуемого. Величина УИ является мерой разовой производительности сердца. Расчет ударного объема левого желудочка производили по формуле:
УИ=От/ЧСС/S поверх ,
QT – сердечных выброс в л/мин.
ЧСС – частота сердечных сокращений в мин.
S поверх – площадь поверхности тела в
м2
2. Сердечный индекс (СИ) – показатель, определяемый отношением МОК к поверхности тела исследуемого. Величина СИ является мерой минутной производительности сердца. МОК рассчитывали по A.Fick.
СИ = QT/Sповерх
Qt – сердечный выброс в л/мин.
Sповерх – площадь поверхности тела в л/мин.
3. Расчет общего периферического сопротивления производили по формуле:
ОПСС=(Ра-Рrа)/От
Ра – среднее системное артериальное давление в мм.рт.ст.
Рrа – среднее давление в правом предсердии в мм.рт.ст.
QT – сердечный выброс в л/мин.
4. Коэффициент доставки (КД) – объем кислорода, поступающий в организм за единицу времени, отнесенный к поверхности тела.
КД = СИ*CtaO2,
СИ – сердечный индекс,
CtaO2 – содержание кислорода в артериальной крови в
мл/100мл.
5. Коэффициент утилизации кислорода (КУ02) характеризует взаимоотношения между реальной доставкой кислорода и его расходованием в тканях. Его расчет производили по формуле:
КЭ = VО2/КД
Маркерами эндогенной токсемии являлись вещества низкой и средней молекулярной массы (ВНСММ), олигопептиды (ОП). ВНСММ определяли в плазме, на эритроцитах смешанной венозной и артериальной крови и в моче по Малаховой М.Я. (1995). Кроме того, проводился анализ форм спектрограмм, что имеет немаловажное значение для заключения. В оценках форм спектрограмм отмечали смещения максимумов длин волн, высоту расположения пиков в плазме, на эритроцитах и моче. В спектрограммах плазмы отмечали наличия отрыва начальных значений спектрограммы на длинах волн 238, 242 нм, в спектрограммах эритроцитов определяли угол наклона ветвей гиперболы к основанию графика, в спектрограммах мочи оценивали выраженность пиков максимумов, "прогиба" спектрограммы, определялись смещения максимумов экстинкций в плазме, на эритроцитах и моче. С целью анализа спектра плазменного пула ВНСММ дополнительно рассчитывали коэффициент Е238-260/Е260-292, который является отношением величины площади на длинах волн от 238 до 260 нм к величине площади на длинах волн от 260 до 292 нм и характеризует интенсивность катаболизма (Малахова М.Я., 1995). Определение олигопептидов проводили по методу микроопределения пептидных связей с реактивом Лоури (Малахова М.Я., 1995). Данный метод обладает достаточной чувствительностью: 0,1-2,0 мг/л пептидных связей в пробе.
При острых отравлениях различными ксенобиотиками нарушается активность функциональных систем детоксикации, в том числе иммунной системы крови, а также функциональное состояние печени и почек. Поэтому представлялось целесообразным исследование основных биохимических, иммунологических и гематологических показателей у больных с острыми отравлениями барбитуратами и этанолом и его суррогатами. Одними из показателей, характеризующих степень выраженности эндогенной интоксикации, считается лейкоцитарный индекс-интоксикации (ЛИИ), который рассчитывался по формуле Кальф-Калифа (Кальф-Калиф Я.Я., 1941) и по современным представлениям отражает инфицированность организма, нейтрофильнолимфоцитарный индекс (НЛИ) по В.И. Кузнецову, ядерный индекс (ЯИ) по Г.А. Даштаянцу.
Целью исследований состояния системы ананразивной защиты оценка влияния препарата Реамберин на активность процессов перекисного окисления липидов (ПОЛ) и состояние системы глутатиона, как ведущей составляющей системы антирадикальной и антиперекисной защиты, в эритроцитах при острых тяжелых отравлениях нейротропными ядами.
Исследование проводилось у больных в ранней фазе острых тяжелых отравлений барбитуратами, этанолом и суррогатами, опиатами и нейролептиками. Группу исследования составили больные с острыми тяжелыми, отравлениям нейротропными, ядами, находившиеся в тяжелом и крайне тяжелом состоянии с нарушениями витальных функций – развитием комы до II-III степени и угнетением функции внешнего дыхания, в связи с чем всем исследуемым больным проводилась ИВ Л. Комплексное лечение пациентов данной группы осуществлялось с включением в проводимую инфузионную терапию препарата Реамберин. Средний возраст больных составил 35,6 года. Исследование проводилось у 24 пациентов (14 мужчин и 10 женщин; острые отравления барбитуратами – 8 человек, нейролептиками – 5 человек, алкоголем и суррогатами – 5 человек, опиатами – 6 человек).
Группу сравнения составили больные с аналогичными отравлениями на фоне интенсивной терапии без Реамберина.
Кровь для исследования забиралась из локтевой вены пациентов при их поступлении в стационар и через 12 часов после инфузии 1.5% раствора Реамберина в дозе 400 мл. Исследованию подвергались эритроциты после отмывания по стандартной методике.
В эритроцитах определялись содержание восстановленного глутатиона (ВГ), уровень свободных сульфгидрильных групп белков (СГ) и активность антирадикальных ферментов системы глутатиона и сопряженных систем – глутатион-пероксидазы (ГП), глутатион-8-трансферазы (ГТ) и катализы. Для оценки интенсивности процессов ПОЛ исследовались концентрации мало нового диальдегида (МДА). Преимущество исследования системы глутатиона и интенсивности протекания процессов ПОЛ в, клетках крови, в частности - в эритроцитах, по сравнению с исследованием аналогичных показателей в плазме крови обусловлено, существованием цикла меж органного обмена окисленной и восстановленной форм глутатиона [1, 2, 3, 4], что позволяет не просто фиксировать факт изменения уровня восстановленного глутатиона, продуктов ПОЛ и активности ферментов антира дикальной защиты (часто обусловленных цитолизом клеток печени, почек и, т.д.), но и косвенно оценить состояние баланса про- и антиоксидантных систем в тканях печени, почек и головного мозга [5].
Концентрацию ВГ определяли методом G.L. Ellman (1959) в нашей модификации, заключавшейся в осаждении белка 20% раствором сульфосалициловой кислоты. Содержание СГ определяли согласно методике G. Bellomo et al. (1990). Концентрацию МДА определяли по методу M. Uchiyama (1978). Активность глутатион-пероксидазы определяли по методу А.Н. Гавриловой и Н.Ф. Хмары (1986) с использованием в качестве субстрата гидроперекиси трет бутила, катализы – по М.А. Королюку (1988). Расчет активности ферментов производился на грамм гемоглобина. Концентрацию гемоглобина в гемолизате определяли гемиглобинцианидным методом.
Статистическую обработку полученных результатов проводили на компьютере IBM PC/AT 386 с помощью пакета прикладных программ EXEL, с использованием методов общей статистики и корреляционного анализа.
Исследование ЭЭГ было предпринято с целью изучения у лиц с острыми тяжелыми отравлениями нейротоксикантами динамики спонтанной биоэлектрической активности головного мозга при введении «Реамберина».
Работа выполнена на 21 человеке (15 мужчин, 6 женщин) в возрасте от 18 до 37 лет, которые находились на лечении в ЦЛОО по поводу острого тяжелого отравления веществами с нейротоксическим действием. Острые отравления были вызваны парентеральным введение мопиатов (8 человек) и лекарственными веществами различных групп: барбитураты определены у 4 человек, амитриптиллин – у 4, азалептин – у 3. У всех больных в группе наблюдения на момент поступления в ЦЛОО степень угнетения ЦНС соответствовала уровню комы II-III, Смертельный, исход наступил в 4 наблюдениях, из них в двух случаях отравление было вызвано опиатами, в двух – барбитуратами. Смерть наступала в период от 3 до 8 сут. с момента острого отравления.
Для сравнения была выбрана группа из 14 человек близкая по возрасту группе наблюдения, с аналогичной картиной острых отравлений, которым проводилась общепринятая интенсивная терапия без использования корректоров метаболизма.
Спонтанная биоэлектрическая активность регистрировалась по стандартной методике в 8 униполярных отведениях по Юнгу (1959) с объединенным референтным электродом на мочках ушей. Оценивались средняя амплитуда и спектральный состав ЭЭГ в каждом отведении. При быстром Фурье-преобразовании (FFT) выделялись 4 диапазона частот: дельта - 0-4 Гц, тета - 4-8 Гц, альфа - 8-12 Гц и бета -12-25 Гц. Для оценки реактивности мозга использовали внешнюю болевую стимуляцию и ритмическую фотостимуляцию (вспышки света различной частоты интенсивностью 1.2 кДж). Уровень функциональной асимметрии мозга (ФАМ) оценивали по амплитуде в затылочных отведениях.
ЭЭГ регистрировали на электроэнцефалографе "Bioscript BST-2000" (Германия).
Исходную ЭЭГ в обеих группах регистрировали при поступлении в стационар по завершению «базовых» реанимационных мероприятий (интубация трахеи, перевод на ИВЛ, катетеризация вен). В группе наблюдения ЭЭГ регистрировали через 12 часов после окончания внутривенного введения «Реамберина» в дозе 400.0. В контрольной группе повторное ЭЭГ, регистрировалось в аналогичные сроки, т.е. через 12 часов после первой регистрации.
Статистическая обработка результатов исследований проводилась на ЭВМ IBM PC/AT 486 по стандартным программам.
Вычисляли среднее значение показателя, среднеквадратическое отклонение, ошибку среднего. Оценка достоверности проводилась по t-критерию Стыодента. Различия считались достоверными, если р составлял 95 и более процентов (р < 0.05-0.01) (Поляков Л.Е. с соавт., 1977; Иванова Ю.И., Погорелюк О.Н., 1990).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ РЕАМБЕРИНА
У БОЛЬНЫХ С ОСТРЫМИ ТЯЖЕЛЫМИ ОТРАВЛЕНИЯМИ
НЕЙРОТРОПНЫМИ ЯДАМИ.
Среди реанимационных мероприятий при острых отравлениях наиболее важную роль играет введение инфузионных растворов с целью увеличения ОЦК, улучшения микроциркуляции, коррекции водно-электролитного баланса, кислотно, основного состояния, уменьшения явлений экзо- и эндотоксикоза, уменьшения, проявлений тканевой гипоксии. В данном исследовании целью работы явилось исследование влияния препарата "Реамберин" клиническое течение острых отравлений нейротоксическими ядами тяжелой степени, а также на показатели нарушений транспорта кислорода, кислородного баланса организма и эндотоксемии.
Исследование проведено у больных, поступивших в отделение реанимации с острыми тяжелыми отравлениями нейротоксическими ядами в тяжелом и крайне тяжелом состоянии. Группы были распределены следующим образом, Из обследованных больных был 41 мужчина и 25 женщин. Средний возраст составил у мужчин 34,7±9,6 лет, у женщин – 36,4±16,2. Возраст между опытной и контрольной достоверно не отличался (см. таблицу №54).Состояние больных на момент поступления расценивалось как тяжелое и крайне тяжелое. У всех больных с отравлениями нейротоксическими ядами при поступлении в стационар регистрировалась глубокая кома II-III с тяжелым угнетением дыхания вплоть до апноэ. Всем больным проводилась ИВЛ в связи с нарушениями функций внешнего дыхания, 18 больным ИВЛ была начата на догоспитальном этапе. В 17 программу интенсивной терапии входили эфферентная, инфузионная и симтоматическая терапии. Больные находились в отделение реанимации с различными видами острых отравлений, из которых 9 больных поступили с отравлениями барбитуратами, 10 больных с отравлениями нейролептиками, 4 больных с отравлением трицикли-ческими антидепрессантами, 5 больных с острым отравлением суррогатами алкоголя и 8 больных с отравлениями опиатами. Объединяющими признаками всех больных при назначении лечения Реамберином являлись тяжелое течение отравлений, обусловленное наличием тяжелой токсической и гипоксической энцефалопатии, выраженными нарушениями транспорта кислорода и эндогенной интоксикации тяжелой степени.
Реамберин вводился 1 раз в сутки внутривенно капельно медленно в дозе 1,5%–400.0 в течение 2 суток нахождения больных в реанимационном отделении на фоне базисной терапии. При проведении статистического анализа все больные были разделены на 2 группы: получавшие метаболическую терапию (I) и не получавшие таковой (II).
Таблица № 54. Клинические критерии эффективности Реамберина
в группе больных получавших метаболическую терапию (I) (n=35)
и в контрольной группе больных (II) (n=31) (М+м)
|
Показатель |
Больные получавшие Реамберин (II)(n=35) |
Больные не получавшие Реамберин (II)(n=31) |
|
Возраст больных, годы. |
35,46 |
35,52 |
|
Время экспозиций яда, часы. |
16,8 |
18,3 |
|
Длительность пребывания на ИВЛ, часы |
32,47** |
56,28** |
|
Длительность коматозного состояния, часы |
32,03** |
56,28** |
|
Длительность пребывания больных в ОРИТ, часы |
52,74** |
76,14** |
|
Летальность, % |
11,43%** |
25,86% ** |
Примечание – *р<0.05 между (I) и (II);
**р<0.01 между (I) и (II).
При исследовании переносимости препарата побочных явлений и резкого ухудшения состояния во время и после введения инфузионного раствора отмечено не было. Все пациенты переносили инфузии Реамберина хорошо. Аллергических, пирогенных реакций на инфузию Реамберина во время и после проведения инфузии не отмечалось.
Из объективных параметров через 12 часов после инфузии Реамберина отмечалась тенденция к увеличению систолического и диастолического артериального давления и урежения частоты сердечных сокращений без достоверных отличий от исходных величин.
В неврологическом статусе отмечались уменьшения явлений неврологического, дефицита, проявлявшиеся в достоверных различиях в длительности коматозного состояния, которая у больных с терапией Реамберином составила 32,03±3,58 часа, тогда как в контрольной группе – 56,28+-3,21 часа (Таблица №54). Длительность нахождения на ИВЛ у больных получавших метаболическую терапию был достоверно ниже в отличие от контрольной группы (56,28+3,21 часа) и составила 32,03±3,58, часов (смотрите таблицу №54). Достоверные отличия также были выявлены по времени нахождения больных в отделении реанимации до перевода в общее токсикологическое отделение, как соответствующее стабилизации состояния до средней степени тяжести, и составившее у пациентов получавших Реамберин 52,74±3,5 часа, и в группе контроля – 76,14±3,38 часа (Таблица № 54). В исследуемой группе летальность больных составила 11,43% (4 больных), в контрольной группе – 25,86% (8 больных).
Таким образом, выявлены положительные моменты при сравнении у больных получавших Реамберин, проявившиеся в уменьшении длительности коматозного состояния, длительности пребывания на ИВЛ, времени нахождения в отделении реанимации и снижением летальности с достоверными отличиями от контрольной группы.
Таблица № 55. Сравнительная оценка клинико-лабораторных
показателей больных с острыми отравлениями неиротокснческими ядами
на фоне проводимого лечения препаратом "Реамберин"
(n=35) (I) и в контрольной группе (n=31) (М±м).
|
Показатели |
До введении |
2-е сутки |
3-и сутки |
|
Нb |
128.5 |
109# |
123.7 |
|
Нb |
133.5 |
116.2# |
115.9# |
|
Еr |
4.2 |
3.3 |
3.6 |
|
Еr |
4.0 |
3.4 |
3.9 |
|
L |
11.6* |
13.3* |
9.1^ |
|
L |
10.6* |
14.8* |
12.8*^ |
|
Билирубин ммоль/л (I) |
13.8 |
12.3 |
11.5^ |
|
Билирубин ммоль/л (II) |
11.8 |
13.3 |
19.5#^ |
|
АЛТ ммоль/л (I) |
0.7 |
0.6 |
0.7^ |
|
АЛТ ммоль/л (II) |
0.9 |
1.1 |
1.8*#^ |
|
ACT ммоль/л (I) |
0.50.1 |
0.4 |
0.6^ |
|
ACT ммоль/л (II) |
0.5 |
0.5 |
10#^ |
|
Белок г/л (I) |
63.4 |
61.4 |
68.2^ |
|
Белок г/л (II) |
61.4 |
55 |
53.3^ |
|
Мочевина ммоль/л (I) |
4.6 |
6.1 |
5.3^ |
|
Мочевина ммоль/л (II) |
5.1 |
9.6 |
10.2*#^ |
|
Креатинин ммоль/л (I) |
0.12 |
0.113 |
0.086^ |
|
Креатинин ммоль/л (II) |
0.1 |
0.18* |
0.23*^ |
|
Уд. вес мочи (I) |
1006 |
1018 |
1012^ |
|
Уд. вес мочи (II) |
1013 |
1008 |
1002*^ |
|
Белок мочи (I) |
0.01Ж |
0.06*#^ |
0.03*#^ |
|
Белок мочи (ІI) |
0.06*^ |
0.106*^ |
0.08*^ |
Примечание:
*р<0.05 от нормы;
**р<0.01 от нормы;
#р<0.05 от исходных значений;
##р<0.01 от исходных значений;
^0.05 между (I) и (II);
^^р<0.01 между (I) и (II).
Исходно в обеих труппах отмечался умеренный лейкоцитоз без достоверных отличий от нормы. В группе больных не получавших метаболическую терапию наблюдалось повышение уровня креатинина без достоверных отличий от опытной группы (см. таблицу № 55).
Через 12 часов после введения препарата "Реамберин" отмечалось умеренное снижение концентрации гемоглобина и количества эритроцитов обусловленное гемодилюцией, с тенденцией к дальнейшему снижению на 2-е сутки. Также из показателей общего анализа крови были отмечены достоверные, отличия на 3-й сутки, проявившиеся в устранении лейкоцитоза в опытной группе, что косвенно может свидетельствовать о меньшем количестве гнойных осложнений в данной группе больных (см. таблицу № 55).
О степени напряжение системы детоксикации мы судили по показателям, характеризующим функциональное состояние печени и почек.
На момент поступления достоверных отличий от нормы биохимических показателей отмечено не было. В контрольной группе (II) наблюдалось статистически достоверное нарастание содержания маркеров цитолиза АЛТ. в 2 раза, ACT в 1.5 раза к 3 суткам нахождения больных в стационаре. Данные изменения свидетельствуют о том, что поражение печени является результатом гипоксического повреждения, так как к 3-м суткам концентрация токсического вещества в крови и моче либо достоверно снижалась, либо отсутствовала. В группе исследуемых, получавших метаболическую терапию данных изменений не отмечалось (см. таблицу № 55, что может, во-первых, подтверждать мнение атом, что поражение печени является следствием гипоксических повреждений, и во вторых, что Реамберин защищает клетки печени при острых отравлениях сопровождающихся нарушениями транспорта кислорода.
Со стороны функции почек в группе больных с острыми отравлениями нейротоксическими ядами регистрировали неблагоприятные изменения. При общем анализе мочи выявлена незначительная протеин-, эритроцит- и лейкоцитурия. При этом высокий темп выведения средне молекулярных токсинов с мочой сохранялся. У наиболее тяжелых больных имело место повышение концентрации креатинина и азота мочевины. Эти нарушения указывают на возникновение у больных с тяжелыми отравлением нейротоксическими ядами токсической гепато- и нефропатии, как следствия гипоксических повреждений при отравлениях барбитуратами, опиатами и сочетанного повреждения прямого токсического действия при отравлениях этанолом и суррогатами и азалептином, еще более усиливающегося в условиях гипоксии (см. таблицу № 55).
У всех умерших больных изучение функционального состояния печени и точек выявило наличие у них токсической тепато- и нефропатии тяжелой, степени, причем у больных с отравлениями этанолом и его суррогатами и азалептином эти нарушения выявлялись уже на момент поступления, тогда как у больных с отравлениями барбитуратами, опиатами, трициклическими антидепрессантами они наступали на 3-5 сутки от момента госпитализации больных. Это еще раз подтверждает, что развитие данных изменений являются следствием гипоксического поражения, а не прямого действия барбитуратов, так как концентрация барбитуратов к этому времени либо снижалась, либо отсутствовала. Установлено прогрессивное повышение, как билирубина, так и азотистых шлаков в крови. Нарушение функционального состояния печени проявлялось также в снижении протромбинового индекса и значительной гипопротеинемии на фоне повреждения мембран гепатоцитов, следствием чего являлось повышение цитолитических ферментов (ACT и АЛТ). Снижение удельного веса мочи, протеин-, эритроцит- и лейкоцитурия свидетельствовали о глубоком нарушении функции почек. По-видимому, гипоксия при остром отравлении нейротропными ядами роль пускового фактора, в результате действия которого формируются эндотоксические процессы, резко усиливающие токсическое воздействие с вовлечением в процесс широкого круга биологических систем (Голиков С.Н., Саноцкий И.В.; Тиунов Л.А., 1986).
В группе выживших больных получавших Реамберин патологических изменений со стороны функционального состояния печения и почек с достоверными отличиями отмечено не было. В группе умерших больных с проведением метаболической терапии изменения наступали на 3-5 сутки, и являлись следствием необратимых поражений систем и органов, связанных в первую очередь, с длительностью пребывания в состоянии тяжелой гипоксии до оказания медицинской помощи и развитием в итоге тяжелой токсической энцефалопатии вплоть до состояния "терминальной комы".
Таким образом, при сравнительном анализе, выявлены следующие эффекты Реамберина, проявившиеся в динамике клинико-лабораторных показателей, это уменьшении воспалительного ответа организма, связанное с антигипоксантным эффектом Реамберина и, вероятно, повышение устойчивости иммунитета к присоединению вторичных гнойных осложнений и стабилизации показателей функциональной активности, основных детоксицирующих систем, то есть печени и почек.
2. ВЛИЯНИЕ РЕАМБЕРИНА НА ПОКАЗАТЕЛИ
ТРАНСПОРТА КИСЛОРОДА У БОЛЬНЫХ
С ОСТРЫМИ ТЯЖЕЛЫМИ ОТРАВЛЕНИЯМИ
НЕЙРОТРОПНЫМИ ЯДАМИ
Зарегистрированные нарушения функции внешнего дыхания на момент поступления больных в стационар совпадают с данными, имеющимися в литературе (Петров Н.С. и др., 1986; Лужников Е.А. и др., 1989; Дзюба Ю.А., 1993; Ильяшенко К.К., 1995). Все авторы отмечают развитие нарушений респираторного компонента транспорта кислорода при острых отравлениях нейротоксическими ядами, связанными с угнетающим воздействием ксенобиотиков на центральную нервную систему и нарушением ее регулирующей функции. Однако, представление о том, что главным направлением формирования гипоксии при острых отравлениях ядами депремирующего действия являются центральные угнетения дыхания – по крайней мере, не точно, так как не включают другие звенья системы транспорта кислорода. Именно здесь закладываются основные механизмы формирования гипоксии при длительной экспозиции токсиканта.
На момент поступления у всех больных с острыми тяжелыми отравлениями нейротоксическими ядами отмечалось явления нарушений транспорта кислорода, проявлявшиеся в достоверном снижении РО2 артериальной крови без отличий между исследуемыми группами. Через после введения "Реамберина" наблюдалось снижение парциального напряжения кислорода в венозной крови, достоверно отличное от исходных величин, имелась тенденция к повышению парциального напряжения кислорода в артериальной крови. На 2-е сутки исследования достоверных изменений от состояния с момента поступления в контрольной группе отмечено не было. На 3-и сутки в группе, в интенсивную терапию которых был включен "Реамберин" наблюдалось достоверное повышение парциального напряжения кислорода в артериальной крови с достоверными отличиями от исходных величин и контрольной группы и сохранялось умеренное снижение парциального напряжения кислорода в венозной крови без достоверных отличий от нормы (см. таблицу, №56).
Таким образом, наиболее отчетливые достоверные изменения были отмечены в опытной группе через 12 часов после введения "Реамберина" и проявлялись в снижении парциального напряжения в венозной крови и на 3-й сутки наблюдения. Повышение парциального напряжения кислорода в артериальной крови на 3-й сутки является следствием улучшения параметров транспорта кислорода, в первую очередь респираторного таблицу №58. При сопоставлении полученных данных выявленное снижение парциального напряжения кислорода, наряду с повышением таких показателей, как увеличение артериовенозной разницы по кислороду (смотрите таблицу №58), повышения коэффициента утилизации кислорода тканями свидетельствует о повышении и улучшении потребления кислорода тканями, находившимися в состоянии кислородного голода.
Таблица № 56. Изменения Р02, PCO2 в
артериальной
и смешанной венозной крови у больных с острыми отравлениями
на фоне проводимого лечения препарат "Реамберин" (I) (n=35)
в сравнении с показателями у лиц, получающих традиционную терапию
(II) <n=31) (М±м).
|
Показатель |
Сутки |
|||
|
Норма |
До |
После инфузии |
3-и сутки |
|
|
Ра 02 |
94,5 |
72,49** |
75,88** |
83,55*#^2,15 |
|
Ра02 |
94,5 |
73,73** |
75,39** |
74,39**#^ |
|
РаС02 |
35,6 |
39,26 |
37,01 |
37,38 |
|
РаС02 |
35,6 |
35,14 |
33,2 |
34,47 |
|
РвО2 |
38,2 |
40,92 |
34,81#^ |
35,69# |
|
Рв02 |
38,2 |
36,85 |
38,01^ |
36,54# |
РвС02 |
41,3 |
45,46 |
41,43 |
41,840,97 |
|
РвС02 |
41,3 |
41,43 |
38,62 |
38,З1 |
Примечание
*р<0 значений;
##р<0.01 между (I) и (II).
**р<0.01 от нормы;
#р<0.05 от исходных значений;
^р<0.05 между
(I) и от исходных (II);
Таблица 57. Показатели КОС у больных с острыми отравлениями
на фоне проводимого лечения препаратом "Реамберин”
в группе выживших (I) (n=6)
и группе умерших (II) (n=8) больных
(М±м)
|
Показатель |
Сутки |
|||
|
Норма |
До введения |
После введения |
3-и |
|
|
рНа(I) |
7,42 |
7,45 |
7,46 |
7,43 |
|
рНа (II) |
7,42 |
7,43 |
7,45 |
7,46 |
|
рНв(I) |
7,36 |
7,4 |
7,4 |
7,38 |
|
рНв(II) |
7,36 |
7,4 |
7,41 |
7,42 |
|
ВЕа (I) |
-1,4 |
3,09 |
2,21 |
0,45 |
|
ВЕа (II) |
-1,4 |
-1,33 |
-0,95 |
0,59 |
|
ВЕв (I) |
-2,1 |
2,69 |
0,9 |
-0,76# |
|
ВЕв(II) |
-2,1 |
1,35 |
-0,14 |
-0,05 |
Примечание:
*р<0.05 от нормы;
**р<0.01 от нормы;
#р<0.05 от исходных значений;
##р<0.01 от исходных значений;
^р0.05 между (I) и (II);
^^р<0.11 между (I) и (II).
Исходно в исследуемой группе отмечался умеренный метаболических ацидоз без достоверных отличий от нормы. В контрольной группе умеренный респираторный алкалоз с компенсацией метаболическим компонентом. Следует отметить, что проводимая интенсивная терапия, включающая в себя и коррекцию нарушений кислотно-основного состояния (режим ИВЛ, инфузию ощелачивающих растворов) проводилась всем больным (см. таблицу №57).
Таким образом, каких-либо достоверных отличий в показателях кислотно-основного состояния отмечено не было.
Таблица № 58. Изменения газо-обмеиных функций легких
у больных с острыми тяжелымиотравлениями нейротоксическимн
ядами
на фоне проводимого лечения препаратом "Реамберин" (I) (n=35)
в сравнения с контрольной группой (II) (n=31)
(М±м)
|
Показатель |
Сутки |
|||
|
Норма |
До инфузии |
После инфузии |
3-и сутки |
|
|
VD/VT (I) |
0,32 |
0,54** |
0,5** |
0,47*#^ |
|
vb/VT(n) |
0,32 |
0,56** |
0,49** |
0,53**^ |
|
VA(D |
4,1 |
3,96 |
4,16 |
3,99 |
|
VA(H) |
4,1 |
3,68 |
4,21 |
3,8 |
|
VA/QT (I) |
0,8 |
0,72 |
0,97# |
0,88# |
|
VA/QT (II) |
0,8 |
1,11* |
1,09* |
1,01 |
|
Qs/Qt (I) |
4,1 |
17,74** |
10,68*##^ |
8,34*##^^ |
|
Qs/Qt (II) |
4,1 |
14,94** |
14,91**^ |
14,46**^^ |
|
PA02 (I) |
100,5 |
103.95 |
101. 75^ |
100.55^ |
|
PA02 (II) |
100,5 |
110.34* |
112.38*^ |
110.86*^ |
|
AaD02(I) |
8,2 |
33.6** |
27.73**#^ |
18.85*##^^ |
|
AaD02(II) |
8,2 |
37.25** |
38.08**^ |
36.3**^^ |
|
Pa02/PA02 (I) |
0,8 |
0.72* |
0.75**^ |
0.82*##^^ |
|
Pa02/PA02 (II) |
0,8 |
0.67** |
0.67**^ |
0.68**^^ |
|
Pa02/Fi02 (I) |
440,1 |
336.14** |
353.65**# |
390.34*##^^ |
|
Pa02/Fi02 (II) |
440,1 |
349.24** |
354.97** |
356.25** |
|
avD02 (I) |
52,9 |
33.49** |
49.28##^^ |
49.6 Ш |
|
avD02 (II) |
52,9 |
45.22 |
38.48*# |
40.74* |
Примечание:
*р<0.05 от нормы;
**р<0.01 от нормы;
#р<0.05 от исходных значений;
##р<0.01 от исходных значений;
^р<0.05 между (I) и (II);
^^р<0.01 между (I) и (П).
Респираторный компонент транспорта кислорода представлен 3 основными процессами легочного газообмена: вентиляцией, диффузией и перфузией. Известно, что при острых отравлениях нейротоксическими ядами в связи с глубокими поражениями центральной нервной системы и ее регулирующей функции работы жизненно важных органов и систем, система дыхания наиболее подвержена как токсическим, так и гипоксическим повреждениям (Ильяшенко К.К., 1997). Имеются некоторые специфические особенности этих повреждений, связанных со специфическими механизмами действия ядов. Например, прямое воздействие на дыхательный центр наркотических веществ, где угнетение дыхания проходит порой без развития тяжелой токсической энцефалопатии. Угнетение дыхания при отравлениях этанолом и психотропными средствами свидетельствует о глубоких токсических поражениях центральной нервной системы, а значит и системы дыхания (Рябов Г.А., 1994).
При исследовании респираторного компонента при поступлении были выявлены грубые нарушения всех его звеньев. Исходно у всех больных наблюдалось достоверное повышение функционального мертвого пространства, в контрольной группе умеренное повышение вентиляционно-перфузионного отношения. Нарушения диффузии газов через альвеолокаппилярную мембрану регистрировались повышением показателей альвеолоартериальной разницы по кислороду, снижением отношения парциального напряжения кислорода в артериальной крови к альвеолярному напряжению кислорода и высокодостоверному снижению отношения парциального напряжения кислорода в артериальной крови к фракции вдыхаемого кислорода. В конечном счете, нарушения респираторного компонента проявлялись достоверным увеличением доли легочного шунтирования, что являлось еще одним фактором снижения парциального напряжения кислорода в артериальной крови и кислородного недообеспечения тканей.
Через 12 часов в опытной группе больных после инфузии "Реамберина" наблюдались следующие изменения: достоверно увеличилось вентиляционно-перфузионное отношение, имелась четкая тенденция к снижению альвеолоартериальной разницы по кислороду, достоверно повышалось отношение: напряжения кислорода в артериальной крови к фракции вдыхаемого кислорода. Регистрировалось достоверное повышение артериовенозной разницы по кислороду за счет снижения парциального напряжения кислорода в смешанной венозной крови. В контрольной группе на 2-е сутки исследования достоверных отличий показателей респираторного компонента отмечено не было.
Наиболее выраженные изменения в дыхательном компоненте транспорта кислорода наблюдались в группе пролеченных "Реамберином" на 3-и сутки исследования. Было выявлено достоверное снижение функционального мертвого пространства к дыхательному объему, стабилизация вентиляционно-перфузионного отношения без достоверных отличий от нормальных величин. Отмечались достоверные изменения диффузионной способности легких, проявившиеся в достоверном снижении от исходных величин и показателей контрольной группы, альвеолоартериальной разницы по кислороду, высоко достоверном повышении коэффициента оксигенации (отношение парциального напряжения кислорода в артериальной крови к фракции вдыхаемого кислорода), стабилизации артериовенозной разницы по кислороду с достоверными отличиями от контрольной группы (см. таблицу № 58).
Таким образом, при острых тяжелых отравлениях были выявлены грубые нарушения всех звеньев дыхательного компонента транспорта кислорода с момента поступления больных и времени нахождения, больных в отделении реанимации. В группе пролеченных "Реамберином" на 3-й сутки наблюдались достоверные изменения в показателях вентиляции, диффузии и перфузии, что свидетельствует о положительном влиянии исследуемого препарата на данные показатели и на респираторный компонент транспорта кислорода вообще.
Таблица 59. Изменения показателей объемного компонента транспорта кислорода и кислородного баланса организма у больных острыми отравлениями на фоне проводимого лечения препаратом "Реамберин" (I) (n=35) в сравнении с контрольной группой больных (II) (n=З1) (М±м)
|
Показатель |
Сутки |
|||
|
Норма |
До введения |
После введения |
3-й сутки |
|
|
СИ л*мин-1/м2(I) |
2,9 |
3,75* |
2,89 |
2,82 |
|
СИ л*мин-1/м2(П) |
2,9 |
3,39* |
2,98 |
2,87 |
|
УИ |
39,7 |
37,16 |
29,43 |
31,91 |
|
УИ |
39,7 |
37,07 |
30,01 |
28,20* |
|
бпсс |
19.2 |
25,64^ |
34#^ |
32,15#^ |
|
ОПСС мм.рт.ст./(л*м-1) |
19.2 |
36,32* |
38,59* |
39,92*^ |
|
Кд |
530,3 |
665,7 |
491,07 |
471,05# |
|
КД |
530,3 |
592,25 |
468,77 |
443,07# |
Примечание:
*р<0.05 от нормы;
**р<0.01 от нормы;
#р<0.05 от исходных значений;
##р<0.01 от исходных значений;
^р<0.05 между (I) и (II);
^^р<0.01 между (I) и (II).
Наиболее интересным на наш взгляд являлось увеличение артериовенозной разницы по кислороду за счет умеренного снижения парциального напряжения в смешанной венозной крови, что свидетельствует об улучшении усвояемости кислорода тканями на фоне инфузии “Реамберина”.
Показатель объемного компонента транспорта кислорода, то есть количество кислорода, которое транспортируется к органам и тканям за определенный промежуток времени, является ключевым в обшей системе оценки кислородного баланса организма (Г.А. Рябов, 1988) и представлен циркуляторным и гемическими компонентами транспорта кислорода (см. таблицу № 59).
Исходно в обеих исследуемых группах наблюдалось умеренное повышение сердечного и ударного индексов, отмечалось достоверное повышение общего периферического сосудистого сопротивления в контрольной группе. Результатом данных изменений явилось умеренное снижение коэффициента доставки в контрольной группе без достоверных отличий от в группы пролеченных "Реамберином" как результат развития гиперкинетической реакции центральной гемодинамики на недостаток кислорода тканям. Через 12 часов после инфузии "Реамберина" было отмечено снижение сердечного и ударного индексов и умеренное повышение общего периферического сосудистого сопротивления как результат скомпенсированной задолженности гипоксии организмом. В контрольной группе на 2-е сутки также отмечалось снижение сердечного, ударного индексов и при сохраняющимся высоком общем периферическом сосудистом сопротивлении без достоверных отличий от исходных величин, что являлось продолжением реакции компенсации циркуляторного компонента гипоксических повреждений. На 3-й сутки достоверные отличия между группами больных отмечались по показателю общего периферического сосудистого сопротивления, которое было достоверно повышено в контрольной группе. Таким образом, было выявлено, что острые отравления нейротоксическими ядами у исследуемых больных сопровождались гиперкинетическим типом реакции центральной гемодинамики на гипоксию и применение метаболических антигипоксантов позволяет устранить напряжение центральной гемодинамики уже через 12 часов после инфузии на фоне проведения базовой интенсивной терапии.
Таблица № 60. Показатели тканевого компонента транспорта кислорода и кислородного баланса организма у больных с острыми отравлениями нейротоксическими ядами на фоне проводимого лечения "Реамберином" (I) (n=35) в сравнении с контрольной группой больных (II) (n=31) (М±м)
|
Показатель |
Сутки |
|||
|
Норма |
До |
После |
3-й сутки |
|
|
V02мл*м-1 (I) |
148,8 |
119,31* |
135,83#^^ |
135,62#^^ |
|
V02мл*м-1 (II) |
148,8 |
125,76 |
98,9#^^ |
94,75#^^ |
|
КИО2(I) |
37,8 |
20,2* |
23,8 1#^ |
26Д2##^^ |
|
КИ02(П) |
37,8 |
22,63* |
17,42*^ |
17,34*^ |
|
КУ02(I) |
28,0 |
18,72* |
28,37#^ |
29,Ш#^ |
|
КУ02(П) |
28,0 |
26,34 |
23,29 |
25,47 |
Примечание:
*р<0.05 от нормы;
**р<0.01 от нормы;
#р<0.05 от исходных значений;
#Яр<0.01 от исходных значений;
^р<0.05 между (I) и (II);
^^р<0.01 между (I) и (II).
По мнению ряда авторов, об эффективности работы системы транспорта кислорода наиболее полно можно судить по показателям кислородного баланса организма - по потреблению кислорода и коэффициенту его использования (Рябов Е.А., 1988; Ильяшенко К.К., 1997).
Из показателей кислородного баланса организма было отмечено умеренное снижение потребления кислорода без достоверных отличий между исследуемыми группами и нормы, однонаправленное снижение коэффициентов использования (см. таблицу №59).
Через 12 часов после инфузии "Реамберина" наблюдалось достоверное повышение потребления кислорода, достоверное повышение Коэффициента использования кислорода с достоверными отличиями от 2-х суток контрольной группы и исходного состояния. В контрольной группе на 2-е сутки исследования было отмечено достоверное снижение потребления кислорода и коэффициента его использования, что свидетельствовало о прогрессировании гипоксии у данной категории больных.
На 3-й сутки в контрольной группе показатель потребления кислорода и коэффициент его использования продолжали оставаться низкими. В группе пролеченных "Реамберином" показатели находились в пределах нормальных величин (см. таблицу №59,).
О нарушениях тканевого компонента транспорта кислорода ряд авторов склонны судить по коэффициенту утилизации кислорода тканями, отражающему реальную доставку кислорода к тканям и его расходование в них (Рябов Г.А., 1988; Ильяшенко К.К., 1997).
При поступлении было отмечено достоверное снижение коэффициента утилизации кислорода у опытной группы, что свидетельствовало о несоответствии потребностей тканей в кислороде и его доставки, в контрольной группе этот показатель находился в пределах нормальных значений.
Через 12 часов после введения "Реамберина" было отмечено высоко достоверное повышение коэффициента утилизации с достоверным отличием от 2-х суток контрольной группы. На 3-й сутки коэффициент утилизации в опытной группе находился в пределах верней границы нормы и был достоверно выше значений в контрольной группе.
Таким образом, острые тяжелые отравления сопровождаются нарушениями транспорта кислорода, проявляющиеся, в конечном счете, в недостатке кислорода в тканях организма и характеризуются снижением потребления кислорода, коэффициента его использования и утилизации кислорода тканями. Наиболее полно антигипоксантные эффекты "Реамберина" отразились на показателях кислородного баланса организма и проявлялись на тканевом уровне, что подтверждается ростом таких показателей как потребление кислорода, коэффициент его использования и утилизация кислорода.
3. ТЕЧЕНИЕ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
У БОЛЬНЫХ С ОСТРЫМИ ОТРАВЛЕНИЯМИ НЕЙРОТОКСИЧЕСКИМИ ЯДАМИ
НА ФОНЕ ПРОВОДИМОГО ЛЕЧЕНИЯ
ПРЕПАРАТОМ "РЕАМБЕРИН"
По данным ряда авторов, острые тяжелые отравления нейротоксическими ядами сопровождаются развитием эндогенной интоксикации, связанной с механизмами действия ядов и являющейся следствием прямого общетоксического действия ядов на системы и органы, гипоксических повреждений и так далее (Лужников Е.А., 1995, 1997, 1998; Зуев В.В., 1997; Батоцыренов Б.В., 1998). В настоящем разделе исследования приведены данные влияния "Реамберина" на показатели эндотоксемии при острых тяжелых отравлениях нейротоксическими ядами.
Исходно все показатели эндогенной интоксикации были достоверно выше нормы в обеих группах больных. После введения "Реамберина" достоверных изменений показателей отмечено не было. В дальнейшей динамике индексы эндогенной Интоксикации продолжали оставаться высокими в обеих группах больных на 2-е и 3-й сутки (см. таблицу № 61).
Таблица № 61. Расчетные показатели эндогенной интоксикации
у больных с острыми отравлениями на фоне проводимой терапии
препаратом "Реамберин" (І) (n=35) в сравнении
с контрольной группой (II) (n=31) (М±м)
|
Показатель |
Сутки |
|||
|
Норма |
До |
После введения |
2-е |
|
|
ЛИИ (I) |
0,9 |
12.6** |
12.3** |
10.2** |
|
ЛИИ (II) |
0,9 |
12.1** |
20.2** |
16.3** |
|
ЯИ (I) |
0,065 |
0.13** |
0.15** |
0.12** |
|
ЯИ (II) |
0,065 |
0.12** |
0.12** |
0.17** |
|
НЛИ (I) |
2 |
3.68* |
3.48** |
3.07** |
|
НЛИ (II) |
2 |
5** |
5.77** |
6.26** |
Примечание:
*р<0.05 от нормы;
**р<0.01 от нормы;
#р<0.05 от исходных значений;
##р<0.01 от исходных значений;
^р<0.05 между (I) и (II);
^^р<0.05 между (I) и (II).
Таким образом, отсутствие достоверности и однонаправленность изменений индексов токсичности в группах больных свидетельствуют об их мало информативности в оценке динамических изменений течения эндогенной интоксикации при острых отравлениях, что соответствует литературным данным.
Таблица № 62. Изменения содержания ВНСММ в плазме
и на эритроцитах смешанной венозной артериальной крови
и моче на фоне проводимого лечения препаратом "Реамберин"
(I) (n=35) в сравнении с контрольной группой (II) (n=31) больных
(М±м)
|
Показатель |
Сутки |
|||
|
Норма |
До |
После |
3-и сутки |
|
|
ВНСММ вена |
12 |
20,41** |
17,14*#^ |
13,68## |
|
ВНСММ вена |
12 |
20,76** |
20,32**^ |
20,72**^^ |
|
ВНСММ вена эр. |
22 |
32,9** |
28,22*#м |
23,4Ш^^ |
|
BHCMM вена эр. |
223 |
33,81** |
32,43**^ |
32,49*^^ |
|
ВНСММ арт. пл. |
11 |
20,28** |
17*#л |
12,6##^^ |
|
ВНСММ арт. пл. |
11 |
20,78** |
20,18**^ |
21,45**^^ |
|
ВНСММ арт. эр, |
20 |
32,9** |
27,56*#^ |
21,04##^^ |
|
ВНСММ арт. эр. |
20 |
32,94** |
31,13**^ |
31,33**^ |
|
ВНСММ моча |
33 |
42,81* |
44,3* |
38,8* |
|
ВНСММ |
33 |
32,53 |
32,96 |
28 |
Примечание:
*р<0.05 от нормы;
**р<0,01 от нормы;
#р<0.05 от исходных значений;
##р<0.01 от исходных значений;
^р<0.05 между (Т) и (II);
^^р<0.01 между (I)и(П).
При поступлении больных наблюдалось повышение факторов вторичной аутоагрессии во всех исследуемых средах с достоверными отличиями от нормы и без достоверных отличий между исследуемыми группами, что подтверждает известное мнение, что острые тяжелые отравления сопровождаются развитием эндогенной интоксикации порой уже с 1-х часов острого отравления (Сосюкин А.Е. с соавт., 1997). Отсутствие различия между содержанием веществ низкой и средней молекулярной массы в венозной и артериальной крови свидетельствует о поражении 36 метаболических, "не дыхательных функций" легких, что, по мнению С.В. Оболенского (1993), может являться свидетельством о поражении системы дыхания (см. таблицу №62).
Через 12 часов после инфузии "Реамберина" было отмечено снижение маркеров токсемии во всех исследуемых средах, достоверное снижение от 2-х суток контрольной группы было зарегистрировано на эритроцитах венозной, артериальной крови, имелась тенденция к снижению, маркеров токсемии в артериальной крови по сравнению с венозной, что является косвенным свидетельством о поддержании детоксицирующей системы легких во время токсической нагрузки.
На 3-и сутки были отмечены высоко достоверное снижение веществ низкой и средней молекулярной массы во всех исследуемых средах в отличие от исходного состояния и контрольной группы. В контрольной группе содержание маркеров токсемии на 1-е сутки продолжало оставаться высоким без достоверных отличий от исходного состояния, что подтверждает, что эндотоксемия при острых отравлениях является следствием гипоксических повреждений, а не прямого токсического действия яда, так как к этому времени концентрация ксенобиотика в средах организма либо резко снижалась, либо отсутствовала (см. таблицу № 62) Таким образом, при острых отравлениях нейротоксическими ядами наблюдается рост факторов вторичной аутоагрессии, являющийся следствием обще токсического действия ядов в ранней фазе острого отравления и гипоксических повреждений. Были выявлено влияние "Реамберина" на снижение содержания веществ низкой и средней молекулярной массы, сопровождающееся и улучшением состояния больных. Ранние эффекты "Реамберина" мы склонны связывать с нивелированием гипоксических повреждений на уровне тканей, как антигипоксантное действие и повышение энергетического статуса организма. Помимо действия "Реамберина" непосредственно на этиопатогенетический фактор эндотоксикоза, были выявлены и его эффекты на функциональное состояния естественных детоксицирующий систем организма, что является еще одним фактором снижения проявлений эндотоксикоза.
Таблица 70. Изменения метаболического пула ВНСММ
в плазме смешанной венозной и артериальной крови
на фоне проводимого лечения препаратом "Реамберин" (I) (n=35)
в сравнении с контрольной группой(II) (n=31) больных (М±м)
|
Показатель |
Сутки |
|||
|
Норма |
До инфузии |
После инфузии |
5-е |
|
|
КП ВНСММ |
4,5 |
11,44** |
7,3**#^ |
6,3*##^^ |
|
КП ВНСММ |
4,5 |
13,54** |
12,2**^ |
12,3**^^ |
|
КП ВНСММ арт. |
4,0 |
14,28** |
8,1**#^ |
5,9*## |
|
КП ВНСММ арт. |
4,0 |
12,78** |
12,58**^ |
12,83**^ |
Примечание - *р<0.05 от нормы; **р<О.Ш от нормы; #р<0.05 от исходных значений; ##р<0.01 от исходных значений; ^р<0.05 между (I) и (II); ^^р<0.01 между (I) и (II).
Исходно отмечалось достоверное повышение катаболического пула ВНСММ в обеих группах больных, без достоверных отличий между исследуемыми группами (см. таблицу № 70).
Через. 12, часов после введения, "Реамберина" отмечалось достоверное снижение катаболического пула маркеров токсемии в отличие от исходных величин и контрольной группы.
На 3-й сутки в опытной группе наблюдалось дальнейшее снижение катаболического пула веществ низкой и средней молекулярной массы, что свидетельствовало о нормализации метаболизма и угнетении катаболических процессов (Таблица № 70) Таким образом, при острых отравлениях нейротоксическими ядами было выявлено преобладание катаболических процессов над анаболическими уже с момента поступления больных в стационар. Отмечено снижение катаболического пула веществ низкой и средней молекулярной 38 массы уже через 12 часов после инфузии "Реамберина" с нормализацией этого показателя в дальнейшем (см. таблицу № 70).
Таблица № 71. Изменения концентрации олигопептидов у
больных
с острыми отравлениями на фоне проводимого лечения препаратом
"Реамберин"(I) (n=6) в сравнении с контрольной группой(II) (n=8)
(М±м)
|
Показатель |
Сутки |
|||
|
4 |
Норма |
До |
После |
2-е |
|
МАХ вена пл. (I) |
0,3 |
0.328** |
0.3* |
0.212#* |
|
МАХ вена пл. (II) |
0,3 |
0.336** |
0.35** |
0.3б**^ |
|
МАХ вена эр. (I) |
0,6 |
0.824** |
0.736* |
0.704 |
|
МАХ вена эр. (II) |
0,6 |
0.845** |
0.7,87* |
0.756 |
|
МАХ арт.пл. (I) |
0,3 |
0.33** |
0.24 |
0.2#^ |
|
МАХ арт.пл. (II) |
0,3 |
0.34** |
0.33** |
0.346*^ |
|
МАХ арт.эр. (I) |
0,6 |
0.834** |
0.706# |
0.704# |
|
МАХ арт.эр. (П) |
0,6 |
0.84** |
0.769* |
0.784* |
|
МАХ моча 1 (I) |
0,5 |
0.286 |
0.282 |
0.232 |
|
МАХ моча 1 (II) |
0,5 |
0.411** |
0.533** |
0.836**# |
|
МАХ моча 2(I) |
0,4 |
0.186* |
0.228* |
0.286^ |
|
МАХ моча 2(II) |
0,4 |
0.274* |
0.35* |
0.498*^ |
Примечание:
*р<0.05 от нормы;
**р<0,01 от нормы;
#р<0.05 от исходных значений;
##р<0.01 от исходных значений;
^р<0.05 между (I) и <П);
^^ р<0.01 между (I) и (II).
Наиболее полно отражает степень эндотоксемии увеличение концентрации олигопептидов в артериальной, венозной крови и моче. Повышение концентрации олигопептидов являются результатом активации процессов неуправляемого протеолиза, развивающего при многих патологических состояниях, особенно в медицине критических состояний. Повышение маркеров протеолиза является следствием разрушения биологических мембран и выхода лизосомальных ферментов в кровь и с последующей денатурацией белков (Дин Р., 1981).
При поступлении у всех больных регистрировалось повышение концентрации олигопептидов во всех исследуемых средах с более выраженным их повышением в артериальной крови в отличие от венозной, что свидетельствует о поражении метаболических функций легких. Через 12 часов после введения "Реамберина" было отмечено достоверное снижение концентрации, олигопептидов в плазме, на эритроцитах артериальной и венозной крови с одновременным их повышением в моче. Одновременно с этими изменениями отмечалось снижение артериовенозное разницы по концентрации олигопептидов, что говорило о восстановлении детоксицирующей функции легких. В контрольной группе повышение концентрации олигопептидов отмечалось и на 3-й сутки исследования с достоверными отличиями от контрольной группы, что свидетельствовало о продолжающихся явлениях эндотоксикоза у данной категории больных (Таблица № 71) Таким образом, при острых отравлениях нейротоксическими ядами отмечен рост концентрации олигопептидов во всех исследуемых средах, подтверждавший наличие тяжелой эндогенной интоксикации у исследуемых больных. Наличие положительной артериовенозной разницы по концентрации олигопептидов говорило и о поражении не дыхательных функций легких и о том, что легкие зачастую сами становились источником эндотоксикоза у больных с острыми тяжелыми отравлениями. Эффекты "Реамберина" проявились уже через 12 часов после инфузии и характеризовались достоверным снижением концентрации олигопептидов в плазме и на эритроцитах артериальной и венозной крови со снижением положительной артериовенозной разницы по концентрации олигопептидов с одновременным их повышением в моче. При сопоставлении полученных данных и клинико-лабораторных показателей можно сказать, что помимо влияния "Реамберина" на процессы повышенного образования токсинов при развитии эндогенной интоксикации при острых тяжелых отравлениях, данный препарат действует и на реабилитацию естественных детоксицирующих систем организма.
Таблица № 72. Изменения высоты максимумов
экстинкций ВНСММ у больных с острыми отравлениями
на фоне проводимого лечения препаратом "Реамберин" (I) (n=35)
|
Показатель |
Сутки |
|||
|
Норма |
До |
После введения |
2-е |
|
|
СМ вена пл. (I) |
282 |
281.2* |
281.6 |
282.6#^ |
|
СМ вена пл. (II) |
282 |
280.3** 0.7 |
281.3 |
280*^ |
|
СМ вена эр. (I) |
258 |
257 |
257.5 |
258.4^^ |
|
СМ вена эр. (II) |
25 |
256.5** |
257.2*# |
256.6**^^ |
|
СМ арт. пл. (I) |
282 |
280.6^ |
281.6 |
281.6 |
|
СМ арт. пл (II) |
282 |
279.7* |
280.5* |
281 |
|
СМ арт. эр. (I) |
258 |
257 |
258^^ |
258^^ |
|
СМ арт. эр. (II) |
258 |
257.3 |
257**^^ |
257**^^ |
|
СМ моча 1 (I) |
242 |
240.4* |
240.8* |
241 |
|
СМ моча 1 (II) |
242 |
244* |
240** |
240.4 |
|
СМ моча 2 (I) |
282 |
281,6 |
286.6 |
282^^ |
|
СМ моча 2 (II) |
282 |
280.5* |
279.2** |
278.5**^^ |
Примечание:
*р<0.05 от нормы;
**р<0.01 значений;
##р<0.01 от исходных значений;
между (I) и (П).
Исходно у всех больных отмечалось повышение высоты максимумов экстинкций на эритроцитах венозной и артериальной крови, имелась тенденция к повышению высот максимумов экстинкций в плазме артериальной и венозной крови, высоты максимумов экстинкций в моче были достоверно повышенными в отличие от нормы. В контрольной группе больных отмечалось повышение высот максимумов экстинкций на эритроцитах венозной и артериальной крови, более высокое стояние высот максимумов экстинкций в моче. Через 12 часов после введения "Реамберина" отмечалось снижение высот в плазме й на эритроцитах венозной и артериальной крови, имелась тенденция к повышению высот в плазме артериальной и венозной крови и моче.
В дальнейшей динамике отмечались разнонаправленные изменения по контрольной и опытной группам, проявлявшиеся в дальнейшем снижении высоты стояния максимумов экстинкций в группе получавших метаболическую терапию с сохранением их повышения в моче и в контрольной группе больных дальнейшим их ростом в артериальной и венозной крови и снижением в моче (Таблица № 12). Таким образом, при острых отравлениях нейротоксическими ядами отмечено повышение стояния пиков экстинкций, свидетельтвующее о наличии эндогенной интоксикации у данной категории больных. При инфузии "Реамберина" отмечено снижение высот максимумов экстинкций в плазме и на эритроцитах венозной и артериальной крови, что говорит о прямом детоксицирующем эффекте данного препарата. Сохраняющееся высокое стояние пиков максимумов экстинкций в моче свидетельствует о сохраняющейся детоксицирующей фунции почек. Учитывая личные клинико-лабораторных показателей отмечен и эффект "Реамберина" связанный с благотворным влиянием данного препарата на функции детоксицирующих систем, так как в контрольной группе на 3-и сутки нахождения больных в отделении реанимации отмечено нарушение функции детоксицирующих систем, являющееся результатом гипоксических повреждений.
По мнению ряда авторов, смещения максимумов экстинкций в сторону более коротких длин волн ультрафиолета свидетельствует о более тяжелой степени эндогенной интоксикации (Степанов Н.Г., 1996; Ерюхин И.А., Шашков Б.В., 1995> На момент поступления наблюдались смещения максимумов экстинкций в плазме артериальной и венозной крови, смещений максимумов экстинкций на эритроцитах в этой группе не отмечались (Таблица № 72). В группе контрольной группе больных исходно отмечались более выраженные смещения максимумов экстинкций в сторону более коротких длин волн ультрафиолета во всех исследуемых средах. После введения "Реамберина" в группах больных наблюдалось незначительное смещение длин волн в сторону более длинных длин волн ультрафиолета.
Таким образом, после инфузии "Реамберина" отмечалось смещение длин волн ультрафиолета в сторону более длинных волн, что является свидетельством об уменьшении степени эндотоксемии у данной категории больных на фоне проводимой терапии.
III. ВЛИЯНИЕ РЕАМБЕРИНА НА СОСТОЯНИЕ СИСТЕМЫ АНТИРАДИКАЛЬНОЙ ЗАЩИТЫ И ИНТЕНСИВНОСТЬ ПРОЦЕССОВ ПЕРЕКИСНОГО ЛИПИДОВ ПРИ ОСТРОМ ОТРАВЛЕНИИ НЕЙРОТОКСИЧЕСКИМИ ЯДАМИ
В эритроцитах обеих групп больных на момент поступления отмечалось достоверное снижение содержания восстановленного глутатиона повышение уровня мало нового диальдегида по сравнению с показателями здоровых доноров (Таблица 73.Таблица 74). Достоверных различий концентрации восстановленного глутатиона и ТБК-связывающих продуктов в эритроцитах лиц исследуемой группы и группы сравнения на момент поступления в стационар не отмечалось.
Через 12 ч после инфузии Реамберина в эритроцитах лиц исследуемой группы отмечалось достоверное повышение содержания восстановленного глутатиона с 0,686+0,120 ммоль/г гемоглобина до 1,140±0,131 (при отсутствии достоверных изменении концентрации ВГ в группе сравнения), тем не менее, этот подъем не достигал уровня нормы, что может быть связано с достаточно длительным временем полу обмена ВГ в эритроцитах – около 3 сут., (Куликовский В.И., Колесниченко Л.С., 1990), а также малой дозой вводимого препарата. Учитывая, что сукцинат не может утилизироваться непосредственно эритроцитами, не обладающими собственной системой митохондрий, повышение уровня ВГ в этих клетках объясняется восстановлением кислород зависимого дыхания и накоплением НАДФН и макроэргических соединений (Кондрашова М.Н., 1976; Liu H., Кеhler J.P., 1996), необходимых для синтеза ВГ в тканях печени, почек, головного мозга и его дальнейшим переносом в эритроциты (Lu S.C., Garsia-Ruiz С. et al., 1990; Lu S.C., Kuhlenkamp J., 1994). В нашем исследовании также отмечался рост потребления кислорода тканями. Кроме того, возможно связывание Реамберином молекул токсикантов и их метаболитов предотвращало расходование восстановленной формы глутатиона в процессе конъюгации с ксенобиотиками. Третья причина восстановления уровня ВГ –компенсация части приходящейся на данное соединение антиоксидантной нагрузки за счет стимулированного сукцинатом синтеза низкомолекулярных антиоксидантов, в первую очередь убихинона и ±-токоферола (Ernster L. et al., 1992; Noack H. et al., 1994).
Концентрация МДА в эритроцитах отравленных, леченных с использованием Реамберина через 12 ч достоверно снижалась (р<0.05) в 1,31 раза соответственно с 55,92+3,71 до 43,02±4,56 нмоль/г гемоглобина, в то время как концентрация ТБК-связывающих продуктов в эритроцитах лиц группы сравнения продолжала нарастать и достигала значений превышающих показали исследуемой группы в 1,64 раза (р<0.05) и в 4,4 раза (р<0.05) показатели здоровых доноров.
Таким образом, использование Реамберина в комплексной терапии поражений нейротоксическими ядами приводило к снижению интенсивности протекания процессов ПОЛ. Возможные причины данного положительного эффекта связаны как с восстановлением пула водорастворимых антиоксидантов (ВГ является одним из основных представителей данной группы) и жирорастворимых антиоксидантов в тканях, различных органов, так и с увеличением активности ферментов антиперекисной защиты (Таблица 75).
Реамберин оказывал положительное влияние на активность ферментов антирадикальной защиты – глутатион-пероксидазы (ГП) и каталазы. На момент поступления в стационар активность ГП и каталазы в эритроцитах пациентов исследуемой группы были ниже показателей здоровых доноров на 40,5% (р<0.05) и 29,2% (р<0.05) соответственно. Данное угнетение активности ферментов, по-видимому, связано с тем, что развитие тяжелой гипоксии тканей сопровождается усиленной наработкой активных форм кислорода (АФК), наибольшее значение среди которых имеет супероксидный радикал (Sies Н., 1985; Reilly R.M. et. al., 1991), В ряде работ 46 имеются указания, что О2 может инактивировать ГП и частично ингибировать каталазу (Жуков А. А., Жиронов Г.Ф., 1988; Кулинский В.И., Колесниченко B.C., 1993; Flohe L.,1982).
Применение Реамберина в комплексной терапии отравлений нейротоксическими агентами приводило к полному или частичному восстановлению активности ферментов антиперекисной защиты. Через 12 ч после использования препарата активность ГП достоверно не отличалась от показателей здоровых доноров. Активность каталазы также повышалась на 16,1 % (р<0.05) и хотя не достигала уровня, характерного для здоровых лиц, превышала соответствующий показатель лиц, не получавших Реамберин на 22,3% (р<0.05). Необходимо отметить, что Реамберин включает в себя особую форму сукцината натрия, обладающую повышенной способностью к проникновению через мембранные структуры и утилизации. В настоящее время сукцинат натрия рядом исследователей относят к препаратам, обладающим антиоксидантной активностью [Reilly P.M. et al., 1991; Ваизов В.Х. с соавт., 1994; Онуфриев М.В. с соавт., 1994; Сергеев П.В. с соавт., 1991; Ray S.D. et al., 1994), тем не менее эта активность связывается только с прямым действием сукцината – антигипоксическим и антиишемическим. Действительно, Реамберин стимулирует потребление кислорода и повышение восстановительного потенциала клетки. Но, как видно из таблицы, в результате применения данного препарата идет активация и высокомолекулярного – ферментативного звена антиоксидантной системы. Причем механизмы повышения активности каталазы и глутатион-пероксидазы под воздействием производных янтарной кислоты отличаются.
Восстановление активности каталазы (представителя тиол-зависимых ферментов) объясняется участием сукцината в поддержании тиол-дисульфидного равновесия в клетке (Liu Н., Кеhler J.P., 1996, Wang S.T. et al., 1996). В таблице № 14 представлено влияние Реамберина на динамику изменений концентрации белковых тиолов в эритроцитах пациентов. Действительно, применение препарата вызывало положительную тенденцию к росту количества SH-групп, хотя достоверное их повышение по сравнению с показателями у лиц, не получавших Реамберин, отмечалось только в группе мужчин.
Механизм восстановления активности ГП, по-видимому, более сложен: во-первых, за счет повышения концентрации субстрата глутатион-пероксидазной реакции – ВГ, во-вторых, за счет восстановления селено-цистеина, входящего в активный центр данного фермента.
Таким образом, выявленные изменения свидетельствуют об антиоксидантних эффектах действия препарата Реамберин, заключающихся в снижении интенсивности протекания процессов перекисного окисления липидов, повышении содержания восстановленного глутатиона, восстановлении тиол-дисульфидного статуса клетки, повышении активности антиоксидантных ферментов (каталазы и глутатион-пероксидазы).
IV. ВЛИЯНИЕ «РЕАМБЕРИНА»
НА БИОЭЛЕКТРИЧЕСКУЮ АКТИВНОСТЬ
ГОЛОВНОГО МОЗГА
В результате проведенного исследования выявлены следующие изменения спонтанной активности головного мозга (Таблица 76).
В исходном состоянии у всех пациентов регистрировалась электрическая активность, электроэнцефалографически трактуемая как «ареактивная кома». Над всеми отделами мозга регистрировались высокоамплитудные волны дельта-диапазона. Уровень ФАМ достигал у отдельных пациентов 60%. При формировании картины отека мозга форм воли была заостренной, присутствовали единичные острые волны, что отражало повышенную судорожную готовность. Реактивность мозга оценивалась как практически отсутствовавшая. При нанесении болевых стимулов (укол тыльной стороны плеча) и при одиночной и ритмической фотостимуляции состояние ЭЭГ не изменялось. Картина электрической активности адекватно отражала во всех наблюдениях степень угнетения ЦНС.
В группе сравнения проводимая стандартная дезинтоксикационная терапия не приводила к значимым изменениям ЭЭГ-семиотики в течении выбранного для наблюдения отрезка времени. Сохранялась медленноволновая активность высокой амплитуды. Уровень межполушарной ассиметрии практически не снижался. Изменения электрической, активности в ответ на внешнюю фото- и болевую стимуляцию отсутствовали, что отражало резко сниженную реактивность головного мозга. Клинически глубина угнетения ЦНС соответствовала коме ІІ-ІІІ.
Ретроспективный анализ ЭЭГ выявил разнонаправленный характер изменений при благоприятных и смертельных исходах в ответ на введение «Реамберина». В группе с благоприятными исходами введение препарата не вызывало «пробуждающего эффекта», тем не менее происходили изменения электрической активности мозга: уменьшалась доля дельта-волн, снижалась амплитуда ЭЭГ. При повторном исследовании регистрировалась альфа-активность, которая практически отсутствовала в исходном состоянии. Уровень межполушарной асимметрии снижался до 25%, что косвенно отражало тенденцию к восстановлению интегративной работы полушарий и, следовательно, уменьшение глубины угнетения ЦНС. Внешняя болевая стимуляция и одиночные вспышки света у половины пациентов вызывала отчетливую реакцию перестройки ЭЭГ. При ритмической фотостимуляции реакция усвоения формировалась в ответ на низкую частоту следования стимулов в диапазоне от 2 до 6 Гц.
Анализ ЭЭГ пациентов, у которых наступил смертельный исход, позволяет предположить, что в данной подгруппе поражение ЦНС было более грубым. Об этом свидетельствует крайне высокая средняя амплитуда ЭЭГ, низкая частота доминирующей дельта-активности (около 0.3-0.5 Гц). 49 при введении «реамберина» уровень медленных волн значимо не изменялся. Обращало на себя формирование бета-активности, что могло быть проявлением терминальных нарушений в корковых отделах мозга. Тем не менее, даже на таком фоне реактивность мозга в отдельных наблюдениях существенно возрастала: формировалась не только реакция перестройки ЭЭГ, но и реакция усвоения ритма. Существенно снижался уровень ассиметрии мозга. Время сохранения выявленных изменений было индивидуальным, вариабельность определялась в переделах 10-24 ч с момента введения препарата.
Лишь в одном наблюдении введение «Реамберина» не сопровождалось изменениями ЭЭГ (пациент Л., и/б № 8535). Исходная семиотика ЭЭГ у данного пациента позволяла трактовать степень поражения ЦНС как «терминальная кома». Над всеми отделами мозга на фоне дельта-волн заостренной формы очень высокой амплитуды (180-200 мкВ) доминирующей частотой около 0.1 Гц периодически возникали эпизоды «электрического молчания» длительностью до 7-10 с., внешняя стимуляция перестройки ЭЭГ не вызывала. Летальний исход наступил на 6 сут. Вероятно, отсутствие эффекта от введения «Реамберина» у данного пациента может быть объяснено чрезмерным повреждением Мозга на момент поступления. Таким образом, введение «Реамберина» вызывает изменения электрической активности головного мозга у лиц с острыми тяжелыми отравлениями нейротоксикантами. Выявленная перестройка ЭЭГ отражает уменьшение глубины угнетения ЦНС, значительное улучшение реактивности мозга. Скорость восстановления функциональной активности мозга при введении в комплексное лечение «Реамберина» существенно превосходит скорость восстановления при стандартной дезинтоксикационной терапии.
ЗАКЛЮЧЕНИЕ
По мнению ряда авторов, тяжесть состояния больных, находящихся в критическом состоянии обусловлена расстройствами метаболизма в связи с дефицитом кислорода, интоксикационными расстройствами функций органов и глобальным иммунологическим конфликтом в организме, те есть механизмами, определяющими танатогенез (Рябов Г.А., 1988); Это же положение справедливо и для больных реанимационного профиля с острыми;* тяжелыми отравлениями, следует добавить лишь, что к вышеперечисленным нарушениям здесь присоединяются и специфические механизмы действия токсического вещества /(Ливанов Г.А. с соавт., 2000). Разработка новых лекарственных препаратов для такого контингента больных, действующих универсально, на все звенья развития патологического процесса представляет в настоящее время наиболее актуальную задачу. Появление на отечественном рынке препаратов на основе янтарной кислоты в определенной мере отвечает этим требованиям. Немаловажным фактам их использования в повседневной реаниматологической практике является и относительная дешевизна этих препаратов.
В настоящей работе были исследованы эффекты препарата на основные звенья, обуславливающие тяжесть состояния больных в критическом состоянии, то есть на гипоксию и эндотоксикоз при острых тяжелых отравлениях нейротоксическими ядами с учетом их специфического действия, то есть на фоне глубоких поражений центральной нервной системы с нарушением ее регулирующей функции витальных органов и систем.
В ходе проведения работы были выявлены многочисленные эффекты "Реамберина", касающиеся практически всех звеньев патологического процесса. При исследовании биоэлектрической активности головного мозга при использовании "Реамберина" в программе интенсивной терапии больных были выявлены изменения, отражающие уменьшение глубины угнетения центральной нервной системы и значительное улучшение реактивности мозга* увеличивалась скорость восстановления функциональной активности мозга, существенно превосходящую при стандартной интенсивной терапии. Данные электроэнцефалографии согласовались с клиническим течением острых отравлений. При включении в интенсивную терапию "Реамберина" достоверно уменьшалось время пребывания больных в коматозном состоянии, время проведения искусственной вентиляции легких. Более быстрое восстановление регулирующей функции головного мозга не могло не сказаться и на результатах лечения данной категории больных. Сокращалось время пребывания больных в реанимационном отделении, то есть был более быстрый выход из угрожающего для жизни состояния, так же достоверно снижалась и летальность.
При исследовании показателей транспорта кислорода были выявлены нарушения респираторного, объемного и тканевого компонентов. При использовании "Реамберина" отмечались более существенные положительные изменения в динамике данных показателей. В респираторном компоненте уменьшалась доля функционального мертвого пространства к дыхательному объему, нормализовалось вентиляционно-перфузионное соотношение, улучшались показатели, отражающие диффузионные и перфузионные нарушения легких. Все вызванные изменения вели в конечном счете к уменьшению доли легочного шунтирования и повышению парциального напряжения кислорода в артериальной крови. Нормализацию показателей респираторного компонента мы склонны связывать с несколькими механизмами действия "Реамберина". Во-первых, как нормализацию метаболизма в легочной ткани, где препарат выступает как энергосубстрат при существенном дефиците энергии связанном с гипоксией. Во-вторых, нормализация вентиляционных и диффузионных показателей в значительной мере может быть связана с улучшением состояния поверхностно-активных веществ легких, так как эта система наиболее подвержена повреждениям при кислородном голодании. В-третьих, антиоксидантные эффекты "Реамберина" позволяют защитить легочную ткань от повреждений, связанных с активацией перекисного окисления липидов при "реоксигенации" тканей. В-четвертых, выявленное действие "Реамберина" на снижение уровня эндотоксемии и восстановление детоксицирующих систем организма позволяет снизить метаболическую нагрузку на легкие, что проявляется в дальнейшем улучшением как не дыхательных, так и газообменных функций.
Были выявлены эффекты "Реамберина" и на объемный компонент транспорта кислорода. При поступлении у, всех больных отмечалось развитие гиперкинетического типа центральной гемодинамики на гипоксию.
При использовании "Реамберина" была отмечена перестройка гиперкинетического типа на нормокинетический тип центрального кровообращения, являющийся следствием уменьшения кислородной задолженности тканям. Снятие напряжения центральной гемодинамики является еще одним из показателей механизмов действия "Реамберина" на стабилизацию энергетического статуса организма в условиях кислородного голодания.
Известно, что в условиях гипоксии нарушение гомеостаза клетки приводит к ухудшению утилизации кислорода, связанной с внутриклеточными нарушениями кислотно-основного состояния, снижением" системы антирадикальной защиты и активации перекисного окисления липидов, ферментативного звена и др. Наиболее четко эффективность препарата проявились на уровне тканевого компонента транспорта кислорода и кислородного баланса организма. Отмечалось достоверное увеличение коэффициента утилизации кислорода, как показателя отражающего реальную доставку кислорода к тканям и его расходование в них, увеличение потребления и коэффициента использования кислорода. Данные изменения свидетельствуют о том, что "Реамберин" оказывает не только энергостабилизирующее действие на уровне ткани, но и повышает утилизацию кислорода в условиях тканевой гипоксии.
Следующим этапом исследования была оценка влияния "Реамберина" на течение эндогенной интоксикации при острых отравлениях нейротоксическими ядами. Установлено, что одним из ведущих факторов формирования эндотоксикоза при отравлениях, помимо прямого цитотоксического действия яда, является развитие гипоксии. Были выявлены положительные эффекты при включении в программу интенсивной терапии "Реамберина". Наблюдалось достоверно более быстрое снижение факторов вторичной аутоагрессии в венозной и артериальной крови из группы веществ низкой и средней молекулярной массы и олигопептидов, снижение положительной артериовенозной разницы по маркерам токсемии, что является свидетельством восстановления метаболических функций легких. Наиболее максимальные значения факторов эндотоксемии при острых отравлениях нейротоксическими ядами отмечается на 3-4 сутки нахождения больных в стационаре, этот факт подтверждают показатели контрольной группы больных. Максимального повышения маркеров токсемии на 3-4 сутки при применении "Реамберина" отмечено не было.
Выявлено положительное влияние "Реамберина" на состояние естественных детоксицирующих систем организма, проявившееся в стабилизации показателей, отражающих функциональное состояние функции печени и почек с достоверными отличиями от контрольной группы.
Одним из факторов эндотоксикоза и нарушения гомеостаза при патологических состояниях является активация перекисного окисления липидов и нарушение состояния системы глутатиона, как ведущей составляющей системы антирадикальной и антиперекисной защиты. Отмечены антиоксидантные эффекты действия препарата "Реамберин", заключающиеся в снижении интенсивности протекания процессов перекисного окисления липидов, повышении содержания восстановленного глутатиона, восстановлении тиол-дисульфидного статуса клетки и повышение активности антиоксидантних ферментов (каталазы и глутатион-пероксидазы). Вызванные изменения являлись результатом нормализации функционирования клеточных мембран, повышения адаптации организма к экстремальному воздействию гипоксии и еще одним фактором снижения проявления эндогенной интоксикации при применении "Реамберина".
Одним из ведущих факторов развития эндотоксикоза при острых отравлениях являются гипоксические повреждения органов и систем. Препараты, относящиеся к группе метаболических антигипоксантов, в том числе и "Реамберин" можно отнести к этиопатогенетическим средствам лечения эндотоксикоза при острых отравлениях нейротоксическими ядами.
Учитывая, что успех в лечении эндотоксикоза зависит от комплексной программы лечения, состоящей из 4 главных направлений: реабилитации естественных детоксицирующих систем, устранения тканевой гипоксии, восстановления тканевого и системного метаболизма, элиминации токсических продуктов из внутренних сред организма, включение в интенсивную терапию "Реамберина" на основе механизмов его действия было бы наиболее целесообразным не только в токсикологической практике, но и в медицине критических состояний вообще.
ВЫВОДЫ
"Реамберин" хорошо переносится больными находящимися в критическом состоянии с острыми тяжелыми отравлениями. Осложнений во время и после инфузии препарата отмечено не было.
Применение "Реамберина" в программе интенсивной терапии у больных в критическом состоянии с острыми и тяжелыми отравлениями нейротоксическими ядами ведет к уменьшению длительности коматозного состояния, сокращению времени проведения искусственной вентиляции легких, снижению сроков пребывания больных в реанимационном отделении и уменьшению общей летальности.
Использование "Реамберина" в программе интенсивной терапии у больных с острыми тяжелыми отравлениями нейротоксическими ядами способствовало резкому уменьшению нарушений транспорта кислорода в респираторном, объемном, тканевом компоненте и показателях кислородного баланса организма.
Инфузия "Реамберина" вызывает изменения электрической активности головного мозга у лиц с острыми тяжелыми отравлениями нейротоксическими ядами. Выявленная перестройка электроэнцефалограммы отражает уменьшение глубины угнетения центральной нервной системы, значительное улучшение реактивности мозга. Скорость восстановления функциональной активности мозга при введении в комплексное лечение "Реамберина" существенно превосходит скорость восстановления при стандартной методике.
"Реамберин" оказывает антиоксидантное действие, заключающееся в снижении интенсивности протекания процессов перекисного окисления липидов, повышение содержания восстановленного глутатиона, восстановлении тиол-дисульфидного статуса клетки, повышении активности антиоксидантних ферментов (каталазы и глутатион-пероксидазы).
Включение препарата "Реамберин" в программу интенсивной терапии у больных с острыми тяжелыми отравлениями нейротоксическими ядами позволило снизить проявления эндотоксикоза. за счет уменьшения тканевой гипоксии, реабилитации систем естественной детоксикации, восстановления тканевого и системного метаболизма и элиминации токсических продуктов из внутренних сред организма.
Учитывая антигипоксантные, антиоксидантные, дезинтоксикационные и восстанавливающее действие препарата на центральную нервную систему "Реамберин" может быть рекомендован как потенциальное средство лечения острых отравлений нейротоксическими ядами.
ИЗУЧЕНИЕ ЭФФЕКТИВНОСТИ РЕАМБЕРИНА
В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ
У БОЛЬНЫХ С ДЕГЕНЕРАТИВНО-
ДИСТРОФИЧЕСКИМИ ПОРАЖЕНИЯМИ СУСТАВОВ
В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ
У БОЛЬНЫХ С ДЕГЕНЕРАТИВНО-
ДИСТРОФИЧЕСКИМИ ПОРАЖЕНИЯМИ СУСТАВОВ
Согласно данным, приведенным в отечественной и зарубежной литературе, от 3% до 12% взрослого населения страдают теми или иными формами поражений суставов (Косинская Н.С., 1963; Волков М.В., Оганесян О.В., 1974; Шапиро К.И., 1981, 1987; Keyes, 1933; Harris et. al., 1970). При этом особенно часто поражаются крупные суставы. М.М. Дворкиным (1966) установлено, что примерно одну треть ортопедических больных составляют пациенты с деформирующими артрозами. При дегенеративно-дистрофических заболеваниях суставов сопровождающихся временной утратой трудоспособности, чаще всего поражается коленный сустав (Шапиро К.И. с соавт., 1992) .Прогрессирование этой патологии в течениие 10-12 лет нередко приводило к инвалидности (Шапиро К.И. с соавт., 1987; Левенец В.Н., с соавт., 1989, Корнилов Н.В. с соавт., 1992).
У большинства пациентов с поражением коленного сустава, диагностируются сопутствующие заболевания такие как гипертоническая болезнь I или II ст., ишемическая болезнь сердца, атеросклеротический кардиосклероз, недостаточность кровообращения I или II, ожирение I, II или III, сахарный диабет, мочекаменная болезнь, желчекаменная болезнь, хронический бронхит, аденома простаты, заболевания женской половой сферы. Коррекция которых требовала предоперационной подготовки. Предоперационная подготовка была направлена на нормализацию клинических и лабораторных параметров измененных вследствие проявлений сопутствующей патологии (Каземирский А.В.,1999).
В настоящее время при патологии коленного сустава приобретают все более широкое распространение такие методы оперативного лечения как околосуставные остеотомии бедренной и большеберцовой костей, артропластика и эндопротезирование (Корнилова Н.В. с соавт., 1992).
Эти операции связаны со значительной продолжительностью и травматичностью, сопровождаются большой кровопотерей во время вмешательства и в раннем послеоперационном периоде. Массивная кровопотеря приводит к снижению кислородной емкости крови, гиповолемии, угнетению дыхания, гипоксии тканей, ацидемии, эндоинтоксикации (Тюкавин А.И., 1991). В организме накапливается одноатомный кислород, вызывающий нарушения в системе перекисного окисления липидов в мембранах митохондрий, что приводит к изменениям проницаемости мембран и гибели клеток (Маzzonі М.С. 1990).
Гипоксия тканей сопровождается нарушением окислительного фосфорилирования, снижая синтез макроэргов (АТФ, креатинфосфата) (Shoemaker W., Kram N., 1988), поэтому важное значение в раннем послеоперационном периоде имеет коррекция расстройств микроциркуляции крови. Нарушения перфузии и обмена веществ на уровне микроциркуляции, не сразу проявляются клинически и, несмотря на нормализацию системных гемодинамических параметров могут иметь место (Deitch E.A., Bridges W., Ma L., 1990).
В экспериментах показано увеличение скорости захвата клетками кальция из инкубационной среды в присутствии янтарной кислоты или ее метиловых эфиров (Софронов Г. А. 1998) .Повышение усвояемости железа в присутствии сукцината натрия обусловлено образованием хорошо растворимых в воде и устойчивых к щелочному гидролизу комплексов железа с лигандами янтарной кислоты. Поскольку янтарная кислота необходима для синтеза порферинов, она является важным компонентом реализации противоанемического эффекта препаратов железа (Ивницкий Ю.Ю., Головко А. И., 1998).
Все выше перечисленные свойства янтарной кислоты и препарата, Реамберин; на ее основе, являлись основанием для применения его в раннем послеоперационном периоде у больных с ортопедической патологией.
Целью работы являлось изучение эффективности применения препарата Реамберин, у больных после хирургических вмешательств на коленном суставе в раннем послеоперационном периоде.
Задачи исследования.
- Изучить после операций на коленном суставе, дезинтоксикационное, антигипоксическое, реологическое действие препарата Реамберин.
- Определить показания для применения препарата Реамберин в послеоперационном периоде.
- Установить переносимость Реамберина, и наличие противопоказаний для его использования.
- Привести сравнительный анализ результатов применения препарата Реамберин и традиционной инфузионной терапии в раннем послеоперационном периоде у больных с патологией коленного сустава.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клиническое обследование больных заключалось в уточнении характера жалоб больного, подробном выяснении анамнеза жизни и заболевания. Клинические данные объективного осмотра также включали оценку общего состояния функции органов и систем. Антропометрические данные позволяли установить конституционные особенности пациентов, наличие избыточного веса. Учитывали двигательный режим, результаты ортопедического осмотра по общепринятой методике (Марко В.О., 1978).
Для объективной оценки функции коленного сустава до операции и после оперативного вмешательства нами использовалась 100-бальная шкала (Joseph et Kaufman, 1990), включающая в себя оценку следующих параметров боль (50 баллов), функция (24 балла), амплитуда движений в суставе (14 балов), деформация конечности (5 баллов), мышечная сила (3 балла), стабильность сустава (4 балла) (табл. 77)
При отсутствии патологии коленный сустав оценивается в 100 баллов, количество баллов уменьшается в зависимости от степени выраженности клинических проявлений дегенеративно-деструктивного поражения сустава.
Таблица 77. 100-балльная оценка функции коленного сустава
БОЛЬ (50 баллов)
|
Ходьба: |
|
|
нет боли |
35 |
|
незначительная |
30 |
|
выраженная |
10 |
|
делающая ходьбу невозможной |
0 |
|
В покое: |
|
|
нет боли |
15 |
|
незначительная |
10 |
|
умеренная |
5 |
|
сильная |
0 |
ФУНКЦИЯ (24 балла)
|
Дистанция ходьбы |
|
|
За пределами квартиры не ограничена |
6 |
|
За пределами квартиры ограничена |
4 |
|
только по квартире |
1 |
|
не способен к ходьбе |
0 |
|
Ходьба по лестнице |
|
|
Нормальная вверх и вниз с опорой или без опоры за перила |
6 |
|
шаг на ступеньку во время опоры на перила |
4 |
|
на одну ступеньку во время опоры на перила с доп. подтягиванием за них |
0 |
|
Подъем со стула |
|
|
может подняться без помощи |
6 |
|
может подняться с дополнительной опорой на одну или обе руки |
4 |
|
поднимается с трудом при помощи рук |
3 |
|
подъем при помощи другого человека |
1 |
|
не может подняться даже с чьей-либо помощью |
0 |
|
Дополнительная опора при ходьбе |
|
|
Нет |
6 |
|
трость иногда (от случая к случаю) |
5 |
|
один костьшь или трость постоянно |
3 |
|
Два костыля или не способен ходить |
1 |
|
АМПЛИТУДА ДВИЖЕНИЙ (14 балов) |
|
|
Активные и пассивные движения по 7 баллов |
|
|
110 градусов и больше |
7 |
|
100-109 градусов |
6 |
|
90-99 градусов |
5 |
|
70-89 градусов |
3 |
|
70 градусов и меньше |
0 |
|
ДЕФОРМАЦИЯ (5 баллов) |
|
|
0-5 градусов |
5 |
|
6-15 градусов |
3 |
|
15 градусов и больше |
0 |
|
МЫШЕЧНАЯ СИЛА (3 балла) |
|
|
нельзя преодолеть сопротивление четырехглавой мышцы |
3 |
|
можно преодолеть сопротивление четырехглавой мышцы |
2 |
|
может совершать активные движения по всей возможной амплитуде |
1 |
|
не может совершать активных движений по всей амплитуде |
0 |
|
НЕСТАБИЛЬНОСТЬ БОКОВЫХ СВЯЗОК (3 балла) |
|
|
нет фронтальной нестабильности |
3 |
|
небольшая (менее 5-ти градусов) |
2 |
|
умеренная (5- 15 градусов) |
1 |
|
Выраженная (более 15 градусов) |
0 |
|
ПЕРЕДНЕ-ЗАДНЯЯ СТАБИЛЬНОСТЬ (1 балл) |
|
|
стабильный сустав |
1 |
|
нестабильный сустав |
0 |
|
ВСЕГО БАЛЛОВ |
100 |
Лабораторное и инструментальное обследование больных включало клинические анализы крови и мочи, определение биохимических параметров сыворотки крови и мочи, определение биохимических параметров сыворотки крови, НСТ-тест (функциональная активность моноцитов), лейкоцитарный индекс интоксикации, ядерный индекс сдвига нейтрофилов, электрокардиографию.
Ренгенологическое исследование включало рентгенограммы коленного сустава, нижней трети бедренной и верхней трети большеберцовой костей в двух стандартных проекциях, рентгенограмму коленного сустава в аксиальной проекции.
По рентгенограммам судили о стадии деструктивного процесса, состоянии костной ткани, взаимоотношении суставных поверхностей бедренной и большеберцовой костей и ширине их костномозговых каналов.
По рентгенограмме коленного сустава в аксиальной проекции судили о стадии дегенеративного процесса в феморо-пателлярном сочленении (переднем отделе коленного сустава) и наличии подвывиха надколенника.
В результате комплексного обследования формировался диагноз, ставили показания к оптимальному способу оперативного лечения для каждого больного.
При статистической обработке данных, полученных в результате клинических исследований, проводили вычисления следующих показателей:
М – среднее значение величины вариационного ряда;
m – величина ошибки среднего значения;
n – количество наблюдений;
t – критерий достоверности;
р – уровень вероятности.
Полученные цифровые данные обрабатывали методом непараметрической статистики (Власов В.В. 1988). Результаты или их различие считали достоверным при значениях р<0,05, которое принято в медико-биологических исследованиях (Гублер Е.В. 1978)
Клинические исследования включают анализ результатов обследования и лечения больных с дегенеративно-дистрофическими поражениями коленного сустава.
Пациенты опытной и контрольной групп были идентичны по полу, возрасту и наличию сопутствующих заболеваний, по характеру ортопедической патологии, способу оперативного вмешательства.
В основной группе 31 больному в послеоперационном периоде назначили внутривенное введение Реамберина. Все больные были госпитализированы в отделение эксперементально-клинической хирургии института в 1998-1999г.
Контрольная группа включает 25 больных, которым в послеоперационном периоде проводили стандартную инфузионную терапию.
Реамберин принимают внутривенно капельно в суточной дозе до 2-х литров раствора. Скорость введения и дозировку препарата определяют в соответствии с состоянием больного.
Мы вводили 400мл 1,5% раствора Реамберина внутривенно капельно в течение 1-1,5 часов ежедневно в течении четырёх-восьми дней после операций. Инфузионную терапию сочетали с приемом антикоагулянтов (гепарина, фенилин), нестероидных противовоспалительных средств (аспирин, анальгин, кетонал и т. д), антибиотиков (гентамицин, ампиокс), препаратов улучшающих кроветворение (ферроградумёт, феррумлек й т.д.), витамины групп В, Д, С, (липостабил, а также препаратов, направлених на коррекцию сопутствующей соматической патологии.
В контрольной группе использовали изотонический раствор хлорида натрия, глюкоза, гемодез, полиглюкин, рефортан, мафусел, дисолъ.
Среди пациентов основной группы было 13 (41,9%) мужчин (средний возраст 50 лет) и 18 (58, 1%) женщин (средний возраст 54 года) в возрасте от 16 до 68 лет (табл. № 78).
Преобладали больные трудоспособного возраста 22 (71%) человека, из них работали 18 (59%) человек.
Таблица 78. Распределение больных основной группы по полу и возрасту
|
Возраст |
Количество больных |
||
|
Мужчин, |
Женщин, |
Всего |
|
|
16-30 |
1 |
2 |
3 |
|
31-40 |
2 |
3 |
5 |
|
41-50 |
2 |
3 |
5 |
|
51-60 |
5 |
4 |
9 |
|
61-70 и старше |
3 |
6 |
9 |
|
Всего |
13 (41,9%) |
18 (58,1%) |
31 (100%) |
Среди пациентов контрольной группы, было 10 (40%) мужчин (средний возраст 51 год) и 15 (60%) женщин (средний возраст 53 года) в возрасте от 16 до 69 лет (табл. №79). Преобладали больные 20 (80%) трудоспособного возраста, из них у 15 (60%) отмечалась стойкая утрата трудоспособности и старше 60 лет – 5 (20%) человек,
Таблица № 79. Распределение больных контрольной группы
по полу и возрасту.
|
Возраст |
Количество больных |
||
|
Мужчин, |
Женщин, |
Всего |
|
|
16-30 |
– |
2 |
2 |
|
31-40 |
2 |
3 |
5 |
|
41-50 |
3 |
4 |
7 |
|
51-60 |
3 |
3 |
6 |
|
61-70 и старше |
2 |
3 |
5 |
|
Всего |
10(40%) |
15 (60%) |
25 (100%) |
Исходя из представленных данных, следует подчеркнуть, что хотя дегенеративно-дистрофические заболевания коленного сустава чаше встречаются у пожилых больных, они не так редки у трудоспособного возраста.
Для оценки тяжести дегенеративно-дистрофического процесса коленного сустава пользовались классификационной схемой Н.С. Косинской (1961), базирующейся на клинико-рентгенологических данных. Большинство больных были госпитализированы при далеко зашедшем, наиболее тяжелом деструктивном процессе (табл. № 80, 81)
Таблица 80. Распределение больных основной группы по
тяжести
дегенеративно-дистрофического поражения коленного сустава
|
Стадия заболевания |
Абс. |
Количество больных % |
|
Первая |
- |
- |
|
Вторая |
10 |
32,2 |
|
Третья |
21 |
67,8 |
|
Всего больных |
31 |
100,0 |
Таблица 81. Распределение больных контрольной группы
по тяжести дегенеративно-дистрофического
поражения коленного
сустава
|
Стадия заболевания |
Абс. |
Количество больных % |
|
Первая |
- |
- |
|
Всего больных |
25 |
100,0 |
В основной группе пациентов произведены следующие операции: тотальное эндопротезирование коленного сустава шарнирным металлополимерным эндопротезом "Феникс" 12 больных, тотальное реэндопротезирование коленного сустава шарнирным металлополимерным эндопротезом "Феникс" 4 больных, тотальное эндопротезирование коленного сустава несвязанным металлополимерным эндопротезом "Biomet-AGG" 8 больным, подмыщелковая остеотомия большеберцовой кости с фиксацией конструкциями из никелида титана (металл с памятью Формы) 7 больным.
Тотальное эндопротезирование коленного сустава металлополимерным эндопротезом "Феникс" 12 больных, анестезиологическое пособие заключалось в эпидуральной анестезии и управляемой гемодилюции, продолжительность операции б среднем составила 100 минут, средняя кровопотеря в период операции и раннем послеоперационном периоде составила 1350 мл.
Тотальное реэндопротезирование коленного сустава шарнирным металлополимерным эндопротезом, Феникс, 4 больных, анестезиологическое пособие заключалось в эпидуральной анестезии и управляемой гемодилюции, продолжительность операции в среднем составила 130 минут, средняя кровопотеря в период операции и раннем послеоперационном периоде составила 2100 мл.
Тотальное эндопротезирование коленного сустава несвязанным металлополимерным эндопротезом, Biomet-AGC, 8 больных, анестезиологическое пособие заключалось в эпидуральной анестезии и управляемой гемодилюции, продолжительность операции в среднем составила 80 минут, средняя кровопотеря в период операции и раннем послеоперационном периоде составила 650 мл.
Подмышеловковая остеотомия большеберцовой кости с фиксацией конструкциями из никелида титана (металл с памятью формы) 7 больных, анестезиологическое пособие заключалось в проводниковой анестезии, внутривенном наркозе и управляемой гемодилюции, продолжительность операции в среднем составила 90минут, средняя кровопотеря в период операции и раннем послеоперационном периода составила 1200 мл
В контрольной группе пациентов произведены следующие операции тотальное эндопротезирование коленного сустава шарнирным металлополимерным эндопротезом Феникс, 11 больных, тотальное реэндопротезирование коленного сустава шарнирным металлополимерным эндопротезом Феникс, 3 больных, тотальное эндопротезирование коленного сустава несвязанным металлополимерным эндопротезом Biomet-AGC, 9 больных подмышелковая остеотомия большеберцовой кости с фиксацией конструкциями из никелида титана (металл с памятью формы) 3 больных.
Тотальное реэндопротезирование коленного сустава шарнирным металлополимерным эндопротезом Феникс, 11 больных, анестезиологическое пособие заключалось в эпидуральной анестезии и управляемой гемодилюции, продолжительность операции в среднем составила 95 минут, средняя кровопотеря в период операции и раннем послеоперационном периоде составила 1200 мл
Тотальное реэндопротезирование коленного сустава шарнирным металлополимерным эндопротезом Феникс 3 больных, анастезиологическое пособие заключалось в эпидуральной анестезии и управляемой гемодилюции, продолжительность операции в среднем составила 135 минут, средняя кровопотеря в период операции и раннем послеоперационном периоде составила 2000 мл.
Тотальное эндопротезирование коленного сустава несвязанным металлополимерным эндопротезом Biomet-AGC, 9 больных анестезиологическое пособие заключалось в эпидуральной анестезии и управляемой гемодилюции, продолжительность операции в среднем составила 85 минут, средняя кровопотеря в период операции и раннем послеоперационном периоде составила 600 мл.
Подмышелковая остиотомия большеберцовой кости с фиксацией конструкциями из никелида титана (металл с памятью формы)3 больных анестезиологическое пособие заключалось в проведении анестезии, внутривенном наркозе и управляемой гемодилюции продолжительность операции в среднем составила 95 минут средняя кровопотеря в период операции и раннем послеоперационном периоде составила 1250 мл. Для оценки эффективности препарата Реамберин в группы исследования включены больные перенесшие операции на коленном суставе.
Для оценки эффективности препарат Реамберин в группы исследования включены больные перенесшие операцию на коленном суставе.
Применение Реамберина показано после операций на коленном суставе, включая следующие эндопротезирование и реэндопротезирование, артропластика, корригирующие остеотомии, ауто и аллотендопластики связок, мобилизирующие операции.
Операции, сопровождающиеся гипоксическим состоянием, массивными кровопотерями во время операции и раннем послеоперационном периоде, с применением наркоза, с применением костного цемента, наличие острой сердечной и/или дыхательной недостаточностью, нарушением водно-электролитного баланса, нарушением кислотно-щелочного равновесия.
Проведено сравнение препарата, Реамберин, с традиционно применяемыми инфузионными растворами на основе лабораторных данных, включающих (клинический анализ крови, биохимический анализ крови общий анализ мочи, протромбиновый индекс. протромбиновое время время образования сгустка крови, НСТ-тест (функциональная активность моноцитов), лейкоцитарный индекс интоксикации, ядерный индекс сдвига нейтрофилов.
Комплексное клинико-лабороторное исследование проведено в основной и контрольной группах в следующие сроки накануне операции, на 1 сутки послеоперационного периода до введения препарата и на 10-12 сутки после проведения курса инфузионной терапии Реамберином на 15-17 сутки после проведения стандартной инфузионной терапии-. Результаты клинико-лабораторного исследования были занесены в специальные медицинские карты наблюдения .
Перед тем, как рассмотреть каждый из этапов в отдельности, отметим, что для проведения статистического анализа показателей, полученных в ходе исследования, использовался статистический пакет «STATGRAPHICS Plus for Windows».
Статистические показатели количества эритроцитов с использованием Реамберина, использованы две точки исследования: первая показатели после операции, вторая после проведения коррекции гомеостаза на 10-12 день
|
Эритроциты после операции |
Эритроциты через |
|
|
число наблюдений |
31 |
31 |
|
ср. арифметическое |
3, 45 |
3, 67857 |
|
медиана |
3, 45 |
3, 6 |
|
мода |
3, 3 |
3, 6 |
|
дисперсия |
0, 147308 |
0, 067967 |
|
станд. отклонение |
0, 383807 |
0, 260705 |
|
станд. ошибка |
0, 102577 |
0, 0696763 |
Используя для статистической обработки t-критерий и р=0,05 уровень вероятности принятый для медицинской статистики, можно сказать что, число эритроцитов увеличивается после использования Реамберина в среднем на 0.22, хотя статистически достоверного отличия при t=-1,84327 и Р=0,07305 между двумя выборками не получено.
Статистические показатели количества эритроцитов
при стандартной терапии
|
Эритроциты после операции |
Эритроциты после |
|
|
Число наблюдений |
25 |
25 |
|
Ср. арифметическое |
3,54167 |
3,56667 |
|
Медиана |
3,3 |
3,55 |
|
Мода |
3,4 |
3,6 |
|
Дисперсия |
0,291742 |
0,0715152 |
|
Станд. отклонение |
0,540132 |
0,267423 |
|
Станд. ошибка |
0,155923 |
0,0771984 |
При t=-0,143689 Р=0,4435 нет статистически значимых отличий с достоверностью 95% между двумя выборками, абсолютные значения показателей эритроцитов при стандартной терапии увеличиваются меньше, чем в опытной группе пациентов.
Статистические показатели исследования гемоглобина
при применении Реамберина
|
Гемоглобин |
Гемоглобин |
||
|
Число наблюдений |
31 |
31 |
|
|
Ср. арифметическое |
99,1429 |
106,643 |
|
|
Медиана |
103,5 |
103,5 |
|
|
Мода |
86,0 |
102,0 |
|
|
Дисперсия |
245,67 |
198,863 |
|
|
Станд. отклонение |
15,6739 |
14,1019 |
|
|
Станд. ошибка |
4,18902 |
3,76888 |
|
При t=-1,33099 Р=0,04556 есть достоверно статистические отличия между двумя выборками, абсолютные показатели гемоглобина увеличиваются в среднем на 7 единиц после 10-12 дней.
Статистические показатели гемоглобина
при стандартной инфузионной терапии
|
Гемоглобин после операции |
Гемоглобин |
|
|
Число наблюдений |
25 |
25 |
|
Ср. арифметическое |
99,0 |
99,25 |
|
Медиана |
95,5 |
100,0 |
|
Мода |
149,818 |
97,4773 |
|
Станд. отклонение |
12,24 |
9,87306 |
|
Станд. ошибка |
3,53339 |
2,85011 |
При t=-0,0550709 Р=0,0758 нет достоверно значимого различия между двумя выборками, абсолютные показатели гемоглобина ниже после коррекции гомеостаза на 15-17 день, чем в опытной группе пациентов на 10-12 день.
Статистические показатели-лейкоцитарного индекса
интоксикации
после применения Реамберина
|
ЛИИ |
ЛИИ |
|
|
Число наблюдений |
31 |
31 |
|
Ср. арифметическое |
2,98357 |
1,47929 |
|
Медиана |
2,95 |
1,45 |
|
Мода |
3, 3 |
2,7 |
|
Дисперсия: |
1,01701 |
0,276561 |
|
Станд. отклонение |
1,00847 |
0,525891 |
|
Станд. ошибка |
0,269525 |
0,14055 |
При t=4, 94879 Р=0, 0545 есть достоверно на 95% значимое отличие между двумя выборками при использовании Реамберина. Абсолютные значения показателей лейкоцитарного индекса интоксикации на 10-12 день становятся меньше в два раза.
График функции распределения
Статистические показатели при стандартной терапии
|
Белок |
Белок |
|
|
Число наблюдений |
25 |
25 |
|
Ср. арифметическое |
55,4 |
62,175 |
|
Медиана |
56,9 |
63,0 |
|
Мода |
50,0 |
64,0 |
|
Дисперсия |
42,2473 |
30,433 |
|
Станд. отклонение |
6,49979 |
5,51661 |
|
Станд. ошибка |
1,87633 |
1,59251 |
При t=-2,75291 Р=0,005891 можно с достоверностью 95% сказать, что есть достоверно значимые отличия между двумя выборками. Однако, абсолютные показатели белка значительно ниже через 15-17 дней, чем в опытной группе пациентов через 10-12 дней.
Статистические показатели креатинина после применения Реамберина
|
|
Креатинин |
Креатинин |
|
Число наблюдений |
31 |
31 |
|
Ср. арифметическое |
103,669 |
91,55 |
|
Медиана |
90,0 |
87,75 |
|
Мода |
90,0 |
89,0 |
|
Дисперсия |
3607,68 |
1872,76 |
|
Станд. отклонение |
60,0639 |
43,2754 |
|
Станд. ошибка |
16,0528 |
11,5658 |
При t=0,612538, Р=О,2727 нет статистически достоверного отличия между двумя выборками, так как р>0,05. Однако абсолютные значения креатинина через 10-12 дней снижаются в среднем на 12 ммоль/л.
Статистические показатели значений креатинина
после стандартной терапии
|
Креатинин |
Креатинин |
|
|
Число наблюдений |
25 |
25 |
|
Ср. арифметическое |
92,925 |
81,325 |
|
Медиана |
96,0 |
85,0 |
|
Мода |
100,0 |
84,0 |
|
Дисперсия |
418,031 |
221,824 |
|
Станд. отклонение |
20,4458 |
14,8938 |
|
Станд. ошибка |
5,9022 |
4,29946 |
При t-1,58858 Р=0,0638 можно с достоверностью 95% сказать, что нет достоверно значимые отличия между двумя выборками, так как р>0,05. Абсолютные значения показателей креатинина после 15-17 дней снижаются в среднем на 11 моль/л.
Статистические показатели ACT
после стандартной терапии
|
ACT |
ACT |
|
|
Число измерений |
25 |
25 |
|
Ср. арифметическое |
38,8333 |
29,75 |
|
Медиана |
30,0 |
25,0 |
|
Мода |
30,0 |
25,0 |
|
Дисперсия |
1218,33 |
281,295 |
|
Станд. отклонение |
34,9046 |
16,7719 |
|
Станд. ошибка |
10,0761 |
4,84162 |
При t=0,812539, Р=0,21427 нет статистически достоверного отличия между двумя выборками, так как р>0, 05. Абсолютные значения показателей снижаются на 9 Нмоль/л через 15-17 дней.
Статистические показатели мочевины
после применения Реамберина
|
Мочевина |
Мочевина |
|
|
Число измерений |
31 |
31 |
|
Ср. арифметическое |
6,065 |
4,98429 |
|
Медиана |
5,85 |
5,0 |
|
Мода |
7,0 |
|
|
Дисперсия |
5,0977 |
4,39729 |
|
Станд. отклонение |
2,25781 |
2,09597 |
|
Станд. ошибка |
0,603425 |
0,560439 |
При t=1,812539, Р=0,100477 нет достоверно значимого отличия между двумя выборками, так как р>0,05. Абсолютные значения уменьшаются в среднем на 1,1 ммоль/л через 10-12 дней.
Статистические показатели мочевины
после стандартной терапии
|
Мочевина |
Мочевина |
|
|
Число измерений |
25 |
25 |
|
Ср. арифметическое |
5,57417 |
5,03083 |
|
Медиана |
5,45 |
4,9 |
|
Мода |
3,8 |
|
|
Дисперсия |
3,48055 |
1,29559 |
|
Станд. отклонение |
1,86562 |
1,13824 |
|
Станд. ошибка |
0,538559 |
0,328582 |
При t=0,861228, Р=0,200161 нет достоверно значимого отличия между двумя выборками, так кэд: р>0,05. Абсолютные значения уменьшается в среднем на 0,5 Ммоль/л через 15-17 дней.
Статистические показатели АЛТ
после применения Реамберина
|
АЛТ |
АЛТ |
|
|
Число наблюдений |
31 |
31 |
|
Ср. арифметическое |
30,2857 |
24,5714 |
|
Медиана |
28,0 |
24,0 |
|
Мода |
||
|
Дисперсия станд. |
188, 527 |
110,571 |
|
Отклонение |
13,7305 |
10,5153 |
|
Станд. ошибка |
3,66964 |
2,81033 |
При t — 1,23628, Р = О,113703 нет достоверно значимого различия между двумя выборками, так как р>0, 05. Абсолютные значения АЛТ снижаются на 10-12 день в среднем на 6 Нмоль/л.
Статистические показатели АЛТ
после стандартной терапии
|
АЛТ |
АЛТ |
|
|
Число наблюдений |
25 |
25 |
|
Ср. арифметическое |
30,4167 |
21,1667 |
|
Медиана |
24,5 |
18,0 |
|
Мода |
18,0 |
18,0 |
|
Дисперсия |
457,902 |
93,0606 |
|
Станд. отклонение |
21,3986 |
9,64679 |
|
Станд. ошибка |
6,17725 |
2,78479 |
При t=1,36512, Р=0,0959805 нет достоверно значимого различия между двумя выборками, так как р>0,05. Абсолютные значения показателей АЛТ снижаются на 15-17 день в среднем на 9 Нмоль/л.
Статистические показатели ACT
после применения Реамберина
|
ACT |
ACT |
|
|
Число измерений |
31 |
31 |
|
Ср. арифметическое |
34,2143 |
27,7857 |
|
Медиана |
32,0 |
23,0 |
|
Мода |
||
|
Дисперсия |
137,566 |
264,027 |
|
Станд. отклонение |
11,7289 |
16,2489 |
|
Станд. ошибка |
3,13467 |
4,34271 |
При t=1,20029, Р=0,120956 нет достоверно значимого отличия между двумя выборками, так как р>0, 05. Абсолютные значения ACT снижаются на 7 Нмоль/л на 10-12день.
Статистические показатели количества эритроцитов
с
использованием Реамберина, использованы две точки исследования:
первая показатели после операции, вторая после проведения коррекции
гомеостаза на 10-12 день
|
Эритроциты |
Эритроциты |
|
|
Число наблюдений |
31 |
31 |
|
Ср. арифметическое |
3,45 |
3,67857 |
|
Медиана |
3,45 |
3,6 |
|
Мода |
3,3 |
3,6 |
|
Дисперсия |
0,147308 |
0,067967 |
|
Станд. отклонение |
0,383807 |
0,26705 |
|
Станд. ошибка |
0,102577 |
0,0696763 |
Используя для статистической обработки t-критерий и р=0,05 уровень вероятности принятый для медицинской статистики, можно сказать что, число эритроцитов увеличивается после использования Реамберина в среднем на 0,22, хотя статистически достоверного отличия при t=-1,84327 и Р=0,07305 между двумя выборками не получено.
Статистические показатели количества эритроцитов
при стандартной терапии
|
Эритроциты |
Эритроциты |
|||
|
Число наблюдений |
25 |
25 |
||
|
Ср. арифметическое |
3,54167 |
3,56667 |
||
|
Медиана |
3,3 |
3,55 |
||
|
Мода |
3,4 |
3, 6 |
||
|
Дисперсия |
0,291742 |
0,0715152 |
||
|
Станд. отклонение |
0,540132, |
0,267423 |
||
|
Станд. ошибка |
0,155923 |
0,0771984 |
||
При t = -0,143689 Р = 0,4435 нет статистически значимых отличий с достоверностью 95 % между двумя выборками, абсолютные значения показателей эритроцитов при стандартной терапии увеличиваются меньше, чем в. опытной группе пациентов.
Статистические показатели исследования гемоглобина
при применении Реамберина
|
Гемоглобин |
Гемоглобин |
|
|
Число наблюдений |
31 |
31 |
|
Ср. арифметическое |
99,1429 |
106,643 |
|
Медиана |
103,5 |
103,5 |
|
Мода |
86,0 |
102,0 |
|
Дисперсия |
245,67 |
198,863 |
|
Станд. отклонение |
15,6739 |
14,1019 |
|
Станд. ошибка |
4,18902 |
3,76888 |
Статистические показатели лейкоцитарного индекса
интоксикации
после стандартной инфузионной терапии
|
ЛИИ |
ЛИИ |
|
|
Число наблюдений |
25 |
25 |
|
Ср. арифметическое |
3,65 |
1,94167 |
|
Медиана |
2,9 |
1,85. |
|
Мода |
1,4 |
1,0 |
|
Дисперсия |
6,81727 |
0,400833 |
|
Станд. отклонение |
2,61099 |
0,633114 |
|
Станд. ошибка |
0,753728 |
0,182764 |
При t=4,94879 Р=0,0568 есть достоверно на 95% значимое отличие между двумя выборками: при" использовании стандартной терапии. Абсолютные значения показателей лейкоцитарного индекса интоксикации на 15-17 день становятся меньше 1,8 раза.
плотность
Статистические показатели белка в крови
при применении Реамберина
|
Белок |
Белок |
|
|
Число наблюдений |
31 |
31 |
|
Ср. арифметическое |
57,5357 |
70,1143 |
|
Медиана |
58,0 |
68,0 |
|
Мода |
50,0 |
67,0 |
|
Дисперсия |
46,6548 |
70,1105 |
|
Станд. отклонение |
6,83043 |
8,3732 |
|
Станд. ошибка |
1,82551 |
2,23783 |
Используя t критерий, можно сказать, что при t = 4,3555 ^= 0,00009 есть статистически достоверные отличия на 95,0% между выборками. После применения Реамберина значительно увеличиваются абсолютные показатели белка в среднем на 13 гр/литр 10-12 дней.
РЕЗУЛЬТАТЫ
Оценку эффективности лечения Реамберином определяли
по следующим показателям:
1) самочувствие больного до начала и после окончания курса
лечения,
2) динамика клинике – лабораторных показателей в процессе
лечения.
Анализ результатов клинического применения, Реамберина, после операций на коленном суставе.
Применение Реамберина в послеоперационом периоде приводило к устранению проявлений астеновегативного синдрома на 2-3 сутки. После 4-5 Дней инфузионной терапии у подавляющего большинства пациентов 28 (93,2%) улучшалось самочувствие, нормализовались артериальное давление и пульс, увеличивался суточный диурез, исчезла слабость, усиливался аппетит, нормализовался сон.
На основании использования Реамберина можно судить, что препарат удовлетворительно переносится и не приводит к развитию осложнений и побочных эффектов при его пролонгированом использовании. В области введения препарата не было отмечено развития эритем или инфильтратов, отсутствовали клинические проявления аллергических реакций как непосредственно после введения, так и за весь период наблюдения. При введении Реамберина внутривенно в объеме 400 мл в дозе 3-4 мл\мин в среднем в среднем в течении 1,5 часов не отмечено токсического воздействия на сердечно-сосудистую, дыхательную, выделительную, нервную систему и желудочно-кишечный тракт. Побочного действия не обнаружено. Противопоказаний не выявлено.
Применение стандартной инфузионной терапии в послеоперационном приводило к устранению проявлений астеновегетативного синдрома на 5-6 сутки После 6-7 дней инфузионной терапии у большинства пациентов 20 (80%) улучшалось самочувствие, нормализовались артериальное давление и пульс, увеличивался суточный диурез, исчезла слабость, усиливался аппетит, нормализовался сон.
В результате лабораторного исследования включены только показатели, динамика изменения которых в сравнении контрольной и основной групп была достоверной (р<0,05).
В результате проведения статистической обработки исследований при р<0,05, значимых различий между двумя выборками не получено при сравнении общего анализа мочи, показателей коагулограмм .Значимые различия при р<0,05 получены в сроках нормализации таких показателей, как гемоглобин, СОЭ, лейкоцитарный индекс интоксикации, общий белок крови, креатенин, мочевина, АлАТ, АсАТ, щелочная фосфатаза, функциональная активность моноцитов. В среднем на 5-7 дней быстро нормализовались эти показатели при применении Реамберина, по сравнению с контрольной группой при стандартной терапии.
Причем, показатели гемоглобина, общего белка крови, креатина лейкоцитарного индекса интоксикации происходило не только быстрее, но и носили достоверно значимые при р<0,05 отличия по своим абсолютным значениям.
Динамика статистических показателей лабораторных анализов крови больных, получавших Реамберин, в сравнении с контрольной группой приведены в таблице (стр. 136-144)
ЗАКЛЮЧЕНИЕ
Выводы об эффективности препарата, Реамберин:
- Клинические показатели (болевой синдром, кожные покровы, заживление послеоперационного рубца, амплитуда движений в оперированном суставе, двигательный режим, дистанция ходьбы, использование дополнительной опоры) в опытной и контрольной группе пациентов существенно не различались. Однако, учитывая, что в контрольной группе применялись несколько инфузионных растворов, обладающих различными фармакологическими свойствами, можно косвенно судить о наличии у Реамберина нескольких свойств (дезинтоксикационного, антигипоксического, антиоксидантного, плазмозамещающего действия).
- Целесообразно использовать Реамберин у больных с дегенеративно-дистрофическими заболеваниями коленного сустава, в период подготовки к оперативному вмешательству ни послеоперационном периоде, учитывая его клиническую эффективность, как инфузионного раствора, обладающего дезинтоксикационным, плазмозамещающим, антигипоксическим, гепатонефропротекторным-действием.
- Применение Реамберина у больных в послеоперационном периоде позволяет в более короткие сроки в среднем на 5-7 дней нормализовать и стабилизировать такие показатели, как гемоглобин, СОЭ, общий белок крови, лейкоцитарный индекс интоксикации, билирубин, щелочная фосфатаза, НСТ тест (функциональная активность моноцитов), креатенин, мочевину, АлАТ, АсАТ.
- Учитывая сходство оперативного вмешательства и послеоперационного периода при дегенеративно-дистрофических заболеваниях крупных суставов можно рекомендовать применение Реамберина при операциях не только на коленном, но и тазобедренном, плечевом, локтевом, голеностопном суставах.
- Не отмечено случаев непереносимости препарата Реамберина при его парентеральном введении по рекомендованной схеме.
- Реамберин может быть рекомендован в качестве этиотропного
средства в коррекции гомеостаза после операции на коленном
суставе.
ЛИТЕРАТУРА - Актаева И.Н., Гулий И.Я., Лихтенштейн И.Е. и др. // Врачебное дело -1985.-№6.-С. 6-8.
- Алабовский В.В., Яценко В.Н., Золотухина В.Н. //Труды Воронежского медицинского института.-1974.-№2.-С. 81-86.
- Анисимов В.Н., Кондрашева М.Н.//Доклад академии Наук СССР. - 1978 -Т.248.-№5.-С. 1242.
- Антипов В.В., Васин М.В., Гайдамакин А.Н. // Космическая биология и авиакосмическая медицина-1989.-Т.23.-№2.-С. 63-66.
- Бабский A.M., Стефанков Ю.С., Коробов В.М. //Украинский биохимический журнал.-1993.-Т.65.-№6.-С. 106-108.
- Байрамкулов Х.Д., Гацура В. В. // Бюл. эксп. биол. и мед.-1976.-Т.82.-№12.-С. 1439-1441.
- Байрамкулов Х.Д., Гацура В.В. // Бюл. эксп. биол. и мед.-1978.-Т.86 -№9 -С. 317-319.
- Бариляк И.Р., Сатмари Е.Ф., Охрончук Б.В. Действие сукцината натрия на внутриутробное развитие крыс. -М., 1980.-7с. Рукопись депонирована в ВИНИТИ, №1357.80.
- Бендер К.И., Фрейдман С.Л., Хлебников А.Н. // Бюл. эксп. биол. и мед -1977.Т.17.-№4.-С. 32-36.
- Береговая Е.Д., Горчакова Н.А., Самарская Т.Н., и др.// Фармакология и токсикология.-1990.-Т.53.-№5.-С. 34-37.
- Березов Т.Т, Коровкин Б.Ф. Биологическая химия. М.: Медицина, 1983 -С. 597.
- Бобков Ю.Г, Кузнецова Г.А., Клейменова Г.Н. //Бюл. эксп. биол. имед.-1984. Т.99.-№1О.-С. 420-422.
- Быкова Л.П., Жукова Т.П. //Бюл. эксп. биол. и мед.-1994.-Т.67.-М°1.-С. 41-44.
- Ванизов B.Х., Плотникова Т.М., Якимова Т.В., Саратиков А.С. //Бюл. эксп. биол. имед.-1995.-Т.68.-№9.-С. 276-278.
- Галенко-Ярошевский П.А., Чекман И.С. Медведев О.С. // Бюл. эксп. биол. и мед.-1998.-Т.126.г№10.-С. 420-424.
- Гацура В.В., Пичугин В.В. //Вестник АМН СССР.-1982.-№5.-С. 34-38.
- Головкин В.А., Лукаш Е.П., Похмелкина С.А. // Фармация.-1991.-Т.40.-№6.-С. 9-12.
- Головкин В.А, Лукаш Е.П., Похмелкина С.А. // Научные труды Всесоюзного научно-исследовательского института фармации.-1990.-Т.28.-С. 70-75.
- Дильман В.М., Анисимов В.Н., Кондрашева М.Н. // Фармакология и токсикология.-1976.-Т.39.-№5.-С. 540-543.
- Дунаев В.В. //Фармация.-1992.-Т.41.-М<>1.-С. 63-64.
- Ещенко Н.Д., Вольский Г.Д. // Методы биохимических исследований. -Л.: ЛГУД982.-С. 207-212.
- Железодефицитные анемии / Под ред. В.И. Никуличева.-Уфа: БГМИ, 1993.-201с.
- Жибинов В.В., Ивницкий Ю.Ю. //Архив патологии.-1994.-Т56.-№1.-С. 88-90.
- Зарецкий Ю.В., Митушкина Е.А, Трубина И.Е. и др.//Анестезиология и реаниматология.-1994.-№5.-С. 44-48.
- Заявка Российской Федерации 95,102993/13 Кл. А31 К9/12, А23 К 1/10. Опубликована 27.01.98.-Бюллетень Изобретений.-1998.-№3.-С. 18-19.
- Зафаров К.А., Садриддинов А.Ф., Тухтаев К.Р. // Патологическая физиология и экспериментальная терапия.-1991.-№5.-С. 32-35.
- Зиновьев Ю.В., Козлов СА., Савельев О.Н. Резистентности к гипоксии. -Красноярск: Енисей, 1988.-67 с.
- Иваницкая Е.В., Леус Н.Ф.// Офтальмологический журнал.-1986.-№5.-С. 311-314.
- Ивницкий Ю.Ю., Штурм Р. // Радиобиология.- 1990.-М°5.-С. 704-706.
- Ивницкий Ю.Ю., Штурм Р.//Радиобиология.-1992.-№1.-С. 117-120.
- Ивницкий Ю.Ю., Головко А.И., Сафронов Г.А. Янтарная кислота в системе средств метаболической коррекции функционального состояния и резистентности организма. Санкт-Петербург: Лань, 1998.-82 с.
- Ивницкий Ю.Ю. Интенсивность клеточного дыхания и радиорезистентность организма: Автореф. дис. д.м.н.-СПб, 1994. 56 с.
- Каминский Ю.Г.//Биохимия.-1982.-Т.47.-№4.-С. 654-659.
- Ковалев М.М., Рой В.П., Малюк В.И., Безродный В.Г.//Физиологический журнал.-1980.-Т.26.-М92.-С. 228-234.
- Коваленко А., Романцов М., Алексеева Л., Петров А. //Врач.-1999.-№10.-С. 32-33.
- Кондрашева М.Н., Чаговец Н.Р. //Доклад академии наук СССР-1971 -Т.198.-№1.-С.243.
- Королева Л.В., Васин М.В. //Радиобиология.-1994.-Т.28.-№2.-С. 228-229.
- Коржов В.И. // Украинский биохимический журнал.-1979 -Т.51 -№2 -С. 147-150.
- Корнеев А.А.//Экспериментальная и клиническая фармакология.-1995.-Т.58.-№5.-С. 34-36.
- Косенко Е.А., Каминский Ю.Г. // Радиационная биология и экология -1994.-T34.-No3.-C. 357-361.
- Кочетыгов Н.И., ПанышеваТ.Ю., Ремизова М.Н. //Патологическая физиология и экспериментальная терапия.-1984.-№ 1.-С. 33-35.
- Левин Г.С., Халматова Г.М., Парлагашвили Ю.Ю. и др. // Проблемы гематологии и переливания крови.-1974.-Т.19.-№7.-С. 40-45.
- ЛенинджерА. Митохондрия.: Пер. с англ.-М.: Мир, 1966.-316 с.
- Лузиков В.Н. Регуляция формирования митохондрий. Молекулярные аспекты. -М.: Наука, 1980.-318 с.
- Лукьянова Л.Д. //Бюллетень экспериментальной биологии и медицины -1997.-Т.124.-№9.-С. 244-254.
- Маевский Е.И., Гришина Е.В., Окон М.С. и др. //Фармакологическая коррекция гипоксических состояний.-М.: НИИ фармакологии АМН СССР 1989.-С.80-82.
- Максутов К.М., Зурдинов А.З., Джакубекова А.У. и др. // Химико-фармацевтический журнал. -1998. -T.32.-№11. -С. 17-20.
- Малер Г., Кордес Ю. Основы биологической химии: пер. с англ.-М.: Мир 1970.-364с.
- Манойлов С.Е., Седых В.Н. //Бюл. эксп. биол. и мед.-1996.-Т.117.-№5 -С. 524-525.
- Малюк В.И., Гройсман С.Д., Киреева Л.М. // Физиологический журнал -1979.-Т.25.-№5.-С. 607-611.
- Малюк В.И., Брук Э.И., Киреева Л.М.//Физиологическийжурнал. -1983 -Т.29.-№5.-С. 616-617.
- Малюк В.И., Коржов В.И.//Украинский биохимический журнал.-1979.-Т.51.-№6.-С. 639-643.
- Малюк В.И., Молотков В.Н., Коржев В.П. //Врачебное дело.-.1981.-№8 -С. 66-68.
- Малюк В.И., Федоров В.И. // Физиологический журнал.-1995.-Т.41.-№1-2.-С. 79-86.
- Малюк В.И., Молотков В.Н., Коржов В.И., Коммисар O.K. // Проблемы туберкулеза.-1981.-№7.-С. 60-64.
- Машковский М.Д. Лекарственные средства в 2-х томах. Харьков.-1997.-Т.2.-С. 197-198.
- Митушкина Е.А., Зарецкий Ю.В., Трубина И.Е. и др. //Анестезиология и реаниматология.-1996.-№5.-С. 61-63.
- Морозова К.И. //Гигиена труда и профессиональные заболевания.-1990.-№7.-С. 53-55.
- Насибуллин В.А. // Морфология.-1994.-Т.107.-№7-12.-С. 53-62.
- Никулин А.А.//Фармакология и токсикология.-1988.-Т.51.-№3.-С. 45-48.
- Никуличева В.И. Железодефицитные анемии. Уфа: Издательство БГМИ, 1993.-200с.
- Ноздрачева Л.В. // Патологическая физиология и экспериментальная терапия.-1986.-МЗ.-С. 61-64.
- Павленко B.C., Хлыстов В.В., Андреева Л.И. и др. //Патологическая физиология и экспериментальная терапия.-1992.-№2.-С. 20-24.
- Патент 2,043,101 А61К31/20; -Опубликован 10.12.94.-Изобретения-1994.-№12.
- Патент 2,056,842 А61К31/19;-Опубликован 27.03.96. -Изобретения-1996.-№9.
- Патент 2,051,675 А61К31/34;-Опубликован 10.01.94 -Изобретения-1996.-№1.
- Патент 2,039,556 МКИ: А61К 31/19,47/00.-Опубликован 20.07.95.-РЖ Хим.-1996.-№24.-О204П.
- Патент 2,012,350 МКИ: А6ІК 35/78.-Опубликован 15.05.94.-РЖ. Хим.1996.-№18.-О163П.
- Патент 2,032,421 МКИ: А61К 35/78;-Опубликован 10.04.95.-РЖ Хим.-1995.-М18.-О183П.
- Патент России 2,114,618 МКИ: А61К31/19;-Опубликован 27.07.97.-Изобретения-1997.-№21.-С. 13-15.
- Патент России 2,070,041 МКИ: А61К31/19;-Опубликован 10.12.96.-Бюллетень Изобретений.-1996.-*№34.
- Патент России 2,108,095 МКИ: А61К31/19;-Опубликован 10.04.98.-Бюллетень Изобретений-1998.-№10.
- Патент России 2,118,161 МКИ: А61К31/615-Опубликован 10.02.98.-Бюллетень Изобретений-1998.-№4.
- Патент России 2,114,617 МКИ: А61К31/19-Опубликован 10.07.98.-Бюллетень Изобретений-№ 19.
- Патент России 2,056,821 МКИ: А61К9/08-Опубликован 27.03.96.-Бюллетень Изобретений №9.
- Патент РФ 2,097,026 МКИ: А61К/22-Опубликован 27.11.97.-Бюллетень Изобретений.-1997.-№33.
- Патент РФ 2,090,187 МКИ: А61К31/135-Опубликован 20.09.97.-Бюллетень Изобретений.-1997.-N926.
- Патент РФ 2,121,836 МКИ: А61К31/19-Опубликован 20.11.98.-Бюллетень Изобретений.-1998.- №32.
- Патент РФ 2,096,043 МКИ: А61К47/02-Опубликован 20.11.97.-Изобретения.-1997.-№32.
- Поборский А.Н., Зимина Т.А. // Патологическая физиология и экспериментальная терапия.-1996.-№1.-С. 19-21.
- Путилина Ф.Е.//Методы биохимических исследований.-Л.: ЛГУ. 1982.-С. 181-183.
- Раевский К.С., Георгиев В.П. Медиаторные аминокислоты: нейрофармакологические и нейрохимические аспекты.-М.: Медицина, 1986.-240 с.
- Рой В.П., Малюк В.И., Безродный В.Г. // Клиническая хирургия.-1979.-№ 9.-С. 32-34.
- Саакян И.Р., Саакян А.Г. //Вопросы медицинской химии.-1998.-Т.44.-№2.-С. 151-157.
- Саакян М.Р., Кондрашева М.Н., Высочина И.В.// Известия АН, Серия биологическая.-1994.-№4.-С. 596-604.
- Сергеев В.П., Снегирева Г.В., Гусаков В.М. и др. // Бюл. эксп. биол. и мед.-1991.-Т.62.-№10.-С. 381-382.
- Сергеев В.П., Снегирева Г.В., Гусаков В.М. // Бюллетень экспериментальной бологии и медицины. -1991.-Т.112.-№10.-С. 381-382.
- Сергеева С.С., Базанова С., Бургова П. //Биофизика.-1986.Т.31.-№4.-С.631-633.
- Сернов Л.Н., Снегирева Г.В., Гацура В.В. // Фармакология и Токсикология.-1989.-T.52.-№6.-C. 47-49.
- Скибицкий В.В: //Терапевтический архив.-1992.-Т.64.-№8.-С. 25-29.
- Скибицкий В.В.//Вестник РАМН.-1996.-№5.-С. 9-12.
- Справочник Видаль.-М.-1998.
- Суслов Е.Н., Малюк В.И., Коржов В.И, и др. // Проблемы туберкулеза.-198.0.-№2.-С. 57-59.
- Терапевтическое действие янтарной кислоты /Под ред. М.Н. Кондрашевой. Пущино: Институт Биофизики АН СССР, 1976.-234 с.
- Федорова З.П.,Федоров В.И., Шмырева Т.И. // Физиологический журнал. -1980.-Т.26.-№5.-С. 607-611.
- Федотчева Н.И., Геслер Н.Н., Аникеева С.П.//Биохимия.-1993.-T.5S.-Na4.-C. 599-605.
- Филатова Г.Ф., Кузнецова Г.А., Бобков Ю.Г. // Бюл. эксц. биол. и мед.-1986.-Т.101.-№9.-С. 315-316.
- Фролышс Р.А. // Гипертоническая болезнь, атеросклероз и коронарная недостаточность.- 1978.-№10.-С. 94-97.
- Хазанов В.А., Зимина Т.А., Саратиков А.С.//Бюл. эксп, биол. и мед.-1986.Т. 101.-№1.-С. 35-38.
- Шевелева Г.А. //Экспериментальная и клиническая фармакология.-1996.-Т.59.-№1.-С. 41-43.
- Щерба М.И., Петров В.Н., Рысс Е.С.и др. Железодефицитные состояния.-Л.: Наука, 1975.-267 с.
- Янтарная кислота в медицине, пищевой промышленности, сельском хозяйстве / Под ред. М.Н. Кондрашевой, Ю.Г. Каминского, Е.И. Маевского. Пущино: ОНТИ РАМН, 1996.-300 с.
- Cairns C.B., Ferroggiaro A.A., Wаlther J.M., atal.// Circulation.-1997/-V.96.-N°9.-P.260-265.
- Ishidate M.J., //Food Chemistry arid Toxicilogy.-1984.-V.22.-№8.-P. 623-636.
- Forssman S.//Acta Physiologica Scandinavica.-1941.-Bd2.-№5.,-S.121.
- Fukui S., Shimoyama T., Tamura K. at al. //Journal of Gastroenterology-1997.-V.32.-№4.-P.464-471.
- Gorzy B., Szent-Gyorgyi A.//Physiologische Chemie.-1934.-Bd.24.-Nbl.-S.l-10.
- Gurvich A.M., Mutushkina E.A., Zarzhetsky Y.I. atal. //Reuscitation.-1997.-V.35.-№2.-С. 165-170.
- Krebs H.A. //Advancesof Enzymology.-1943.-V.3.-Nb2,-R191.
- Krebs H.A., Eggleston L.V., Alessandro A. ///Biochemical Journal /-196L-V.79.-№5.-P.537-542.
- Landauer W., Sopher D. //Journal of Embriology & Experimental Morphology .-1970,-V.24.-Nbl.-P.187-202.
- Malaisse W.J., Adullah S. //American Journal of Physiology.- 1993.-V.264:-Nb3.-P.434.
- Malaisse W.J., Reaschaert M.J., Villanueva-PenacarilloM.L., etal. //American Journal of Physiology.-1993.-V.264.-№3.-P.429-433.
- Martindale. The Extra Pharmacopoeia, 30-th Editioa, London, 1993.-P.976
- Mc Donald M.J., Fahien L.A. // Diabetes.-1988.-V.37.-№.9.-P.997-999.
- Mishra G., Ronntary R./ Das S.R. at al // Indian Journal of Physiology and Pharmacology-1995.-V.39.-N93.-P.271-274:
- Miyji K. // Kyushi Journal Medical Science.- 1956.-№7.-P. 14-28.
- Patent Japan 56-125 С1.А6ІК 31/19,31/195 Арр П.1.10.81.-РЖ Хим.-1983.-№3.
- Patent France 2,642,420 CI:C07C55/10.-Publ.03.08.90.-Chem. Abste-1991.-V.114.-№16.-P150-190y.
- Pisarenko O.L., Stodneval. M., Shulzhenko VS. etal//Pflugers Archives.-1990.-V.416.-№54.-P431-441.
- Roberts E., Bredoff H.M.//Journal Biological Chemistry.-153.-V.201.-№3.-P.393-398.
- Ronai E., Tretter L., Szabados G. etal //International Journal of Radiational Biology. -1987.-V.51.-№4.-P.6U-617.
- Rosental O., Drabkin D.L.// Cancer Research.- 1944.-V4.-N8.10.-R487.-491.
- Saarma J.; Saarma N., Aadamsoo A. etal // International Pharmacopsychiatry.-1975.-V.10.-№3.-P.149-156.
- Sacamoto M., Takeshige K.,Yasui H. //Surgery Today. 1998. -V28.-№5.-P, 522-528.
- Sanders A.P., Currie W.D., Woodhall B. //Journal Society Experimental Biology and Medicine.-1969.-V.130.-№8.-P.1021-1022.
- Strabados G., Ando A., Tretter L., Horvath I. // Journal of Bioenergetics and Biomembranes.-1987.-V.19.-№l.-P.21-30.
- Taylor D.E., Ghio A.J., Piantadosi CA// Archives Biochemistry & biophysics.1995.-V.316.-№l.-.P. 70-76.
- Thind S.K., Datta B.N., Malik A.K. et al. // International Journal of Clinical Pharmacology and Biopharmacy.-1978.-V.16.-№11. -P. 516-518.
- Thind S.K., Datta B.N., Malik A. K. et al. // Indian journal of Medical research. -1980.-V.71.-№4.-P. 611-616.
- Valle A.B., Panek A.D., Mattoon J.R. //Analytical Biochemystry.-1978.V.9L-№2.-P. 583-599.
- Westergaard N., Sonnewald U., Schousboe A.//Neuroscience Letters.-1994.V.176.-№l.-P. 105-109.
- Zhang T, Sener A., Malaisse W.J. // Archives Biochemistry & Biophysics. -1994.-V.314.-N°1.-P. 186-192.
- Zhang T.M., Nadi A.B., Malaisse W.I. //Medical Science Research.-1994,-V.22.-№5.-P. 365-368.
- Батоцыренов Б.В. Нарушения транспорта кислорода и формирование синдрома эндогенной интоксикации при острых тяжелых отравлениях ядами нейротропного действия//Автореф. дис… канд. мед. наук. -СПб, 1998. -24с.
- Ваизов В.X., Плотникова Т.М., Якимова Т.В. и др. Сукцинат аммония -эффективный корректор циркуляторной гипоксии // Бюл. эксперим. биологии и медицины. -1994. -T.118, N, 9. -С. 276-278.
- Глушков С.М., Сравнительная оценка состояния системы глутатиона в различных органах и тканях при острых пероральных отравлениях дихлорэтаном //Автореф. дис...канд. мед. наук -СПб, 1998.-21с.
- Ерюхин И.А., Шашков Б.В. Эндотоксикоз в хирургической клинике СПб: "Logos", 1995.-304с.
- Ерюхин И.А., Шашков Б.В, Повзун С.А., Эндотоксикоз при травматической болезни // Эндогенные интоксикации. Тезисы международного симпозиума 14-16 июня 1994 г.-СПб, 1994.- С. 29-30.
- Жуков А.А., Жиронов Г.Ф. Механизм оксигеназных реакций: основные, промежуточные и побочные продукты оксигеназного цикла // Вести. АМН СССР.-1988.-№1-С. 33-43.
- Зуев В.В. Эндотоксикоз при острых отравлениях карбофосом и способы его коррекции: Автореф. дисс. канд. мед. наук. - СПб 1997.-24 е.
- Ивницкий Ю.Ю. Янтарная кислота в системе метаболической коррекции функционального состояния и резистентности организма. СПб, 1998. - 82с.
- Ильяшенко К.К. Кислородотранспортная функция крови у больных с острыми отравлениями. //Анестезиология и реаниматология. -1996. - С. 20-22.
- Ильяшенко К.К. Токсическое поражение дыхательной, системы при острых отравлениях и его лечение: Автореф. дис. д-ра Мед. наук. - М., 1997: -40с.
- Кальф-Калиф Я.Я. О лейкоцитарном индексе интоксикации и его практическое значение //Врачебное дело.-1941,-№l.-С. 31-35.
- Калмансон М.Л. Нарушения транспорта кислорода при тяжелых формах острых отравлений карбофосом: Автореф. дисс... канд. мед. наук. - СПб., 1994.-21с.
- Кирсанова А.К., Миротворская Г.Н., Мутускина Е.А. Влияние барбитуратов на течение постреанимационного периода после системной остановки кровообращения. //Анестезиология и реаниматология. - №3. -1983.-С. 39-43.
- Кондрашова М.Н. Выясненные и наметившиеся вопросы на пути исследования регуляции физиологического состояния янтарной кислотой //Терапевтическое действие янтарной кислоты/Под ред. Кондрашовой В.Н. -ПущИно, 1976. -С, 8-30.
- Кондрашова М.Н. Схема отклонений состояния митоходрий от нормы и вещества, обращающие эти изменения //Реакция живых систем и состояния энергетического обмена. - Пущино: 1979. -С. 185-187.
- Кулинский В.И., Колесниченко Л.С. Обмен глутатиона //Успехи биол. химии. - 1990. -Т. 31. -С. 157-Л79.
- Кулинский В.И., Колесниченко Л.С. Структура, свойства, биологическая роль и регуляция глутатионпероксидазы //Успехи совр. бйод. - 1993.-ІІ 113, вып. 1.-С 107-122. 12.18,
- Ливанов Г.А., Калмансон М.Л., Батоцыренов Б.В. Нарушения транспорта кислорода при острых отравлениях. Принципы дифференцированного подхода к диагностике и интенсивной терапии. /Тезисы докладов на УП всероссийском сзьезде анестезиологов и реаниматологов. - СПб.
- Ливанов Г.А., Бучко В.М., Калмансон М.Л., Бонитенко Е.Ю. Отравления алкоголем и его суррогатами, //Актуальные проблемы теоретической и прикладной токсикологии: Тезисы докладов Всероссийской конференции токсикологов. -СПб. -1995. -С. 56.
- Лужников Е.А. Актуальные проблемы клинической токсикологии //60 Анестезиология и реаниматология. - 1995. -№3. - С. 4-10.
- Лужников Е.А. Клиническая токсикология. - М.; Медицина, 1994. - 254 с.
- Лужников Е.А, Гольдфарб Ю.С. Механизмы и принципы лечения эндотоксикоза при острых отравлениях и их осложнениях // Вторая конференция московского общества гемафереза. - М., 1994, -С. 25-28.
- Лужников Е.А, Дагаев В.Н., Фирсов Н.Н. Основы реаниматологии при острых отравлениях. - М.: Медицина, 1977. –375с.
- Лужников Е.А. Клиническая токсикология. - М. - Мед. - 1994. - 2156 с.
- Лужников Е.А,, Костомарова Л.Г., Острые отравления. -М- Медицина, 1989. –432с.
- Малахова М.Я. Метод регистрации эндогенной интоксикации. - СПб.: МАЛО, 1995.-33с.
- Малахова М.Я. Методы биохимической регистрации эндогенной интоксикации. Сообщение первое.//Эфферентная терапия. 1995, -Т.1, №1, С. 61-65.
- Малахова М.Я. Методы биохимической регистрации эндогенной интоксикации, Сообщений второе. // Эфферентная терапия. - 1995. – Т.2, №2, С. 61-66.
- Мусселиус С.Г.// Диагностика, клиника и лечечение критических состояний при острых отравлениях и эндотоксикозах. - М., 1988. - С. 64-69. 30
- Николайчик В.В.//Международный симпозиум по гемосорбции, 7-й; Тезисы докладов. -Киев, 1986.- С. 40.
- Новиков Г.Д., Суворов А.В., Макаров И.А. Затянувшиеся комы при острых отравлениях. // Клинические аспекты постгипоксических энцефалопатий. Реабилитация коматозных и посткоматозных состояний: Мат. науч.-практ. конференции М., 1992. -С. 95-96.
- Оболенский С.В., Малахова М.Я. Лабораторная диагностика интоксикаций в практике интенсивной терапии. - СПб, 1991;-16с.
- Оболенский С.В. Острая легочная паренхиматозная недостаточность.
- Степанов Н.Г. Эндогенная интоксикация при гнойных заболеваниях мягких тканей. // Автореферат диссертации на соискание ученой степени кандидата медицинских наук.-СПб. ,-1996.
- Строкова В.А., Дагаев В.Н., Зимина Д.Н. и др. Клинико-токсикологическая токсикодинамика при отравлениях фосфоорганическими инсектицидами // Вопросы судебной медицины. - М., 1994. - С. 142-147.
- Ernster L., Forsmark P, Nordenbrand К. The mode of action of lipid-soluble antioxidants in biological membranes: relationship between the effects of ubiquinol and vitamin E as inhibitors of lipid peroxidation in submitochondrial particles // Biofactors. -1991 - Vol., N. 4V P. 241-248.
- Flohe L. Glutathione peroxidase brought into focus //Free Rad. Biol. - 1982. -Vol. 5. -P. 223-254.
- Garella Serafino, Lorch Jonathan A. Hemodialysis and haemoperfusion for poisoning//AK/FNephrol. Lett. - 1993,- Vol.10, N1. -P. 1-19.
- Jean P.A., Reeid D.J. Utilization of glutatione during 1,2-dihaloethane metabolism in rat hepatocytes//Cherri. Res. Toxicol. -1992. – Vol.5, №3, - P. 386-391.
- Liu H., Kehrer J.P. The reduction of glutathione disulfide produced by t-butyl hydroperoxide in respiring mitochondria // Free Radio. Biol. Med. -1996. - AM. 20, N. 3. -P. 433-44251
- Lu S.C., Garcia-Ruiz C., Kuhlenkamp J. et al. Hormonal regulation of glutathione efflux//J. Biol. Chem. -1990. -Ш. 265, N. 27. -P. 16088-16095.
- Lu S.C., Kuhlenkamp J., Ge J.L., Sun W.M., Kapiowitz N. Specificity and directionality of thiol effects on sinusoidal glutathione transport in rat liver// Моl. Pharmacol.-1994.- Vol. 46, N.3.-P. 578-585.
- Meister A., Anderson M.E. Glutathione //Ann. Rev. Biochem. - 1983. -Vol. 52. -P.711-760.
- Meister A., Tate S.S. Glutathione and related glutamyl compounds: biosynthesis and utiliization // Ann. Rev. Biochem. - 1976. - Vol. 45, N. 3. - P. 559-564.
- Noack H., Kube U., Augustin W. Relations between tocopherol depletion and coenzyme Q during lipid peroxidation in rat liver mitochondria//Free Radic. Res. -1994.- Vol. 20, N. 6. -F 375-386.
- Oxidative stress / Ed by H. Sies. - London: Acad. press, 1985. - 507 p.
- Ray S.D., Fariss M.W. Role of cellular energy status in tocophery hemisuccinate cytoprotection against ethyl methanesulfonate-induced toxicity //Arch. Biochem. Biophys.-1994. - Vol. 311, N.I.-P. 180-190.
- Reilly P.M., Schiller H.J., Bulkley G.B. Pharmacologic approach to tissue injury mediated by free radicals and other reactive oxygen metabolites //Amer. Journ. Surg. - 1991.-vol. 161, N. 4.-P. 488-503.
- Tate S.S., Thompson G.A., Meister A. Recent studies on і-glutamyl transpeptidase // Glutathione: metabolism and function. - N. Y: Raven press. -1976. -Vol. 6.-P. 45-55.
- Wang S.T., Kuo J.H., Chou R.G., Lii C.K.Vitamin E protection of cell morphology and protein thiols in rat hepatocytes treated with tert-butyl hydroperoxide// Toxicol. Lett. -1996.-Vol. 89, N. 2.-P. 91-98.
- Браун А.Д. Некоторые аспекты молекулярных механизмов клеточного повреждения. О6шие механизмы клеточных реакций на повреждающее воздействие,- Л., 1977-С.14-16
- Брауштейн А.Е. Процессы и ферменты клеточного метаболизма — М., Наука, 1987.-548 с.
- Брехман И.И., Нестеренко И.Ф. Природные комплексы физиологически активных веществ. -Л., Наука, 1989 .-93 с.
- Белый К.П. Патофункциональная характеристика деформирующего артроза коленного сустава. Дис ... канд. мед. наук. — Л., 1980 . - 329 с.
- Битхем У.П., Паллей Г.Ф., Слакамб Ч.Х., Уйвер УФ, Клиническое исследование суставов. -М., Медицина, 1970. —187 с.
- Боринский С.Ю. Комплексный подход к консервативному лечению деформирующего гонартроза в условиях дневного стационара. Автореф. дис... канд. мед. наук. - Самара, 1997. -24 с.
- Геворкян А.А. Восстановительное лечение больных после эндопротезирования коленного сустава. Автореф. дис... канд. мед. наук. -М 1988 . -19 с
- Гублер Е.В. Вычислительные методы анализа и распознавания патологических процессов. -Л., Медицина, 1978.-294 с.
- Гуляева Н.В. Янтарная кислота. \\ Большая медицинская энциклопедия. - 3-е изд.-1986, - Т. 28 . - с. 526-527.
- Дунаев В.В., Тишкин В.С., Милонова Н.П., Белай И.М., Макаренко С. Работоспособность и ее востоновление после истощающей мышечной деятельности \\ Фармакол. Токсиколог, 1988. - Т. 51, № 3 . - с. 18-21.
- Ермолаев Е.К. Эндопротезирование коленного сустава. Дис... канд. мед. наук. - С. Пб, 1994. - 178 с.
- Ещенко Н.Д., Вольский Г.Г. Определение количества янтарной кислоты и активности сукцинат дегидрогеназы \\Методы биохимических исследований. -Л. ЛГУ, 1982.-С 207-212.
- Каземирский А.В. Комплексная предоперационная подготовка и восстановительное лечение при реконструктивных операциях на коленном суставе. Автореф. дис. ...канд. мед. наук. -СПб, 1999 .–20с.
- Колчинская А.З. Вторичная тканевая гипоксия. – Киев. Наукова думка, 1983.
- Комарова Ф.И., Меньшиков В.В. Биохимические исследования в клинике.- Л. Медицина, 1976.- 383 с.
- Кондрашова М.Н. Схема отклонений состояния митохондрий от нормы, и вещества, обращающие эти изменения .\\ Реакции живых систем и состояния энергетического обмена . – Пущино . Б.И., 1979 . –С . 185-197
- Корнилов Н.В., Карпцов В.И., Новоселов К.А., Ермолаев Е.К. Опыт тотального эндопротезирования коленного сустава \\Плановые оперативные вмешательства в травматологии и ортопедии. С-Пб, 1992 . – С. 176-180 .
- Корнилов Н.В., Карпцов В.И., Новоселов К.А., Ермолаев Е.К.
Результаты
тотального эндопротезирования коленного сустава \\Эндопротезирование в травматологии и ортопедии. - М ., 1993 . –С . 78-82 . - Корнилов Н.В. Эндопротезирование суставов: прошлое, настоящее, будущее (Отчет о работе Российского центра эндопротезирования суставов конечностей) \\Травматология и ортопедия России. — 1994 .-№5.- С 7-11.
- Корнилов Н.В., Карпцов В.И., Новоселов К.А. Клинические результаты тотального эндопротезирования коленного сустава \\ Травматология и ортопедия России. -1996 .-№ 4 .- С. 11-15
- Корнилов Н.В., Карпцов В.И., Новоселов К.А. Каземирский А.В. Применение адаптационной подготовки пациентов для профилактики осложнений при плановых ортопедических операциях \\ II съезд травматологов и ортопедов республики Армения. Тезисы докладов. - Ереван, 1996 . - С. 219-220.
- Корнилов Н.В., Новоселов К.А., Каземирский А.В., Засульский Ф.Ю. Москалев Э.В. Основные направления послеоперационного восстановительного лечения больных с эндопротезами коленного сустава. Тотальное эндопротезирование коленного сустава \\Тезисы докладов областной научно-практической конференции травматологов-ортопедов и хирургов Ленинградской области. -С Пб, 1997 .-С. 40-41.
- Косенко Е.А., Каминский Ю.Г. Выживаемость крыс и митохондриальное отношение свободных НАД+\НАДН печени при действии ионизирующего излучения и сукцината натрия \\Рад. биол. Радиоэкол ., 1994 . - Т.34, вып . 3 -С .357-461
- Косинская Н.С. Дегенеративно-дистрофические поражения костно-суставного аппарата. - Л. Медгиз,1961. - 196 с.
- Косинская Н.С., Рохлин Д.Г. Рабочая классификация и общая характеристика поражений костно-суставного аппарата. - Л. Медицина, 1961. -169 с .
- Маевский Е.И., Гришина Е.В., Окон М.С., Кутышенко В.П, Анаэробное образование сукцината и ресинтез АТФ в митохондриях тканей крыс \\Фармакологическая коррекция гипоксических состояний. - М. НИИ фармакологии АМН СССР, 1989 . - С 80 -92 .
- Путилина Ф.Е. Определение активности глутатионредуктазы \\ Методы биохимических исследований. - Л. ЛГУ, 1982 . - С. 181 -183
- Раевский К.С., Георгиев В.П. Медиаторные аминокислоты нейрофармакологические и нейрохимические аспекты. - М. Медицина, 1986. - 240 с.
- Ратников В.И., Ратникова Л.И. Фармакологическая регуляция адаптации иммунной системы к экстремальному воздействию острой гипоксии \\ Фармакологическая регуляция состояний дезадаптации. - М. Б.И., 1986 - С. 74-81.
- Родуэлл В. Анаэробные дегидрогеназы \\ Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека в 2-х томах. Т. 1. Пер. с англ. - М. Мир 1993 . -С. 121
- Сергеев П.В., Снегирева Г.В., Гукасов В.М., Гуцура В.В. Соотношение антиоксидантного и противоишемического эффектов некоторых энергообеспечивающих средств \\ Бюл. экспер. биол. мед., 1991. - Т. 62, № 10 - С. 381-382.
- Скулачев В.П. Биоэнергетика. Мембранные преобразователи энергии. - М. Высшая школа, 1989 . - С 214-236
- Терапевтическое действие янтарной кислоты \ Подред. М.Н. Кондрашовой.- Пущино. Институт биофизики АН СССР, 1976 ,- 234 с.
- Штурм Р. Ивницкий Ю.Ю. Радиорезистентность мышей при включении в рацион янтарной кислоты и ее солей \\ Радиобиология, 1992 . - Т. 32, вып . 1. - С 117-200.
- Chance В., Williams G.R. Respiratory enzymes in oxidative phosphorilation \\J.Biol.Chem.. 1955 .Vol .217.№ 1. -P. 383-438.
- Choudhy Z.M. Studies on succinate degydrogenating system. Interaction of the mitochondrial succinate-ubiquinone reductase with piridoxal phosphate\\Biochim. Biophys. Acta, 1986. -Vol. 10, №1 . -P. 131-138.
- Domingo J.L., Mercedes Gomez, Llobet J.M. Citric, malic and succinic acids as possible alternatives to deferoxamine in а luminium toxicity \\ Clin . Toxicol., 1986 -Vol .26, №1-2 .-P. 67-79.
- Krebs H.A., Eggleston L.V., d Alessandro A.The effect
Таблица 2. Показатели ЭКГ
у больных осложненными формами гриппа и ОРЗГруппы
больныхДо лечения
После лечения
Нормальные показатели,
%-(абс. ч.)Нарушение ритма,
%-(абс. ч.)Нарушение трофики
миокарда,
%-(абс. ч.)Сочетанное нарушение,
%-(абс. ч.)Положит. динамика,
%-(абс. ч.)Отриц. динамика,
%-(абс. ч.)Без динамики, %-(абс. ч.)
I.
Олифен (n=17)29,4(5)
5,8(1)
58,8(10)
5,8(1)
58,8(10)
5,8(1)
5,8(1)
II.
Реамберин (n=37)40(15)
20(8)
40(15)
7(3)
48(18)*
8,5(3)*
43,5(16)
III.
Клинический контроль (n=9)22,2(2)
11,1(1)
44,4(4)
22,2(2)
25(2)
33,3(3)
41,7(4)
Обозначения: р< 0,05 (показатели II и III групп)
Таблица 3. Показатели функции внешнего дыхания
у больных гриппом, осложненным пневмониейГруппы больных
До лечения
После лечения
Нормальные показатели, %-(абс. ч.)
Снижение ВСЛ, %-(абс. ч.)
Нарушение проходимости бронхов, % (абс. ч.)
Положительная динамика, % (абс. ч.)
Отрицательная динамика %, (абс. ч.)
Без динамики,
% (абс. ч.)Олифен (n=17)
11,7 (2)
82,3 (14)
52,9 (9)
82,3 (14)
5,8 (1)
11,9 (2)
Реамберин (n=37)
33,3 (12)
53,3 (19)
33,3 (12)
60 (22)*
6,6 (2*)
33,4 (13)*
Клинический контроль (n=9)
55,5 (5)
33,3 (3)
11,1 (1)
33,3 (3)
22,2 (2)
45,5 (4)
Обозначения: р< 0,05 (показатели II и III групп)
Таблица 4. Показатели оксигенации
у больных осложненным гриппом и ОРЗГруппы больных
До лечения
После лечения
Нормальные показатели,
% (абс. ч.)Нормальная оксигенация при тахикардии,
% (абс. ч.)Положительная динамика,
% (абс. ч.)Отрицательная динамика,
% (абс. ч.)Без динамики,
(абс. ч.)Олифен
(n=17)35,2 (6)
64,7 (11)
41 (7)
23,8 (4)
35,2 (6)
Реамберин
(n=37)33 (12)
66 (25)
33 (12)
20,8 (8)*
49,2 (17)
Клинический контроль
(n=9)33,3 (3)
66,6 (6)
20 (2)
33,3 (3)
46,7 (4)
Обозначения: р< 0,05 (показатели II и III групп)
Таблица 5. Содержание сывороточных металлоферментов
с учетом антиоксидантной терапии.Уровень
металлоферментов в
сыворотки кровиВид терапии
Олифен (n=21)
Реамберин (n=37)
Витамин Е (n=20)
Базисная терапия (n=18)
Трансферин
(2,344±0,048 г/л) *до лечения (1)
после курса(2)
1-2(%)*1,384±0,02
2,22±0,005
↑37,81,198±0,03б
2,200±0,040
↑45,61,395±0,008
1,824±0,013
↑26,31,394+0,003
487±0,005
↑24,2Лактоферин
(0,40±0,032 мкг/мл)до лечения (1)
после курса(2)
1-2(%)0,404+0,002
0,442±0,004
↓00,479±0,023
0,411±0,021
↓14,20,480±0,003
0,425±0,002
↓11,20,483±001
0,475±001
↓11,1Церулоплазмин
(0,398±0,01 г/л)до лечения (1)
после курса(2)
1-2(%)0,574±0,002
0,557±0,002
↓26,70,532±0,001
0,415±0,002
↓22,00,598±0,002
0,588±0,002
↓19,60,535±0,002
0,465±0,004
↓13,8СОД
(49,6±0,06 т/мл)до лечения (1)
после курса(2)
1-2(%)54,39±0,3
53,34±0,33
↓5,752,1±0,17
50,0±0,09
↓4,054,36±0,25
51,95±0,26
↓4,454,8±0,12
53,6±0,22
↓2,2Обозначения:
* – норма по результатам обследования 35 доноров;
** – разница (в %) между показателями 1-го и 2-го обследований (р< 0,05);
↑– увеличение показателя;
↓ – снижение показателя.Таблица 7. Содержание металлопротеидов в сыворотке крови
и цереброспинальной жидкости у больных менингитами различной этиологииУровень металло-
протеидов СК/ЦСЖГруппы больных и исследованный материал
Серозный менингит (n=16)
Гнойный менингит (n=11)
Сыворотка
кровиЦСЖ
Сыворотка
кровиЦСЖ
1. Трансферрин (N = 2,344 ± 0,048 г/л / 2,438 ± 0,034 г/л)*
1 обследов.
2 обследов.
3 обследов.
(1-3)** (%)1,846 ±0,025
2,136±0,020
2,234±0,040
↑на 21%1,883±0,030
2,156±0,034
2,35б±0,048 Т
↑на 25%1,744 ±0,025
1,862 ±0,030
2,000 ±0,023
↑на 14,7%1,800 ±0,009
1,882±0,004
2,100±0,004
↑на 16,7%2. Лактоферрин (N = 0,405 ± 0,032 мкг/мл / 0,428 ± 0,012 мкг/мл)*
1 обследов.
2 обследов.
3 обследов.
(1-3)** (%)0,448 ±0,035
0,426 ±0,030
0,415 + 0,025
↓на 7,3%0,426 ± 0,020
0,443 ± 0,033
0,425±0,022
↑на 8%0,542 ±0,020
0,526±0,025
0,456±0,030
↑на 15,8%0,562 ±0,004
0,555 ±0,002
0,488±0,010
↑на 15%3. Церулоплазмин (N = 0,398 ± 0,015 г/л /0,400 ± 0,013 г/л)*
1 обследов.
2 обследов.
3 обследов.
(1-3)** (%)0,470 ±0,022
0,438 ±0,010
0,419 ±0,025
↑на 10,8%0,473 ± 0,025
0,446 ±0,030
0,399 ±0,015
↑на 15,6%0,566 ±0,020
0,526 ±0,025
0,429 ±0,0101
↑на 24%0,566 ±0,011
0,546 ±0,004
0,464 ±0,008
↑на 18%4. Супероксиддисмутаза плазмы (N = 49,6 ±0,1 нг/мл / 52,3 ±0,1)*
1 обследов.
2 обследов.
3 обследов.
(1-3)**(%) в нг52,5 ±0,4
52,0 ±0,5
51,3±0,2
↑на 2,2%
↑на 1,2 нг53,3 ±0,6
52,8 ±0,5
52,5±0,4
↑на 1,5%
↑ на 0,8 нг54,2 ±0,6
53,7 ±0,7
52,8 ±0,5
↑на 2,6%
↑на 1,4 нг55,4±0,2
54,5 ±0,4
53,1±0,5
↑на 4,2%
↑на 2,3 нгОбозначения:
*N норма по результатам обследования 35 доноров; показатели сыворотки крови / показатели ЦСЖ (10 человек);
СК – сыворотка крови;
ЦСЖ – цереброспинальная жидкость;
первое (1-е) обследование – 2-й день болезни;
второе (2-е) обследование – 12-й день;
третье (3-е) обследование – перед выпиской (24-й день);
(1-3)** – разница между показателями 1-го и 3-го обследований;
↑ – увеличение показателя;
↓ – снижение показателя.Таблица 8. Содержание металлопротеидов в сыворотке крови
и цереброспинальной жидкости
у больных менингитами, леченных реамбериномУровень
металлопротеидов СК/ЦСЖГруппы больных и исследованный материал
Реамберин (n = 16)
Базисная терапия (n = 10)
Сыворотка крови
ЦСЖ
Сыворотка крови
ЦСЖ
1. Трансферрин (N = 2,344 ± 0,048 г/л / 2,438 ± 0,034 г/л)*
1 обследов.
2 обследов.
(1-2)**(%)1,776 ± 0,055
2,096 ± 0,0460
↑18%1,814±0,025
2,216 ±0,034
↑23%1,789 ± 0,069
1,669 ±0,012
↑-7,3%1,764 ±0,027
2,0 14 ±0,024
↑14%2. Лактоферрин (N = 0,405 ± 0,032 мкг/мл / 0,428 ±0,012 мкг/мл)*
1 обследов.
2 обследов.
(1-2)** (%)0,458 ± 0,037
0,442 ±0,096
↓0,9%0,439 ±0,020
0,293 ± 0,026
↑34%0,469 ± 0,027
0,529 ±0,035
↑12,7%0,444 ± 0,034
0,333 ± 0,032
↑24%3. Церулоплазмин (N = 0,398 + 0,015 г/л / 0,400 ±0,013 г/л)*
1 обследов.
2 обследов.
(1-2)**(%)0,493 + 0,026
0,473 ± 0,0360
↑4.4%0,501+0,016
0,426 ± 0,027
↑13,9%0,488 ±0,025
0,483 ± 0,02
↑41%0,485 ± 0,026
0,478 ±0,0171
1,4%4. Супероксидцисмутаза (N = 49,6 ± 0,1 нг/мл/ 52,3 ±0,1)*
1 обследов.
2 обследов.
(1-2)**(%)52,5 ±0,2
52,0 ±0,4
Не влиял53,3 ±0,6
52, 8 ±0,5
↑0,01%51,2 ±0,1
53,1 ±0,3
↑3,9%52,96 ±0,2
51,95 ±0,5
↑1,8%ОБОЗНАЧЕНИЯ:
*N – норма по результатам обследования 35 доноров; показатели сыворотки крови / показатели ЦСЖ (10 человек);
СК – сыворотка крови;ЦСЖ – цереброспинальная жидкость;
первое (1-е) обследование – до лечения;
второе (2-е) обследование – после курса терапии;;
(1-2)** – разница между показателями 1-го и 2-го обследований;;
↑ – увеличение показателя;
↓– снижение показателя.Таблица 9. Лабораторные показатели больных
серозным менингитом на фоне лечения реамбериномПрепараты
Количество
лейкоцитов,
тыс. (абс. ч.)Палочкояд. лейкоциты, (%)
Цитоз ЦСЖ (число клеток в 1мм3)
Содержание белка в ЦСЖ, (г/л)
СОЭ
(в мм в час)Обследование
1
2
1
2
1
2
1
2
1
2
Реамберин
9,4
5,8
14,1
6,0.
972
31
0,50
0,24
11
5
Базисная
терапия11,5
7,4
15,8
6,1
1021
63
0,48
0,36
8
10
Таблица 15. Показатели иммуннологической реактивности
в динамикелечения больных желтушным вариантом вирусных гепатитовПрепарат
Период обследования
Показатели имуннологической реактивности
ПР
ТР
СЗ
ЦИК
Т-акт.
лимфоциты, %Реамберин
Исходный фон
Окончание лечения0,08*
0,27*2,9*
3,4*0,72*
0,80*0,61
0,7330,4
64,6Здоровые n=30
>0,3-0,4
3,4-3,7
0,6-0.9
0,6-0,8
62-65
5% раствор глюкозы-
контрольная группаИсходный фон
0,10
3,0
0,65
0,63
41,3
Окончание лечения
0,22
3,6
0,87
0,64
57,6
Примечание: * – р < 0,01-0,001 в сравниваемых показателях.
Таблица 16. Биохимические показатели №
Показатель
Норма
Основная группа
Контрольная группа
До
леченияПосле
лечения
До
леченияПосле
лечения1
Щелочная фосфатаза
до 120 ед/л
197±15
105±9
189±12
115±11
2
Билирубин общий
3,4-17,1 мкмоль/л
247±17
19±13
231±13
21±2
3
Креатинин
44,2-106 мкмоль/л
139±12
92±5
127±15
94
4
АсАТ
0,06-0,46 мкмоль/л
0,76±0,11
0,42±0,09
0,71±0,13
0,49±0,0
5
АлАТ
0,12-0,68 мкмоль/л
0,98±0,12
0,63 ± 0,11
0,92±0,09
0,72±0,08
Таблица 26. Общая характеристика больных
Препарат
Средний возраст больных
Диагноз
ВГС
ВГВ
ВГВ + ВГС
ХВГ В+С
ОВГ С
ХВГ С
ОВГ В+С
ОВГ В
ХВГ В+С
РЕАМБЕРИН
22±2
20±2
16±4
35±4
38
32
27
25
23
Таблица 27. Максимальные значения
биохимических показателей у больных ОГСГруппа больных
БИЛ
АлАТ
АсАТ
Тимоловая проба
Сулемовая
пробаSH-
SS-
К
SH-/SS-Опытная
Контрольная231
2103992
2423202
19012.6
8.22.0
1.6290
310230
1301,2
2,5Таблица 29. Динамика изменения тиол-дисульфидного равновесия
в процессе терапии препаратом РЕАМБЕРИНДо приема РЕАМБЕРИНА
Через сутки после 1-го приема РЕАМБЕРИНА
Через сутки после
5-го приема РЕАМБЕРИНАЧерез сутки после 7-го приема РЕАМБЕРИНА
SH
SS
sh/ssК
SH
SS
sh/ssК
SH
SS sh/ss
К
SH
SS sh/ss
К
320
160
2
380
180
2.1
370
160
2.31
460
184
2.5
Таблица 30. Динамика биохимических показателей у больных ОГС
Группы больных
БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ
Билирубин
АлАТ
SH
До лечения
После лечения.
До лечения
После лечения
До лечения
После лечения
Опытная
181,0
51,0
2143,0
673,2
280,5
360,5
Контрольная
210,0
86,0
2423,0
860,0
250,0
300,0
Таблица 31. Динамика биохимических показателей у больных ХГС Группы больных
БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ
Билирубин
АлАТ
SH
До лечения
После лечения
До лечения
После лечения
До лечения
После лечения
Опытная
27,45
15,3
202,5
161,1
310,0
280,5
Контрольная
19,0
18,8
89,6
71,5
320,0
360,0
Таблица 32. Динамика биохимических показателей у больных ОГВ
Группы больных
БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ
Билирубин
АлАТ
SH
До лечения
После лечения
До лечения
После лечения
До лечения
После лечения
Опытная
340,2
239,0
2132,8
1379,0
210,5
320,0
Контрольная
210,75
180,0
1232,0
1140,5
190,0
300,0
Таблица ЗЗ. Динамика биохимических показателей у
больных ХГ-микст (В+С)Группы больных.
БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ
Билирубин
АлАТ
SH
До лечения
После лечения
До лечения
После лечения
До лечения
После лечения
Опытная
136,3
71,0
1809,3
1095,0
290,0
350,0
Контрольная
96,0
52,0
1310,0
1093,0
270,0
310,0
Таблица 34. Изменение показателей щелочной фосфатазы и креатинина
в динамике наблюдения у больных с вирусными гепатитамиПоказатель
Уровень нормы
Группы больных
Опытная группа
РЕАМБЕРИНКонтрольная группа
Исходный
фонОкончание лечения
Исходный
фонОкончание лечения
Щелочная фосфатаза
до 120 ед.
203
115
199
12
Креатинин
44-105
ммоль/л127
92
131
112
Таблица 35. Показатели неспецифического иммунного ответа
у больных, получавших РЕАМБЕРИНПоказатели
Норма
Группа больных
Основная
Контрольная
До лечения
После лечения
До лечения
После лечения
Фагоцитарное число нейтрофилов
60 - 90 %
51,0
72,0
61,4
93,1
Фагоцитарный индекс
4 - 9
21,0
7,1
17,3
14,3
НСТ-тест
8 - 12 %
17,0
9,2
14,0
16,2
РТМЛ с ФГА
2 - 4
3,1
1,5
4,0
2,9
Таблица 37. Динамика биохимических показателей больных,
получавших Реамберин (РА), в сравнении с базисной терапией (БТ)Пока-
зателиБольные ХВГ с умеренной и выраженной степенью активности
Больные ХГВ на стадии цирроза печени
Больные с первичным билиарным циррозом печени
До РА
После РА
До БТ
После БТ
До РА
После РА
До БТ
После БТ
До РА
После РА
До БТ
После БТ
АсАт НМО (с:л)
68,3
±
12,837,5
±
3,87*52,2
±
6,4661,6
+
5,25*87,5
±
18,539,5
±
11,561.6
±
29,654,0
±
6,1136,1
±
27,4103
±
20,8141,3
±
4,5127,6
±
6,1АлАТ Нмоль/ (с:л)
111,1
±
20,670,8
±
12,9*118,4
±
0,8993,2
±
15,7*106,1
±
26,727,6
±
13,7*35,2
±
4,4*178,2
±
6,2158,3
±
4,6182,3
±
4,6182,3
±
10,8171,4
±
3,9Билирубин Мк моль/л ПТИ%
38.5
±
2.26 87,1
±
3,811,0
±
1,59 89,9
±
2.74*37,36
±
4,13 74,11
±
1,8629,14
±
5,18 80,69
±
3,1432,7
±
6,8 83. 7
±
4.915,7
±
1,1* 68,3
+
13,635,14
±
1,95 66,1
+
2,529,5
±
1.2* 72, 1
±
2,380,3
±
36,4 86,1
±
6.378,8
±
32,1 86,1
±
5,294,8
±
15,2 73,5
±
1,972,6
±
12,3 72,1
±
2,3ЩФ Нмоль/ (с:л)
186,4
±
12,3113,1
±
11,8193,0
±
14,2167,4
±
15,4206,7
±
15,5125,1
+
12,9201,2
±
10,8167,3
±
12,6178,1
±
14,0165,2
±
16,4188,7
±
14,3180,2
±
15,0Примечание: * – достоверно при Р<0,05
Таблица 38. Интерфероновый ответ при различных формах ХЗП
Показатели ИНФ статуса, МЕ/мл
Клинические формы ХЗП
Больные ХВГ с минимальной степенью активности, n=11
Больные ХВГ с умеренной и выраженной степенью активности, n=11
Больные ХВГ на стадии цирроза печени, n=11
Больные первичным билиарным циррозом печени, n=4
Сывороточный ИНФ Индуцированная продукция ИНФ-α/β
22±1,44
124±16,224,6±2,08
113,1±21,125,8±3,12
52,0±15,324,0±2,0
83,3±15,2Индуцированная продукция ИНФ-γ
75,3±20,3
54,3±7,72
46,5±16,1
92,0±35,0
Таблица 46. Влияние Реамберина на длительность симптомов интоксикации
у больных острыми вирусными гепатитамиСимптомы
Испытуемая группа
(n=27)Группа сравнения
(n=31)Частота,
%Длительность, в днях (Міn)
Частота,
%Длительность, в днях (М+т)
Слабость
93
2,5±0,3**
94
5,2±0,б**
Анорексия
93
2,5±0,3*
87
4,2±0,7*
Тошнота
70
1,3±0,5
74
2,1±0,3
Головная боль
11
1,8±0,1
16
2,0±0,1
Головокружение
4
6
1,3±0,3
Кожный зуд
59
4,0±1,4
55
9,б±3,2
Койко/день
18,8±1,8**
27,б±1,7**
Статистически достоверные различия:
* – р <0,05;
** – р < 0,001.Таблица 47. Влияние Реамберина на динамику биохимических показателей крови у больных острыми вирусными гепатитами
Наименование
показателяИспытуемая группа
(n=27)Группа сравнения
(n=31)До лечения (М±n)
После лечения
(М±m)До лечения (М±m)
После лечения
(М±m)Билирубин общий (мкмоль/л)
194,04±11,3
80,85±9,9
225,2±18,9
119,32±17,1
АсАТ (мкмоль/мин. л)
1299,85±126,0
452,22±58,7
1624,45± 185,3
519,7±40,5
АлАТ (мкмоль/мин. л)
2019,29±157,6
862,55±107,9
2326,71±201,9
915,84±125,5
Гаммаглутамилтранспептидаза
(мкмоль/мин. л)180,77±26,9
163,44±23,1
222,53±25,9
218,54±46,4
Щелочная фосфатаза, ед.
184,3±10,9
162,72±12,5
233,0±31,0
176,21±17,2
Холестерин, мммоль/л
3,3±0,3
4,2±0,3
3,7±0,3
3,8±0,4
Натрий, мммоль
140,2±1,4
143,2±1,8
141,8±1,8
146,2±2,0
Калий, мммоль
4,4±0,6
5,4±0,1
4,6±0,2
4,9±0,9
Протромбиновый индекс, %
79,2±0,9
86,9±0,8*
69,2±1,2
77,3±0,9*
Тимоловая проба, ед.
39,1±2,8
32,0±2,3
42,б±1,2
32,7±3,7
Общий белок (г/л)
78,3±2,7
79,4±0,6
79,8±0,9
80,0±0,4
* – статистически достоверные различия (р <0,05).
Таблица 48. Влияние Реамберина на показатели периферической крови
у больных острыми вирусными гепатитамиПараклинические показатели
Испытуемая группа
(n=27)Группа сравнения
(n=31)До лечения (M±m)
После лечения (М±m)
До лечения (М±m)
После лечения (M±m)
Гемоглобин Эритроциты Лейкоциты Тромбоциты
149,0±4,7 г/л 4,4±0,3x1012/л 5,2±1,7x109/л 257,0±12,3x109/л
152,0±2,8 г/л 4,2±0,5x1012/л 5,4±0,9x109/л 2б,5±11,7x109/л
151,0±3,7г/л 4,3±0,2x1012/л 5,4±1,2x109/л 241,5±14,2x109/л
154,0±4,2г/л 4,4±0,7x1012/л 6,2±1,6x109/л 258,9±10,4x109/л
Таблица 50. Изменение "альбуминового теста"
на фоне введения Реамберина у больных разлитым перитонитомПоказатели
Уровень нормы
Исходный фон
Период наблюдения*
3-и сутки
5-е сутки
7-е сутки
9-е сутки
ЭКА
29-54
23,9/23,7
24/29
28/33
30/33
30/32
ОКА
31-57
33,6/34,2
34/42
33/46
38,6/44,0
39/46
РСА
71-98
68,0/69.0
70/75
69/71
72/72
72/73
Т
0,02-0,40
0,40/0,38
0,40/0,30
0,20/0,30
0,28/0,38
0,29/0,30
* обозначения:
в числителе – показатель больных контрольной группы;
в знаменателе – показатель больных основной группы.Таблица 52. Состояние больных по шкале SAPS
Группа больных
Период наблюдения
До введения препарата
1 сутки после введения
3 сутки после введения
5 сутки после введения
8 сутки, после введения
Основная
14,8
12,4
10,3
7,8
6,7
Контрольная
14.9
14,1
13,4
11.0
8,9
Таблица 53. Изменение "альбуминового теста"
на фоне введения Реамберина у больных
с сосудистыми поражениями головного мозгаПоказатель
Период наблюдения
1
2
3
4
5
6
7
8
9
10
ЭКА
36,8
36,7
33,3
36,3
24,0
27,0
23,0
23,3
24,9
23,7
ОКА
49,6
50,0
48,7
50,3
34,2
38,0
36,6
34,6
36,9
39
РСА
72,9
73,2
70,4
72,6
73.6
75,2
74,5
74,0
72,6
70,7
Т
0,34
0,36
0,46
0,38
0,41
0,4
0,59
0,49
0,4
0,4
Таблица 73. Динамика измененийконцентрации при острых отравлениях нейротропными ядами и использовании Реамберина
Показатель
Время исследования
Группы иследования (норма-здоровые доноры-24 человека: 16 мужчин и 8 женщин;
отравленные-приведена характеристика группы)Мужчины
Женщины
Мужчины+Женщины
Норма
Исслед. группа
Группа сравн.
Норма
Исслед. группа
Группа сравн.
Норма
Исслед. группа
Группа сравн.
GSN (ммоль/г гемогл.)
Поступление
2,858±
0,1010,663±
0,152
*0,693±
0,121
*3,424±
0,3460,779+
0,110
*0,802±
0,113
*2,982±
0,1230,686±
0,120
*0,704±
0,126
*Через
12 ч2,858±
0,1011,007±
0,143
*0,748±
0,121
*3,424±
0,346
1,309±
0,127
0,882±
30,124
*2,982±
0,123
1,140±
0,131
*+0,767±
0,146
*SH-группы (мкмоль/г гемоглоб)
Поступление
7,38±
1,12
3,04±
0,58
*3,24±
0,33
*17,86±
3,344,06±
1,89
*3,79±
0,77
*9,74±
1,49
3,24±
1,49
*3,52±
0,58
*Через
12 ч7,38±
1,12
3,58±
0,46
*2,74±
0,61
*14,86±
3,344,83±
0,78
*4,06±
0,89
9,74±
1,49
0,42±
0,67
*3,24±
0,79
** – достоверность отличия р<0,05 по сравнению с показателями нормы
+ – достоверность отличия р<0,05 по сравнению с показателями группы сравнения.Таблица 74. Динамика изменений концентрации малонового диальдегида в эритроцитах при острых отравлениях нейротропными ядами и использовании Реамберина
Показатель
Время исследования
Группы иследования (норма - здоровые доноры - 24 человека: 16 мужчин и 8 женщин;
отравленные-приведена характеристика группы)Мужчины
Женщины
Мужчины+Женщины
Норма
Исслед группа
Группа сравн.
Норма
Исслед. группа
Группа сравн.
Норма
Исслед. группа
Группа сравн
МДА
(нм Моль/г гемогл.)Посту-
пление15,6±
1,2754,46±
3,91*54,46±
3,91*18,9±
2,9758,46±
7,92*57,61±
4,39*16,09±
1,2655,92±
3,7156,72±
4,31*Через 12 ч
15,6±
1,2741,89±
2,38*65,78±
4,35*18,9±
2,9744,97±
6,2143,32±
4,39*16,09±
1,2643,02±
4,56*+70,65±
4,54** - достоверность отличия р<0,05 по сравнению с показателями нормы.
+ - достоверность отличия р<0,05 по сравнению с показателями группы сравнения.Таблица 75. Динамика изменений активности каталазы и глутатион-пероксидазы в эритроцитах при острых отравлениях нейротропными ядами и использовании Реамберина
Показатель
Время исследования
Группы иследования (норма - здоровые доноры - 24 человека: 16 мужчин и 8 женщин;
отравленные - приведена характеристика группы)Мужчины
Женщины
Мужчины+Женщины
Норма
Исслед. группа
Группа сравн.
Норма
Исслед. группа
Группа сравн.
Норма
Исслед. группа
Группа сравн.
ГП Ммоль
(гем*мин)Поступление
2,975±
0,4602,006+0,160
*2,026±
0,171
*4,216±
0,9842,510±
0,497
*2,660±
0,521
*3,298±
0,7512,203±
0,217
*2,313±
0,271
*Через
12 ч2,975±
0,4602,467±
0,176
+2,058±
0,171
*4,126±
0,9843,313±
0,5132,471±
0,231
*3,298±
0,751
2,798±
0,228
+2,256±
0,198
*Каталаза
Мкмоль
(г гем*мин)Поступление
33,30±
1,4624,22±
2,29
*23,88±
1,67
*39,42±
2,45
27,90±
3,95
*28,45±
3,54
*35,44±
1,4125,66±
2,06
*25,76±
2,37
*Через
12 ч33,30±
1,4626,25±
2,58
*+21,37±
1,29
*39,42±
2,4532,08±
2,76
*27,31±
2,94
*35,44±
1,4129,77±
2,63
*+24,34±
2,18* - достоверность отличия р<0,05 по сравнению с показателями нормы.
+ - достоверность отличия р<0,05 по сравнению с показателями группы сравнения.Таблица 76. Изменения параметров спонтанной активности головного
у лиц с острыми тяжёлыми отравлениями нейротоксикантами
при использовании «Реамберина» в комплексном лечении (М±т)Параметры
ЭЭГГруппа
наблюденияГруппа
сравненияБлагоприятный исход
Смертельный
исходI
II
I
II
I
II
Спектральный состав, %
Дельта-Активность
90±10
76±10
*+<93±10
95±5
92±8
94±6
Тета-Активность
10±5
14±10
*+<7±5
3±3*
11±8
6±6
Альфа-Активность
0±2
10±5
*+<0+2
0+1
*+0+1
0+2
Бета-Активность
0±1
0+2
+<0+1
2+2
0+1
0+1
Амплитуда, мкВ
110±20,
80±20
*+<160+3
0155±20
+125±120
115*15
Уровень ФАМ, %
52±10
25±10
*+<'61±10
42±15
*+56*10
50*15
Реакция,
Перестройки,
Частота возникновения0+0.1
0,5±0.2
*+<0+0.1
0.3±0.2
*+0+0,1
0. 1±0. 1
Диапазон усвоения ритмической фотостимуляции, Гц
0
2-6
*+<0
1-2*
0
1-2
Примечание:
* - различия достоверны по сравнению с исходным состоянием (р<0. 05);
+ - достоверные различия между группой наблюдения и группой сравнения (р<0. 05);
< - различия достоверны между наблюдениями с благоприятным и смертельным исходом (р<0.05).
I - исходное состояние, II - повторное исследование.