Янтарная кислота (ЯК) – универсальный промежуточный метаболит, образующийся при взаимопревращениях углеводов, белков и жиров в растительных и животных клетках. В физиологических условиях ЯК диссоциирована, поэтому название ее аниона – сукцинат, часто применяют как синоним термина "янтарная кислота". Она является продуктом пятой реакции и субстратом шестой реакции цикла Кребса.
Превращение ЯК в организме связано с продукцией энергии, необходимой для обеспечения жизнедеятельности. При возрастании нагрузки на любую из систем организма, поддержание ее работы обеспечивается преимущественно за счет окисления ЯК. Мощность системы энергопродукции, использующей ЯК, в сотни раз превосходит все другие системы энергообразования организма. Это и обеспечивает широту диапазона неспецифического терапевтического действия ЯК и ее солей.
Окисление ЯК в реакции Кребса осуществляется с помощью сукцинат дегидрогеназы, локализованной на внутренней мембране митохондрий и ее активность не зависит от концентраций окисленной и восстановленной форм НАД/НАДН+, что позволяет сохранить энергосинтезирующую функцию митохондрий в условиях гипоксии при нарушении НАД-зависимого дыхания клеток. ЯК снижает концентрацию в крови интермедиаторов цикла – лактата, пирувата и цитрата, накапливающихся в клетках на ранних стадиях гипоксии.
Антистрессорное действие ЯК обусловлено антигипоксическим эффектом, за счет влияния на транспорт медиаторных аминокислот и увеличения содержания в мозге у аминомасляной кислоты (ГАМК) через шунт Робертса.
Противоишемический эффект ЯК связан с восстановлением активности окислительно-восстановительного фермента дыхательной цепи митохондрий клеток – цитохромоксидазы.
Гепатотропное действие ЯК обусловлено повышением соотношения НАДН+/НАД, стимуляцией синтеза мочевины и энергетического обмена в гепатоцитах. Активация сукпинатдегидрогеназы в митохондриях гепатоцитов под действием ЯК нормализует печеночный холестаз и препятствует жировой дистрофии печени и образованию коллагенозной ткани. При поражении печени ксенобиотиками ЯК стимулирует ее метаболизирующую функцию с одновременным повышением устойчивости мембран гепатоцитов к радикальному окислению.
Таким образом, являясь фармакологически высоко активным соединением, ЯК может быть использована для получения лекарственных препаратов с улучшенными фармакологическими свойствами.
Биологическое действие
и фармакологическая активность
янтарной кислоты
А.Л. Коваленко, А.Ю. Петров, М.Г.Романцов
Биологическая активность экзогенного сукцината зависит от дозы, режима введения препарата, его химической формы (кислота, соль, сложный эфир) и функционального состояния организма.
При применении физиологических доз янтарной кислоты можно выделить две группы эффектов:
- прямое действие ЯК на клеточный метаболизм,
- влияние ЯК на транспорт свободного кислорода в ткани.
Добавление небольших количеств фумарата, малата или сукцината к суспензии измельченной мышечной ткани приводит к приросту потребления тканью кислорода, многократно большему, чем можно было бы объяснить только окислением добавленных субстратов до диоксида углерода и воды.
Процесс носит каталитический характер, поскольку одна молекула добавленной к ткани дикарбоновой кислоты обеспечивает окисление многих эндогенных субстратов. Однако, стимулирующее действие какой-либо из названных карбоновых кислот на потребление кислорода отменяется ингибитором сукцинат дегидрогеназы (СДГ) – малонатом. Иными словами, окисление сукцината является необходимым условием каталитического действия любой другой из карбоновых кислот на усвоение тканью кислорода.
Этот феномен был объяснен Кребсом, который показал, что последовательность реакции окисления ряда три- и дикарбоновых кислот замкнуты в цикл, позже названный его именем. Для поддержания нормального тканевого дыхания теоретически достаточно лишь активированной уксусной кислоты (ацетил-КоА), а другие субстраты не расходуются.
Однако в действительности ди- и трикарбоновые кислоты постоянно отвлекаются из цикла Кребса в качестве субстратов анаболических реакций.
Потеря интермедиатов цикла возрастает при острых и хронических отравлениях аммиаком. Пополнение пула кислот цикла Кребса нарушается при алкоголизме, гиповитаминозе В и при отравлениях ингибиторами пиридоксальфосфат зависимых ферментов. Поэтому пополнение пула интермедиатов цикла Кребса, в том числе и из пищевых источников, является необходимым. Для пополнения пула всех органических кислот цикла Кребса оказалось достаточным экзогенного введения лишь одного сукцината
Сукцинат является стимулятором синтеза восстановительных эквивалентов в клетке. Феномен быстрого окисления сукцината в цитоплазме клеток, сопровождающийся восстановлением пула динуклеотидов, отмечаемый при внесении избытка ЯК, получил название - "монополизация дыхательной цепи сукцинатом". Биологическое значение данного явления заключается в быстром ресинтезе клетками АТФ и в повышении их антиоксидантной резистентности.
Кроме того, сукцинат положительно влияет на оксигенацию внутренней среды, стабилизирует структуру и функциональную активность митохондрий, являясь индуктором синтеза некоторых белков, влияя на ионный обмен в клетке.
Введение здоровым людям или лабораторным животным сукцината натрия приводит к снижению уровня органических кислот в крови и экскреции кислых продуктов обмена из организма (частично – в виде аммонийных солей), что указывает на нормализацию аэробной фазы тканевого дыхания.
Преимущества сукцината в скорости окисления перед другими субстратами клеточного дыхания наиболее выражено в условиях гипоксии, когда НАД-зависимый транспорт электронов в дыхательной цепи тормозится, а активность СДГ и продукции эндогенного сукцината возрастает.
Способность экзогенной янтарной кислоты существенно интенсифицировать диффузию кислорода в клетке различных тканей in vitro свидетельствует о возможном повышении сукцинатом трансмембранного градиента концентрации кислорода и, соответственно, снижения оксигенации ядра и цитоплазмы.
Исследования показали наличие у янтарной кислоты биологической активности с уникальным сочетанием проявлений: по отношению к здоровому организму сукцинаты выступают в роли адаптагенов и актопротекторов, а при наличии патологических проявлений проявляют нетипично высокий для адаптагенов терапевтический эффект. Особенно перспективно лечебное применение сукцинатов при заболеваниях сердечно-сосудистой (острая и хроническая ишемическая болезнь сердца), дыхательной, эндокринной систем, при желудочно-секреторной недостаточности и поражениях печени различной этиологии, онкологических, психических заболеваниях, в качестве стимуляторов посттравматической регенерации.
С профилактической целью янтарная кислота используется в спортивной медицине, для профилактики состояния пониженной иммунологической реактивности и для повышения устойчивости к неэлектролитному действию алкоголя. Перспективно ее применение для формирования статуса повышенной резистентности организма к ионизирующим излучениям, алкилирующим ядам и биологическим агентам.
В основе лечебно-профилактических свойств янтарной кислоты и ее соединений лежит модифицирующее влияние на процессы тканевого метаболизма - клеточное дыхание, ионный транспорт, синтез белков. При этом амплитуда и направленность модификаций зависят от исходного функционального состояния тканей, а ее конечный результат выражается в оптимизации параметров их функционирования.
Такие свойства позволяют отнести сукцинаты к лечебно-профилактическим препаратам нового поколения - так называемым "умным лекарствам".
Учитывая уникальную разносторонность проявлений биологической активности ЯК, сфера ее применения в медицинской практике является пока еще - чрезмерно узкой. Поэтому направление по созданию препаратов на основе ЯК является весьма перспективным.
Янтарная кислота (рис. 1) и е. соли и эфиры - сукцинаты представляют собой универсальный внутриклеточный метаболит, широко участвующий в обменных реакциях в организме, являясь малотоксичным соединением и не обладает мутагенным и тератогенным действием.
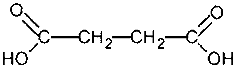
Рис. 1. Янтарная кислота
Содержание ЯК в тканях организма человека и животных, составляет 0.2-0.8 ммоль/кг, а ее концентрация в плазме крови значительно меньше и не превышает 0.04 ммоль/л.
Окисление ЯК в шестой реакции цикла Кребса осуществляется с помощью специфического фермента - сукцинат дегидрогеназы, характерной особенностью которой является локализация на внутренней мембране митохондрий и независимость е. активности от концентраций окисленной и восстановленной форм НАДН+/НАД, что позволяет сохранить энергосинтезирующую функцию митохондрий в условиях гипоксии при нарушении НАД-зависимого дыхания клеток; выполняя каталитическую функцию по отношению к циклу Кребса ЯК снижает концентрацию в крови других интермедиатов цикла - лактата, пирувата и цитрата, накапливающихся в клетках на ранних стадиях гипоксии.
В нервной ткани функционирует, так называемый g-аминобутирантный шунт (цикл Робертса), в ходе которого ЯК образуется из g-аминомаслянной кислоты через промежуточную стадию янтарного альдегида. Следует заметить, что в условиях стресса и гипоксии органов и тканей образование ЯК возможно в реакции окислительного дезаминирования a-кетоглутаровой кислоты в печени .
ЯК в организме нормализует содержание гистамина и серотонина в крови и повышает микроциркуляцию в органах и тканях, не оказывая влияния на артериальное давление и показатели работы сердца. Экспериментально показано при остром инфаркте миокарда в крови, вытекающей из зоны ишемии, происходит резкое уменьшение содержания ЯК, усугубляя гипоксию миокарда. Экзогенное поступление в организм ЯК нормализует активность сукцинат дегидрогеназы, ограничивает зону некроза в миокарде, при этом усиливается биоэлектрическая активность сердца (под действием ЯК), улучшается гемодинамика и увеличивается толерантность сердца к физическим нагрузкам.
Противоишемический эффект ЯК связан не только с активацией сукцинат дегидрогеназного окисления, но и с восстановлением активности ключевого окислительно-восстановительного фермента дыхательной цепи митохондрий клеток - цитохромоксидазы.
Антиаритмическое действие ЯК обусловлено улучшением метаболических процессов в миокарде, подавлением процессов перекисного окисления липидов в кровотоке и стабилизацией коронарного кровоснабжения. Потенцирующее действие ЯК на противоаритмическую эффективность новокаинамида обусловлено, помимо влияния на метаболические процессы в миокарде, влиянием на калиевый/кальциевый обмен в кардиомиоцитах. Кардиопротекторное действие ЯК связано с активацией сукцинат дегидрогеназного пути окислительного ресинтеза АТФ в кардиомиоцитах, с одновременным снижением уровня жирных кислот и НАД-зависимых субстратов цикла Кребса в зоне ишемии.
В условиях экспериментального шока, вызванного 10-минутной остановкой сердца, ЯК снижала уровень свободнорадикальных процессов в мозге и сыворотке крови, ослабляла деструкцию мембраных элементов нейронов и способствовала полному восстановлению функций и структуры мозга. В постреанимационном периоде ЯК способствовала нормализации функций центральной нервной системы, снижала чувствительность животных к стрессу, накопление свободно-радикальных продуктов и восстанавливала морфологические изменения в крови и головном мозге. Избирательное действие ЯК на гипоталамические структуры мозга позволяет усиливать действие эстрогенов на гормонозависимые органы и ткани.
При экспериментальном шоке, вызванном массивной кровопотерей ЯК повышала выживаемость животных и восстанавливала функциональную активность почек; способствовала растворению камней при экспериментальном уролитиазе, подавляя синтез оксалатов.
При экспериментальной острой гипоксии мозга ЯК ограничивала объем ишемических повреждений, уменьшала количество продуктов перекисного окисления липидов и увеличивала выживаемость животных.
Повышение трансмембранного градиента концентрации кислорода и снижение оксигенации ядра и цитоплазмы кислорода свидетельствует о способности ЯК интенсифицировать диффузию кислорода в различные ткани и органы, стимулируя при этом клеточное дыхание: так, прирост скорости потребления кислорода клетками печени при добавлении ЯК увеличивается в 60 раз. Способность ЯК интенсифицировать утилизацию кислорода тканями и восстановление НАД-зависимого клеточного дыхания характеризуют е. антигипоксическое действие.
Восстановление пула пиримидиновых динуклеотидов приводит к увеличению концентрации восстановленного глутатиона и усилению устойчивости митохондрий к перекисной деградации, стимулированной ксенобиотиками, при этом , ЯК под действием сублетальных доз активного генератора радикальных частиц - нитрита натрия полностью нивелирует блокирование дыхательной цепи митохондрий.
Гепатотропное действие ЯК обусловлено повышением соотношения НАДН+/НАД, стимуляцией синтеза мочевины и энергетического обмена в гепатоцитах. Активация сукцинат дегидрогеназы в митохондриях гепатоцитов под действием ЯК нормализует печеночный холестаз и препятствует жировой дистрофии печени и образованию коллагенозной ткани. При поражении печени ксенобиотиками ЯК стимулирует ее метаболизирующую функцию с одновременным повышением устойчивости мембран гепатоцитов к радикальному окислению.
Несмотря на известные фармакологические эффекты ЯК, зарегистрированных лекарственных форм, содержащих в качестве основного компонента ЯК, немного.
В составе комплексных лекарственных препаратов, ЯК потенцирует фармакологические эффекты многих активных субстанций (антигипоксическую активность 1, 2, 4-тиадиазола). Высокая алкопротекторная активность ЯК реализована в таблетках "Лимонтар", содержащих комбинацию янтарной и лимонной кислот и в антиоксидантном препарате "Мексидол".
Комбинация ЯК с ацетилсалициловой кислотой предложена в качестве противоспалительного, а сорбитом (ксилитом) в качестве противодиабетического лекарственного средства. В качестве противоастматического средства и бронходилататора разработана комбинация ЯК с сальбутамолом.
Исследователями (Галенко-Ярошевский с соавт., 1998; Малюк В.И. с соавт., 1981; Морозова К.И., 1990) показана стимуляция мерцательного эпителия бронхов, нормализация состава бронхолегочного лаважа и функциональной активности альвеолярных макрофагов, под воздействием ЯК, при бронхолегочной патологии.
Таким образом, ЯК являясь фармакологически высоко активным соединением может быть использована для получения новых лекарственных препаратов с улучшенными фармакологическими свойствами.
Высокая антигипоксическая и антиоксидантная активность ЯК нашла применение в дезинтоксикационном растворе "Реамберин 1,5% для инфузий" в состав которого входят: активное вещество - смешанная натрий N-метил-глюкаминовая соль янтарной кислоты, микроэлементы в оптимальных концентрациях.
Препарат разрешен ФГК МЗ РФ к клиническому применению и показан при экзо- и эндогенных интоксикациях.
Как показали экспериментальные исследования на животных при изучении обще токсического действия на доклиническом этапе изучения препарата Реамберин в остром, подостром и хроническом эксперименте продемонстрировано, что во всех исследуемых дозах не выявлено патологических сдвигов со стороны основных жизненно важных функций органов и систем; также установлено, что препарат не вызывает дистрофических, деструктивных, очаговых склеротических изменений в паренхиме и строме изучаемых органов; не отмечено местно-раздражающего действия препарата при внутривенном способе введения.
При изучении подострой и хронической токсичности показано, что препарат не оказывает токсического воздействия на функционирование сердечно - сосудистой системы, на морфологический состав и биохимические показатели периферической крови и костного мозга, на функциональное состояние печени, почек, а также на белковый, углеводный, жировой и электролитный виды обмена веществ.
Результаты доклинического исследования, проведенного в соответствии с утвержденным Фармакологическим Комитетом МЗ РФ протоколом изучения обще токсического действия препарата Реамберин, позволяют заключить, что он относится к 5 классу практически нетоксичных лекарственных средств, является безопасным и безвредным препаратом, что позволило разрешить его применение в клинической практике.
На основании полученных данных можно заключить, что препарат Реамберин удовлетворительно переносится и не приводит к развитию осложнений и побочных эффектов при его пролонгированном использовании.
Исследования проводились на основании решения ГФК МЗ РФ "О разрешении клинических испытаний Реамберина 1,5% для инфузий" в качестве метаболического средства при интоксикациях различного генеза (протокол N11 от 30.12.99)."
Таким образом, Реамберин препарат, содержащий натрия сукцинат, магния хлорид, калия хлорид, натрия хлорид, обладающий дезинтоксикационным, антигипоксическим, антиоксидантным, гепато, нефро и кардиопротекторным действием. Основной фармакологический эффект препарата обусловлен способностью усиливать компенсаторную активацию аэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса в дыхательной цепи митохондрий клеток с увеличением внутриклеточного фонда макроэнергетических соединений аденозинтрифосфата (АТФ) и креатинфосфата.
Реамберин активирует антиоксидантную систему ферментов и тормозит процессы перекисного окисления липидов в ишемизированных органах, оказывая мембраностабилизирующее действие на клетки головного мозга, миокарда, печени и почек. Препарат способствует процессам репаративной регенерации гепатоцитов, что проявляется снижением уровня в крови маркерных ферментов поражения ткани печени.
Показания:
- Интоксикации различной этиологии: отравление ксенобиотиками, инфекционно-токсический шок, лекарственные, токсические и холестатические гепатиты, желтушные формы вирусных гепатитов;
- Гипоксические состояния различного генеза: искусственный наркоз, ранний постоперационный период, массивная кровопотеря, острая сердечная и дыхательная недостаточность и другие нарушения кровообращения органов и тканей.
Клиническая эффективность препарата
"Реамберин 1,5% для инфузий" у детей,
больных желтушным вариантом
острого вирусного гепатита
Л. Г. Горячева
Вирусные гепатиты относятся к наиболее значимым проблемам медицинской науки и практического здравоохранения (Покровский В И ,1995, Ивашкин В. Т., 1995, ,Сологуб Т.В., 1996г, Мукомолов С. Л.,1996, Соринсон С.Н., 1998) Несмотря на определенные успехи в изучении вирусных гепатитов, вопросы терапии остаются наиболее актуальными в гепатологии. Лечение ВГ, как и при других инфекциях, включает два направления - этиотропное и патогенетическое.
Одним из основных механизмов разрушения печеночной клетки является избыточная активация процессов перекисного окисления липидов (ПОЛ) и резкое истощение резервных возможностей системы антиоксидантной защиты (АОЗ) Именно активация ПОЛ и гипоксемия тканей печени лежат в основе развития дезинтоксикационного, гепатотропного, холестатического симптомов. В связи с этим, патогенетическая терапия, направленная на их устранение, проводится при всех типах гепатитов, независимо от этиологии, и требует использования препаратов, сочетающих в себе дезинтоксикационные, антиоксидантные, антигипоксические и гепатопротекторные свойства.
Изучена переносимость и проведена клиническая эффективность препарата "Реамберин 1,5% для инфузий" у детей, больных желтушным вариантом острого вирусного гепатита.
Под наблюдением находилось 45 пациентов с желтушным вариантом острого вирусного гепатита различной этиологии, в возрасте от 8 до 14 лет. Диагноз был установлен на основании клинико-эпидемиологических и биохимических данных, а также подтверждался серологическими и вирусологическими исследованиями. Все больные подвергались обследованию по единой программе; клинически оценивалась выраженность синдрома интоксикации, динамика размеров печени, сроки пребывания в стационаре и велось наблюдение за появлением побочных эффектов от изучаемого препарата. Лабораторный контроль включал: количественное определение билирубина в сыворотке крови, активность АлАТ и АсАТ, гемограмму, общий анализ мочи, специфические маркеры вирусных гепатитов А, В, С, и проводился до начала лечения, после окончания курса и перед выпиской из стационара.
Методом случайной выборки больные дети были разделены на 2 группы: опытную и контрольную. В опытную группу вошло 30 чел. (19 мальчиков и 11 девочек), получавших Реамберин, в контрольную - 15 чел. (11 мальчиков и 4 девочки),получавших 5% раствор глюкозы. Средний возраст детей в группах составил 11,5 и 10,4 года (табл.1). Как видно из таблицы большинство детей (90,0% и 93,3%) переносили вирусный гепатит А (ВГА).
Таблица 1. Характеристика больных и этиология вирусного
гепатита
в опытной и контрольной группах
|
Группа |
М |
Д |
Средний возраст, годы |
Этиология |
||
|
ВГА |
ВГВ |
ВГС |
||||
|
Опытная |
63,3 |
36,6 |
11,5 |
90,0 |
6,7 |
3,3 |
|
Контрольная |
73,0 |
26,6 |
10,4 |
93,3 |
6,7 |
- |
Все больные поступали на одинаковых сроках болезни: 6-7 день от начала заболевания и 2-4 день от начала появления желтухи (табл. 2). По выраженности симптомов интоксикации, уровню гиперферментемии, гипербилирубинемии также существенных различий нами выявлено не было (табл. 2). У детей обеих групп была диагностирована среднетяжелая форма заболевания с нарушением пигментного обмена. Сопутствующая патология регистрировалась у 23,3% больных опытной группы и 26,7% контрольной. Среди сопутствующей патологии регистрировались пиелонефрит, тиреотоксикоз, нейродермит, эпилепсия, хронический гастродуоденит, дискинезия желчевыводящих путей, фурункулез, ОРВИ и отит.
Лечение больных и опытной, и контрольной групп начиналось с поступления в стационар и включало в себя диету N5, базисную терапию (поливитамины, спазмолитики), а также инфузионную терапию – внутривенное капельное введение растворов. Больные опытной группы получали раствор Реамберина 1.5% 10 мл/кг массы 1 раз в сутки, а контрольной – раствор глюкозы 5% в том же объеме. Количество проведенных инфузий определялось длительностью сохранения симптомов интоксикации. На фоне проводимой терапии симптомы интоксикации достаточно быстро купировались, исчезала тошнота, слабость, боли в животе С 4-5 дня от начала лечения улучшался аппетит (табл. 3). Как видно из таблицы после реамберинотерапии нормализация размеров печени отмечалась несколько быстрее Длительность инфузионной терапии была одинаковой и составила в опытной группе 3,4 дня, в контрольной – 3,3 дня.
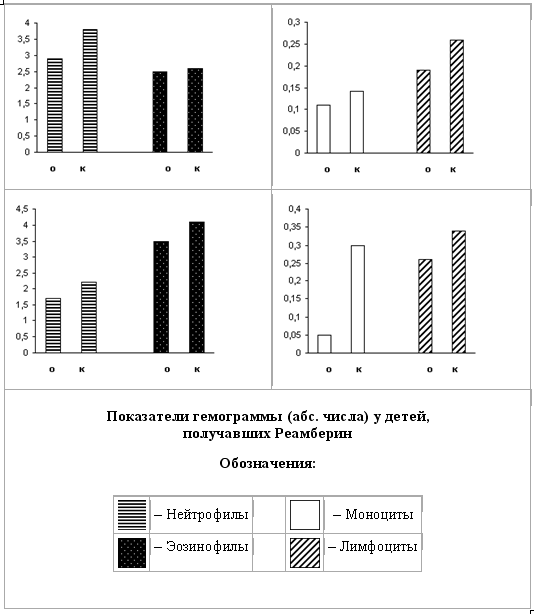
Анализ лабораторных исследований крови и мочи свидетельствовал об отсутствии токсического влияния препарата реамбирин на кроветворную, мочевыделительную системы, а также на аллергизацию организма в целом, (табл. 4).
Таблица 4. Показатели периферической крови у детей,
больных острым вирусным гепатитом,
в опытной и контрольной группах
|
Показатели |
Опытная группа |
Контр. группа |
||
|
до |
после |
до |
после |
|
|
Гемоглобин г/л |
123,1 |
127,1 |
128,3 |
119,0 |
|
Эритроциты 1012/л |
3,2 |
3,6 |
3,4 |
3,9 |
|
Лейкоциты109/л |
5,2 |
5,4 |
4,9 |
7,1 |
|
Палочкоядерные |
5,8 |
5,1 |
6,6 |
5,3 |
|
Сегментоядерные |
40,3 |
49,1 |
38,1 |
48,3 |
|
Эозинофилы |
2,0 |
2,1 |
1,5 |
2,0 |
|
Базофилы |
1,0 |
1,0 |
1,0 |
1,0 |
|
Лимфоциты |
51,1 |
46,3 |
47,9 |
36,0 |
|
Моноциты |
3,6 |
3,6 |
3,2 |
3,6 |
|
СОЭ |
15,6 |
10,2 |
18,5 |
12,2 |
|
Тромбоциты 109/л |
241,5 |
259,0 |
239,1 |
212,4 |
Показатели гемограмм, в том числе и абсолютное число эозинофилов, не претерпевали каких-либо существенных изменений в ходе проведения инфузионной терапии Реамберином. Аналогичные результаты нами были получены и при внутривенной инфузии 5% раствора глюкозы.
Биохимические показатели у детей, получавших Реамберин, имели благоприятную тенденцию к нормализации, хотя статистически существенных различий с контрольной группой после окончания терапии не установлено. Показатели билирубина были выше в опытной группе, что объясняется более высокими его цифрами при поступлении (табл.5).
Таблица 5. Динамика биохимических показателей крови у
детей,
больных острым вирусным гепатитом,
в опытной и контрольной группах
|
Биохимические показатели |
Опытная группа |
Разность показателей |
Контр. группа |
Разность показателей |
|
|
АлАТ, |
до лечения |
1923 |
-1798 |
1780 |
-1692 |
|
после окончания терапии |
1156 |
970 |
|||
|
выписка |
125 |
88 |
|||
|
АсАТ, |
до лечения |
1680 |
-1579 |
1566 |
-1502 |
|
после окончания терапии |
624 |
530 |
|||
|
выписка |
83 |
64 |
|||
|
Билирубин, |
до лечения |
90/58 |
-44,3/-28,3 |
76/52,2 |
-34/-9,3 |
|
после окончания терапии |
45/29 |
41,4/32,1 |
|||
|
выписка |
9,6 |
7,5 |
|||
Препарат Реамберин 1,5% достаточно хорошо переносился больными детьми, однако все же нами были зарегистрированы и его побочные действия. Среди них самым частым был "металлический" привкус во рту, появляющийся в первые 5-10 минут введения препарата, который отмечался у 12 (40,0%) больных. У 2-х (6,6%) детей наряду с "металлическим" привкусом отмечались першение в горле и сухой кашель, что потребовало отмены препарата у одного из больных. Слабость и головокружение выявлены у 1 ребенка. Каких либо тяжелых сопутствующих заболеваний, кроме дискинезии желчевыводящих путей, легкой формы ОРВИ у больных с побочными с эффектами нами не отмечалось. Не установлено также и других негативных проявлений.
Заключение: Проведенным исследованием установлена эффективность препарата Реамберин 1,5% в качестве дезинтоксикационного средства у детей, больных острым вирусным гепатитом, протекающим с нарушением пигментного обмена. При его применении наблюдалось уменьшение длительности симптомов интоксикации, по сравнению с контрольной группой, гепатомегалия исчезала быстрее и сокращался период пребывания детей в стационаре на 3,5 койко-дня (с 21,1 до 18,6). Переносимость препарата Реамберин была достаточно хорошая, а зарегистрированные побочные действия в виде сухого кашля и "металлического" привкуса во рту, появляющихся в первые 5-10 минут после начала введения препарата, в большинстве случаев не требовали его отмены. Инфузионный раствор Реамберин 1,5%, в качестве дезинтоксикационного средства, может быть рекомендован для лечения больных острыми вирусными гепатитами, независимо от этиологии заболевания, с выраженными признаками интоксикации.
Терапевтическая эффективность
препарата Реамберин у детей,
больных острыми кишечными инфекциями,
с выраженными симптомами интоксикации
Тихомирова О.В.
Для решения вопроса об эффективности инфузионного раствора препарата Реамберин (НТФФ "Полисан", Санкт-Петербург) в лечении больных острыми кишечными инфекциями в клинике кишечных инфекций НИИ детских инфекций МЗ РФ Санкт-Петербурга были проведены контролируемые рандомизированные исследования.
Под наблюдением и обследованием находилось 62 ребенка в возрасте от 1года до 12 лет, больные острыми кишечными инфекциями. Диагноз был верифицирован на основании клинико-эпидемиологических, бактериологических и серологических данных с использованием стандартных методов.
По признаку случайной выборки 32 ребенка в острый период заболевания в комплексной терапии получали Реамберин в виде инфузионного раствора. Из них у 6 человек (17,1%) была диагностирована дизентерия Флекснера 2-а и Зонне, у 4 детей (12,5%) - сальмонеллез группы Д enteritidis, 12 больных (37,5%) переносили ротавирусный гастроэнтерит и у 2-х (6,2%) была зарегистрирована клебсиеллезная инфекция. У 8 детей (25%) этиология гастроэнтерита не была расшифрована. Группу сравнения составили 30 детей того же возраста, в комплексную терапию которых в качестве инфузионного раствора вводился глюкозо-солевой раствор. В группе сравнения - дизентерия была диагностирована у 5 больных (16,7%), сальмонеллез - у 4-х больных (13,3%), ротавирусный гастроэнтерит - у 11 детей (36,6%). Одну треть(33,4%) контрольной группы составили больные с острым гастроэнтеритом не установленной этиологии.
Больные в обеих группах были сопоставимы по полу, возрасту, срокам поступления в стационар и тяжести течения заболевания. В испытуемой группе мальчики составили 40,6%, девочки - 59,4 % (в группе сравнения 43,3% и 55,7%, соответственно). Все больные поступали на 2-3-и сутки заболевания. По клинико-лабораторным данным и выраженности симптомов интоксикации у всех больных была диагностирована среднетяжелая форма заболевания.
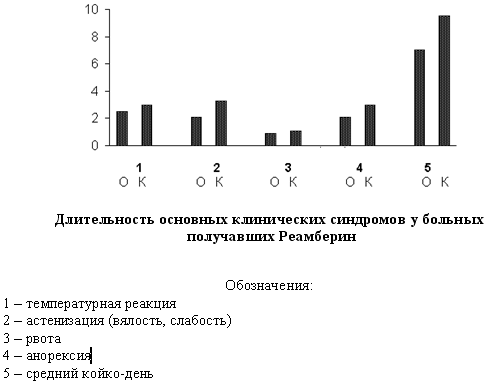
Основные симптомы интоксикации встречались в сравниваемых группах практически с одинаковой частотой, однако продолжительность температуры, рвоты и диареи у детей, получавших Реамберин имела тенденцию к снижению. Длительность таких проявлений интоксикации как слабость, вялость и анорексия, у получавших Реамберин больных была достоверно ниже, чем в группе сравнения. Благоприятная динамика клинических показателей у больных, получавших в комплексной терапии Реамберин, привела к более быстрому выздоровлению и достоверному снижению продолжительности пребывания в стационаре. Койко-день в испытуемой группе составил 7,24±0,52 дня против 9,45±0,41 дня в группе сравнения, р<0,05.
Динамика основных биохимических показателей у обследованных детей представлена в таблице 6.
Таблица 6. Биохимические показатели крови у детей,
больных острыми кишечными инфекциями,
получавших лечение Реамберином и в группе сравнения
|
Показатели |
Испытуемая группа (n=32) |
Группа сравнения |
||
|
До лечения |
После лечения |
До лечения |
После лечения |
|
|
АлАТ (ед/л) |
31,8 |
29,5 |
34,7 |
31,6 |
|
Калий (ммоль/л) |
3,8 |
3,7 |
3,8 |
3,5 |
|
Натрий (ммоль/л) |
135,2 |
134,8 |
134,2 |
133,9 |
|
Мочевина (ммоль/л) |
3,8 |
3,4 |
3,6 |
3,2 |
|
Креатинин(мкмоль/л) |
71,2 |
65,4 |
67,8 |
66,7 |
Статистически достоверных различий в исследуемых биохимических показателях выявлено не было. Уровень мочевины и креатинина в сыворотке крови находился в нормальных пределах и под воздействием Реамберина не претерпевал существенных изменений. Внутривенное введение Реамберина не приводило к изменению содержания основных электролитов крови - калия и натрия, уровень, которых в сыворотке крови находился в нормальных пределах. Следовательно, применение Реамберина не изменяло ионный состав крови и не оказывало гепато- и нефротоксичного эффекта у детей. Данные гемограммы больных острыми кишечными инфекциями в динамике заболевания представлены в таблицах 7, 8.
Таблица 7. Показатели периферической крови у детей,
больных острыми кишечными инфекциями,
получавших лечение Реамберином и в группе сравнения
|
Показатели |
Испытуемая группа |
Группа сравнения |
||
|
До |
После лечения |
До |
После лечения |
|
|
Гемоглобин, г/л |
123,3 |
123,2 |
118,1 |
121,1 |
|
Эритроциты, 1012 |
4,0 |
4,1 |
3,9 |
4,1 |
|
Лейкоциты 109 |
7,6 |
5,5 |
7,5 |
7,8 |
|
СОЭ, |
9,1 |
8,6 |
7,9 |
10,1 |
Таблица 8. Лейкоцитарная формула у больных
острыми кишечными инфекциями детей,
получавших Реамберин и в группе сравнения
|
Показатели |
Испытуемая группа |
Группа сравнения |
||
|
До |
После лечения |
До |
После лечения |
|
|
Лейкоциты, 1099 |
7,6 |
5,5* |
7,5 |
7,8 |
|
Юные |
- |
- |
- |
- |
|
Палочкоядерные |
19,3 |
6,5* |
11,6 |
6,1* |
|
Сегментоядерные |
42,3 |
24,3 |
40,2 |
22,0* |
|
Лимфоциты |
33,0 |
62,6* |
40,3 |
53,4 |
|
Моноциты |
4,9 |
4,8 |
5,4 |
4,4 |
|
Эозинофилы |
0,4 |
0,8 |
2,5 |
3,6 |
*- статистически достоверные различия (р<0,05)
Абсолютное и относительное снижение лейкоцитов происходило за счет уменьшения количества палочкоядерных и сегментоядерных лейкоцитов в динамике болезни, что является закономерным для инфекционного процесса. Одновременно, в группе получавших Реамберин, отмечалось достоверное увеличение относительного (с 33,0±4,22 до 62,6±4,58%) и абсолютного (с 4958±236,5 до 3222±232,8 клеток) содержания лимфоцитов, что свидетельствовало об адекватном формировании клеточного звена иммунного ответа. В группе сравнения достоверных изменений содержания лимфоцитов выявлено не было. Лабораторные данные, отражающие характер изменений в моче, в процессе лечения Реамберином, не претерпевали заметных изменений. Переносимость Реамберина была хорошей. Только в одном случае у ребенка 4-х лет появилась сыпь аллергического характера, которая быстро купировалась после отмены препарата.
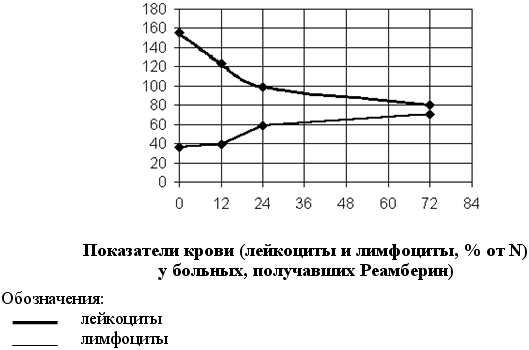
У детей, получавших в комплексной терапии Реамберин внутривенно уже к периоду ранней реконвалесценции отмечалось достоверное снижение количества лейкоцитов в периферической крови, в отличие от больных группы сравнения, у которых в динамике заболевания сохранялся лейкоцитоз (5,5±0,40)х109л против (7,8±0,96)х109л соответственно, р<0,05).
Анализ полученных в результате исследования данных свидетельствует, что внутривенное капельное введение Реамберина в количестве 200-400 мл в течение 2-4-х дней детям в острый период кишечной инфекции, с явлениями интоксикации, независимо от этиологии, оказывало дезинтоксикационное действие. Применение Реамберина приводило к уменьшению продолжительности симптомов интоксикации, по сравнению с группой сравнения, оказывало нормализующее действие на гематологические показатели, что в совокупности обеспечило благоприятное течение болезни и способствовало достоверному снижению сроков пребывания больных в стационаре. Переносимость Реамберина хорошая, он не вызывает токсических реакций местного и общего характера. В отдельном случае отмечено появление аллергической сыпи на составляющие препарата. Инфузионный раствор Реамберина может быть рекомендован для лечения детей, больных острыми кишечными инфекциями различной этиологии, с выраженными симптомами интоксикации в качестве детоксицирующего средства. Практические рекомендации.
Показанием к применению инфузионного раствора Реамберина у детей, больных острыми кишечными инфекциями независимо от этиологии, являются выраженные признаки интоксикации. Инфузионный раствор применяется внутривенно капельно (со скоростью 40-50 капель в минуту) в количестве 200 мл у детей с весом до 20 кг, 400 мл у детей с весом более 20 кг ежедневно в течение 2-4-х дней. Сроки применения могут быть сокращены или увеличены в зависимости от состояния ребенка, тяжести течения заболевания и необходимости продолжения инфузионной терапии. Эффективность лечения, контролируемая по клинико-лабораторным показателям, проявляется в сокращении продолжительности симптомов интоксикации, нормализации показателей общего анализа крови.
Эффективность Реамберина
1,5% раствора для инфузий
при гнойно-септических заболеваниях
у детей
Челнов И. Г., Черемисин В. Е., Гордеев В.И.
В настоящее время препараты янтарной кислоты, к коим относится Реамберин, широко применяются в педиатрии: при воспалительных заболеваниях у новорожденных, острой респираторной патологии и аллергических состояниях у детей.
По фармакологическим свойствам препарат характеризуется как дезинтоксикационный, антигипоксический, антиоксидантный, гепато-, нефро- и кардиопротекторный, что делает его привлекательным для использования в качестве компонента интенсивной терапии в гнойно-септической хирургии у детей, тем более, что таким многогранным комплексным эффектом не обладает ни один из традиционных препаратов инфузионной детоксикации.
Таблица 9. Показатели, используемые в качестве критерия, для оценки эффективности Реамберина
Кроме того, доклинические исследования показали хорошую переносимость Реамберина без токсического или деструктивного воздействия на органы и системы. Существенным является также и то, что он экономичен, доступен и производится в России.
Обследовано 48 пациентов отделения гнойно-септической хирургии КБ СПбГПМА в возрасте от 1 до 15 лет. У 31 из них имелась острая гнойная патология в брюшной полости в основном аппендикулярного происхождения, у 6 - гнойно-воспалительные заболевания л.гких, у 5 - острый гематогенный остеомиелит, у 3 - ЛОР-патология и у 3 - сепсис неясного генеза. Пациенты обследовались по форме, в которой фигурирует 37 контрольных показателя с наблюдением в динамике: до инфузии Реамберина, а также через 12, 24 и 72 часа после инфузии препарата в средней дозе 11,3 мл/кг. Для окончательного анализа выбраны 32 показателя, среди которых были интегральные критерии с использованием всех, предложенных в анкете (пример интегральных показателей: шоковый индекс, индекс циркуляции, средний объ.м эритроцита, средняя концентрация гемоглобина в эритроците, расч.тная осмолярность плазмы).
Для оперативной обработки данных использовали метод сигмальной оценки по Мартину, изложенный в монографии Д. Сепетлиева "Статистические методы в научных медицинских исследованиях" (М., Медицина, 1968, 419 с.).
По параметру "%N" оценка выразилась следующим образом:
- средние величины оказались в пределах 86-152%
- выше средних - от 152 до 185%
- высокие - от 185 до 218%4) очень высокие - выше 218%
- ниже средних - от 53 до 86%
- низкие - от 20 до 53%
- очень низкие - ниже 20%
По параметру "Δ%" аналогично:
- средние величины - от 87 до 129%
- выше средних - от 129 до 150%
- высокие - от 150 до 171%
- очень высокие - выше 171%
- ниже средних - от 66 до 87%
- низкие - от 45 до 66%7) очень низкие - ниже 45%
При анализе табличных данных очевидно, что большинство показателей, выраженных в процентах к средней возрастной норме и более половины таковых, соотнес.нных с исходными данными находятся в зоне средних величин, которую условно можно рассматривать как "стресс-норму", однако отдельные параметры требуют особого комментария:
- Лейкоциты:
- По параметру "N%": до инфузии Реамберина наблюдается лейкоцитоз выше "стресс-нормы" (156%), который через 12 часов после инфузии оказывается в пределах "стресс-нормы" (123%), через 24 часа - 99% от средней возрастной нормы, а на третьи сутки падает на 20% ниже возрастной нормы, тем не менее, составив в среднем за весь период лечения 101% к возрастной норме.
- По параметру "Δ%":через 12 часов после введения Реамберина лейкоцитоз ниже "стресс-нормы" (79% от исходного), а через 24 и 72 часа его величина стабилизируется на уровне оценки "низкий" (64% и 51%, соответственно), составив в среднем за весь пост инфузионный период "низкую" величину по отношению к исходной (65%). Указанный выше лейкоцитоз начального этапа имеет нейтрофильный характер с характерным сдвигом влево и токсической зернистостью нейтрофилов:
- По параметру "N%": сегментоядерные нейтрофилы до введения препарата находятся в зоне "стресс-нормы" (145%), оставаясь в ней в течение всего постинфузионного периода, хотя и с тенденцией к снижению: 136%, 126% и 124%, - в среднем 129% за период исследования.
- По параметру"Δ%": уровень сегментоядерных нейтрофилов - 93% к исходному фону через12 часов после получения препарата, что составляет "стресс-норму", через 24 и 72 часа эта величина снижается до оценки "ниже нормы": 86% и 85% соответственно (88% за период наблюдения в среднем), Примерно аналогичную динамику имеет токсическая зернистость нейтрофилов.
- По параметру "N%" имеет место ярко выраженный палочкоядерный сдвиг, начиная с периода до лечения (312% - "очень высокий" уровень) и продолжаясь после инфузии до 24 часов наблюдения включительно: 318%через 12 часов и 254% через 24 часа (обе величины - "очень высокие"). Через 72 часа указанный показатель оказывается в зоне "стресс-нормы" (140%), в среднем за после инфузионный период составив "очень высокую" величину (237%) к возрастной норме.
- По параметру "Δ%": после стабилизации в пределах "стресс-нормы" за первые 12-24 часа наблюдения (102% и 140% к исходному соответственно) спад до "низкой" величины (45%) на третьи сутки. В среднем за постинфузионный период - 76% к исходному, что означает "ниже нормы".
- Параметр "N%" - лимфоциты: "низкая" . величина до лечения (36% к возрастной норме) сохраняется в этих пределах (39%) и через 12 часов после Реамберина с некоторым нарастанием до уровня "ниже нормы" через 24 и 72 часа (59% и 70% соответственно) со средней величиной за период наблюдения 76% ("ниже нормы"). По параметру "Δ%" ид.т нарастание лимфоцитов по отношению к исходному в процессе лечения от границ "стресс-нормы" через 12 часов (108%) до "высоких"(164%) и "очень высоких" (194%) величин через 24 и 72часа соответственно с "высоким" средним уровнем (155%)в процессе коррекции.
- Исходный "ниже нормы" (66% к возрастной норме)уровень моноцитов продержался до третьих суток лечения (84%, 76%), но через 72 часа достиг "средней нормы" (95%).
- По параметру "Δ%" моноциты дали положительную динамику по отношению к исходному: 128% - N, 116% - N и 145% - "выше нормы" через 72 часа лечения, в среднем дав 30% прироста, т.е. "выше нормы" (130%).
- "Низкий" исходный уровень эозинофилов по отношению к возрастной норме (48%) в процессе лечения существенно возрос: 147% (N) через 12 часов, сохранив уровень "средней нормы" в последующем (102% и 115% - 121% в среднем). Особенно выраженная динамика проявилась по параметру "Δ%": 315%, 219% и 245% со средним значением 260% к исходному, все - в зоне "очень высоких величин".
- Очень ровную динамику от нормальных исходных величин(99% к возрастной норме) и нарастанием по параметрам "N%"и "Δ%" со средними их значениями за время коррекции (114%и 115% соответственно) показали тромбоциты.
- Стабильно "очень высокие" цифры по отношению к возрастной норме в течение всего периода наблюдения продемонстрировала СОЭ: от исходных 432% до 408% в среднем в процессе коррекции. Тем не менее, положительная динамика по параметру "Δ%" была: от 104% (N) через 12часов до 80% к исходному ("ниже нормы") через 72 часа.
- Заметную тенденцию к снижению по параметрам "N%" и"Δ%" показал билирубин: от 131% - к возрастной норме("стресс-норма") до 100% (N) и 76% ("ниже нормы"),соответственно в среднем за период лечения.
- Температурная реакция, начавшись с 38,6 oС к истечению 72 часов составляла 37,3 oС.
- Гематокрит не показал каких-либо особенностей ни по одному из параметров ("N%" и "Δ%"), оставаясь в пределах "средней нормы" (101% и 94% соответственно) в течение всего периода наблюдения.
- Сопряжённые между собой показатели MEV и МСН не выходили за рамки "стресс-нормы" по параметрам "N%" и"Δ%" (в среднем 119%, 98% и 90%, 100% соответственно), отражая видимо, умеренную степень гипоосмии свойственной катаболической фазе синдрома адаптации.
- Аналогичная, даже более ровная ситуация отмечена с сывороточными ионами (Na+, К+, Са2+) и общим белком плазмы: все они по параметрам "N%" и "Δ %" стабильно на протяжении всего наблюдения находились в пределах"средней нормы" - от 93% до 108% без заметной динамики.
- Глюкоза крови в течение всего периода наблюдения находилась в пределах "стресс-нормы": от 128% к возрастной норме до инфузии Реамберина к 108% через 72 часа после инфузии с заметной динамикой снижения е. уровня по отношению к исходной величине: до 85% ("ниже нормы")через 72 часа при средней величине за период коррекции 90%(N).
- Уровень мочевины крови имел тенденцию к снижению по отношению к возрастной норме от 92% (N) до лечения к 82% ("ниже нормы") через 72 часа после коррекции, хотя динамика по отношению к исходной величине была не столь выраженной, прич.м все величины параметра "Δ%"находились в пределах "стресс-нормы" (в среднем 91% за период коррекции).
- С нормальных величин в исходе заметно убывающая динамика отмечена у трансаминаз: до "низких" величин через72 часа после введения Реамберина (65% к исходной величине) при средних величинах за период лечения, преимущественно попадающих в зону "ниже нормы" (70-80%).
- Ни по гемоглобину, ни по параметрам КОС и газам крови существенной динамики также не было: все показатели стабильно находились в зоне "средней нормы" по "N%" и"Δ%" в пределах 90-100%.
- По отношению к возрастной норме частота дыхания в течение всего периода наблюдения, находилась в пределах от "стресс-нормы" в исходе и через 12 часов после инфузии Реамберина(129% и 135% соответственно) до 99-100% в последующем, со столь же выраженной динамикой по параметру "Δ%": от 107%к исходному (N) через 12 часов после инфузии до 79% через 24 и 72 часа, что оценивается "ниже нормы".
- Несколько дольше на верхней границе стресс-нормы и близко к этому по параметру "N%" держались показатели кровообращения: шоковый индекс, коррелирующий с ОЦК, и индекс циркуляции, характеризующий МОС, что в среднем составило больше 120% в постинфузионном периоде при исходных 134-149%. Что же касается динамики по параметру "Δ%", то она не очень выражена и колеблется в пределах нижних границ "стресс-нормы", составляя в среднем от 90% и чуть выше до 80% и уровня "ниже нормы" через 72 часа.
- Отчетливую нарастающую динамику по обоим параметрам продемонстрировало ЦВД: от исходных 62% к возрастной норме ("ниже нормы") оно в процессе лечения поднялось до91%, 116% и 136% (вс. в зоне "средней нормы"). Особенно выраженная динамика проявилась по "Δ%": через 12 часов после введения Реамберина ЦВД возросло по отношению к исходному на 37%, что в целом составило 137%, т.е. "выше нормы"; через 24 часа - 174%, а спустя 72 часа от начала лечения - 200% (и та, и другая величины - "очень высокие") без каких-либо признаков гиперволемии (соответствующая 136% возрастной нормы абсолютная величина - 8 см.вод.ст., т.е. норма, хотя и близкая к верхней границе).
- Ярко проявился диуретический эффект препарата: через 12 часов после его введения почасовой диурез на кг массы тела составил 244% от возрастной нормы, через 24 часа от начала лечения - 208%, через 72 часа - 206%. Все величины в зоне "очень высоких".
Таким образом, включение Реамберина в комплекс интенсивной терапии детей с гнойно-септическими заболеваниями привело к следующим отчётливым изменениям:
- Снижение лейкоцитоза, по отношению к исходному уровню, минимум на 20% максимум на 50%, при сохранении количества лейкоцитов в среднем в пределах 100% к возрастной норме в течение ближайших 12-72 часов острого периода. Это сопровождается существенным снижением доли незрелых форм (на 25-50% к исходному) и токсического поражения зрелых нейтрофилов.
- Наряду со снижением лейкоцитоза, главным образом, за счёт незрелых нейтрофилов, происходит нарастание числа лимфоцитов. Интенсивность этого нарастания от коэффициента 1,08 (108% к исходному) через 12 часов после введения Реамберина к концу первых суток достигает коэффициента 1,64 (164% к исходному), а через 72 часа почти удваивается (194% к исходному). Однако, даже через72 часа, дефицит лимфоцитов по отношению к возрастной норме ещ. сохраняется в пределах более 20%. Примерно такая же динамика, но с гораздо меньшей интенсивностью нарастания (в среднем 130% к исходному) отмечена и у моноцитов. Эти изменения со стороны лимфоцитов и моноцитов, наряду с очень высокой реакцией на лечение со стороны эозинофилов (в среднем до 260% к исходному при 121% к возрастной норме), свидетельствуют об активации иммунной защиты. Максимальная выраженность реакции эозинофилов через 12 часов после введения Реамберина (147% к возрастной норме и 315% к исходной величине)позволяет предположить вероятность аллергических или псевдоаллергических реакций на препарат, хотя клинических проявлений таковых мы не наблюдали ни у одного из пациентов.
- Эффективность подавления инфекционного гнойно-септического процесса в результате лечения продемонстрировало также активное динамическое снижение СОЭ (правда, при сохранении очень высоких цифр до конца наблюдения - до 408% к возрастной норме в среднем и билирубина, как к возрастной норме (до 100% в среднем), так и к исходному уровню (более20.0%), о том же свидетельствовала и температурная реакция, которая, начавшись с 38,6., к истечению 72 часов составляла 37,3..
- Умеренно увеличенный средний объем эритроцита (MEV до 119% к возрастной норме в среднем) и тенденция к снижению средней концентрации гемоглобина в н.м (МСН до 90%), наряду с таким же умеренным снижением натрия сыворотки отражали столь же умеренную степень гипоосмии (до минимум 270 мосм.кг), которая свойственна катаболической фазе синдрома адаптации. Нет убедительных оснований связать это с гипонатриемическим эффектом (по клиническим наблюдениям) Реамберина, хотя готовность к динамическому контролю и коррекции натрия при использовании Реамберина должна быть.
- Нами не отмечено существенных особенностей изменения прочих лабораторных показателей, (глюкозы крови) которая в течение всего периода наблюдения находилась в пределах "стресс-нормы": от 128% к возрастной норме до инфузии Реамберина к 108% через 72 часа после инфузии с заметной динамикой снижения е. уровня по отношению к исходной величине: до 85% ("ниже нормы") через 72 часа при средней величине за период коррекции 90% (N). Наблюдаемая иногда в клинике взрослых гипергликемия, как реакция на Реамберин в нашем исследовании не подтвердилась.
- Нами не отмечены какие-либо негативные изменения дыхания и кровообращения у обследованных больных: все они показали динамику ЧД, ЧСС, АД, ШИ и ИЦ в полном соответствии с физиологическими проявлениями адренергической фазы синдрома адаптации без каких-либо признаков декомпенсации, в том числе, шоковой. Особенности отмечены лишь по динамике ЦВД:( от исходных 62% к возрастной норме ("ниже нормы") оно в процессе лечения поднялось до 91%, 116% и 136% (вс. в зоне "средней нормы"). Особенно выраженная динамика проявилась по "Δ%": через 12 часов после введения Реамберина ЦВД возросло по отношению к исходному на37%, что в целом составило 137%, т.е. "выше нормы"; через 24 часа - 174%, а спустя 72 часа от начала лечения -200% и та, и другая- величины очень высокие, без каких-либо признаков гиперволемии (соответствующая 136% возрастной нормы абсолютная величина - 8.см.вод.ст., т.е. норма, близкая к верхней границе).
Таким образом, показан эффективный волемический эффект, который оказывается в некотором противоречии с диуретическим эффектом Реамберина: через 12 часов после его введения почасовой диурез на кг массы тела составил 244% от возрастной нормы, через 24 часа от начала лечения - 208%, через 72 часа - 206%. Все величины в зоне "очень высоких", это также как и гипонатриемический феномен Реамберина, требует внимания и наблюдения. Эта проблема, не возникает в связи с динамической коррекцией на основе адаптивной интенсивной терапии, принятой в КБ СПбГПМА, что подч.ркивает хорошую управляемость препарата и перспективность его использования при гнойно-септических заболеваниях у детей.
С учетом вышеизложенного, целесообразно рекомендовать 1.5% раствор Реамберина для инфузий в практику отделений интенсивной терапии и реаниматологии в качестве дезинтоксикационного средства при гнойно-септических заболеваниях у детей.
Патогенетическое обоснование
и клиническая эффективность
применения Реамберина
в терапии атопического дерматита у детей
И.Г.Короткий, О.Д. Куликова
Проблема лечения атопического дерматита у детей одна из наиболее актуальных в современной медицине. Социальная значимость е. обусловлена увеличением общего числа больных, в том числе и детей старшего возраста, а также недостаточной эффективностью терапии, что приводит к нарушению психо-эмоционального развития детей и подростков, при этом, страдает и их социальная адаптация.
Вместе с тем, сложность патогенеза атопического дерматита, вовлечение в патологический процесс всех органов и систем, созда.т значительные трудности в выборе оптимальных способов фармакологической коррекции. Общепризнанным универсальным неспецифическим патогенетическим звеном в развитии атопического дерматита, является усиление перекисного окисления липидов (ПОЛ) мембран, в результате чего нарушается их структурная целостность, повышается проницаемость и изменяется функциональное состояние. Активация ПОЛ вед.т к нарушению центральных механизмов регуляторных систем, развитию метаболического ацидоза, гипоксии, что является одной из причин, вызывающей воспалительный процесс кожных покровов, на этом фоне снижаетя антиоксидантная защита, значительно ухудшая адаптационно-защитную реакцию организма в ответ на воздействие различных раздражителей.
Применение известных антиоксидантов, как прямого, так и не прямого действия у больных атопическим дерматитом ограничено, вследствие нарушения всасывания в кишечнике, возникновения аллергических реакций как на сами препараты, так и на их метаболиты, плохой проницаемости большинства из них через биологические мембраны.
В связи с этим, вызывает большой интерес и является перспективным, использование производных янтарной кислоты в различных модификациях.
Основной механизм действия янтарной кислоты состоит в прямом воздействии на клеточный метаболизм за сч.т "монополизации дыхательной цепи" митохондрий. Биологический смысл которого заключается в быстром ресинтезе клетками АТФ и повышении их антитиоксидантной резистентности; кроме того, в условиях гипоксии повышается НАД зависимый транспорт свободного кислорода, восстанавливаются НАД-зависимые дегидрогеназы, нормализуя тем самым энергетический баланс митохондрий, стабилизируя их структуру и функциональную активностъ, то есть энергообеспечение, это ведет к устранению тканевой гипоксии и метаболического ацидоза.
Под наблюдением находилось 59 детей с атопическим дерматитом в возрасте от 10 до 15 лет. Тяжесть течения заболевания оценивалась по индексу SCORAD. Давность заболевания составляла от 9 до 14 лет.
Субъективно всех детей беспокоил интенсивный зуд, особенно в ночное время (даже при легком течении заболевания).
Реамберин вводится внутривенно, капельно из расчета 10 мг/кг массы. Курс лечения состоял из 5 инфузий, вводили препарат через 2 - 3 дня. Общая курсовая доза препарата составила 32 - 60 мг/кг массы.
После лечения Реамберином клиническая ремиссия наблюдалась у 25,4% детей, значительное улучшение - у 49,2% и улучшение - у 23,7% пациентов. Не выявлено положительной динамики у 1 больного с тяжелым течением (1,7%)
По соотношению значений малонового диальдегида и показателей общей антиокислительной активности рассчитывали индекс пероксидации (ИП), а по соотношению продуктов ПОЛ и уровней церулоплазмина и токоферола высчитывали интегральный показатель соотношения ПОЛ/АОА коэффициент "К".
До начала терапии Реамберином у всех больных выявлено повышение уровня токоферола, по сравнению с контролем, причем максимально высоким этот показатель был у детей с легкой и средней тяжестью течения заболевания, превышая контрольные значения в 2 раза, тогда как у больных с тяжелым течением, этот показатель был увеличен в 1,7 раза.
Уровень церулоплазмина в сыворотке крови детей, исследуемой группы также превышал значения такового, у больных в контрольной группе: при легком течении - в 1,2 раза, при средней степени тяжести в 1,3 и при тяжелом течении в 1,1 раза.
Общая антиокислительная активность сыворотки у больных с легким течением заболевания была выше в 1,3 раза контрольных значений, а при средней степени тяжести и тяжелом течении - в 1,2 и 1,4 раза соответствeнно.
Индекс пероксидации до начала лечения превышал таковой в контрольной группе в 1,8; в 2,4 и 2,1 раза.
Коэффициент "К" у больных также был выше аналогичного показателя больных контрольной группы; при легком течении - в 1,4 paзa, при средней степени тяжести в 1,6 раза, а у больных с тяжелым течением заболевания в 2,5 раза.
Таким образом, полученные данные свидетельствуют о том, что при атопическом дерматите у детей имеется значительное усиление процессов перекисного окисления липидов на фоне увеличения показателей антитоксидантной системы.
В группе больных с тяжелым течением заболевания констатировали клиническую ремиссию у 4 больных, значительное улучшение - 19 больных, улучшение у 8 пациентов. Надо отметить, что практически у всех пациентов после первой инфузии значительно уменьшился зуд, побледнела эритема, а после четвертой инфузии уменьшилась инфильтрация и лихенизация. К окончанию курса терапии документировано улучшение цвета кожи, уменьшение сухости и отсутствие шелушения.
Во второй группе больных, со средней тяжестью течения заболевания, констатировали клиническую ремиссию у 5 детей, значительное улучшение у 7 пациентов и улучшение у 7 детей. В этой группе, как и в предыдущей, после первой инфузии Реамберина значительно уменьшился или полностью прекратился зуд, после окончания лечения практически все очаги инфильтрации и лихенизации разрешались.
Среди больных с легким течением клиническая ремиссия наступила у 6-ти, значительное улучшение у 3-х детей.
Следует отметить, что после первой и второй инфузии у всех пациентов улучшалось общее состояние, повышалось настроение, нормализовался сон и аппетит.
Изучены показатели перекисного окисления липидов (ПОЛ) и антиоксидантнои системы (АОС) сыворотки до и после лечения. Состояние ПОЛ оценивали по содержанию промежуточных (диеновые конъюгаты) и конечных (малоновый диальдегид) продуктов. Антиокислительную активность сыворотки крови оценивали по уровню токоферола, церулоплазмина, показателю общей антиокислительной активности сыворотки (ОАОА).
После проведения курса лечения Реамберином наблюдали достоверное снижение уровня токоферола у больных с легким течением в 1,7 раза, у больных со средней степенью тяжести в 1,8 раза, а при тяжелом течении снижение этого показателя было недостоверным.
Содержание церулоплазмина в сыворотке также имело тенденцию к снижению у больных всех групп. У детей со средней степенью тяжести наблюдалась нормализация этого показателя, а при тяжелом течении уровень церулоплазмина снизился в 1,1 раза и достоверно не отличался от контроля.
Показатели общей антиокислительной активности после проведенной терапии имели четкую тенденцию к повышению (в среднем в 1,5 раза). Индекс пероксидации после лечения напротив уменьшился в 1,5 раза при легком течении, в гpyппe больных со средней степенью тяжести в 1,6 раза, при тяжелом течении в 1,2 раза.
На фоне лечения Реамберином коэффициент снижался, особенно у больных с тяжелой степенью тяжести течения - в 1,5 paзa.
Таким образом, анализируя динамику лабораторных показателей и клиническую эффективность, патогенетически обоснованным является использование Реамберина в терапии атопического дерматита. В процессе проводимой терапии не отмечено побочных реакций и осложнений, все больные хорошо переносили лечение. Реамберин является высокоэффективным препаратом, который способствует смягчению течения заболевания, удлиняя при этом сроки ремиссии, нормализуя аптиоксидантную защиту организма.
Приложение
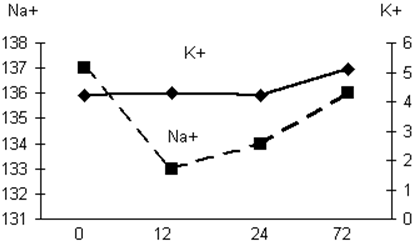
Уровень электролитов (абс. ед) у больных,
получавших Реамберин
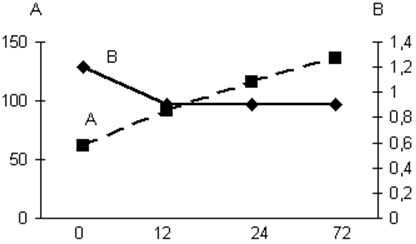
Показатели ЦВД (А) и индекс Альговера (В) у больных, получавших Реамберин
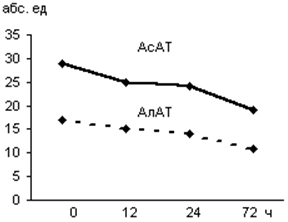
Уровень АлАТ и АсАТ у больных,
получавших Реамберин
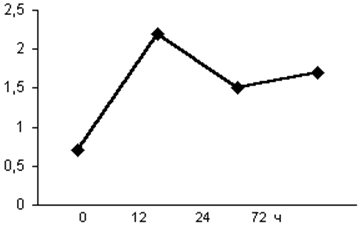
Уровень эозинофилов (абс. числа) у детей, получавших Реамберин
Список литературы
- Ивницкий Ю.Ю., Головко А.И., Софронов Г.А. Янтарная кислотав системе средств метаболической коррекции функционального состояния и резистентности организма.-СПб.-1998.
- Ивницкий Ю.Ю. Интенсивность клеточного дыхания и радиорезистентность организма // Автореф. дис. доктора медицинских наук.-СПБ.-1994.
- Коваленко А.Л., Романцов М.Г., Петров А.Ю. //Врач.-1999.-N10.
- Маевский Е.И., Гришина Е.В., Окон М.С. Фармакологическая коррекция гипоксических состояний // В сб. НИИ фармакологии АМН СССР-1989.-С.80-82.
- Терапевтическое действие янтарной кислоты /под ред. М.Н. Кондрашевой. - Пущино; НИИ биофизики АН СССР.-1976.
- Янтарная кислота в медицине, пищевой промышленности, сельском хозяйстве / под ред. М.Н. Кондрашевой. - Пущино, ОНТИ РАМН.-1996.
- Романцов М.Г., Сологуб Т.В., Коваленко А.Л. Реамберин 1.5% для инфузий - применение в клинической практике.-СПБ.-2000.