Современные определения
и общие механизмы развития
полиорганной дисфункции-недостаточности
Синдром полиорганной дисфункции-недостаточности (СПОН), Multiple Systems Organ Failure (MSOF), Multiple Organ Dysfunction Syndrome (MODS) в настоящее время определяется, как универсальное поражение всех органов и систем организма в результате тяжёлой неспецифической стресс-реакции на множественные этиологические факторы, когда нарушения физиологических функций отдельных органов и систем не могут спонтанно восстанавливаться путём ауторегуляции для поддержания постоянства внутренней среды в целом и сохранения собственной структуры в частности и требуют частичной или полной коррекции или протезирования утраченных функций [1].
Для СПОН характерна однотипность патологических изменений независимо от характера патологического процесса и особенностей этиологического фактора, приводящих к развитию критического состояния.
Причины развития СПОН разнообразны и сложны, до настоящего времени не сформулированы единые механизмы его развития, нет единых методов его профилактики и лечения.
По данным Ferreira F.L. et al, 2002 [2,8], летальность, обусловленная СПОН, остаётся высокой и зависит от количества систем, вовлечённых в патологический процесс. Так, при недостаточности двух систем летальность составляет 30 -40%, а трёх-четырёх – 90-97%. У больных, находящихся в критических состояниях, наиболее часто определяется дыхательная недостаточность (65-80%), недостаточность кровообращения (60%), почек (60%), печени (50%).
У больных, находящихся в отделениях интенсивной терапии (ОИТ) СПОН развивается у 15-20% пациентов. Непосредственными факторами, которые определяют выраженность полиорганной дисфункции, являются: различные способности органов противостоять гипоксии и снижению кровообращения; характер шокового агента; исходное состояние самого органа.
В механизмах поражения органов и систем важное значение имеют следующие факторы [3]:
- Глубокая продолжительная гипоксия, возникающая в период шока и прогрессирующая после рециркуляции и реоксигенации.
- Длительное выраженное нарушение перфузии тканей несмотря на стабилизацию центральной гемодинамики.
- Раннее развитие и длительность нарушений гемокоагуляции.
- Степень нарушений тканевого клеточного метаболизма.
- Генерализованная инфекция.
По этиологии СПОН разделяют на два основных вида:
- СПОН, возникающий в связи с нарастанием тяжести основной патологии.
- Ятрогенный СПОН, возникающий в связи с профилактическими, диагностическими, лечебными медицинскими действиями.
По клиническому течению различают два варианта СПОН:
- Быстрое развитие, когда клинические признаки возникают в первые 24 – 48 часов от начала действия этиологического фактора.
- Каскадное течение с постепенным и последовательным развитием нарушений различных органов. В большинстве случаев последовательность вовлечения систем в СПОН выглядит таким образом: острое повреждение лёгких’энцефалопатия’синдром почечной дисфункции’синдром печёночной дисфункции’стресс-язвы желудочно-кишечного тракта.
В развитии СПОН выделяют три основных фазы:
- Индукционная фаза, результатом которой является синтез целого ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа (ССВО).
- Каскадная фаза, сопровождающаяся развитием острого повреждения лёгких, активацией каскадов калликреин-кининовой системы, цикла арахидоновой кислоты, систем коагуляции и фибринолиза.
- Фаза вторичной аутоагрессии, предельно выраженной органной дисфункции и метаболического стресса, когда органы больного утрачивают способность к самостоятельной регуляции гомеостаза.
Сепсис является наиболее частой причиной развития СПОН, как определяющего фактора критических состояний. СПОН следует рассматривать, как наиболее тяжёлую степень ССВО, имеющего два основных пути его развития. Первичный СПОН является прямым результатом воздействия определённого повреждающего фактора любой этиологии. Вторичный СПОН развивается после латентной фазы и является результатом генерализованного системного ответа организма на повреждающий фактор, чаще инфекционного генеза – септический вариант СПОН.
Последовательность органных нарушений при сепсисе зависит от ряда факторов [1-4].
- Характер и локализация септических очагов и микробиологические факторы. Наиболее частым очагом инфекции являются лёгкие, затем следует брюшная полость и мочевыводящие пути. У 20-30% больных не удаётся установить локализацию первичного очага.
- Антимикробная терапия может вызвать парадоксальную индукцию септического шока (реакция Яриша-Герцгеймера). К сожалению, большинство антибактериальных препаратов обладают органотоксичностью и способны углубить СПОН.
- Неконтролируемая транслокация условно-патогенных микробов вследствие нарушения барьерной функции кишечника поддерживает септический процесс даже при достаточно эффективной санации других очагов инфекции.
- Развитие альтернативных очагов инфекции, например, нозокомиальной пневмонии.
- Транслокация условно-патогенной флоры с поверхности слизистых оболочек и даже с кожи.
- Вторичные повреждения отдельных органов вследствие феномена ишемии-реперфузии.
- Исходное состояние отдельных органов.
- Тяжесть нарушения функции отдельных органов и систем: чем ниже парциальное давление кислорода в артериальной крови при ОРДС или чем выше уровень креатинина при почечной недостаточности, тем вероятнее вовлечение других органов и систем в СПОН.
- Выраженность гипоперфузии органов и тканей, нарушений микроциркуляции, гипоксии, аномально высокие концентрации промежуточных и конечных продуктов метаболизма, биогенных аминов, продуктов перекисного окисления липидов, которые усиливают «медиаторную бурю».
Биохимические основы
полиорганной недостаточности
Органная недостаточность является следствием уникальной комбинации клеточных, метаболических, сосудистых и воспалительных нарушений у больных, находящихся в критических состояниях.
Активация воспаления
Инициальный ответ организма на причинный фактор индуцирует провоспалительное состояние с продукцией воспалительных медиаторов: фактора некроза опухолей (tumor necrosis factor – alpha – TNF-α), интерлейкинов IL-1, IL-6, лейкотриенов, простагландинов, интегринов, селектинов, оксида азота и других биологически активных веществ[4]. Для защиты от деструктивного действия избыточных концентраций провоспалительных медиаторов организм выделяет противовоспалительные медиаторы, в частности IL-4, IL-10. Нарушение баланса между про- и антивоспалительными медиаторами приводит к клеточному повреждению, нарушениям тканевого метаболизма и органной дисфункции.
Метаболический ответ на воспаление
Провоспалительные медиаторы повышают метаболические потребности висцеральных клеток. Смесь цитокинов TNF-α, IL-1, IFN-γ резко увеличивают потребность клеток в кислороде с повышением анаэробного гликолиза. В результате митохондриальной дисфункции при сниженной доставке кислорода возрастает потребление глюкозы, продукция лактата. Ткани, которые чаще потребляют глюкозу, превращают её быстрее в лактат, чем в конечные продукты. В результате лактат транспортируется в печень, где превращается снова в глюкозу (цикл Кори). Часть тканей организма потребляет жирные кислоты и кетоновые тела как энергетический субстрат, недостаточная адаптация тканей к липидам и кетоновым телам повышает протеолиз. Фактор, индуцирующий протеолиз (proteolysis inducing factor – PIF) во взаимодействии с цитокинами TNF-α, IL-1 в присутствии эссенциальных кофакторов – кортикостероидов, оксида азота, свободных кислых радикалов, ингибирующих анаболические факторы – инсулин, инсулиноподобный фактор роста – IGF-1, провоцируют цитокин-индуцированный протеолиз с повреждением мышечных белков и нарушением синтеза протеинов.
Биосинтез глюкозы из углеводных прекурсоров – аминокислот, пирувата, лактата и глицерола, является универсальным механизмом у животных, грибов и микробов.
Повреждение митохондрий с деполяризацией их мембран и нарушением редокси-статуса в митохондриальном аппарате играют центральную роль в продукции фактора, инициирующего апоптоз (apoptosis initiating factor – AIF).
В условиях свободно-радикального и оксидативного стресса, антигенной нагрузки и гипоксии усиление апоптоза лежит в основе нарушений в иммунной системе.
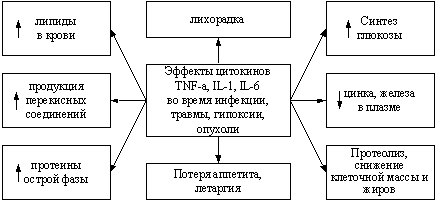
Рис. 1. Метаболический ответ на инфекцию, травму, опухоли,
хирургические вмешательства (Grimble R. F., 2004).
В результате развивается гиперметаболическое состояние, ускоренная потеря белка скелетных мышц, возрастает толерантность к глюкозе, повышается продукция белков острой фазы с появлением лихорадки, лейкоцитоза, что определяется, как острофазовый ответ на повреждение – интегральный ответ организма на критическое состояние. Общие механизмы метаболического ответа на инфекцию, травму, опухоли и хирургические вмешательства представлены Grimble R.F., 2004[5].
Коагулопатия – ведущий путь к органной дисфункции-недостаточности.
Провоспалительные цитокины IL-1a, IL-1b, TNF-α индуцируют выделение из эндотелиальных клеток и моноцитов тканевого фактора (TF), являющегося ключевым медиатором между иммунной и свёртывающей системами и принципиальным активатором внешнего пути коагуляции. TF взаимодействует с фактором VIIa, формируя VIIa-TF-комплекс, активирующий факторы IX и X. Усиление коагуляции через тромбин-опосредованные процессы сочетается с активацией факторов V, VIII, XI в заключительной стадии и сопровождается образованием значительного количества тромбина. Фибриновые нити формируют сгусток с активацией тромбоцитов в местах эндотелиального повреждения с последующим образованием стабильного тромба.
В большинстве экстремальных случаев разбаланс между воспалением, коагуляцией и фибринолизом результируется в распространённую коагулопатию и микрососу-дистый тромбоз [6].
Коагулопатия, известная как ДВС-синдром, является предвестником полиорганной недостаточности и часто предвещает неблагоприятный исход. Снижение эндогенного протеина С – интегрального модулятора воспаления, коагуляции и фибринолиза указывает на развитие неконтролируемых изменений в этих каскадах с переходом от системного воспалительного ответа к тканевой гипоперфузии, органной дисфункции и недостаточности.
Схема патогенеза полиорганной недостаточности представлена на рисунке 2.
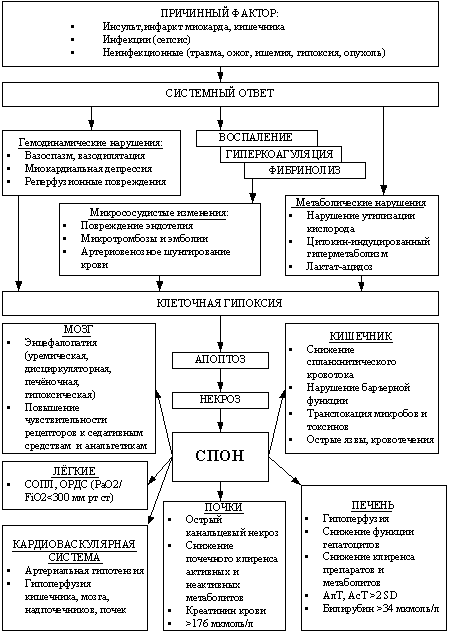
Рис. 2. Схема патогенеза полиорганной дисфункции-недостаточности (Lerch C. et al., 1999 с дополнениями).
Клинические маркеры органной дисфункции и диагностические системы.
Для оценки полиорганных нарушений в настоящее время используются клинические и биохимические критерии, составляющие основу балльных систем (Multiple Organ Dysfunction Syndrome – MODS, Sequential Organ Failure Assessment – SOFA, Logistic Organ Dysfunction System – LODS, Brussels Score – BS).
Признаки острой органной дисфункции для различных популяций больных представлены в собирательной модифицированной модели Balk R.A., Levi M. еt al., Marshall J.C. et al., Baue A.E., Smith O.P. et al., 2002. [1]:
Респираторная дисфункция определяется, как нарушение состояния оксигенации со снижением индекса PaO2/FiO2, необходимостью в дополнительной инсуффляции кислорода, повышении ПДКВ или искусственной вентиляции лёгких. Градации этих параметров отражают степень дисфункции с недостаточностью лёгких, если требуется FiO2 > 0,40 или ПДКВ > 5 см вод ст или ИВЛ.
Почечная дисфункция выражается клинически значимым нарушением диуреза (d 400 мл/сут) или повышением концентрации креатинина выше 176 мкмоль/л, когда необходимы гемодиализ или другие виды терапии с восполнением дефицита жидкости, коррекцией КЩС, электролитного гомеостаза.
Сердечно-сосудистая дисфункция может проявляться артериальной гипотензией, аритмиями, необходимостью применения инотропных и вазопрессорных средств.
Печёночная дисфункция может начинаться появлением желтухи, гипербилирубинемии > 34,2 мкмоль/л, повышением уровня печёночных энзимов в 2 и более раз, затем гипоальбуминемией и удлинением протромбинового времени.
Гематологическая дисфункция может характеризоваться тромбоцитопенией, лейкоцитозом или лейкопенией и маркерами коагулопатии, включая протромбиновое время, активированное частичное тромбиновое время, Д-димеры и другие признаки ДВС, снижением гематокрита < 0,2 л/л.
Гастроинтестинальная дисфункция определяется признаками динамической кишечной непроходимости, наличием эрозий и острых язв слизистой оболочки пищевода, желудка, кишечника, бескаменного холецистита, панкреатита, перфорации кишечника или некротизирующего энтероколита.
Неврологическая дисфункция характеризуется нарушением ментального статуса, который оценивается по шкале ком Глазго, а также наличием признаков перифери-ческой полинейропатии.
Эндокринная дисфункция проявляется гипергликемией, гипертриглицеридемией, гипоальбуминемией, снижением массы тела, гиперкатаболизмом, адреналовой дисфункцией.
Иммунологическая дисфункция может сопровождаться развитием нозокомиальных инфекций, лейкоцитозом, лихорадкой.
Для динамической оценки СПОН целесообразно использовать шкалу MODS или SOFA [1] (приложение 1).
Основные направления профилактики и
лечения
полиорганной дисфункции
Адекватное лечение основного заболевания лежит в основе профилактики СПОН. Следует оценить наличие многочисленных факторов, играющих роль в развитии полиорганной дисфункции. Согласно R. Balk, 2002 [7] к ним относятся:
- Факторы хозяина (возраст, сопутствующие заболевания, вредные привычки);
- Первичное клеточное повреждение;
- Неадекватная тканевая перфузия;
- Микро- и макротромбозы;
- Ишемия-реперфузия;
- Диффузное повреждение эндотелиальных клеток;
- Циркулирующие воспалительные медиаторы;
- Снижение потребления белка и других нутриентов;
- Транслокация токсинов и бактерий;
- Дефицит глобулярного объёма;
- Побочные эффекты терапевтических вмешательств.
Предвестниками СПОН у критических больных становятся признаки системного воспалительного ответа (эпизоды гипертермии выше 38оС, тахикардия более 100 мин-1, тахипноэ более 20 дыханий в минуту, лейкоцитоз выше 12*109/л или сдвиг в лейкограмме до 10 и более незрелых форм).
Появление признаков ССВО и биохимических маркеров (гипергликемия более 7,7 ммоль/л при отсутствии сахарного диабета, снижение концентрации протеина С, снижение сатурации венозной крови ниже 70%, повышение уровня лактата более 1 ммоль/л) свидетельствуют в пользу инфекционного генеза воспаления, что предполагает немедленную диагностику возможных первичных инфекционных очагов у больных, находящихся в ОИТ. Вероятными источниками сепсиса могут быть центральный венозный доступ, интубационная или трахеостомическая трубка, уретральный катетер, назогастральный зонд, а следствием инфицирования становятся бактериемия, нозокомиальная пневмония, трахеобронхит, плевриты, синуситы, инфекционный эндокардит.
Для их исключения или подтверждения следует провести необходимые исследования, включая рентгенологические, УЗИ-сканирование, компьютерную томографию.
Ключевые рекомендации для профилактики и лечения полиорганных нарушений у критических больных, при тяжёлом сепсисе и септическом шоке представлены международным Комитетом Движения за выживаемость при сепсисе (Surviving Sepsis Campaign) в 2004 году для их широкого применения, которые включают [9]:
А. 1. Первоначальная интенсивная терапия должна начинаться немедленно после распознавания синдрома ещё до поступления больного в ОИТ. Целью её должно быть достижение следующих конечных пунктов:
- ЦВД 100 – 160 мм вод ст;
- Среднее артериальное давление (САД) e65 мм рт ст;
- Диурез >0,5 мл/кг/ч;
- Сатурация венозной крови e70%.
2. Если в первые 6 часов интенсивной терапии сатурация смешанной венозной крови не достигает 70% при уровне ЦВД 100 – 160 мм вод ст, прибегают к переливанию эритроцитной массы для достижения уровня Ht >0,3 л/л или назначают инфузию добутамина (не более 20 мкг/кг/мин).
В. Диагностика инфекции
- До назначения антибактериальной терапии обязательный забор проб материала для бактериологического исследования.
- Должны быть проведены необходимые диагностические исследования для выявления первичного инфекционного очага.
С. Антибактериальная терапия
- Внутривенная антибиотикотерапия широкого спектра действия начинается в первый час после распознавания инфекции после взятия образцов материала для бактериологического исследования.
- Стартовая эмпирическая антибактериальная терапия должна включать одно или более средств с высокой активностью против вероятных патогенов и прониканием в ткани предполагаемого очага инфекции.
- Через 48 – 72 часа после стартовой эмпирической антибиотикотерапии необходимо оценить её эффективность и провести коррекцию.
- Если уточнено, что имеющийся синдром неинфекционного генеза, антибактериальная терапия должна быть приостановлена.
Д. Контроль состояния септического очага предполагает диагностику первичного очага и его хирургическое дренирование.
Е. Инфузионная терапия
- Инфузионная терапия проводится с использованием натуральных или искусственных коллоидных растворов или растворов кристаллоидов. Нет доказательств в пользу того или другого типа инфузионных сред.
- У больных с гиповолемией начальная скорость введения растворов в первые 30 минут составляет для коллоидов 300 – 500 мл, для кристаллоидов от 500 до 1000 мл. При отсутствии адекватного ответа (повышение АД и ЦВД) начальная нагрузочная проба может повторяться до достижения заданных конечных пунктов.
F. Применение вазопрессоров
- Если соответствующее введение жидкости не приводит к восстановлению адекватного АД и органной перфузии, прибегают к терапии вазопрес-сорами.
- Норадреналин или допамин являются вазопрессорными агентами первого выбора. Норадреналин более эффективен для коррекции гипотензии.
- Низкие дозы допамина не должны применяться для почечной протекции, как составная часть лечения тяжёлого сепсиса.
G. Инотропная терапия.
- У больных с низким сердечным выбросом препаратом первого аыбора является добутамин. При низких цифрах АД он может сочетаться с вазопрессорной терапией.
- Стратегия с повышением сердечного выброса до супранормального уровня не рекомендуется.
H. Кортикостероиды
- У больных с септическим шоком показан гидрокортизон в дозе 200-300 мг/сут в течение 7 дней.
- Дозы гидрокортизона не должны превышать 300 мг/сутки.
- При отсутствии признаков шока кортикостероиды не должны назначаться, исключая случаи их назначения по эндокринологическим показаниям.
J. Рекомбинантный человеческий активированный протеин С (rhAPC) рекомендован у больных с высоким риском смерти (APACHE II >25 баллов), полиорганной дисфункцией при отсутствии абсолютных противопоказаний (активное кровотечение, опасность кровотечения и др.)
I. Назначение препаратов крови
- При стойкой тканевой гипоперфузии при отсутствии признаков кровотечения эритроцитная масса назначается при снижении уровня Hb ниже 70 г/л.
- Эритропоэтин не рекомендован, как специфическое средство для лечения анемии, ассоциированной с тяжёлым сепсисом, но может быть назначен при наличии хронической почечной недостаточности.
- Рутинное применение свежезамороженной плазмы для коррекции нарушений свёртывающей системы не рекомендуется при отсутствии кровотечения или инвазивных процедур.
- Применение антитромбина III для лечения тяжёлого сепсиса и септического шока не рекомендуется.
- Тромбоцитарная масса назначается при тромбоцитопении <5000 в 1 мм3 для предупреждения кровотечений.
К. Респираторная терапия при синдроме острого повреждения лёгких и ОРДС.
- При СОПЛ/ОРДС высокие дыхательные объемы в сочетании с высоким давлением к концу выдоха должны быть исключены. Следует постепенно уменьшать ДО каждые 1 – 2 часа до уровня 6 мл/кг расчётной массы тела в сочетании с поддержанием пика давления на вдохе ниже 30 см вод. ст, удерживая SaO2 в пределах 88 – 95%.
- Умеренная гиперкапния в сочетании с низкими дыхательными объёмами может быть полезной при ОРДС (допустимая гиперкапния).
- Минимальное положительное давление в конце выдоха должно применяться для профилактики легочного коллапса. Оптимальные значения ПДКВ следует подбирать у постели больного в зависимости от выбранного режима FiO2.
- Кинетическая терапия с позицией больного на животе (prone position) показана у больных, требующих применения потенциально вредных значений FiO2, если такое положение больного в постели позволяет избежать вредных последствий, включая случайное смещение эндотрахеальной трубки или центрального венозного катетера.
- При отсутствии противопоказаний больные на ИВЛ должны находиться в полусидящем положении с приподнятым на 450 головным концом для предупреждения вентилятор-ассоциированной пневмонии.
- Протокол по отлучению больных от респиратора должен включать
следующие критерии:
- способность больного к пробуждению;
- гемодинамическая стабильность, отсутствие вазопрессорной стимуляции;
- отсутствие признаков вновь возникших опасных состояний;
- низкие значения МОД и ПДКВ;
- требуемый уровень FiO2 может быть достигнут с помощью лицевой маски или назальной канюли.
Если пробы на готовность к отлучению от респиратора благоприятны, может быть рассмотрена возможность экстубации трахеи.
L. Седация, анальгезия и нейромышечная блокада.
- Протокол седации при ИВЛ должен включать цель седации, которая оценивается в соответствии со стандартными шкалами её оценки.
- Седация путём болюсного введения препаратов или непрерывной их инфузии с ежедневным прерыванием или уменьшением доз снижает длительность нахождения больных на ИВЛ, продолжительность постельного режима, пребывания в ОИТ и потребности в трахеостомии.
- Нейромышечная блокада должна расцениваться, как вынужденная мера. Риск продлённой слабости скелетной мускулатуры у критических больных может быть снижен мониторингом нейромышечного блока и прерывистым управлением глубиной блока.
М. Контроль уровня глюкозы крови.
- Мониторинг уровня гликемии должен проводиться каждые 30 – 60 мин до стабилизации концентрации глюкозы в пределах 4,4 – 6,1 ммоль/л и в последующем каждые 4 часа на фоне экзогеного введения глюкозы и инсулина.
- Стратегия гликемического контроля у критических больных должна проводиться в соответствии с протоколом нутритивной поддержки с предпочтительным использованием энтерального питания.
N. Заместительная терапия почечной недостаточности.
- При развитии острой почечной недостаточности и отсутствии гемодинамической нестабильности длительная вено-венозная гемофильтрация и прерывистый гемодиализ считаются эквивалентными. У больных с нестабильной гемодинамикой гемофильтрация предпочтительнее, как более мягкая методика, позволяющая одновременное управление балансом жидкости.
- Нет доказательств в пользу применения длительной вено-венозной гемофильтрации у критических больных без необходимости замещения почечной функции.
О. Терапия гидрокарбонатом натрия.
Применение гидрокарбоната натрия не рекомендовано с целью улучшения гемодинамических показателей или снижения режима вазопрессорной поддержки при лечении лактат-ацидемии, обусловленной гипоперфузией тканей с рН e7,15. При более низких значениях рН эффективность применения гидрокарбоната не изучена.
Р. Профилактика тромбозов глубоких вен.
Больные, находящиеся в ОИТ, должны обязательно получать профилактические дозы нефракционированного или низкомолекулярного гепарина. При наличии противопоказаний (тромбоцитопения, тяжёлая коагулопатия, кровотечение) применяется механическая перемежающая компрессия конечностей.
Q. Профилактика стресс-язв желудочно-кишечного тракта должна проводиться у всех больных. Блокаторы Н2-гистаминовых рецепторов более эффективны, чем сукральфат. Ингибиторы протонной помпы не оценивались в прямом сравнении с Н2-блокаторами и их истинная эффективность не изучена.
Многие из приведенных терапевтических методов носят универсальный, полифункциональный характер. Так, устранение гиповолемии и дегидратации, нарушений доставки кислорода нормализуют электролитный гомеостаз и кислотно-основное состояние, тканевой метаболизм. Отдельные препараты для проведения интенсивной терапии могут оказывать как нежелательные побочные эффекты (вазопрессин для вазопрессорной поддержки, снижающий сердечный выброс), так и проявлять свои положительные свойства наряду с их основным терапевтическим качеством. Так, инсулин, кроме участия в нормализации уровня гликемии, обладает анаболическим эффектом, улучшая тканевой метаболизм. Одним из препаратов полифункционального положительного влияния на гомеостаз является РЕАМБЕРИН.
Сведения о реамберине
1. Состав препарата
Реамберин – 1,5% раствор для инфузий представляет собой хорошо сбалансированный полиионный раствор с добавлением янтарной кислоты, содержащий:
- Натрия хлорида - 6,00 г
- Калия хлорида - 0,3 г
- Магния хлорида - 0,12 г
- N-(1-дезокси-D-глюцитол-1 ил)-`N-метиламмония натрия сукцината - 15,0 г
- Вода для инъекций - до 1 л
Ионный состав раствора:
- Натрия 142,4 ммоль
- Калия 4,0 ммоль
- Магния 1,2 ммоль
- Хлорида 109,0 ммоль
- Сукцината 44,7 ммоль
- N-метилглюкаммония 44,7 ммоль
2. Осмолярность и pH 1,5% раствора Реамберина
Нормальная осмолярность плазмы крови человека колеблется от 275 до 310 мосм/кг, составляя в среднем - 290 мосм/кг. Реамберин в виде 1,5% раствора является сбалансированным препаратом с осмолярностью, приближенной к нормальной осмолярности плазмы крови человека, т.е. изотоническим раствором и слабощелочным, в пределах нормальных значений pH для крови [10,11].
Биохимические показатели крови после введения реамберина достоверно не изменяются. Показатели основных электролитов в крови также достоверно не меняются, при этом показатели осмолярности плазмы никогда не выходят за верхние пределы нормальных колебаний.
Введение реамберина сопровождается достоверным увеличением рН и буферной емкости крови (изменение BE, BEecf, BB). Это приводит к ощелачиванию мочи (увеличению рН мочи). Следует отметить, что при сохранении концентрационной способности почек на фоне введения реамберина отмечается достоверное снижение выделения натрия с мочой.
Включение янтарной кислоты в сбалансированный полиионный раствор определяет его основополагающие свойства метаболического и энергетического корректора.
3. Физиологическая роль янтарной кислоты
Превращение янтарной кислоты в организме связано с продукцией энергии необходимой для обеспечения жизнедеятельности. При возрастании нагрузки на любую из систем организма, поддержание ее работы обеспечивается преимущественно за счет окисления янтарной кислоты. Мощность системы энергопродукции, использующей янтарную кислоту, в сотни раз превосходит все другие системы энергообразования организма.
Именно это и обеспечивает широкий диапазон неспецифического
лечебно-го действия янтарной кислоты и ее солей. Кроме того,
янтарная кислота обладает и такими эффектами, как актопротекторный
и противовирусный.
В экспериментальных исследованиях биологическая активность
экзогенного сукцината зависила от дозы, режима введения препарата,
его химической формы (кислота, соль, сложный эфир), а также от
функционального состояния организма.
При применении физиологических доз янтарной кислоты выявлены две ведущие группы эффектов:
- прямое действие янтарной кислоты на клеточный метаболизм;
- влияние янтарной кислоты на транспорт свободного кислорода в ткани.
В экспериментах in vitro было показано, что применение сукцината приводило к приросту потребления кислорода тканями за счёт окисления добавленных субстратов до конечных продуктов - углекислоты, воды и тепла. Одна молекула добавленной к ткани дикарбоновой кислоты обеспечивает окисление многих эндогенных субстратов. Иными словами, окисление сукцината является необходимым условием каталитического действия любой другой из карбоновых кислот для усвоения тканью кислорода (цикл три- и дикарбоновых кислот).
Потеря интермедиатов цикла возрастает при острых и хронических отравлениях аммиаком. Пополнение пула кислот цикла Кребса нарушается при алкоголизме, гиповитаминозе В6 и при отравлениях ингибиторами пиридоксальфосфат зависимых ферментов. Поэтому пополнение пула интермедиатов цикла Кребса, в том числе из пищевых источников, является необходимым. Янтарная кислота является метаболитом человеческого организма и эндогенный уровень её в плазме крови человека колеблется от 1 до 6 мкг/мл.
Свободная янтарная кислота распространена в природе. В значительных количествах (0,1-1,0 г/кг, или 0,8-8,0 ммоль/кг) она содержится в незрелых ягодах, соке сахарной свеклы, сахарного тростника, репы, в ревене, алоэ, боярышнике, землянике, каланхоэ, крапиве, чистотеле, полыни и других растениях, а также в продуктах спиртового брожения. Дополнительным источником янтарной кислоты в тканях является липолиз.
Для пополнения пула всех органических кислот цикла Кребса у человека достаточным оказалось экзогенное введение лишь одного сукцината, который является стимулятором синтеза восстановительных эквивалентов в клетке. Биологическое значение данного явления заключается в быстром ресинтезе клетками АТФ и в повышении их антиоксидантной резистентности.
Введение сукцината натрия лабораторным животным или здоровым людям приводило к снижению уровня органических кислот в крови, экскреции кислых продуктов обмена из организма, что указывает на нормализацию аэробной фазы тканевого дыхания.
Преимущества сукцината перед другими субстратами клеточного дыхания наиболее выражены в условиях гипоксии, когда возрастает продукция эндогенного сукцината и скорость его окисления.
В основе лечебно-профилактического действия янтарной кислоты и ее соединений лежит модифицирующее влияние на процессы тканевого метаболизма – клеточное дыхание, ионный транспорт, синтез белков. При этом амплитуда и направленность модификаций зависят от исходного функционального состояния тканей, а ее конечный результат выражается в оптимизации параметров их функционирования. Такие свойства позволяют отнести янтарную кислоту к лечебно-профилактическим препаратам нового поколения – к так называемым "умным лекарствам".
И тем не менее, при уникальной разносторонности проявлений биологической активности янтарной кислоты, сфера ее применения в медицинской практике остается пока еще узкой.
4. Биологические эффекты янтарной кислоты
- Более, чем тридцатилетний опыт лабораторного и клинического исследования действия ЯК указывает на наличие у препарата следующего спектра физиологических эффектов.
- Антиацидотическое действие. Препарат эффективно снижает тканевой метаболический ацидоз, что позволяет рекомендовать его как не имеющее аналогов средство для предотвращения поражения тканей при накоплении молочной кислоты и снижении внутриклеточного pH (физические нагрузки, ишемии миокарда головного мозга и других органов).
- Антигипоксическое действие. Базируется на низкой чувствительности системы окисления ЯК к недостатку кислорода. Препарат эффективен при купировании внутриутробной гипоксии плода.
- Антистрессорное, адаптогенное действие. В основе лежит мощная энергетическая поддержка активности систем обеспечения адаптации.
- Детоксикационное действие. Связано с энергетической поддержкой системы окисления ЯК процессов дезинтоксикации и выведения чужеродных веществ. Препарат купирует токсическое действие анестетиков, противосудорожных, туберкулостатиков, гормонов, сердечных гликозидов, алкоголя; снижает кетоз и уровень сахара при диабете; стабилизирует работу сердца, улучшая показатели микроциркуляции, биоэлектрической активности и внутрисердечной гемодинамики.
- Мочегонное действие. Обусловлено преимущественным энергообеспечением работы почек за счет окисления ЯК.
- Противовирусное действие (герпес, коревая краснуха). Связано с повышением резистентности организма.
- Актопротекторное действие. Способствует поддержанию продолжительное время высокой физической активности. Связано с усилением энергообеспечения мышечной активности, интенсификации метаболизма молочной кислоты.
- Предотвращение преждевременного старения организма , снижение проявления возрастных изменений в организме. Основано на уникальной нормализации внутриклеточного соотношения АТФ/АДФ.
- Радиопротекторное действие. В основе лежит способность системы окисления ЯК обеспечивать активность системы естественной антиоксидантной защиты организма и тем самым предотвращать развитие свободнорадикальных реакций, ингибировать перекисное окисление липидов.
- Защита организма при гипервитаминозе Д2. В основе лежит защита почек от нефрокальциноза. Терапевтический эффект связан с антиоксидантным, мембраностабилизирующим действием препарата, предотвращением внутриклеточного отложения кальция.
Механизм действия реамберина может быть представлен на рисунке 3.
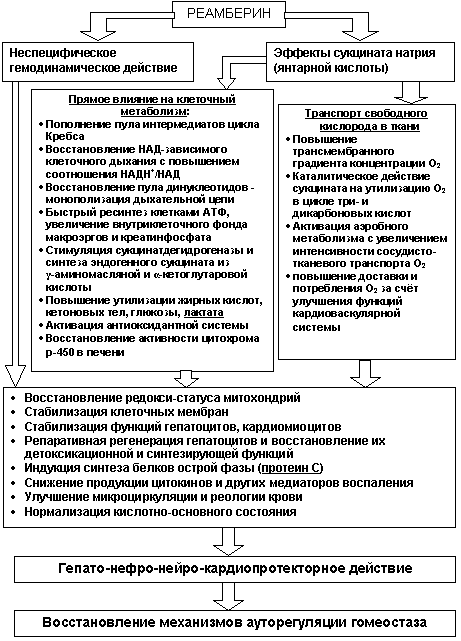
Рис. 3. Механизмы органопротекторного действия реамберина
5. Методика введения реамберина
Реамберин применяют только внутривенно капельно в суточной дозе для взрослых до 2 литров раствора. Скорость введения и дозирование препарата определяют в зависимости от состояния больного, но не более 90 капель в минуту (1–1,5 мл/мин). Взрослым обычно назначают 400–800 мл/сутки (6–14 мл/кг/сутки) на протяжении 7–11 дней.
Реамберин сочетается с основными лекарственными препаратами, которые используются в практике интенсивной терапии. При шоке препарат рекомендуется вводить совместно с коллоидными кровозаменителями, растворами кристаллоидов, применением вазопрессорных и инотропных агентов.
Возможны аллергические реакции, металлический привкус во рту. При быстром введении препарата не исключены кратковременные реакции в виде чувства жара и покраснения верхней части тела.
Препарат противопоказан при индивидуальной непереносимости, черепно-мозговой травме с отёком головного мозга. При передозировке может возникнуть артериальная гипотензия.
Препарат является антагонистом барбитуратов, что следует учитывать в послеоперационном периоде и при проведении седации во время ИВЛ.
Препарат хранится в защищённом от света месте при температуре 0 - 25°С.
При изменении цвета раствора или наличии осадка применение препарата недопустимо.
Форма выпуска – флаконы по 200 мл и 400 мл, срок хранения – 3 года.
Препарат разрешён для клинического применения в Украине (регистрационное свидетельство № ИА/0530/01/01)
Клиническая эффективность реамберина
В клинике анестезиологии и интенсивной терапии Днепропетровской государственной медицинской академии нами изучена клиническая эффективность реамберина, используемого для профилактики и лечения синдрома полиорганной дисфункции-недостаточности у больных отделений интенсивной терапии многопрофильного стационара.
Целью исследования являлось изучение эффективности реамберина в профилактике синдрома полиорганной дисфункции у больных с причинными заболеваниями и факторами риска развития СПОН, а также влияние препарата на течение заболевания и исход у больных с исходными органными нарушениями.
Реамберин назначали в дозе 6–14 мл/кг/сутки на протяжении 3–5 дней в дополнение к базисной терапии основного заболевания, для поддержания необходимого расчётного суточного баланса жидкости объём вводимых кристаллоидных растворов сокращали пропорционально количеству назначенного реамберина.
Для оценки профилактического эффекта реамберина в группу 1А включены больные с причинными заболеваниями и факторами риска развития СПОН, контрольную группу 1Б составили больные ОИТ с наличием аналогичных факторов, получавшие стандартную базисную терапию (таблица 1).
Таблица 1. Основные демографические
и клинические характеристики
больных
для оценки профилактического эффекта реамберина
|
Показатели |
Группы больных |
|
|
1А |
1Б |
|
|
Количество больных |
22 |
21 |
|
Возраст больных, лет |
47,3 |
49,1 |
|
Пол: - мужчин |
12 |
12 |
|
Причинные заболевания: - Ишемический инсульт |
6 |
6 |
|
Факторы риска: - Возраст старше 60 лет - Тяжёлые сопутствующие заболевания (ИБС, сахарный диабет и др.) - Перенесенные эпизоды кровопотери, нарушений коагуляции, артериальной гипотензии, гипоксии) |
14 (63,6%) 12 (54,5%) |
14 (66,6%) 10 (47,6%) |
Ежедневно регистрировали появление или отсутствие признаков системного воспалительного ответа (ССВО) по критериям Согласительной конференции по сепсису (2001) [2] и ранних маркеров органных нарушений по R.A. Balk et al. [7].
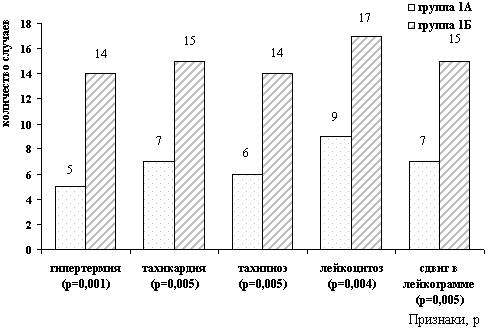
Оценка различий между частотами появления признака в отдельных сериях наблюдений выявила достоверные различия в наличии проявлений ССВО, как раннего системного ответа на причинные факторы, в зависимости от назначенной терапии. В группе больных, получавших реамберин, частота появления маркеров ССВО наблюдалась существенно реже (рис. 4).
Рис. 4. Частота появления маркеров ССВО
в зависимости от
профилактического назначения реамберина.
Существенные различия выявлены также между группами сравнения в появлении ранних признаков полиорганных нарушений (рисунок 5).
Рис. 5. Частота развития органных нарушений
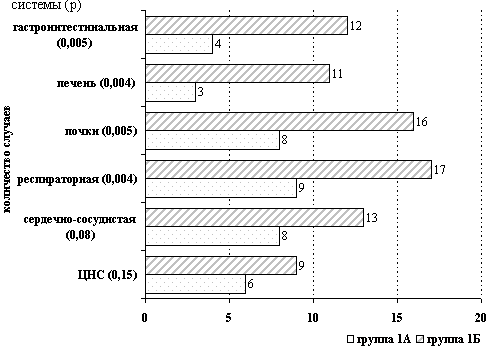
Недостоверность различий в частотах появления церебральной и кардиоваскулярной дисфункции обусловлено включением в группы сравнения равного количества больных с сердечно-сосудистыми заболеваниями и ишемией головного мозга, тогда как достоверные различия в развитии респираторной, почечной, печёночной и гастроинтестинальной дисфункций при исходных равных условиях имеют принципиальные отличия, которые характеризуются признаками системного воспалительного ответа и, вероятно, патогенетически детерминированы комплексом последующих нарушений в системах воспаления, коагуляции, тканевого метаболизма (рисунок 2).
Для оценки влияния реамберина на возможные механизмы развития СПОН в условиях ССВО в группу 2 включены для исследования больные с выраженными признаками системного воспалительного ответа и наличием органных нарушений. Определяющим фактором в генезе ССВО являлась инфекция. У больных в группе 2А использовали реамберин в дозе 6 – 14 мл/кг/сутки в течении 3 – 7 дней, больные в группе 2Б получали стандартную терапию [9].
Основные характеристики больных представлены в таблице 2.
Таблица 2. Основные демографические
и клинические характеристики
больных
с исходными признаками ССВО и СПОН
|
Показатели |
Группы больных |
|
|
Группа 2А |
Группа 2Б |
|
|
Количество больных |
18 |
19 |
|
Возраст больных, лет |
49,3 |
48,8 |
|
Пол: - мужчин |
9 |
9 |
|
Заболевание: - Инфекции мягких тканей |
2 |
2 |
Реамберин в комплекс интенсивной терапии включали, начиная с ранней гемодинамической поддержки, продолжая инфузии после достижения заданных конечных пунктов [9].
В качестве маркера тканевой перфузии и метаболизма использовали уровень лактата в смешанной венозной крови. Доставку и потребление кислорода определяли методом непрямой калориметрии. Выраженность ССВО и СПОН определяли по соответствующим параметрам. В качестве конечных точек служили длительность пребывания больных в ОИТ, результаты лечения до 28-го дня болезни.
Существенные различия между группами сравнения выявлены после первоначальной гемодинамической ресусцитации с достижением заданных параметров (САД >70 мм рт ст, SvO2 e70%, ЦВД 100 – 120 мм вод. ст).
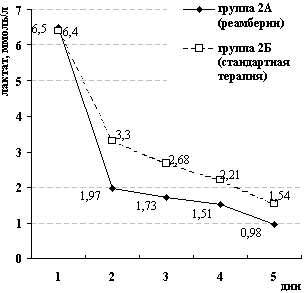
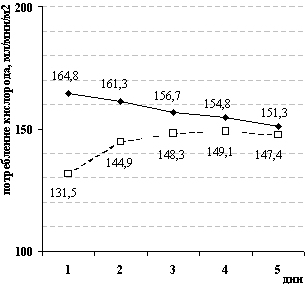
Рис. 6. Динамика потребления кислорода и концентрации лактата
крови
у больных с исходными проявлениями ССВО и СПОН
Эффективный транспорт кислорода (DO2) восстановлен у больных обеих групп в среднем до 468,3±44,1 мл/мин/м2 в первые 24 часа интенсивной терапии, что сопровождалось достоверным увеличением доставки кислорода в группе больных, получавших реамберин, с 103,9±10,7 до 164,8±11,9 мл/мин/м2 (р=0,003) и одновременным снижением концентрации лактата с 6,53±1,38 до 2,33±0,9 ммоль/л (р=0,016).
В группе больных, получавших стандартную терапию, потребление кислорода возрастало с 104,7±11,3 до 131,5±13,2 мл/мин/м2 (р=0,12), снижение концентрации лактата у больных в группе 2Б в первые 24 часа терапии было медленным, с 6,41±1,37 до 4,06±1,21 ммоль/л (р=0,175).
Динамика показателей VO2 и лактата крови в последующие дни представлена на рисунке 6.
Влияние реамберина на показатели углеводного обмена и функцию печени представлены в таблице 3.
Таблица 3. Динамика показателей
углеводного обмена и функции печени
|
Показатели |
Группа 2А |
Группа 2Б |
||
|
Исходный уровень |
Через 48 часов |
Исходный уровень |
Через 48 часов |
|
|
Глюкоза крови, ммоль/л |
9,81±1,76 |
6,11±0,73 |
9,76±1,94 |
7,1±0,93 |
|
Дозы инсулина, ЕД/сутки |
33,8±6,7 |
12,3±2,4* |
34,1±7,3 |
24,4±6,1 |
|
АлТ, мкмоль/гЧл |
1,34±0,22 |
0,58±0,07* |
1,36±0,26 |
0,84±0,33 |
|
АсТ, мкмоль/гЧл |
1,12±0,29 |
0,54±0,09 |
1,09±0,22 |
0,91±0,27 |
|
Протромбиновый индекс, % |
64,3±8,8 |
81,3±7,6 |
63,1±9,7 |
71,8±8,3 |
|
Билирубин, мкмоль/л |
17,9±0,81 |
11,3±0,64* |
17,3±0,9 |
16,9±0,8 |
Примечание: * - различия достоверны по сравнению с исходным уровнем.
Снижение суточной дозы инсулина для поддержания оптимальных значений глюкозы в крови в группе больных, получавших реамберин, наряду с повышением потребления кислорода и снижением концентрации лактата указывают на значимую роль сукцината натрия в обмене веществ у критических больных, что согласуется с данными Румянцева и соавт. [11].
Улучшение функционального состояния печени, как отмечено в работах Pastor C.M. et al. [6], Mizock B.A. et al. [3] вносит весомый вклад в предупреждение дальнейшего прогрессирования СПОН.
Отчётливая положительная динамика с улучшением общего состояния больных в баллах APAHE II и регрессом органных нарушений по шкале SOFA на фоне терапии реамберином представлена на рисунке 7.
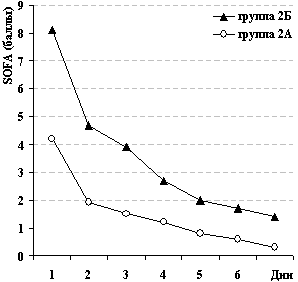
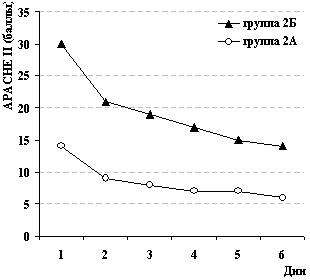
Рис. 7. Динамика показателей тяжести
состояния и выраженности СПОН.
Существенным представляется тот факт, что на фоне терапии реамберином у септических больных с исходно неудачной эмпирической антибактериальной терапией (n=5) сохранялись проявления ССВО с эпизодами гипертермии, тахикардией, лейкоцитозом, но в первые 48 часов не наблюдалось прогрессирования полиорганных нарушений, что позволило получить благоприятные исходы после модификации антибиотикотерапии.
В группе контроля неудачная стартовая антибиотикотерапия сопровождалась быстрым прогрессом СПОН с вовлечением непоражённых исходно систем и усугублением исходных нарушений.
Оценка результатов лечения по конечным точкам представлена на рис. 8.
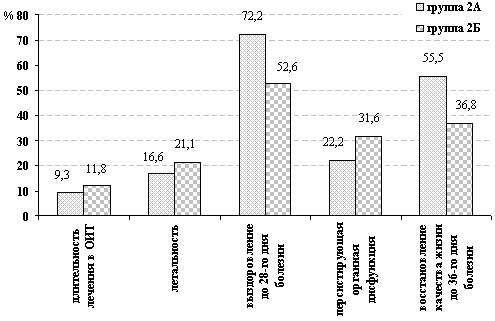
Рис. 8. Оценка результатов лечения с применением реамберина
по конечным точкам
ЗАКЛЮЧЕНИЕ
Применение реамберина при заболеваниях и состояниях с высоким риском развития полиорганных нарушений способствует существенному снижению случаев респираторной, почечной, печёночной и гастроинтестинальной дисфункции и системного воспалительного ответа.
У больных с исходными признаками системного воспалительного ответа и органными нарушениями применение реамберина приводит к повышению потребления кислорода, утилизации лактата и глюкозы, улучшению функции печени, что сопровождается улучшением общего состояния больных, быстрым регрессом полиорганных нарушений, улучшением клинических исходов с повышением выживаемости и качества жизни.
ЛИТЕРАТУРА
- Підгірний Я. Синдром поліорганної недостатності: патофізіологічні та патобіологічні аспекти (огляд літератури)//Біль, знеболювання і інтенсивна терапія.-1998.-№4(5).-с.8-17.
- Ма льцева Л.А., Усенко Л.В., Мосенцев Н.Ф. Сепсис: Эпидемиология, патогенез, диагностика, интенсивная терапия/Под общей ред. чл.-корр. НАН и АМН Украины, проф. Л.В. Усенко.-Д.: АРТ-ПРЕСС, 2004.-160 с.
- Mizock B.A. Redox pairs, tissue hypoxia, organ dysfunction, and mortality//Crit Care Med.-2000.-vol.28.-No.1.-p.270-271.
- Alvarez B., Quinn L.S., Busquets S. Direct effects of tumor-necrosis factor alpha (TNF-alpha) on murine skeletal muscle cell lines biomodal effects on protein metabolism//Eur. Cytokine Netw.-2001.-vol.12.-p.399-410.
- Grimble R.F. Immunity: nutriens or genes as modulators//Nestle 3th Clinical Nutrition Course, 20th to 26th gune, 2004.-Glion-Switzerland.-s.15.
- Pastor C.M., Suter P.M. Hepatic hemodynamic and cell functions in hyman and experimental sepsis//Anesth Analg.-1999.-No.89.-p.344-352.
- Advances in the diagnosis and management of the patients with severe sepsis/Edited by R.A. Balk.-Royal Society of Medicine Press Limited.-2002.-p.118.
- Ferreira F.L., Bota D.P., Bross A. et al. Serial evaluation of the SOFA score to predict outcome in critically ill patients//JAMA.-2002.-vol.286.-p.1754-1758.
- Dellinger R.P., Carlet J.M., Masur H. et al. Surviving Sepsis Campaign guidelines for management of severe sepsis and septic shock//Crit Care Med.-2004.-vol.32.-p.858-873.
- Оболенский С.В. Реамберин – новое средство для инфузионной терапии в практике медицины критических состояний. Методические рекомендации.-СПб.-2002.-19с.
- Реамберин: реальность и перспективы. Сборник научных статей.-СПб., 2002.-168с.
Приложение
ИНТЕРПРЕТАЦИЯ:
Летальность в зависимости от количества пораженных систем
(по Vincent J.L. et al., 1998)
|
Число |
Балл |
Летальность |
Число |
Балл SOFA |
Летальность |
|
0 |
0 – 2 |
до 9% |
3 |
9 – 12 |
до 69% |
|
1 |
3 – 4 |
до 22 % |
4 и более |
13 и более |
83% и более |
|
2 |
6 – 8 |
до 38% |
Шкала SOFA
|
Оценка |
Показатель |
1 |
2 |
3 |
4 |
|
Оксигенация |
РаО2 / FiО2, |
< 400 |
< 300 |
< 200 |
< 100 |
|
Коагуляция |
Тромбоциты, Г/л |
< 150 |
< 100 |
< 50 |
< 20 |
|
Печень |
Билирубин, мг/дл (мкмоль/л) |
1,2 – 1,9 |
2,0 – 5,9 |
6,0 – 11,9 |
> 12,0 |
|
(20 – 32) |
(33 – 101) |
(102 – 204) |
(> 204) |
||
|
Сердечно-сосудистая система |
Гипотензия или степень инотропной поддержки |
среднее АД <70 мм рт. ст. |
допамин Ј 5 или добутамин |
допамин > 5 |
> 15 > 0,1 > 0,1 |
|
ЦНС |
Показатель по шкале ком Глазго |
13 - 14 |
10 - 12 |
6 - 9 |
< 6 |
|
Почки |
Креатинин, мг/дл (мкмоль/л) |
1,2 – 1,9 (110 – 170) |
2,0 – 3,4 (171 – 299) |
3,5 – 4,9 (300 – 440) или < 500 мл/сут. |
> 5 (> 440) или <200 мл/сут. |