|
|
| |
|
|
|
|
Применение препарата реамберин 1,5% у эндокринологических больных
|
|
РАЗРАБОТКА ИНДИВИДУАЛЬНЫХ РЕЖИМОВ ДОЗИРОВАНИЯ РЕАМБЕРИНА
И.В. Сарвилина
Южный научный центр РАН, г. Ростов-на-Дону
Сегодня на фармацевтическом рынке России представлено большое
количество средств метаболической направленности действия, которые
в зарубежной медицинской литературе определяются как “модификаторы
биологического ответа”. Основной проблемой в применении их в
клинической практике является отсутствие доказательных режимов
дозирования при каждой конкретной патологии и у каждого
конкретного пациента. Эта проблема связана как с отстутствием
многоцентровых рандомизированных исследований эффективности и
безопасности применения данной группы лекарственных средств, так
и разработанной технологической платформы для проведения
фармако-кинетических исследований и оценки фармакодина мических
эффектов на молекулярном уровне.
В настоящем исследовании (на примере популяции пациентов с
сахарным диабетом (СД) тип 1, находящихся в стадии декомпенсации)
разработана схема оценки фармакодинамических эффектов и предложена
новая методика оценки фармакокинетических показателей инфузионной
среды «Реамберин 1,5% для инфузий» в состав которой входит активное
вещество – смешанная натрий N-метилглютаминовая соль янтарной
кислоты, электролиты в оптимальных для солевого кровезаменителя
концентрациях.
СД относится к распространенным заболеваниям. Им страдает около
3-4% населения. Ожидаемая распространенность СД к 2010 году
составит около 215 млн человек [1]. СД тип 1 составляет 15-20% от
всех больных диабетом. В настоящее время, несмотря на появляющиеся
эпидемиологические данные и результаты многоцентровых
исследований, свидетельствующих о наличии патогенетической
взаимосвязи между метаболическими расстройствами при СД и его
осложнениями, современные клинические руководства и
международные рекомендации не уделяют достаточного внимания
новым методам лечения СД, эффективно воздействующим на
метаболомные процессы. В связи с интенсивным развитием новых знаний
в области геномики, транскриптомики, метаболомики становятся
возможными разработка и применение лекарственных средств с
целенаправленным воздействием на молекулярные процессы,
происходящие на уровне клетки при СД. СД сопровождается
структурными изменениями сосудов и ткани почек, сердца, головного
мозга. В основе этих изменений лежит энергодефицит, нарушение
ресинтеза белка, фосфолипидов и других структурных компонентов
клетки, активация свободнорадикального окисления. Дискуссионным
остается вопрос, касающийся применения лекарственных средств,
обладающих метаболическим действием и способствующих улучшению
нейронального метаболизма, стабилизации физиологических механизмов
ауторегуляции мозгового, кардиального и почечного кровообращения,
которые нарушены в условиях энергетического дисбаланса при СД тип
1.
Цель работы – разработка нового подхода к
индивидуализации дозирования лекарственных средств с
метаболической направленностью действия у пациентов с СД тип 1 на
примере инфузионной среды «Реамберин 1,5% раствор для инфузий» в
условиях клинико-фармакологического исследования с разработкой
новых методов оценки регуляции и функционирования метаболических
шунтов, связанных с продукцией и трансформацией янтарной
кислоты.
Материал и методы
Настоящее исследование являлось проспективным сравнительным с
параллельным дизайном. В исследование было включено 36 пациентов с
СД тип 1, находившихся в ста дии декомпенсации, согласно
клинико-анамнестической характеристике, представленной в таблице
1. Контрольную группу пациентов составили 17 человек, принимавших
интенсифицированный режим инсулинотерапии (ИИ), исследуемую группу
– 19 человек, получавших ИИ и Реамберин 1,5% раствор, внутривенно
ка пельно, со скоростью 60 капель в минуту, 400 мл, в 17.00, через
48 часов, количество внутривенных введений 5. Категория
пациентов с СД тип 1 соответствовала критериям СД тип 1 подтип Б,
отличающегося от пациентов с СД тип 1 подтип А длительностью
заболевания к моменту появления потребности в инсулине (не
превышает 3-4 лет). Конечной точкой исследования являлись критерии
компенсации СД [2]. В стадии декомпенсации больной получал ИИ,
включавшую введение инсулина короткого действия (Хумулин R, Eli
Lilly, США) и инсулина продленного действия дважды в день (вместо
базальной секреции, Хумулин Н, Eli Lilly, США). Доза инсулина
короткого действия определялась из расчета 1 ЕД на каждые 1,7
ммоль/л. постпрандиальной гликемии выше 7,8 ммоль/л. Инсулин
средней продолжительности действия назначался в начальной дозе из
расчета 0,2-0,5 Ед/кг веса и корригировался по уровню гликемии:
натощак 1 ЕД инсулина на каждые 1,1 ммоль/л, превышающие 7,7
ммоль/л.
Таблица 1. Клинико-анамнестическая характеристика пациентов
|
Показатель
|
Целевая популяция (выборка)
|
|
Пол (мужчины/женщины)
|
12/24
|
|
Возраст, годы:
I возрастная группа (до 25 лет), кол.
II возрастная группа (до 30 лет), кол.
III возрастная группа (до 50 лет), кол.
|
8
22
6
|
|
Масса тела, кг
|
68,2±3,7
|
|
Индекс массы тела, кг/см2
|
25,5±1,1
|
|
Рост, см
|
170,3±3,3
|
|
Длительность диабета, годы
|
7,8±2,3
|
|
Длительность АГ годы:
I ст.
II ст.
III ст.
|
3,2±1,8
6,8±1,2
9,8±1,6
|
|
Длительность приема инсулина, годы
|
5,7±1,1
|
|
Сроки возникновения потребности в инсулине, годы
|
2,4±0,5
|
|
Диабетическая нефропатия:
стадия начинающейся диабетической нефропатией (III стадия),
кол.
|
27
|
|
ХСН, ФК, кол.:
ФК I класс
|
15
|
|
Диабетическая нейропатия, кол.
|
18
|
Для оценки влияния Реамберина на фоне ИИ на глюкодинамику у
больных определяли содержание глюкозы натощак и в 9.00, 13.00,
17.00 (гликемический профиль больного) на биохимическом диализаторе
BioStat Fax+ (США). Для оценки характера изменений концентрации
глюкозы использовались критерии диагностики СД и других нарушений
толерантности к глюкозе, предложенных американской ассоциацией
диабета. Определялся уровень НbА1c, являвшийся косвенным
подтверждением наличия метаболического эффекта у Реамберина на
фоне ИИ. Нормальный уровень НbА1c не превышал 8,3%. О
степени компенсации углеводного обмена в процессе лечения
инсулином и Реамберином судили по следующим показателям
HbA1c: HbA1c до 9% – хорошая компенсация;
HbA1c 9-10 – удовлетворительная компенсация; HbAlc более
10% – плохая компенсация. Концентрация креатин и на определялась
кинетическим методом по реакции Яффе. Регистрировались уровнь
адренокортикотропного гормона (АКТГ), кортизола, иммунореактивного
инсулина (ИРИ), тиреотропного гормона (ТТГ), тироксина
(T4), трийодтиронина (Т3) методом
радиоиммунологического анализа (РИА). Концентрация глутамата в
сывротке крови определялась с целью анализа роли янтарной кислоты в
реализации активности глутамата в организме пациентов с СД тип 1 на
фоне приема Реамберина (биохимический анализатор BioStat Fax+,
США). Для оценки активности ПОЛ определяли содержание МДА по
реакции с ТБК в кислой среде. Норма составляет 3,4-6,8 мкмоль/л.
Определение активности СОД основано на способности фермента
подавлять реакцию восстановления нитросинего тетразолия
супероксидным анион радикалом, генерированным in vitro в системе
ксантин: ксантиноксидаза. Динамика содержания Na+,
K+, Са ++, Mg++в сыворотке крови
больных СД тип 1 оценивалась методом пламенной спектрофотометрии.
Определение ионов хлора в сыворотке крови выполнялось
меркуриметрическим методом с индикатором дифенилкарбазоном.
Регистрировали степень протеинурии и уровень креатинина в
моче. Применялась методика S. M. Marshallв оценке
соотношения альбумин/креатинин мочи (ДСА - 2000, «Вауеr». [3, 4,
5].
В настоящее время разрабатывается технологическая платформа для
фармакокинетического анализа Реамберина на основе концентраций
янтарной кислоты (уровня концентрации янтарной кислоты в крови
пациента до назначения и на фоне приема Реамберина) в
биологических жидкостях у данного контингента больных. В
программе ADAPT II рассчитываются индивидуальные значения
оптимальных моментов измерений концентрации сукцината в крови в
популяции пациентов с СД тип 1.
В качестве внутреннего стандарта применялась янтарная кислота
(сукцинат, Sigma Aldrich, Германия).
Условия LC/MS-анализа . Электроспрейная
ионизация (ESI), скорость потока через колонку 1,5 мл/мин,
температура генератора азота 3500єС со скоростью потока азота 12
л/мин, давление распылителя 172 кПа, хроматографическая колонка
Hypersil Amino Acid(5јm, 250x4,6 mm), температура на колонке
подвижные фазы ацетонитрил: аммония ацетат (Sigma Aldrich) (70:30
от объема соответственно). Диапазон m/zсоставляет 50-200.
Вводимый объем образца 5 мкл.
Качество жизни (КЖ) пациентов оценивали по опроснику
theDiabetes Quality of Life (низкий бал – дискомфорт и
беспокойство, высокий – удовлетворительное КЖ). Длительность
исследования составила 1 месяц.
Первичную и вторичную статистическую обработку материала
исследования проводили на персональном IBM совместимом компьютере с
процессором Pentium IV с использованием пакета статистических
программ для биомедицинских исследований «Statisticа 6.0». В
клиническом исследовании определялись следующие параметры
описательной статистики; средняя (М), стандартная ошибка средней
(SEM), t-критерий Стъюдента. Проводилась оценка нормальности
распределения полученных данных.
Результаты и их обсуждение
В контрольной группе пациентов отмечено достоверное снижение
среднесуточного, максимального уровней глюкозы при отсутствии
достоверных изменений ее минимального уровня и уровня
HbA1c, концентрации МДА в крови, скорости образования
сопряженных диенов и концентрации глутаминовой кислоты в крови.
Зарегистрировано значимое увеличение уровня СОД в крови и
продолжительности лаг-периода (табл. 2).
Таблица 2. Динамика показателей гликемии, глутамата и активности продуктов
ПОЛ в крови пациентов СД тип 1 (контрольная группа)
|
Параметры
|
Исходно
M±SEM
|
через месяц
М±SEM
|
|
Глюкоза плазмы, ммоль/л
среднесуточный уровень
максимальный уровень
минимальный уровень
|
9,3±3,9
13,5±3,4
4,6±1,4
|
6.53±0,6***
10,2±0,3***
4,6±0,3`
|
|
HbAlc, %
|
10,3±0,7
|
9,3±0,3`
|
|
Концентрация МДА, мкмоль/л
|
1.8±0,03
|
1,7±0,05`
|
|
Лаг-период (мин)
|
55,3±2,4
|
60,8±1,8*
|
|
Скорость образования сопряженных диенов, нмоль х л-1
х мин-1
|
17,6±0,3
|
17,1±0,5`
|
|
СОД, усл. ед.
|
1,2±0,1
|
1,5±0,1**
|
|
Глутаминовая кислота, мкмоль/л
|
37,3±2,7
|
38,9±4,0`
|
` – недостоверные различия; * – р < 0,05; ** – р<0,01; ***
– р<0,001
Применение Реамберина приводило к достоверному снижению
среднесуточного, максимального и минимального уровней глюкозы,
HbA1с концентрации МДА, уменьшению
продолжительности лаг-периода и скорости образования ДК с
увеличением СОД и содержания глутаминовой кислоты в крови (табл.
3).
Таблица 3. Динамика показателей гликемии, глутамата и активности продуктов
ПОЛ в крови пациентов СД тип 1 на фоне приема ИИ и Реамберина
|
Параметры
|
Исходно
M±SEM
|
Через месяц
М±SEM
|
|
Глюкоза плазмы, ммоль/л
среднесуточный уровень
максимальный уровень
минимальный уровень
|
9,94±0,48
14,07±1,55
4,98±0,78
|
5,48±0,59***
8,59±0,58***
4,18±0,35`
|
|
HbAlc, %
|
10,21±0,40
|
8,11±0,38***
|
|
Концентрация МДА, мкмоль/л
|
1,79±0,079
|
1,55±0,036***
|
|
Лаг-период (мин)
|
56,39±1,92
|
61,39±1,76***
|
|
Скорость образования сопряженных диенов, нмоль х л-1
х мин-1
|
17,77±0,43
|
16,38±0,15**
|
|
СОД, усл. ед.
|
1,12±0,095
|
1,44±0,058***
|
|
Глутаминовая кислота, мкмоль/л
|
34,21±3,33
|
68,2±2,34***
|
` – недостоверные различия; * – р < 0,05; ** – р<0,01; ***
– р<0,001
Таблица 4. Динамика показателей протеинурии и уровня креатинина в сыворотке
крови у пациентов контрольной группы
|
Параметры
|
Исходно
M±SEM
|
Через месяц
М±SEM
|
|
Креатинин, мкмоль/л
Протеинурия, г/сут
|
103,5±8,6
1,6±0,1
|
96,7±3,7`
1,5±0,1`
|
` – недостоверные различия; * – р < 0,05; ** – р<0,01; ***
– р<0,001
Таблица 5. Динамика показателей протеинурии и уровня креатинина в сыворотке
крови у пациентов с СД тип 1 на фоне приема ИИ и Реамберина
|
Параметры
|
Исходно
M±SEM
|
Через месяц M±SEM
|
|
Креатинин, мкмоль/л Протеинурия, г/сут
|
106,4±4,6
1,6±0,02
|
72,3±3,0***
0,4±0,2***
|
` – недостоверные различия; * – р < 0,05; ** – р<0,01; ***
– р<0,001
Таблица 6. Оценка микроальбуминурии по соотношению альбумин/креатинин
мочи
в контрольной и исследуемой группах пациентов с СД тип 1
|
Режимы фармакотерапии
|
Альбумин/креатинин мочи (мг/ммоль)
M±SEM
|
|
ИИ
|
|
исходно
|
12,4±0,3
|
|
через месяц
|
12,1±0,2`
|
|
ИИ + Реамберин
|
|
исходно
|
12,1±0,2
|
|
через месяц
|
4,7±0,1***
|
` – недостоверные различия; * – р < 0,05; ** – р<0,01; ***
– р<0,001
В контрольной группе пациентов с СД тип 1 и в исследуемой группе
обнаружены микро-, макроальбуминурия и протеинурия, при этом
уровень креатинина сыворотки крови находился на верхней границе
нормальных значений (табл. 4, 5). Применение Peaмберина
сопровождалось достоверным уменьшением выраженности протеинурии,
при статистически значимом снижении концентрации креатинина в
сыворотке крови в пределах нормальных значений по сравнению с
контрольной группой (таблица 5). В контрольной группе пациентов
выявлено увеличение коэффициента альбуминурия/креатинин мочи >
10 мг/ммоль, что свидетельствовало о существовании стабильной
микроальбуминурии (таблица 6). В группе больных, принимавших
Реамберин зарегистрировано статистически достоверное устранение
микроальбуминурии с последующим снижением отношения
альбумин/креатинин мочи (табл. 6).
В контрольной группе отмечено достоверное уменьшение
концентрации ионов Na+, ионов хлора в сыворотке крови
при увеличении содержания ионов Са++ и соотношения
Na+/K+ (табл. 7). В группе пациентов,
получавших ИИ и Реамберин, отмечалось достоверное и более
выраженное уменьшение ионов Na+, K+ и хлора в
сыворотке крови при значимом увеличении соотношения
Na+/K+, Mg++ и Са++ в
сыворотке крови (табл. 8).
Таблица 7. Изменение параметров электролитного баланса
у пациентов с СД тип 1 (контрольная группа)
|
Параметры
|
Исходно
M±SEM
|
Через месяц
М±SEM
|
|
Na+, ммоль/л
|
155,7±2,3
|
147,9±3,8*
|
|
K+, ммоль/л
|
5,0±0,4
|
4,5±0,2`
|
|
Na+/K+
|
30,2±2,2
|
32,5±1,9*
|
|
Mg++, мкмоль/л
|
0,5±0,05
|
0,51±0,1`
|
|
Cl+, ммоль/л
|
107,8±2,7
|
98,2±3,7*
|
|
Са ++, ммоль/л
|
`2,2±0,1
|
2,5±0,1*
|
` – недостоверные различия; * – р < 0,05; ** – р<0,01; ***
– р<0,001
Таблица 8. Изменение параметров электролитного баланса у пациентов с СД тип
1
на фоне приема ИИ и Реамберина
|
Параметры
|
Исходно
M±SEM
|
Через месяц
М±SEM
|
|
Na+, ммоль/л
|
154,9±2,5
|
139,8±3,5***
|
|
K+, ммоль/л
|
5,0±0,3
|
3,9±0,3***
|
|
Na+/K+
|
29,7±1,9
|
35,7±1,4***
|
|
Mg++, мкмоль/л
|
0,5±0,05
|
0,8±0,04***
|
|
Cl+, ммоль/л
|
106,3±2,6
|
97,3±2,9***
|
|
Са ++, ммоль/л
|
2,3±0,1
|
2,5±0,03**
|
` – недостоверные различия; * – р < 0,05; ** – р<0,01; ***
– р<0,001
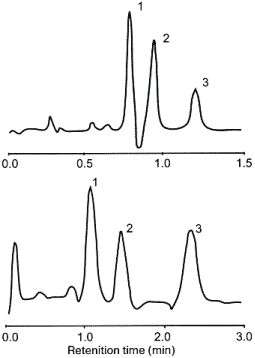
Рис. 1. Хромато-масс-спектрометрические пики:
1-гомоцистеин; 2-метилмалоновая кислота
Анализ результатов исследований содержания гормонов
гипофизарно-надпочечниковой оси, оси гипофиз-щитовидная железа и
инсулина в течение суток в состоянии покоя, а также АКТГ у
пациентов с СД тип 1, обнаружил, что уровни этих гормонов
значительно выше, чем вечерние, за исключением ТТГ (табл. 9, 10).
Сравнительный анализ содержания гормонов в крови пациентов
контрольной группы продемонстрировал следующие закономерности
У больных, принимавших Реамберин, значительно уменьшался
процент лиц с неудовлетворительным КЖ и увеличивалось количество
пациентов с удовлетворительным КЖ по шкале the Diabetes Quality of
Life по сравнению с контрольной группой пациентов.
В ходе исследования обнаружен высокий терапевтический эффект
янтарной кислоты («Реамберин 1,5% для инфузий»), связанный с
гормонально-метаболическим (обменномодифицирующим) и
антиоксидантным действием вещества. Как известно, основной причиной
поражения органов-мишеней (сердце, головной мозг, почки, глазное
дно) при СД тип 1 является поражение сосудов этих органов. Основная
роль в развитии сосудистых осложнений СД принадлежит
неферментативному аутоокислительному гликозилированию и
окислительному стрессу. При терапии Реамберином, вероятно,
увеличивается чувствительность инсулиновых рецепторов к инсулину
и уменьшается гипергликемия, что устраняет механизмы активации
окислительного стресса. Увеличение чувствительности к экзогенному
инсулину может быть связано с положительным действием сукцината на
оксигенацию внутриклеточной среды, стабилизацию структуры и функции
митохондрий, ионный обмен в клетке, о чем косвенно могут
свидетельствовать внеклеточные изменения
Na+/K+, Ca++, хлора,
Mg++. Обнаружены сопряженные изменения
функционирования оси гипофиз-надпочечники и системы ПОЛ-АОС на
фоне приема Реамберина. Наиболее вероятной мишенью представляются
глюкокортикоидные рецепторы II и III типа. Механизм их
ингибирования (концепция G. Vailette) может быть связан со
взаимодействием со вторым неспецифическим локусом, расположенным
вне пределов специфического глюкокортикоидного локуса
глюкокортикоидного рецептора II и III типа, что вызывает
трансформацию специфического глюкокортикоидного локуса, которая
является причиной снижения глюко-кортикоидсвязывающей способности
рецептора II и III типа. В конечном итоге, снижается уровень
активности Са++-кальмодулинзависимой NО-синтазы с
восстановлением физиологического уровня N0. Возможными
механизмами реализации кардио- и вазопротективного эффекта
Реамберина у пациентов с СД тип 1 являются:
- устранение неблагоприятных эффектов гипергликемии – угнетение
активности гликозилирования, пероксидации белков и радикала
N0;
- влияние на биохимические процессы – бета-окисление жирных
кислот, окислительное фосфорилирование глюкозы в миокарде, синтез
АТФ, синтез коллагена в сердце;
- опосредованное изменение уровня функционирования
нейроэндокринной регуляции (инсулин, кортизол, Т3).
Достоверное уменьшение активности ПОЛ и снижение концентрации
НbА1су пациентов с СД тип 1 в ходе приема Реамберина
может свидетельствовать о снижении образования продуктов
неферментативного гликозилирования белков-оснований Шиффа
(обратимых), слабо обратимых (продуктов Амадори) и необратимых
конечных продуктов гликозилирования. На уровне нефроцита
представляется вероятным возникновение на фоне приема Реамберина
явления адаптационного резерва, который связан с активностью
глутаматдегидрогеназного комплекса: происходит снижение активности
глутаматдегидрогеназы, что может быть вызвано увеличением
содержания NAD·H2 в результате торможения активности
ферментов NAD·H-дегидрогеназы и цитохромоксидазы в митохондриях
почек. Возможно накопление пиридиннуклеотида за счет генетически
опосредованного синтеза, являющегося аллостерическим регулятором
глутаматдегидрогеназы, что обращает ферментативную реакцию в
сторону образования глутаминовой кислоты, которая способна связать
аммиак в этот период. Другим важным следствием обращения этой
реакции является генерирование окисленного NAD, наличие которого
обеспечивает возможность катализа дегидрирования субстратов. На
уровне нефроцита происходит убывание глутамата в цикле Робертса,
что способствует предохранению сукцинатдегидрогеназы от
ингибирующего действия оксалоацетата и обеспечивает достаточно
высокий уровень энергопродукции для клеток органа. Увеличение
окисления глутамата может приводить к шунтированию α-кетоглутарата
с преобразовнием последнего в цикле Кребса. Наблюдающаяся
активация гликолиза является одним из механизмов, способствующих
поддержанию уровня АТФ, а также служит поставщиком субстратов
окисления для цикла Кребса. С другой стороны, не исключен рост
глутаминсинтетазы, что может способствовать накоплению
N-ацетилглутамата, активирующего карбомоилсинтетазу.
Механизмами антиоксидантного эффекта Реамберина в отношении
нейронов головного мозга являются:
- увеличение активности процессов гликолиза при снижении
активности бета-окисления жирных кислот посредством прямого
воздействия на транспортные системы переноса глюкозы в клетку;
- усиление активности окислительного фосфорилирования и синтеза
АТФ в митохондриях сопровождается повышением активности
креатинфосфокиназной системы, что сопряжено с нормализацией
окислительно-восстановительных процессор нарушаемых при
дисциркуляторной энцефалопатии;
- усиление окисления NAD·H и генерации NAD+;
- усиление метаболизма накапливающегося при нарушении мозгового
кровотока лактата, который используется для синтеза глюкозы и
гликогена и способствует ускорению метаболизма пирувата путем
присоединения низкомолекулярных радикалов в оксалоацетат с
дальнейшим включением последнего в цикл Кребса.
- создание физиологических концентраций глутамата, близких к
верхней границе нормы, может определять ингибирование синтеза N0`
в связи с блокадой индуцибельной синтазы N0;
- восстановление уровня глутатиона в результате блокады S –
нитрозилирования и уменьшение активности пентозофосфатного
пути.
Механизмы реализации психокоррегирующего эффекта Реамберина,
лежащего в основе улучшения КЖ, могут быть связаны с основными
путями синтеза ГАМК с учетом эффекта Бэлша (компартментализация
метаболизма глутамата, глутамина и ГАМК). Возможна
активация γ-глутамильного цикла. Представляется возможным влияние
Реамберина на активность окислительного декарбоксилирования
α-кетоглутарата с образованием сукцинил-КоА, так как данная реакция
обеспечивает поддержание суммарной концентрации метаболитов цикла
на стационарном уровне. Образование α-кетоглутарата способствует
его дальнейшему участию как в ЦТК, так и в
глутаматдегидрогеназной и трансаминазной реакциях.
Сукцинатдегидрогеназная реакция играет большую роль в
энергетическом метаболизме при хронической гипоксии и обеспечивает
поддержание энергетического баланса ткани, особенно на
пи-ридиннуклеотидном участке дыхательной цепи. Основными
энергозависимыми процессами, функция которых улучшается при приеме
Реамберина, являются: проведение нервных импульсов; поддержание
пространственной ориентации и конформации структурных единиц
нейрона; образование синаптических структур, функционирование
синапсов; нейрологическая память; трансмембранный перенос
субстратов, нейромедиаторов; аксональный и ретроградный ток.
Выводы
Продемонстрирована необходимость разработки «стратегии»
оптимизации режимов метаболической биорегуляции на примере одной
нозологии (СД тип 1) на основе комплексной системы анализа
фармакодчнамических эффектов инфузионного раствора «Реамберин 1,5%»
Разработана новая платформа для фармакоки-нетического анализа при
применении Реамберина 1,5% для инфузий.
Список литературы
- Дедов И.И., Сунцов Ю.И., Кудрякова С.В.,
Рыжкова С.Г. Эпидемиология инсулинзависимого
сахарного диабета // Кардиология.- 1998.-№3.-C- 47-55.
- Claasification and Diagnosis of Diabetes Mellitus and Other
Categories of Glucose Intolerance //Diabetes,- 1979,-Vol. 28,- P,
1039- 1057.
- Hoffman G.F. Organic acid analysis // Blau N., Du ran M.,
Blaskovics M.E., eds. Phisician`s guide to the laboratory
diagnosis of metabolic diseases,- Chapman & Hall London, 1996,-
P. 31-40.
- Holleland G.,. Schneede J,. Ueland P.M., Lund
P.K., Ref'sum H., Sandberg S. Cobalamin deficiency in
general practice. Assessment of the diagnostic utility and
cost-benefit analysis of methylmalonic acid determination in
relation to current diagnostic strategies//Clin.Chem,- 1999,- Vol.
45.- P.189-198.
- Pfeiffer С.М., Smith S.J., Miller D.T.,
Gunter E.W., Comparison of serum and plasma
methylmalonic acid measurements in 13 laboratories: an
international study // Clin.Chem. - 1999,- Vol. 45. –
P2236-2242.
|
|
|
Ліцензія Державної інспекції з контролю якості лікарських засобів МОЗ України з оптової торгівлі лікарськими засобами АВ №528116
| 2024 ТОВ "Аптечний склад медичної академії" |
|
* webmaster |
|