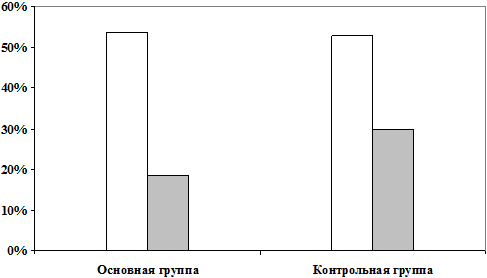
Рис 1. Динамика индекса PASI
в основной и контрольной группах
Источник: И.Б. Трофимова, Е.Н. Костянова, А.В. Коралкин
Некоторые аспекты патогенеза и лечения псориаза // Весник дерматолигии и венерологии 6’ 2004
Кафедра кожных и венерических болезней
Московского государственного медико-стоматологического университета;
Отделение радиоизотопной диагностики
городской клинической больницы №1 им. Н.И. Пирогова
И.Б. Трофимова, Е.Н. Костянова, А.В. Коралкин
Проведены исследования окислительного стресса и тканевого кровотока у 54 больных псориазом в возрасте от 18 до 67 лет. Установлено, что у больных в прогрессирующей стадии псориаза показатели перекисного окисления липидов: диеновые конъюгаты и малоновый лиальдегид в среднем в 2-2,5 раза выше нормы. Резко изменены значения антиоксидантной системы, в основном за счет увеличения концентрации церулоплазмина, снижения содержания α-токоферола, что свидетельствует о наличии воспалительного синдрома. Значительно отличаются от нормальных значений показатели эндогенной интоксикации. Выявлено, что в области псориатической бляшки период полувыведения радиоактивного технеция значительно превышает норму. Показано, что введение в комплексную терапию псориаза реамберина корригирует показатели окислительного стресса, уменьшает эндогенную интоксикацию, улучшает тканевый кровоток. Его применение приводит к более быстрой стабилизации кожного процесса.
По современным представлениям, псориаз рассматривается как хронический, тяжелый, мультифакториальный дерматоз, характеризующийся гиперпролиферацией эпидермиса, эритематозно-сквамозными высыпаниями, стадийным течением и нередко патологическими изменениями в различных органах и системах [3, 6].
В формировании и реализации клинических проявлений псориаза участвуют многочисленные факторы. Среди них особое место принадлежит изменениям микроциркуляторного русла [7, 9], усилению активности перекисного окисления липидов (ПОЛ) со снижением показателей антиоксидантной системы (АОС)[1, 2, 4, 5].
Целью исследования явилось изучение процессов свободнорадикального окисления, синдрома эндогенной интоксикации (ЭИ), функциональных нарушений микроциркуляторного русла у больных псориазом, особенно в прогрессирующей стадии, и с псориатической эритродермией. В этой связи актуальным представляется совершенствование терапии с применением препарата реамберин, основным действующим веществом которого является сукцинат натрия, обладающий антигипоксическим, антиоксидантным и дезинтоксикационным свойствами [5].
Под наблюдением находились 54 больных (38 мужчин, 16 женщин в возрасте от 18 до 67 лет) с диагнозом прогрессирующей стадии псориаза и псориатической эритродермии. Из них 32 пациента получали реамберин внутривенно капельно ежедневно по 400 мл в течение 10 дней, традиционные десенсибилизирующие и антигистаминные средства. Группу сравнения составили 22 человека.
Всем больным проводилось клинико-лабораторное обследование до и после лечения, включающее осмотр, сбор анамнестических данных, исследование общих анализов крови, мочи, биохимических анализов крови.
Помимо этого, хемилюминесцентным методом проведены исследования продуктов ПОЛ: диеновых конъюгатов (ДК), малонового диальдегида (МДА), степени окисленности (СО); показателей АОС: церулоплазмина (ЦП), α-токоферола (ТФ), антиокислительной активности (АОА).
Кроме того, флюориметрическим методом определялись показатели ЭИ: общая концентрация альбумина (ОКА), эффективная концентрация альбумина (ЭКА), средние молекулярные пептиды (СМП).
С помощью математической формулы ДКi/ДКп-МДАi/МДАпСО i/СОп: ТФi/ТФпЦПi/ЦПп был вычислен интегральный показатель коэффициент окислительного стресса (К), отражающий состояние дисбаланса в системе ПОЛ – АОС.
Функциональные нарушения микроциркуляторного русла оценивали на основании регистрации периода полувыведения (ППВ) радиоактивного технеция 99Тс на компьютерном эмиссионном томографе Siemens ("Diacam") в отделении радионуклидной диагностики Городской клинической больницы №1 им. Н.И. Пирогова.
Степень выраженности патологического процесса в коже оценивали с помощью индекса PASI [8].
Результаты исследований обрабатывали с применением общепринятых способов вариационной статистики и корреляционного анализа.
У большинства больных псориаз начался в юношеском возрасте с поражения волосистой части головы.
Среди факторов, провоцирующих начало заболевания, наиболее часто встречались стрессовые ситуации, инфекции.
У родственников 10% больных первой степени родства в анамнезе были выявлены хронические дерматозы. У 75% больных обострения наблюдались 2-3 раза в год, у 20% – 1 раз в год, преимущественно в осенне-зимний период, у 5% – заболевание возникло впервые.
У 18 (33%) больных отмечались боли в суставах. У 21 пациента заболевание носило торпидный характер с кратковременными периодами улучшения длительностью 3-7 дней. У 31 больного процесс имел распространенный характер, у 23 – универсальный.
Степень тяжести и распространенности кожного процесса оценивали с помощью индекса PASI.
Из табл. 1 видно, что до начала терапии у всех больных уровень ДК и МДА превышал норму в среднем в 2-2,5 раза. Концентрация ЦП была выше нормы в среднем в 1,4 раза. Уровень ТФ как в основной, так и в контрольной группе (группе сравнения) отставал от нормального. Наблюдалась тенденция к увеличению АОА.
Таблица 1. Коррекция реамберином окислительного стресса и ЭИ
у больных псориазом (M±m)
|
Показатель |
Норма |
Группа |
Срок исследования |
|
|---|---|---|---|---|
|
до лечения |
после лечения |
|||
|
ПОЛ: |
||||
|
ДК, ”D233/мл.мг |
0,62±0,02 |
К |
1,68±0,2* |
1,66±0,24* |
|
О |
1,65+0,18* |
1,1±0,1*** |
||
|
МДА, нмоль/мл |
1,24±0,07 |
К |
2,5±0,09* |
2,19±0,14* |
|
О |
2,6±0,2* |
1,95+0,15* |
||
|
СО, ”D233/ ”D218 |
0,54+0,02 |
К |
0,5±0,04 |
0,48+0,02* |
|
О |
0,49+0,02 |
0,48±0,03 |
||
|
АОС: |
||||
|
ТФ, мкг/мл.мг |
3,24±0,15 |
К |
3,14±0,29 |
3,03+0,13 |
|
О |
3,07+0,19 |
4,18±0,23*** |
||
|
ЦП, мкг/100 мл |
31,8+2,1 |
К |
43,4±2,54* |
44,4±2,1* |
|
О |
46,03+1,19*** |
34,0+1,0** |
||
|
АОА, мМ аскорбатных ед. |
0,91+0,09 |
К |
1,05±0,06 |
1,4+0,09* |
|
О |
1,1 ±0,08 |
2,24±0,09* ** |
||
|
ЭИ: |
||||
|
ОКА, г/л |
47,8±0,73 |
К |
41,8+1,4* |
41,7±1,0* |
|
О |
44,6±1,1* ** |
47,15+1,13*** |
||
|
ЭКА, г/л |
40,7+2,18 |
К |
29,5±2,56* |
27,6±2,6* |
|
О |
25,4±2,28* ** |
36,3±2,1* ** |
||
|
СМП, усл. ед. |
0,219±0,008 |
К |
0,299+0,011* |
0,305+0,008* |
|
О |
0,304+0,007* |
0,250+0,006** |
||
|
К окислительного стресса |
1,12+0,1 |
К |
4,15±0,52 |
3,3+0,48 |
|
О |
3,83±0,45 |
1,89+0,29 |
||
Примечание:
О – основная группа;
К – контрольная;
* – достоверность различий с нормой;
** – достоверность различий между группами.
Из показателей ЭИ отмечалось значительное снижение ЭКА (в среднем в 1,6 раза по сравнению с нормой), уменьшение ОКА, существенное повышение величины СМП (0,304±0,007 усл. ед. в основной группе при норме 0,219±0,008 усл. ед.), что свидетельствует о высоком уровне ЭИ у больных псориазом.
На фоне лечения содержание ДК и МДА превышало норму, хотя отмечалась тенденция к его снижению, более выраженному в основной группе.
Таблица 2. Влияние реамберина на ППВ 99Тc (в мин)
у больных псориазом (М±m)
|
Группа больных |
До лечения |
После лечения |
||
|---|---|---|---|---|
|
псориатическая бляшка |
видимо здоровая кожа |
псориатическая бляшка |
видимо здоровая кожа |
|
|
Основная |
15,6±1,3 |
9,6±0,5 |
11,3±0,7 |
9,3±0,3 |
|
Контрольная |
14,9±1,3 |
9,5±0,6 |
13,6±1,0 |
9,3±0,4 |
Концентрация ТФ несколько снизилась в контрольной группе, в то время как в основной группе его уровень возрос в 1,36 раза.
В основной группе отмечено значительное приближение к норме величины ЦП, существенное возрастание АОА.
Величина СМП в основной группе существенно снизилась – до 0,250+0,006 усл.ед., что составило незначительное превышение нормы.
В основной группе наблюдалось повышение ОКА до нормальных величин, концентрация ЭКА увеличилась в 1,4 раза.
Установлено, что в основной группе величина К снизилась с 3,83±0,5 до 1,89±0,3, в то время как в контрольной группе значение К до лечения составило 4,15±0,5, а после лечения – 3,3±0,5.
Результаты оценки тканевого кровотока (табл. 2) показали, что ППВ 99Тс в области псориатической бляшки в основной и контрольной группах значительно превышает норму (8-10 мин).
Динамика индекса PASI в основной и контрольной группах представлена на диаграммах (рис.1).
У больных основной группы уже на 3-й сутки можно было отметить значительное уменьшение эритемы и шелушения. По сравнению с контрольной группой в 1,6 раза быстрее наблюдалось разрешение инфильтрации, отсутствие новых высыпаний и переход прогрессирующей стадии в стационарную.

Рис 1. Динамика индекса PASI
в основной и контрольной группах
Таким образом, введение в комплекс традиционной терапии реамберина существенно повысило эффективность лечения больных псориазом в его прогрессирующей стадии за счет коррекции дисбаланса в системе ПОЛ–АОС, уменьшения ЭИ, улучшения тканевого кровотока в зоне псориатической бляшки, что привело к значительному снижению индекса PASI, уменьшению длительности прогрессирующей стадии и более ранней стабилизации кожного процесса.