Янтарная кислота является универсальным промежуточным метаболитом, образующимся при взаимопревращении углеводов, белков и жиров в растительных и животных клетках. В физиологических условиях янтарная кислота диссоциирована, поэтому название ее аниона – сукцинат, часто применяют как синоним термина "янтарная кислота". Она является продуктом пятой и субстратом шестой реакции в цикле Кребса.
Превращение янтарной кислоты в организме связано с продукцией энергии необходимой для обеспечения жизнедеятельности. При возрастании нагрузки на любую из систем организма, поддержание ее работы обеспечивается преимущественно за счет окисления янтарной кислоты. Мощность системы энергопродукции, использующей янтарную кислоту, в сотни раз превосходит все другие системы энергообразования организма.
Именно это и обеспечивает широкий диапазон неспецифического лечебно-го действия янтарной кислоты и ее солей. Кроме того, янтарная кислота обладает и такими эффектами, как актопротекторный и противовирусный.
В экспериментальных исследованиях биологическая активность экзогенного сукцината зависила от дозы, режима введения препарата, его химической формы (кислота, соль, сложный эфир), а также от функционального состояния организма.
При применении физиологических доз янтарной кислоты выявлены две ведущие группы эффектов:
- прямое действие янтарной кислоты на клеточный метаболизм;
- влияние янтарной кислоты на транспорт свободного кислорода в ткани.
В экспериментах in vitro было показано, что применение сукцината приводило к приросту потребления кислорода тканями за счёт окисления добавленных субстратов до конечных продуктов - углекислоты, воды и тепла. Одна молекула добавленной к ткани дикарбоновой кислоты обеспечивает окисление многих эндогенных субстратов. Иными словами, окисление сукцината является необходимым условием каталитического действия любой другой из карбоновых кислот для усвоения тканью кислорода (цикл три- и дикарбоновых кислот).
Потеря интермедиатов цикла возрастает при острых и хронических отравлениях аммиаком. Пополнение пула кислот цикла Кребса нарушается при алкоголизме, гиповитаминозе В6 и при отравлениях ингибиторами пиридоксальфосфат зависимых ферментов. Поэтому пополнение пула интермедиатов цикла Кребса, в том числе из пищевых источников, является необходимым. Янтарная кислота является метаболитом человеческого организма и эндогенный уровень её в плазме крови человека колеблется от 1 до 6 мкг/мл.
Свободная янтарная кислота распространена в природе. В значительных количествах (0,1–1,0 г/кг, или 0,8–8,0 ммоль/кг) она содержится в незрелых ягодах, соке сахарной свеклы, сахарного тростника, репы, в ревене, алоэ, боярышнике, землянике, каланхоэ, крапиве, чистотеле, полыни и других растениях, а также в продуктах спиртового брожения. Дополнительным источником янтарной кислоты в тканях является липолиз.
Для пополнения пула всех органических кислот цикла Кребса у человека достаточным оказалось экзогенное введение лишь одного сукцината,который является стимулятором синтеза воссстановительных эквивалентов в клетке. Биологическое значение данного явления заключается в быстром ресинтезе клетками АТФ и в повышении их антиоксидантной резистентности.
Введение сукцината натрия лабораторным животным или здоровым людям приводило к снижению уровня органических кислот в крови, экскреции кислых продуктов обмена из организма, что указывает на нормализацию аэробной фазы тканевого дыхания.
Преимущества сукцината перед другими субстратами клеточного дыхания наиболее выражены в условиях гипоксии, когда возрастает продукция эндогенного сукцината и скорость его окисления.
В основе лечебно-проффилактического действия янтарной кислоты и ее соединений лежит модифицирующее влияние на процессы тканевого метаболизма - клеточное дыхание, ионный транспорт, синтез белков. При этом амплитуда и направленность модификаций зависят от исходного функционального состояния тканей, а ее конечный результат выражается в оптимизации параметров их функционирования. Такие свойства позволяют отнести янтарную кислоту к лечебно-профилактическим препаратам нового поколения - к так называемым "умным лекарствам".
И тем не менее, при уникальной разносторонности проявлений биологической активности янтарной кислоты, сфера ее применения в медицинской практике остается пока еще узкой.
Роль и место реамберина в инфузионной терапии
медицины критических состояний
медицины критических состояний
Показания к использованию препарата должны определяться его влиянием на основные звенья патогенеза критических состояний, которые невзирая на полиэтиологичность их возникновения (кровопотеря, асфиксия, шок, эндо-токсикоз и др.), имеют единую патофизиологическую основу, состоящую из 3 основных процессов:
- гипоксии,
- интоксикации,
- иммуносупрессии.
Основную роль играет гипоксия и интоксикация, которые сами по себе, т.е по отдельности, могут привести к развитию критических и терминальных состояний, сопровождающихся нарушением метаболизма и энергообмена в клетках организма. Учитывая, что гипоксия и интоксикация взаимосвязаны и взаимообусловлены (эффект взаимного потенцирования или отягощения"), и являются основными факторами танатогенеза, то изучение антигипоксического и антитоксического действия реамберина и его влияния на иммунную систему, представляется актуальным.
Антигипоксическое действие
реамберина
Антигипоксанты являются новой действенной группой средств метаболической коррекции критических состояний в клинике. Сукцинат натрия (янтарная кислота) по клинической классификации относится к субстратным антигипоксантам.
Конечным эффектом гипоксии является дефицит кислорода в тканях, что приводит к снижению ресинтеза макроэргических соединений.
Повышение устойчивости к гипоксии проявляют энергообеспечивающие интермедиаты цикла Кребса - фумаровая, лимонная и янтарная кислоты. Включаясь в энергетический обмен как субстраты, они направляют процессы окисления по наиболее экономичному пути. Так, фумаровая кислота входит в состав кровезаменителя мафусола, успешно применяемого в медицинской практике при гиповолемических и гипоксических состояниях различной этиологии (кровопотеря, травма, шок, интоксикация).
При гистотоксической гипоксии, вызванной фторидом натрия, происходит блокада гликолиза, но при этом дыхательная цепь продолжает функционировать. Реамберин, как субстрат цикла Кребса, активирует процессы окисления, поставляющие электроны для дыхательной цепи митохондрий. Можно полагать, что реамберин удлиняет продолжительность жизни животных, находящихся в условиях гистотоксической гипоксии, обеспечивая необходимый для жизнедеятельности клеток синтез макроэргов.
Выявленная антигипоксическая активность реамберина на тканевом уровне послужила основанием для его изучения при локальной гипоксии-ишемии миокарда в условиях эксперимента.
Проведенные исследования дали возможность заключить, что:
- реамберин проявляет доза-зависимый антигипоксический эффект на модели гистотоксической гипоксии, вызванной введением фторида натрия;
- реамберин в дозах 250 и 500 мг/кг не оказывает влияния на величину зоны некроза в условиях ишемии миокарда;
- реамберин в дозе 250 мг/кг по показателям ЭКГ-исследования проявляет противоишемическое действие на ранней фазе инфаркта миокарда;
- реамберин в дозах 250 и 500 мг/кг устраняет дефицит КФ в сердечной мышце, улучшая тем самым энергообеспечение миокарда;
- реамберин в дозе 250 мг/кг проявляет отчетливую тенденцию выживания животных в условиях ишемии миокарда.
Анализируя полученные данные, можно полагать, что реамберин будет оказывать более благоприятное влияние на течение ранних постишемических аритмий. Инфузионный способ введения Реамберина в течение первых часов может усилить ранний антиишемический эффект препарата.
Антитоксическое действие реамберина
Одним из ведущих синдромов интоксикации различными ксенобиотиками является всё та-же гипоксия, поэтому изучение антигипоксантов в качестве средств патогенетической терапии экзогенной и эндогенной интоксикации актуально.
Как известно, печень является основным местом метаболизма ксенобиотиков, поэтому этот орган становится мишенью токсического действия ядов с первичным нарушение функции мембран с последующим развитием синдрома острой полиорганной недостаточности (СОПОН).
Экспериментальные исследования свидетельствуют о том, что реамберин в дозах 100 и 250 мг/кг оказывает гепатозащитное действие, сопоставимое с эффектами известного гепатопротектора карсила. Реамберин снижает продолжительность процессов ПОЛ, препятствует истощению запасов гликогена гепатоцитов и препятствует повышению концентрации билирубина в сыворотке крови.
Антитоксическое действие Реамберина при отравлении барбамилом, оказалось более эффективным, чем действие пирацетама и мафусола. Реамберин снижал продолжительность гексеналового сна в 2,8 раза и предотвращал гибель животных. Таким образом, реамберин в дозах 100 и 250 мг/кг оказывал положительное и влияние при интоксикации барбамилом. Эти данные могут свидетельствовать о защитном действии реамберина на микросомальную ферментативную систему метаболизирующую ксенобиотики.
Накопленные к настоящему времени сведения о биологической активности янтарной кислоты позволяют отнести ее к адаптогенам. Использование реамберина в дополнение к традиционной терапии сопровождается улучшением клинической картины, снижением летальности, нивелированием и ускорением регрессии разнообразных лабораторно-диагностических отклонений.
Мутагенные свойства реамберина
На основании проведенных исследований в соответствии с Методическими указаниями Фармакологического государственного комитета МЗ России по тестированию препаратов на стадии их доклинического токсикологического изучения сделан вывод о том, что реамберин в концентрациях 0,1-1000 мкл/чашку не обладает мутагенным действием в тесте Эймса. Не выявлено и достоверных различий в уровне хромосомных обераций в клетках костного мозга под действием препарата.
По результатам проведенных исследований Реамберин не обладает мутагенным действием, а также не является канцерогеном по прогнозу канцерогенности.
Фармакокинетика 1,5% раствора реамберина
Изучение фармакокинетики 1,5% раствора реамберина показало, что при внутривенном введении препарата в дозе 5 мг/кг массы тела максимальный уровень реамберина в крови наблюдается в течение первой минуты после введения с последующим быстрым снижением до уровня 9 - 10 мкг/мл и через 40 минут после введения концентрация препарата в крови возвращается к значениям близким к фоновым (от 1 до 6 мкг/мл) и остается на таком уровне до конца наблюдения.
Заключение по экспериментальному изучению
реамберина
Результаты доклинического исследования, проведенного в соответствии с утвержденным Фармакологическим Комитетом МЗ РФ протоколом изучения общетоксического действия препарата реамберин, позволяют заключить, что он относится к 5 классу практически нетоксичных лекарственных средств, является безопасным и безвредным препаратом, что позволило разрешить его применение в клинической практике.
Разрешение клинических испытаний и его
результаты
Основанием для проведения клинических исследований явилось решение ФГК МЗ РФ № 211-15-1301 о разрешении проведения клинических исследований в качестве дезинтоксикационного средства на здоровых добровольцах (волонтерах).
Задачи клиничесского исследования:
- изучить клинические особенности переносимости и безвредности препарата при парентеральном введении здоровым добровольцам;
- выявить побочные эффекты препарата;
- изучить влияние Реамберина на различные стороны жизнедеятельности организма.
Исследование переносимости Реамберина проведено в группе практически здоровых лиц в возрасте 18-33 лет, включающей 20 мужчин и 10 женщин. Обследование включало врачебный осмотр и наблюдение до, в процессе вливания и после введения реамберина.
Характеристика препарата
Реамберин – 1,5% раствор для инфузий представляет собой хорошо сбалансированный полиионный раствор с добавлением янтарной кислоты содержащий:
- Натрия хлорида – 6,00 г
- Калия хлорида – 0,3 г
- Магния хлорида – 0,12
- N – (1 – дезокси – D – глюцитол – 1 – ил) – N – метиламмония натрия сукцината – 15,00 г
- Вода для инъекций – до 1 л.
Ионный состав раствора:
- Натрия – 142,4 ммоль
- Калия – 4,0 ммоль
- Магния – 1,2 ммоль
- Хлорида – 109,0 ммоль
- Сукцината – 44,7 ммоль
- N – метилглюкаммония – 44,7 ммоль.
Осмолярность и pH 1,5% раствора Реамберина
Нормальная осмолярность плазмы крови человека колеблется от 275 до 310 мосм/кг, составляя в среднем – 290 мосм/кг. Реамберин в виде 1,5% раствора является сбалансированным препаратом с осмолярностью, приближенной к нормальной осмолярности плазмы крови человека, т.е. изотоническим раствором и слабощелочным, в пределах нормальных значений pH для крови.
Биохимические показатели крови после введения реамберина достоверно не изменялись. Показатели основных электролитов в крови также достоверно не изменялись, однако отмечена тенденция к увеличению осмолярности плазмы у 9 (30%) человек. При этом показатели осмолярности плазмы никогда не выходили за верхние пределы нормальных колебаний.
Введение реамберина сопровождалось достоверным увеличинем рН и буферной емкости крови (изменение BE, BEecf, BB). Это сопровождалось ощелачиванием мочи (увеличение рН мочи). Следует отметить, что при сохранении концентрационной способности почек на фоне введения реамберина отмечалось достоверное снижение выделения натрия с мочой.
Препарат Реамберин в виде стерильного раствора только для внутривенного введения изначально применялся в объеме 400 мл капельно в дозе 3-4 мл/мин в среднем в течение 2 часов.
Основные результаты
клинических исследований
клинических исследований
1. Температурная реакция – исследована температура тела в динамике наблюдения: до введения препарата; на фоне введения препарата, по окончании введения препарата и через 1 час после введения препарата.Отмечено отсутствие пирогенного эффекта.
2. Сердечно-сосудистая система: умеренное снижение АД, но не ниже нормальных значений, отмечено у 4 (12%) испытуемых в течение первого часа введения: умеренное повышение АД до пограничных значений – у 5 (15%) испытуемых через 2 часа после начала введения препарата. Умеренная брадикардия имела место у 1 (3,3%) испытуемого через 2 часа после начала введения.
Патологических измнений при ЭКГ – обследовании здоровых добровольцев под воздействием Реамберина не отмечено. Показатели ЭКГ не изменились по отношению к фоновым значениям и в сравнении с контрольной группой, получавший плацебо (физиологический раствор 0,85%).
3. Нервная система – осложнений не отмечено.
4. Желудочно-кишечный тракт – осложнений не отмечено.
5. Дыхательная система – осложнений не отмечено. Частота дыхания оставалась в пределах нормы.
6. Кожные реакции – гиперемия лица, шеи, верхней половины туловища, рук по типу сосудистой реакции, самостоятельно проходящая при снижении скорости введения препарата до 1 мл/мин у 7 (23%) испытуемых.
7. Местные реакции в области введения – не отмечено.
8. Аллергические реакции – заложенность носа, исчезнувшая самостоятельно при снижении скорости введения препарата у 1 (3,3%) испытуемого.
У препарата Реамберин 1,5% для инфузий установлено наличие антиоксидантных и антигипоксантных свойств.
Тяжелых реакций и осложнений, потребовавших прекращения введения препарата, не было.
Сразу после прекращения введения реамберина у всех исследуемых отмечен умеренный диуретический эффект – получено не менее 400 мл мочи.
Исследование показателей периферической крови показало, что после введения реамберина отмечено увеличение числа лейкоцитов в крови без изменения формулы крови и снижение числа тромбоцитов в крови. Изменения абсолютных значениях клеточных элементов периферической крови было недостоверно, показатели укладывались в доверительные границы нормы.
Полученные данные свидетельствуют о том, что препарат Реамберин, в виде 1,5% раствора для внутривенной инфузии, применённый по указанной методике (капельно в дозе 3-4 мл/мин, в среднем в течение 2-х часов, в объеме 400 мл), удовлетворительно переносится пациентами и не приводит к развитию осложнений и побочных эффектов при его пролонгированном использовании. При этом не отмечено токсического воздействия Реамберина на основные жизненно-важные системы организма: сердечно-сосудистую, дыхательную, выделительную, а также на показатели гомеостаза.
Препарат Реамберин 1,5% для инфузий проявил высокий клинический эффект в качестве дезинтоксикационного средства у больных с тяжелыми формами эндогенной интоксикации (больные с механической желтухой).Препарат улучшал функциональную активность печени, что подтверждено динамикой показателей внутриклеточных ферментов печени – щелочной фосфатазы, АсАТ и АлАТ. Препарат может быть рекомендован в качестве этиотропного средства в терапии эндогенной интоксикации больных с механической желтухой. Препарат улучшает дезинтоксикационную функцию печени, способствуя процессам репаративной регенерации гепатоцитов. Реамберин активирует антиоксидантиую систему ферментативного звена, снижая процессы перекисного окисления липидов, обладая мембрано-стабилизирующим действием.
Спектр применения препарата в клинической практике довольно широк. Наряду с использованием его в гепатологической практике в комплексной терапии различных клинических форм вирусных гепатитов, возможно также применение его с дезинтоксикационной целью и с целью коррекции гипоксических состояний различного генеза.
Реамберин улучшает микроциркуляцию и реологические свойства крови: за счет повышения осмотического давления крови наблюдается отток жидкости и токсинов из тканей в кровь; при этом наблюдается усиление обмена веществ, стимуляция диуреза, выведение токсинов из организма.
Препарат оказывает мембраностабилизирующее действие на клетки печени. Оценка клинико-лабораторной эффективности препарата Реамберин оценивалась по результатам комплексной терапии больных различными клиническими формами вирусных гепатитов с гемоконтактным механизмом передачи (ОГС, ХГС, ОГВ, ХГВ и микст-гепатитов).
На фоне лечения Реамберином отмечалось улучшение общего самочувствия больных, снижались интоксикационные проявления и у 80% больных к 5-6 дню от начала лечения улучшалось настроение, повышалось качество жизни и исчезали диспептические расстройства.
У больных вирусным гепатитом С, получавших Реамберин внутривенно к 8-10 дню от начала приема практически исчезала желтуха (значения общего билирубина составили 52,2 + 1,2 мкм/л по сравнению с исходными значения-ми 231,0 + 1,4 мкм/ л), а также наблюдалась положительная динамика в нормализации размеров печени (у 87,6% против 60%). Нарушение пигментного обмена восстанавливалось быстрее при введении Реамберина (р < 0,01) в сравнении с группой больных, находящихся на симпатоматической терапии. При изучении влияния Реамберина на биохимические показатели в процессе терапии у больных вирусным гепатитом С обращает внимание достаточно выраженная положительная динамика параметров АлАТ, билирубина, а также SH-, SS-групп.
В результате проведенного исследования установлена эффективность препарата в качестве дезинтоксикационного, антиоксидативного средства; отсутствие побочных эффектов и аллергических реакций делают применение препарата при вирусных поражениях печени перспективным.
Реамберин может быть использован в качестве дезинтоксикационного средства перед назначением специфической противовирусной терапии больным с различными клиническими формами вирусных гепатитов, включая микст-формы.
Основной фармакологический эффект препарата обусловлен способностью усиливать компенсаторную активность аэробного гликолиза, снижать степень yгнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличен содержания АТФ и креатинфосфата. Реамберин активирует антиоксидантную систему ферментов и тормозит процессы перекисного окисления липидов в ишемизированных органах, оказывая мембраностабилизирующее действие.
Положительная динамика по данным спектрограмм при проведении мониторинга ЭЭГ у больных с тяжелыми энцефалопатиями, активация состояния сознания у части больных, увеличение сроков жизни у больных с тяжелейшими поражениями головного мозга, снижение летальности у больных указанных групп позволяют рекомендовать использование препарата Реамберин в клинической реанимационной и нейрореанимационной практике в качестве инфузионного нейрометаболического корректора.
Препарат Реамберин 1,5% для инфузий может быть использован и в терапии больных разлитым перитонитом при развитии у больных данной группы синдрома полиорганной недостаточности. Применение данного препарата может быть использовано как для предоперационной подготовки больных с разлитым перитонитом, так и для проведения интенсивной терапии в после-операционном периоде.Препарат может быть использован в качестве корректора характерных для больных перитонитом и при развитии синдрома ПОН расстройств энергометаболизма, способствуя уменьшению выраженности эндотоксикоза как по клинико-лабораторным, так и по энцефалографическим параметрам. Применение препарата позволяет увеличить период жизни пациентов и снизить уровень летальности больных перитонитом даже при развитии синдрома полиорганной недостаточности.
Реамберин 1,5% для инфузий может быть рекомендован и для терапии больных с сосудистыми поражениями головного мозга при развитии синдрома полиорганной недостаточности. Применение Реамберина показано как для предоперационной подготовки больных с сосудистыми поражениями головного мозга (при геморрагическом инсульте, когда планируется хирургическое вмешательство), так и для проведения интенсивной терапии в послеоперационный период. Препарат может быть использован в качестве корректора характерных для больных с ишемическими и вторичными ишемическими поражениями головного мозга при развитии синдрома полиорганной недостаточности, расстройств энергометаболизма, что способствует уменьшению выраженности эндотоксикоза, постишемических поражений как по клинико-лабораторным, так и по энцефалографическим параметрам. Применение препарата позволяет увеличить период жизни пациентов и снизить уровень летальности больных с сосудистыми поражениями голоного мозга даже при развитии синдрома полиорганной недостаточности. Реамберин может быть использован как комплексный энергометаболит и корректор инфузионных расстройств у больных с сосудистыми поражениями головного мозга как ишемического, так и геморрагического характера в качестве средства выбора для недифференцированной патогенетически обусловленной терапии.
Таким образом, Реамберин обладает антигипоксическим и антиоксидантным действием, оказывая положительный эффект на аэробные процессы в клетке, уменьшая продукцию свободных радикалов и восстанавливая энергетический потенциал клеток.
Препарат активирует ферментативные процессы цикла Кребса и способствует утилизации жирных кислот и глюкозы клетками, нормализует кислотно-щелочной баланс и газовый состав крови. Обладает умеренным диуретическим действием.
Корнилов Н.В., Новоселов К.А., Орлов Ю.Н.
РНИИТО им. Р.Р. Вредена, СПбГМУ им. акад. И.П. Павлова
кафедра травматологии и ортопедии, САНКТ-ПЕТЕРБУРГ
Экспериментальное изучение
и клиническая апробация
1.5% раствора Реамберина
при ортопедических операциях на коленном
суставе
и клиническая апробация 1.5% раствора Реамберина
при ортопедических операциях на коленном суставе
Ортопедические операции на коленном суставе связаны со значительной продолжительностью и травматичностью, сопровождаются большой кровопотерей во время вмешательства и в раннем послеоперационном периоде (4, 5, 7, 9, 10, 11, 12, 22, 25). Массивная кровопотеря приводит к снижению кислородной емкости крови, гиповолемии, угнетению дыхания, гипоксии тканей, ацидемии, эндоинтоксикации (1, 2, 8, 13).
Большинство пациентов с дегенеративно-дистрофическими поражениями коленного сустава имеют сопуствующие заболевания, коррекция которых необходима в предоперационном и раннем послеоперационном периодах для снижения риска развития осложнений (2, 7, 9, 19, 20, 24).
В настоящее время для инфузионной терапии используются физиологический раствор NaCI, полиглюкин, реополиглюкин, стабизол, рефортан, гелофузин, глюкоза, гемодез, полиионные растворы, гемодез, растворы аминокислот, их фармакологические свойства направлены на коррекцию одного из параметров гомеостаза (1, 2, 7, 9, 16). Растворы с полипотентным действием (антигипоксическим, энергетическим, антиоксидантным, цитопротекторным) и сбалансированным составом электролитов, к которым относится "Реамберин" широкого клинического применения ещё не получил (3, 14, 19, 21, 23).
Препарат "Реамберин" представляет собой изотонический, 1,5% раствор натрий-метилглюкаминовой соли янтарной кислоты со сбалансированным содержанием электролитов натрия, калия, магния, хлора. Его осмолярность составляет 320±10 мосмоль/л. Предназначен для внутривенного введения, поставляется для инфузий в маркированных флаконах по 400 мл (3).
Янтарная кислота является естественным метаболитом, принимающим непосредственное участие в энергетическом обмене через цикл Кребса, поэтому использование Реамберина эффективно в период гипоксии, кровопотери и расстройств микроциркуляции (3, 23, 24).
В экспериментальных исследованиях на лабораторных животных мы провели сравненительный анализ эффективности использования раствора "Реамберин" и широко распространеных растворов (физ. раствор NaCl, гемодез, мафусол).
На основании анализа клинико-лабораторных данных экспериментального исследования была проведена клиническая апробация раствора "Реамберин" в раннем послеоперационном периоде после ортопедических операций на коленном суставе.
Материалы и методы экспериментальных исследований
Исследования на животных проведены в экспериментальной лаборатории Санкт-Петербургского института Токсикологии МЗ РФ руководитель - старший научный сотрудник С.Е. Колбасов.
Экспериментальные исследования нами осуществлены на половозрелых нелинейных самцах-альбиносах серых крыс в двух сериях опытов, всего на 80 животных (15, 17, 18).
В первой серии моделировали острую кровопотерю (из хвостовой вены), объем которой составил 3-5 мл, т. е. 2,3-3% от массы тела и 35-40% от ОЦК. Темп и объем кровопотери приводил к развитию гемодинамического шока у всех экспериментальных животных. После завершения кровопотери, через 2-3 минуты, начинали дозированную инфузионную терапию: внутривенно медленно (1 мл за 20 секунд). Объём вводимых растворов на 1 сутки был равен кровопотере, на 2 и 3 сутки составлял 50% от его величины.
В первую серию эксперимента было включено 60 животных, разделенных на 6 групп в зависимости от характера проведенной инфузионной терапии.
- Интактные животные (фоновые нормальные показатели).
- Контрольная группа с кровопотерей без применения инфузионных
растворов.
Компенсацию кровопотери осуществляли:
- Внутривенным введением физиологического раствора NaCl.
- Введением раствора "Гемодез".
- Введением раствора "Мафусол".
- Основная группа введением раствора "Реамберин".
Растворы использованные в эксперименте: мафусол, ООО "Самсон-Мед" Санкт-Петербург; гемодез, ОАО "Краснофарма" Красноярск; физиологический раствор NаСI 0,9 % ОАО "Биосинтез" Пенза.
Животным второй серии эксперимента выполняли резекцию суставных поверхностей мыщелков бедренной и большеберцовой костей, с суммарной кровопотерей (операционная и из хвостовой вены) 3-5 мл. Операционная кровопотеря составила в среднем 0,7-1,0 мл. 20 крыс этой серии были разделены на две группы. Животным первой группы вводили 8-10 мл раствора "Реамберин" в течении 3-х суток после операции, во второй группе инфузионных растворов не вводили.
Вмешательства осуществляли под общим обезболиванием внутрибрюшинным введением 1% раствора гексенала из расчета 100 мг/кг, в положении животного на спине на деревянном столике с фиксацией трех конечностей.
Оценку эффективности применения Реамберина проводили, основываясь на динамике клинических и лабораторных параметров (17, 18).
Показатели клинико-лабораторных данных интактных животных принимали за норму.
Исследование лабораторных показателей производили на 1, 3, 10 сутки соответственно общепринятым методикам (17, 18).
Эвтаназию производили с использованием передозировки 0,5% раствора тиопентала, либо 1% раствора гексенала при внутрибрюшинном введении на 14 сутки.
Активность АлАТ, АсАТ, щелочной фосфатазы (ЩФ), креатин-фосфатазы (КФ), лактатдегидрогеназы (ЛДГ), содержание общего белка и липидов, холестерина, билирубина сыворотки крови определяли с помощью наборов Био-Ла-Тест Чешской фирмы "Лахема".
Уровень глюкозы в крови определяли ортотолуидиновым методом.
Содержание молочной кислоты определяли по методу Баркера. Остальные показатели оценивали по стандартным методикам.
Состояние кислотно-щелочного равновесия и уровни ионов плазмы крови определяли на анализаторе, АВL-3 фирмы "Radiometer" Дания.
Об интенсивности процессов перикисного окисления липидов (ПОЛ) судили по концентрации малонового диальдегида (МДА), а состояние антиоксидантных систем оценивали по активности каталазы плазмы крови.
Показатели, характеризующие степень выраженности эндогенной интоксикации - олигопептиды (ОП) плазмы, молекулы средней и низкой массы (ВНСМ), определяли по методу Малаховой М.Е. (1995).
Рентгенографию проводили на рентгеновском аппарате "Электроника 100" (Россия), с двухкратным увеличением, только животным, которым выполняли резекцию мыщелков бедренной и большеберцовой костей.
Статистическая обработка полученных данных проведена методом непараметрической статистики.
Результаты экспериментального исследования
В результате клинических наблюдений, было установлено, что массивная кровопотеря у животных всех групп первой серии эксперимента существенно снижает двигательную активность крыс, ухудшает аппетит (уменьшается количество потребляемого корма) и увеличивает продолжительность сна животных.
В отсуствии компенсации кровопотери растворами животные умирали на 1-2 сутки от осложнений гемодинамического шока.
Во второй серии эксперимента после резекции мыщелков бедренной и большеберцовой костей с массивной кровопотерей двигательная активность снижается у всех животных на протяжении первых 3-x суток. Крысы не наступали на оперированную конечность в течении 2-3 суток, а затем ещё 10-12 дней щадили её при движениях. Увеличивалась продолжительность сна, особенно в группе без компенсации кровопотери инфузионной терапией, четыре крысы этой же группы умерли на 1-2 сутки после операции.
При применении раствора "Реамберин" рана заживала первичным натяжением на 1-2 суток раньше. При сравнении рентгенограмм нижних конечностей крыс (интактного и оперированного коленных суставов) определялась выраженная дисконгруентность суставных поверхностей после резекции мыщелков коленного сустава.
Динамика лабораторных параметров
у экспериментальных животных
у экспериментальных животных
1. Группа животных без компенсации острой кровопотери
инфузионными растворами.
На 3-10 сутки после кровопотери - гемоглобин 8,2-10,5 г/л (норма 12,7±0,5), гематокрит 35-38% (норма 48,0±2,0%), эритроциты 4,6-5,6х1012/л (норма 6,5±0,2), лейкоциты 7,0-7,5 х 109/л (норма 7,3±0,2), продолжительность свертывания крови 36-45 сек (норма 44,7±2,0), протромбиновый индекс 9-12% (норма 16,5±0,5), т.о. эти показатели отличались от показателей интактных животных.
Биохимические показатели на 3-7 сутки - общий белок 65-63 г/л (норма 75±5), креатинин 0,13±0,10 ммоль/л (норма 0,08±0,01), глюкоза 7,9-7,1 ммоль/л (норма 7,1±0,1), АСаТ, Е/л 0,72±0,69 (норма 0,66±0,04), АЛаТ, Е/л 0,47±0,40 (норма 0,36±0,06), щелочная фосфатаза Е/л 1,97-1,95 (норма 1,21±0,33), НСТ тест усл.ед 90-81 (норма 70±5), т.о. показатели имели достоверные отличия при р<0,05 от интактной группы
Динамика показателей электролитного и кислотно-щелочного балансов показывает, что отклонения от нормальных параметров не компенсировались на 10 сутки.
Динамика эндогенной интоксикации и перикисного окисления липидов на 3-10 сутки - олигопептиды плазмы 0,32-0,28 г/л (норма 0,22±0,03), ВНСМ усл. ед. 47-42 (норма 36,8±1,4), каталаза 300-350 мг мл/мин (норма 450±20), малоновый диальдегид нмоль/мг белка 3,65-2,27 (норма 1,55±0,25), т.о. имеются достоверные отличия при р<0,05 от параметров интактной группы животных.
2. Группа компенсация кровопотери физиологическим раствором NaCI.
Установлено, на 3-10 сутки после кровопотери - гемоглобин 8,6-11,2 г/л (норма 12,7±0,5), гематокрит 32-39% (норма 48,07± 02,0%), эритроциты 5,0-5,9х1012/л (норма 6,5±0,2), лейкоциты 7,5-6,9 х 109/л (норма 7,3±0,2), продолжительность свертывания крови 45-46 сек (норма 44,7±2,0), протромбиновый индекс 12,1-14,1% (норма 16,5±0,5), т.о. эти показатели имели достоверные отличия при р<0,05 на 3-5 сутки.
Биохимические показатели на 3-7 сутки - общий белок 57-65 г/л (норма 75±5), креатинин 0,11±0,10 ммоль/л (норма 0,08±0,01), глюкоза 6,7-6,8 ммоль/л (норма 7,1±0,1), АСаТ, Е/л 0,68±0,02 (норма 0,66±0,04), АЛаТ, Е/л 0,38±0,4 (норма 0,36±0,06), щелочная фосфатаза Е/л 1,87-1,88 (норма 1,21±0,33), НСТ тест усл.ед 90-75 (норма 70±5), т.о. показатели имели достоверные отличия при р<0,05 от интактной группы.
Динамика показателей электролитного и кислотно-щелочного балансов показывает, что отклонения от нормальных параметров компенсировались на 8-10 сутки.
Динамика эндогенной интоксикации и перикисного окисления липидов на 3-10 сутки - олигопептиды плазмы 0,29-0,21 г/л (норма 0,22±0,03), ВНСМ усл. ед. 44-35 (норма 36,8±1,4), каталаза 290-320 мг мл/мин (норма 450±20), малоновый диальдегид нмоль/мг белка 3,8-2,51 (норма 1,55±0,25), т.о. имеются достоверные отличия при р<0,05 на 3-10 сутки.
3. Группа животных с компенсацией кровопотери раствором "Гемодез".
Установлено, на 3-10 сутки после кровопотери - гемоглобин 10,3-12,5 г/л (норма 12,7±0,5), гематокрит 40-47 % (норма 48,0 7±2,0%), эритроциты 6,1-6,0х1012/л (норма 6,5±0,2), лейкоциты 7,2-7,6х109/л (норма 7,3±0,2), продолжительность свертывания крови 46-42 сек (норма 44,7±2,0), протромбиновый индекс 9,2-16% (норма 16,5±0,5), т.о. эти показатели не имели достоверных отличий при р<0,05 на 3-10 сутки.
Биохимические показатели на 3-7 сутки - общий белок 70-69 г/л (норма 75±5), креатинин 0,08±0,10 ммоль/л (норма 0,08±0,01), глюкоза 6,8-6,4 ммоль/л (норма 7,1±0,1), АСаТ, Е/л 0,64±0,02 (норма 0,66±0,04), АЛаТ, Е/л 0,33±0,4 (норма 0,36±0,06), щелочная фосфатаза Е/л 1,55-1,65 (норма 1,21±0,33), НСТ тест усл. ед. 90-83 (норма 70±5), т.о. показатели имели достоверные отличия при р<0,05 от интактной группы.
Динамика показателей электролитного и кислотно-щелочного балансов показывает, что отклонений от нормальных параметров на 8-10 сутки не отмечено.
Динамика эндогенной интоксикации и перикисного окисления липидов на 3-10 сутки - олигопептиды плазмы 0,30-0,28 г/л (норма 0,22±0,03), ВНСМ усл.ед. 32-36 (норма 36,8±1,4), каталаза 360-410 мг мл/мин (норма 450±20), малоновый диальдегид нмоль/мг белка 3,2-2,18 (норма 1,55±0,25), т.о. имеются достоверные отличия при р<0,05 на 3 сутки.
4. Группа животных с компенсацией кровопотери раствором "Мафусол".
Установлено: на 3-10 сутки после кровопотери - гемоглобин 10,3-12,5 г/л (норма 12,7±0,5), гематокрит 40-47 % (норма 48,0±2,0), эритроциты 6,0-6,5х1012/л (норма 6,5±0,2), лейкоциты 7,2-7,6х109/л (норма 7,3±0,2), продолжительность свертывания крови 46-42 сек (норма 44,7±2,0), протромбиновый индекс 9-16% (норма 16,5±0,5), т.о. эти показатели не имели достоверных отличий при р<0,05 на 3-10 сутки.
Биохимические показатели на 3-7 сутки - общий белок 68-70 г/л (норма 75±5), креатинин 0,08±0,07 ммоль/л (норма 0,08±0,01), глюкоза 6,8-6,5 ммоль/л (норма 7,1±0,1), АСаТ, Е/л 0,64±0,02 (норма 0,66±0,04), АЛаТ, Е/л 0,31±0,4 (норма 0,36±0,06), щелочная фосфатаза Е/л 1,53-1,22 (норма 1,21±0,33), НСТ тест усл.ед. 95-80 (норма 70±5), т.о. показатели не имели достоверных отличий при р<0,05 от параметров интактной группы.
Динамика показателей электролитного и кислотно-щелочного балансов показывает, что отклонения от нормальных параметров компенсировались на 3-8 сутки.
Динамика эндогенной интоксикации и перикисного окисления липидов на 3-10 сутки - олигопептиды плазмы 0,30-0,23 г/л (норма 0,22±0,03), ВНСМ усл.ед. 30-34 (норма 36,8±1,4), каталаза 370-430 мг мл/мин (норма 450±20), малоновый диальдегид нмоль/мг белка 2,95-2,06 (норма 1,55±0,25), т.о. нет достоверных отличий при р<0,05 на 3-10 сутки.
5. Основная группа животных с компенсацией кровопотери раствором Реамберин".
При анализе динамики лабораторных параметров крови установлено, что на 3-10 сутки после применения Реамберина - гемоглобин 11-13 г/л (норма 12,7±0,5), гематокрит 43-49% (норма 48,0±2,0%), эритроциты 6,3-6,8х1012/л (норма 6,5±0,2), лейкоциты 7,1-7,4х109/л (норма 7,3±0,2), продолжительность свертывания крови 41-45 сек (норма 44,7±2,0), протромбиновый индекс 14-16 % (норма 16,5±0,5), т.о. эти показатели были в пределах нормы. В контрольных группах (физ. раствор, гемодез, мафусол) данные показатели только на 8-10 сутки восстанавливались до нормальных значений.
Биохимические показатели в основных группах (Реамберин) на 3-7 сутки - общий белок 71-76 г/л (норма 75±5), креатинин 0,08±0,05 ммоль/л (норма 0,08±0,01), глюкоза 7-7,2 ммоль/л (норма 7,1±0,1), АСаТ, Е/л 0,67±0,05 (норма 0,66±0,04), АЛаТ, Е/л 0,37±0,08 (норма 0,36±0,06), щелочная фосфатаза Е/л 1,46-1,26 (норма 1,21±0,33), НСТ тест усл. ед. 80-81 (норма 70±5), т.о. данные показатели имели незначительные отклонения от показателей группы интактных животных.
Динамика показателей электролитного и кислотно-щелочного балансов показывает, что в основных группах (Реамберин) отклонения от нормальных параметров компенсировались на 3-7 сутки, в контрольных группах на 6-10 сутки.
Динамика эндогенной интоксикации и перикисного окисления липидов на 3-8 сутки – основные группы (Реамберин) олигопептиды плазмы 0,2-0,21 г/л (норма 0,22±0,03), ВНСМ усл. ед. 28-33 (норма 36,8±1,4), каталаза 400-510 мг мл/мин (норма 450±20), малоновый диальдегид нмоль/мг белка 2,55-1,36 (норма 1,55±0,25). В контрольных группах данные параметры восстанавливались на 8-10 сутки.
Оперированные животные
1. Резекция суставных поверхностей мыщелков бедренной
и большеберцовой костей без применения инфузионной терапии.
Установлено, на 3-10 сутки - гемоглобин 8,2-10,2 г/л (норма 12,7±0,5), гематокрит 35-37% (норма 48,0±2,0%), эритроциты 4,6-5,2х1012/л (норма 6,5±0,2), лейкоциты 7,0-7,5х1012/л (норма 7,3±0,2), продолжительность свертывания крови 36-48 сек (норма 44,7±2,0), протромбиновый индекс 9-12% (норма 16,5±0,5), т.о. эти показатели отличались от показателей интактных животных.
Биохимические показатели на 3-7 сутки - общий белок 65-70 г/л (норма 75±5), креатинин 0,13±0,11 ммоль/л (норма 0,08±0,01), глюкоза 7,9-6,8 ммоль/л (норма 7,1±0,1), АСаТ, Е/л 0,72±0,05 (норма 0,66±0,04), АЛаТ, Е/л 0,47±0,41 (норма 0,36±0,06), щелочная фосфатаза Е/л 1,97-2,17 (норма 1,21±0,33), НСТ тест усл. ед. 90-91 (норма 70±5), т.о. показатели имели достоверные отличия при р<0,05 от интактной группы.
Динамика показателей электролитного и кислотно-щелочного балансов показывает, что отклонения от нормальных параметров не компенсировались на 10 сутки.
Динамика эндогенной интоксикации и перикисного окисления липидов на 3-10 сутки - олигопептиды плазмы 0,32-0,27 г/л (норма 0,22±0,03), ВНСМ усл. ед. 47-42 (норма 36,8±1,4), каталаза 300-350 мг мл/мин (норма 450±20), малоновый диальдегид нмоль/мг белка 3,45-2,20 (норма 1,55±0,25), т.о. имеются достоверные отличия при р<0,05 от параметров интактной группы животных.
2. Резекция суставных поверхностей мыщелков бедренной и большеберцовой костей с компенсацией кровопотери раствором "Реамберин".
При анализе динамики лабораторных параметров крови установлено, на 3-10 сутки - гемоглобин 10-13 г/л (норма 12,7±0,5), гематокрит 43-48 % (норма 48,0±2,0%), эритроциты 6,3-6,7х1012/л (норма 6,5±0,2), лейкоциты 7,1-7,4х1012/л (норма 7,3±0,2), продолжительность свертывания крови 40-45 сек (норма 44,7±2,0), протромбиновый индекс 14-16% (норма 16,5±0,5), т.о. эти показатели были в пределах нормы.
Биохимические показатели на 3-7 сутки - общий белок 71-75 г/л (норма 75±5), креатинин 0,08±0,02 ммоль/л (норма 0,08±0,01), глюкоза 7,0-7,2 ммоль/л (норма 7,1±0,1), АСаТ, Е/л 0,67±0,03 (норма 0,66±0,04), АЛаТ, Е/л 0,37±0,02 (норма 0,36±0,06), щелочная фосфатаза Е/л 1,46-1,22 (норма 1,21±0,33), НСТ тест усл. ед. 80-70 (норма 70±5), т.о. данные показатели имели незначительные отклонения от показателей группы интактных животных.
Динамика показателей электролитного и кислотно-щелочного балансов показывает, что отклонения от нормальных параметров компенсировались на 3-7 сутки.
Динамика эндогенной интоксикации и перикисного окисления липидов на 3-8 сутки - олигопептиды плазмы 0,2-0,21 г/л (норма 0,22±0,03), ВНСМ усл. ед. 28-33 (норма 36,8±1,4), каталаза 400-510 мг мл/мин (норма 450±20), малоновый диальдегид нмоль/мг белка 2,45-1,38 (норма 1,55±0,25), т. о. данные показатели не отличались от показателей интактной группы животных.
Достоверные отличия лабораторных параметров от интактных животных получены на 1 и 3 сутки в группах с применением Реамберина, в контрольных группах на 1, 3, 10 сутки.
Учитывая, динамику лабораторных параметров можно заключить что Реамберин обладает антигипоксическим, дезинтоксикационным и цитопротекторным свойствами.
На основании анализа проведенного экспериментального исследования можно заключить, что показанием для применения "Реамберина" являются острая кровопотеря, применение анестезиологического пособия, гипоксия, ранний послеоперационный период.
Материал и методы клинических исследований
Клиническая часть работы включает анализ результатов лечения 100 больных с дегенеративно-дистрофическими поражениями коленного сустава, которым нами выполнены корригирующие околосуставные остеотомии большеберцовых костей и эндопротезирование коленного сустава. Основная группа 40 (40%) больных, которым в раннем послеоперационном периоде применяли раствор "Реамберин". В контрольной группе 60 (60%) пациентов осуществляли традиционную инфузионную терапию. Все больные проходили обследование и лечение на отделении экспериментально-клинической хирургии РосНИИТО им. Р.Р. Вредена.
Среди пациентов основной группы было 18 (45%) мужчин и 22 (55%) женщины в возрасте от 36 до 73 лет. Преобладали больные трудоспособного возраста 25 (62,5%) человека, из них работали 22 (81,4%). Стойкая утрата трудоспособности отмечена у 13 (32,5%) больных.
Среди пациентов контрольной группы, было 26 (43,3%) мужчин и 34 (56,7%) женщины в возрасте от 36 до 74 лет. Также преобладали больные трудоспособного возраста 39 (64,9%) человек, из них у 25 (41,6%) отмечена стойкая утрата трудоспособности, старше 60 лет было 21 (35,1%) больных.
Для оценки тяжести дегенеративно-дистрофического процесса коленного сустава пользовались классификационной схемой Н.С.Косинской (1961), базирующейся на клинико-рентгенологических данных (6).
Для комплексной объективной оценки функции коленного сустава перед операцией и в послеоперационном периоде использовали 100-балльную шкалу (Josef et Kaufman, 1990), включающую в себя оценку следующих параметров: боль (50) баллов, функция (24 балла), амплитуда движений в суставе (14 баллов), деформация конечности (5 баллов), мышечная сила (3 балла), стабильность сустава (4 балла) (26).
Всем больным проводили клинический анализ крови, общий анализ мочи, биохимический анализ крови, коагулограмму крови, показатели кислотно-щелочного равновесия, электрокардиографию, обязательный осмотр анестезиолога, при необходимости консультации специалистов (терапевт, ангиохирург, уролог, гинеколог и другие).
В основной группе 40 больным произведены следующие операции:
- тотальное эндопротезирование коленного сустава шарнирным эндопротезом "Феникс" 18 больным (кровопотеря 1350±110 мл),
- тотальное реэндопротезирование коленного сустава шарнирным эндопротезом "Феникс" 4 больным (кровопотеря 2100±150 мл),
- тотальное эндопротезирование коленного сустава несвязанным эндопротезом "Biomet-AGC-V2" 11 больным (кровопотеря 750±60 мл),
- подмыщелковая остеотомия большеберцовой кости с фиксацией конструкциями из никелида титана (металл с памятью формы) 7 больным (кровопотеря 1250±120 мл).
В контрольной группе 60 больным произведены следующие операции:
- тотальное эндопротезирование коленного сустава шарнирным эндопротезом "Феникс" 34 больным (кровопотеря 1200±120 мл),
- тотальное реэндопротезирование коленного сустава шарнирным эндопротезом "Феникс" 3 больным (кровопотеря 2000±80 мл),
- тотальное эндопротезирование коленного сустава несвязанным эндопротезом "Biomet-AGC V2" 10 больным (кровопотеря 700 7± 050 мл),
- подмыщелковая остеотомия большеберцовой кости с фиксацией конструкциями из никелида титана (металл с памятью формы) 13 больным (кровопотеря 1250±120 мл).
Результаты эффективности клинической апробации
инфузионного раствора "Реамберин"
инфузионного раствора "Реамберин"
В обеих группах на первые сутки в палате интенсивной терапии проводилась инфузионная терапия в суммарном обьеме 4-6 литров, стандартными растворами в различных комбинациях.
Общую кровопотерю в период вмешательства и раннем послеоперационном периоде восполняли, в основном, донорской консервированной кровью, переливали аутологичную консервированную кровь, проводили реинфузию крови, собранной во время операции и в раннем послеоперационном периоде при помощи реинфузатора "SELL-SAVER-4" фирмы "HAEMONETICS" (США). Средний объем переливаемой крови и кровезаменителей во время операции и раннем послеоперационном периоде в основной группе составил 795±120 мл, в контрольной группе больных 860±110 мл.
Больным основной группы вводили 1,5% - 400-800 мл раствора "Реамберин" внутривенно капельно в течении 1-1,5 часов ежедневно в течении четырех-восьми дней после операции. Скорость введения и дозировку препарата определяли в соответствии с состоянием больного.
В контрольной группе для инфузионной терапии использовали: изотонический раствор хлорида натрия, глюкоза, гемодез, полиглюкин, рефортан, мафусол, дисоль, стабизол в различных комбинациях и суточной дозе от 400 до 800 мл.
Инфузионную терапию в обеих группах сочетали с приемом антикоагулянтов (гепарина, фенилин), нестероидных противовоспалительных средств (аспирин, анальгин, кетонал и т.д.), антибиотиков (гентамицин, ампиокс), препаратов улучшающих кроветворение (ферроградумет, феррумлек и т.д.), витамины групп В, Д, С, липостабил, а также препаратов, направленых на коррекцию сопутствующей соматической патологии.
Оценку эффективности лечения Реамберином определяли по следующим показателям: 1) самочувствие больного до начала и после окончания курса лечения, 2) динамика клинико-лабораторных показателей в процессе лечения.
Применение общепринятой инфузионной терапии в послеоперационном периоде приводило к устранению проявлений астеновегетативного синдрома на 5-7 сутки. Только через 8-10 дней у 80% больных улучшалось самочувствие, восстанавливался аппетит, нормализовался сон, нормализовались артериальное давление и показатели пульса, температура. У 20% пациентов эти показатели восстанавливались на 14-16 сутки.
Боли в оперированной конечности и ее отек уменьшались на 5-7 сутки, заживление послеоперационной раны первичным натяжением на 12-14 сутки отмечено у всех больных, тромбозов и тромбофлебитов вен нижней конечности не отмечано. У 4 больных с сопуствующей гипертонической болезнью отмечали повышение артериального давления до 170-185 мм рт. ст. в течении 4-5 дней, у 3х больных с ишемической болезнью сердца возникли в течении первых 2х суток боли в области сердца.
Применение Реамберина в послеоперационном периоде приводило к устранению проявлений астеновегетативного синдрома на 2-3 сутки. Через 4-5 дней инфузионной терапии у подавляющего большинства пациентов 34 (85%) улучшалось самочувствие, исчезла слабость, восстанавливался аппетит, нормализовался сон и температура, артериальное давление и показатели пульса, увеличивался суточный диурез.
Боли в оперированной конечности стихли на 4-5 день, исчезал отек оперированной конечности, применении "Реамберина" позволило начинать раннюю мобилизацию больного вставать со 2-х суток. Заживление ран первичным натяжением на 10-14 сутки отмечено у всех больных, тромбофлебитов вен нижних конечностей и тромбоэмболий не было, клинические проявления сопуствующей патологии не усугублялись.
Динамика лабораторных показателей в основной
и контрольной
группах больных
Показатели гемоглобина, эритроцитов, гематокрита, СОЭ, лейкоцитарного индекса интоксикации, лейкоцитов, протромбинового индекса в основной группе (Реамберин) приходили к дооперационным значениям на 10-14 сутки, в контрольной группе больных на 12-18 сутки.
Биохимические показатели общего белка, мочевины, креатинина, глюкозы, билирубина, АСаТ, АЛаТ, щелочной фосфатазы, электролитного состава, кислотно-основного баланса нормализовались в основной группе (Реамберин) на 8-14 сутки, в контрольной группе на 12-18 сутки.
В основной группе достоверно значимые отличия в показателях гемоглобина, СОЭ, общего белка, креатинина получены на 3-5 сутки, в контрольной группе на 8-10 сутки (см. графики 1-4).
Клиническая апробация Реамберина позволила установить, что препарат хорошо переносим, не приводит к развитию общих и местных осложнений при пролонгированном использовании.
Противопоказаний к применению Реамберина в раннем послеоперационном периоде не выявлено.
Следовательно Реамберин может быть рекомендован для широкого клинического применения для коррекции гомеостаза после ортопедических операций на крупных суставах.
Использованная литература
- Зильбер А.П. Интенсивная терапия в хирургической клинике - Петрозаводск, 1981. - 128 с.
- Каземирский А.В. Комплексная предоперационная подготовка и восстановительное лечение при реконструктивных операциях на коленном суставе: Авторефер. дисс. ... канд. мед. наук (14.00.22). С-Пб., 1999. - 20 с.
- Коваленко А.Л., Романцов М.Г. Реамберин 1,5% для инфузий: от эксперимента в клинику. Санкт-Петербург, 1999. - 112 с.
- Корнилов Н.В., Карпцов В.И., Новоселов К.А., Ермолаев Е.К. Опыт тотального эндопротезирования коленного сустава // Плановые оперативные вмешательства в травматологии и ортопедии. С-Пб., 1992. - С. 176-180.
- Корнилов Н.В., Карпцов В.И., Новоселов К.А., Каземирский А.В. Применение адаптационной подготовки пациентов для профилактики осложнений при плановых ортопедических операциях // II съезд травматологов и ортопедов республики Армения / Тезисы докладов. - Ереван, 1996. - С. 219-220.
- Косинская Н.С., Рохлин Д.Г. Рабочая классификация и общая характеристика поражений костно-суставного аппарата. - Л.: Медицина, 1961. - 169 с.
- Кустов В.М. Хирургическое лечение дегенеративно-дистрофических заболеваний и повреждений тазобедренного сустава с использованием регионарной анестезии // Автореф. дисс. ... д-ра мед. наук. - С-Пб., 1997. - 42 с.
- Литл Д. Управляемая гипотония в хирургии. М.: 1961.
- Малышев В.Д. Интенсивная терапия острых водно-электролитных нарушений. - Москва: Медицина, - С. 192.
- Москалев В.П., Корнилов Н.В., Эпштейн Г.Г., Каныкин А.Ю., Сафрай Е.А., Григорьев А.И. Оценка сопутствующих заболеваний заболеваний у больных, нуждающихся в эндопротезировании крупных суставов // Материалы III Пленума правления Ассоциации травматологов и ортопедов России. С-Пб.-Уфа, 1998. - С. 180.
- Новоселов К.А. Оперативное лечение дегенеративно-дистрофических заболеваний коленного сустава: Автореф. дисс. ... докт. мед. наук (14.00.22). - С-Пб., 1994. - 36 с.
- Новоселов К.А., Каземирский А.В., Засульский Ф.Ю., Москалев Э.В., Куляба Т.А., Хрулев В.Н., Орлов Ю.Н., Корнилов Н.Н. Оценка реконструктивных операций на коленном суставе // Повреждения и заболевания позвоночника и крупных суставов (материалы научно-практической конференции). - Минск, 1998. - С. 111-113.
- Ратников В.И., Ратникова Л.И. Фармакологическая регуляция адаптации иммунной системы к экстремальному воздействию острой гипоксии // Фармакологическая регуляция состояний дезадаптации. - М.: Б.И., 1986. - С. 74-81.
- Руденко М.И., Андрюшкин В.Н., Артемов В.Г. Использование мафусола при острой кровопотере // Военно-медицинский журнал. 1994. - N10. - С. 33-34.
- Руководство по содержанию лабораторных животных в питомниках и экспериментально-биологических клиниках (вивариях). - М., 1993. - 93 с.
- Ржанович А.П. Регуляторы водно-солевого обмена и кислотно-щелочного состояния (электролитные растворы). В кн.: Справочник по переливанию крови и кровозаменителей / Под ред. О.К. Гаврилова. М., 1982, с. 176.
- Справочник Лабораторные исследования в клинике. Под редакцией Меньшикова В.В. - М., Медицина, 1987. - 254 с.
- Справочник по функциональной диагностике. Под редакцией Каширского И.А. - М., Медицина, 1970. - 178 с.
- Стеблева Т.В. Экстенное эндопротезирование больных пожилого и старческого возраста с переломами проксимального отдела бедренной кости, его анестезиологическое, обеспечение, профилактика соматических осложнений. Дисс. ... канд. мед. наук (14.00.22., 14.00.27). - С-Пб., 2000. - 187 с.
- Deitch E. A., Bridges W., Ma L., Granger D. N. Hemorrhagic shock-induced bacterial translocation, the role of neutrophils and hydroxyl radicals. J. Trauma. 1990. N30, - C. 942-952.
- Choudhy Z.M. Studies on succinate dehydrogenating system. Interaction of the mitochondrial succinate-ubiquinone reductase with piridoxal phosphate //Biochim. Diphys. Acta, 1986. - Vol.10, N1. - P. 131-138.
- Coventry M.B. Proximal tibial varus osteotomy for osteoartritis of the laterel compatment of the knee // J. Bone Jt. Surgery. - 1987. - V. 69-A, N1. - P. 32-38.
- Domingo J.L., Mercedes Gomez, Liobet J.M. Citric, malic and succunic acids as possible alternatives to deferoxamine in aluminium toxicity //Clin. Toxicol., 1988. - Vol. 26, N1-2. - P. 67-79.
- Hardaway R.M. Microcoagulation in shock. Amer. J. Surg., 1965. - C. 298-301.
- Insall J.N. Knee arthroplasty: then, now and tomorrow // Orthopedics. - V. 18, N9. - 1995. - P. 889-892.
- Joseph J., Kaufman E.E. Preliminary results of Miller-Galante uncemented total knee arthroplasty // Int. Orthop. - 1990. - V. 13, N 5. - P. 511-516.
Иллюстрации к статье
Динамика показателей гемоглобина после острой кровопотери и компенсации инфузионными растворами.
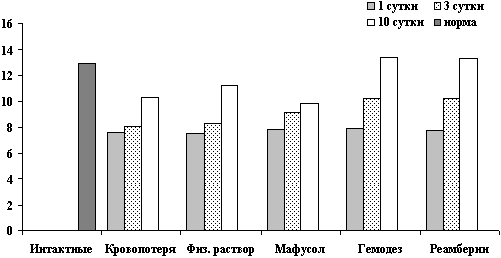
Рис. 1. Показатели гемоглобина (г/л) на 1, 3, 10 сутки.
Динамика показателей эритроцитов после острой кровопотери и компенсацией инфузионными растворами.
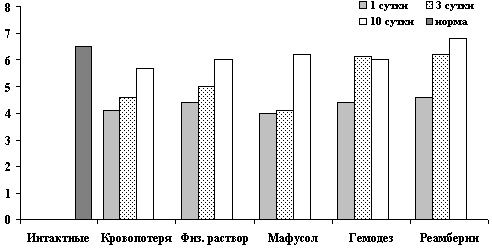
Рис. 2. Показатели эритроцитов на 1, 3, 10 сутки
Динамика показателей СОЭ после острой кровопотери и компенсацией инфузионными растворами.
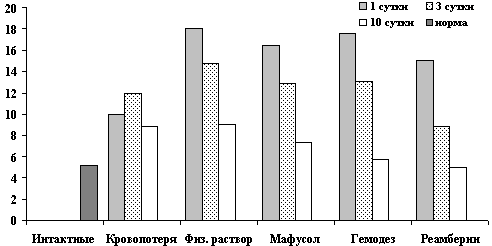
Рис. 3. Показатели СОЭ в крови на 1, 3, 10 сутки
Динамика показателей общего белка после острой кровопотери и компенсацией инфузионными растворами.
Рис. 4. Показатели общего белка в крови крысы на 1, 3, 10 сутки
Динамика показателей креатинина после острой кровопотери и компенсацией инфузионными растворами.
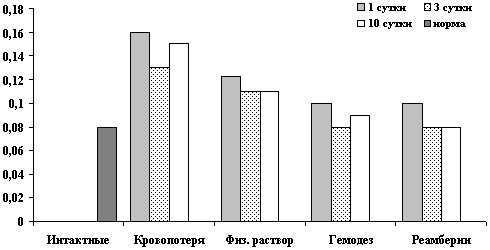
Рис. 5. Показатели креатинина ммоль/л на 1, 3, 10 сутки
Динамика показателей АСаТ после острой кровопотери и компенсацией инфузионными растворами.
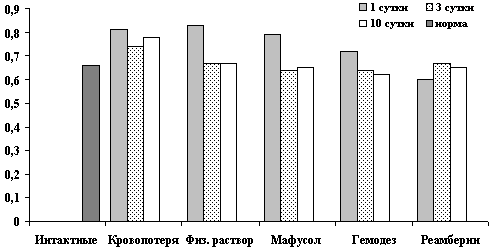
Рис. 6. Показатели АСаТ, Е/л в крови на 1, 3, 10 сутки
Динамика показателей АЛаТ после острой кровопотери и компенсацией инфузионными растворами.
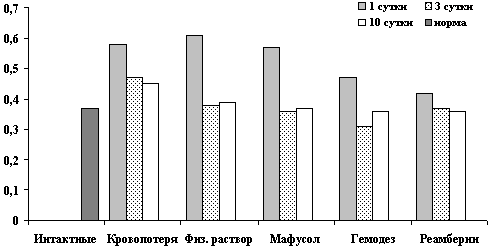
Рис. 7. Показатели АЛаТ, Е/л в крови на 1, 3, 10 сутки
Г.А. Ливанов, С.А. Куценко, С.И. Глушков,
М.Я. Малахова, Б.В. Батоцыренов, А.И. Карпищенко,
Т.М. Новикова, А.Н. Лодягин
Научно-исследовательский институт Скорой помощи
им. И.И. Джанелидзе,
Военно-медицинская академия,
Медицинская академия последипломного образования,
г. Санкт-Петербург
Роль нарушений системы антиоксидантной защиты
в формировании критических состояний
у пациентов с острыми тяжелыми отравлениями веществами с угнетающим
действием на ЦНС
и возможности их коррекции препаратом "Реамберин"
в формировании критических состояний
у пациентов с острыми тяжелыми отравлениями веществами с угнетающим действием на ЦНС
и возможности их коррекции препаратом "Реамберин"
Одним из основных повреждающих факторов, формирующих критические состояния, является нарушение баланса про- и антиоксидантных систем, получившее название "окислительного стресса". Прямые цитотоксические свойства ядов и гипоксия, сопровождающая острые отравления нейротропными ядами, создают условия для активации процессов свободнорадикального окисления и истощения систем антирадикальной и антиперекисной защиты, что в конечном итоге лежит в основе формирования эндотоксикоза и полиорганной несостоятельности и может определять исход химической травмы.
Исходя из этого, в литературе сложилось мнение о возможности использования метаболических антигипоксантов на основе сукцината в интенсивной терапии острых тяжелых отравлений нейротропными ядами [3, 7]. Снижение тяжести гипоксии и ее последствий, обусловленных нарушениями транспорта и утилизации кислорода, позволит в свою очередь препятствовать дальнейшему прогрессированию нарушений системы гомеостаза.
Настоящая работа посвящена исследованию роли тканевой гипоксии в условиях тяжелых отравлений нейротропными веществами в формировании патологических процессов, связанных с активацией свободнорадикального окисления и истощения возможностей системы антиоксидантной и антиперекисной защиты, а также возможности применения препаратов на основе янтарной кислоты в качестве компонента корригирующей терапии.
Материалы и методы
Исследование проводилось в условиях отделения реанимации и интенсивной терапии Центра лечения острых отравлений НИИ Скорой помощи в процессе лечения 66 пациентов (41 мужчина и 25 женщин), поступивших с острыми отравлениями нейротропными ядами (опиаты, гипнотические препараты, нейролептики, антидепрессанты, этанол и его суррогаты) в тяжелом и крайне тяжелом состоянии. Больные были разделены на 2 группы. I группа больных, в интенсивную терапию которых был включен реамберин (35 человек); группа II, лечение которых проводили по традиционной схеме (31 человек).
Рандомизация исследования осуществлялась путем:
- Случайного включения пациентов в I или II группы;
- В процессе исследования назначение препаратов (и соответственно включение пациентов в одну из исследуемых групп) и проведение исследований проводилось различными исследователями.
Сопоставимость групп исследования обеспечивалась:
- Исключением из групп исследований пациентов, имеющих тяжелую соматическую патологию (хронические заболевания сердечно-сосудистой и дыхательной систем, патологию ЦНС);
- Отсутствием достоверных различий между группами по возрасту (из групп исключали пациентов моложе 18 и старше 60 лет).
"Реамберин" вводили в дозе 400 мл 1,5% раствора 1 раз в сутки в течении 3 суток на фоне базисной интенсивной терапии.
Параметры кислородного баланса определяли на момент поступления в стационар; через 12 ч после начала лечения; на 2 и 3 сут госпитализации. Определение парциального давления газов крови и показателей КОС производилось на газоанализаторе Stat Profile Ultra (Nova biomedical, США). Расчетные параметры газообмена, системы транспорта кислорода и КЩР получали, используя формулы, приведенные в стандартах NCCLS и в монографиях Г.А. Рябова (1988).
Концентрацию ВГ определяли методом G.L. Ellman (1959) в модификации, заключавшейся в осаждении белка 20% раствором сульфосалициловой кислоты. Содержание СГ определяли согласно методике G.Bellomo et al. (1990). Концентрацию МДА определяли по методу M. Uchiyama (1978). Активность глутатион-пероксидазы определяли по методу А.Н. Гавриловой и Н.Ф. Хмары (1986) с использованием в качестве субстрата гидроперекиси трет-бутила, каталазы - по М.А. Королюку (1988). Расчет активности ферментов производился на грамм гемоглобина. Концентрацию гемоглобина в гемолизате определяли гемиглобинцианидным методом.
Полученные в процессе исследования результаты обрабатывались на ЭВМ типа IBM-PC c помощью программной системы STATISTICA for Windows (версия 5.5). Достоверность различий определяли непараметрическими методами (Р<0,05).
Результаты и обсуждение
На момент поступления у всех пострадавших отмечались нарушения внешнего дыхания в связи с развитием токсической энцефалопатии до комы II-III степени, что совпадает с данными, имеющимися в литературе [4]. Учитывая, что время с момента воздействия токсикантов до поступления отравленных в стационар (и вероятно продолжительность нахождения в условиях гипоксии) составило 16,6±1,8 ч в I группе и 18,3±2,8 ч во II группе, уже на момент поступления были выявлены выраженные расстройства всех звеньев транспорта кислорода [5, 6].
У всех больных отмечалось снижение потребления кислорода и коэффициента его использования (Таблица 1). На 2-е сутки после инфузии "Реамберина" наблюдалось повышение потребления кислорода и коэффициента использования отличиями от исходного состояния. В группе сравнения на 2-е сутки исследования было отмечено снижение потребления и коэффициента использования кислорода, что свидетельствовало о прогрессировании явлений гипоксии у данной категории больных. На 3-и сутки во II группе показатель потребления кислорода и коэффициент его использования продолжали оставаться низкими. В группе пролеченных "Реамберином" показатели находились без достоверных отличий от нормальных величин (Таблица 1).
При поступлении было отмечено снижение коэффициента утилизации кислорода в I группе, что свидетельствовало о несоответствии потребностей тканей в кислороде к его доставке. Имело место снижение артериовенозной разницы по кислороду. Данные изменения свидетельствовали о нарушении тканевого компонента дыхания при острых тяжелых отравлениях.
После инфузии реамберина было отмечено повышение коэффициента утилизации кислорода и рост артериовезного различия по кислороду, что свидительствовало о нормализации процессов утилизации кислорода тканями. В группе II на 2-е сутки отмечали снижение артериовенозной разницы по кислороду, что свидетельствовало о прогрессировании нарушений тканевого компонента транспорта кислорода. На 3-и сутки артериовенозная разница во II группе была достоверно ниже нормы (Таблица 1).
Таким образом, острые тяжелые отравления сопровождаются нарушениями транспорта кислорода, проявляющиеся, в конечном счете, в недостатке кислорода в тканях организма и характеризуются снижением потребления кислорода, коэффициента его использования и утилизации кислорода тканями. Антигипоксантные эффекты реамберина отразились на показателях кислородного баланса организма и проявлялись на тканевом уровне, что подтверждается ростом таких показателей как потребление кислорода, коэффициент его использования и утилизация кислорода, а также увеличение артериовенозной разницы по кислороду за счет умеренного снижения парциального напряжения в смешанной венозной крови, что свидетельствует об улучшении утилизации кислорода тканями на фоне инфузии "Реамберина".
Нарушение процессов доставки и утилизации кислорода в тканях, наряду с процессами биотрансформации ксенобиотиков системой микросомальных монооксигеназ, лежат в основе активации свободнорадикальных процессов и истощении резервов антирадикальной защиты.
Так в эритроцитах обеих групп больных на момент поступления отмечалось снижение содержания восстановленного глутатиона и повышение уровня малонового диальдегида по сравнению с показателями здоровых доноров, при отсутствии межгрупповых различий на момент поступления в стационар (Таблица 2) и (Таблица 3).
Через 12 ч после инфузии Реамберина в эритроцитах лиц I исследуемой группы отмечалось повышение концентрации восстановленного глутатиона с 0,686±0,120 до 1,140±0,131 (ммоль/г гемоглобина), в эритроцитах пациентов II группы достоверного роста содержания ВГ не отмечалось. Учитывая, что сукцинат, входящий в состав реамберина, не может утилизироваться непосредственно эритроцитами, не обладающими собственной системой митохондрий, повышение уровня ВГ в этих клетках может объясняется восстановлением кислородзависимого дыхания и накоплением НАДФ H и макроэргических соединений [11], необходимых для синтеза ВГ в тканях печени, почек, головного мозга и его дальнейшим переносом в эритроциты [12]. Что косвенно подтверждается данными, свидетельствующими о росте потребления кислорода тканями после назначения препарата. Кроме того, связывание реамберином молекул токсикантов и их метаболитов могло предотвращать расходование восстановленной формы глутатиона в процессе конъюгации. Третья причина восстановления уровня ВГ - компенсация части приходящейся на данное соединение антиоксидантной нагрузки за счет стимулированного сукцинатом синтеза низкомолекулярных антиоксидантов, в первую очередь убихинона и α -токоферола [13].
Через 12 ч концентрация МДА в эритроцитах пациентов, леченных с использованием реамберина, снижалась в 1,31 раза (р<0.05) - соответственно с 55,92±3,71 до 43,02±4,56 (нмоль/г гемоглобина). А в эритроцитах больных II группы концентрация ТБК-связывающих продуктов продолжала нарастать и достигала значений превышающих показали I группы в 1,64 раза (p<0.05) и в 4,4 раза (p<0.05) показатели здоровых доноров (Таблица 3).
Таким образом, использование реамберина в комплексной терапии поражений нейротропными ядами приводило к снижению интенсивности протекания процессов ПОЛ. Возможные причины данного положительного эффекта связаны как с восстановлением пула водорастворимых антиоксидантов (ВГ является одним из основных представителей данной группы) и жирорастворимых антиоксидантов в тканях различных органов, так и с увеличением активности ферментов антиперекисной защиты (Таблица 4).
Реамберин оказывал положительное влияние на активность ферментов антирадикальной защиты - глутатион-пероксидазы (ГП) и каталазы. На момент поступления в стационар активность ГП и каталазы в эритроцитах пациентов были ниже показателей здоровых доноров на 40,5% (p<0.05) и 29,2% (p<0.05) соответственно. Данное угнетение активности ферментов, по-видимому, связано с развитием тяжелой гипоксии тканей и усиленной наработкой активных форм кислорода (АФК), наибольшее значение среди которых имеет супероксидный радикал [15 ]. В ряде работ имеются указания, что O2- может инактивировать ГП и частично ингибировать каталазу [2, 8, 10].
Применение реамберина в комплексной терапии отравлений нейротропными ядами приводило к полному или частичному восстановлению активности ферментов антиперекисной защиты. Через 12 ч после использования препарата активность ГП в эритроцитах достоверно не отличалась от показателей здоровых доноров. Активность каталазы также повышалась на 16,1 % (p<0.05) и хотя не достигала уровня, характерного для здоровых лиц, но превышала соответствующий показатель у лиц, не получавших реамберин на 22,3 % (p<0.05).
Необходимо отметить, что реамберин включает в себя особую форму сукцината натрия, обладающую повышенной способностью к проникновению через мембранные структуры и утилизации. В настоящее время сукцинат натрия рядом исследователей относят к препаратам, обладающим антиоксидантной активностью [1, 9, 14], тем не менее, эта активность связывается только с прямым действием сукцината - антигипоксическим и антиишемическим. Действительно, реамберин стимулирует потребление кислорода и повышение восстановительного потенциала клетки. Но как видно из таблицы 4, в результате применения данного препарата идет активация и высокомолекулярного - ферментативного звена антиоксидантной системы. Причем механизмы повышения активности каталазы и глутатион-пероксидазы под воздействием производных янтарной кислоты отличаются.
Восстановление активности каталазы (представителя тиол-зависимых ферментов) объясняется участием сукцината в поддержании тиол-дисульфидного равновесия в клетке [16]. В таблице 2 представлено влияние реамберина на динамику изменений концентрации белковых тиолов в эритроцитах пациентов. Действительно, применение препарата вызывало положительную тенденцию к росту количества SH-групп.
Механизм восстановления активности ГП, по-видимому, более сложен: во-первых, за счет повышения концентрации субстрата глутатион-пероксидазной реакции - ВГ, во-вторых, за счет восстановления селено-цистеина, входящего в активный центр данного фермента.
Таким образом, выявленные изменения свидетельствуют об антиоксидантных эффектах действия препарата реамберин, заключающихся в снижении интенсивности протекания процессов перекисного окисления липидов, повышении содержания восстановленного глутатиона, восстановлении тиол-дисульфидного статуса клетки, повышении активности антиоксидантных ферментов (каталазы и глутатион-пероксидазы).
Выводы:
- Острые тяжелые отравления нейротропными ядами сопровождаются нарушениями транспорта и утилизации кислорода тканями, активацией процессов свободнорадикального окисления и снижением активности системы антирадикальной защиты.
- Использование "Реамберина" в программе интенсивной терапии у больных с острыми тяжелыми отравлениями нейротоксическими ядами способствовало уменьшению нарушений транспорта кислорода в тканевом компоненте и показателях кислородного баланса организма.
- "Реамберин" оказывает антиоксидантное действие, заключающееся в снижении интенсивности протекания процессов перекисного окисления липидов, повышение содержания восстановленного глутатиона, восстановлении тиол-дисульфидного статуса клетки, повышении активности антиоксидантных ферментов (каталазы и глутатион-пероксидазы).
Литература
- Ваизов В.Х., Плотникова Т.М., Якимова Т.В. и др. Сукцинат аммония - эффективный корректор циркуляторной гипоксии // Бюл. эксперим. биологии и медицины. - 1994. - Т. 118, N9. - С. 276-278.
- Жуков А.А., Жиронов Г.Ф. Механизм оксигеназных реакций: основные, промежуточные и побочные продукты оксигеназного цикла // Вестн. АМН СССР.- 1988. - N1. - С. 33-43.
- Ивницкий Ю.Ю. Янтарная кислота в системе метаболической коррекции функционального состояния и резистентности организма. СПб., 1998. - 82 с.
- Лужников Е.А., Костомарова Л.Г. Острые отравления. - М.: Медицина, 1989. -432 с.
- Ильяшенко К.К. Токсическое поражение дыхательной системы при острых отравлениях и его лечение: Автореф. дис. д-ра мед. наук. - М., 1997. - 40 c.
- Калмансон М.Л. Гипоксия и ее коррекция у больных с острыми отравлениями ядами нейротропного действия: Автореф. дис. д-ра мед. наук. - СПб., 2001. - 40 с.
- Кондрашова М.Н. Выясненные и наметившиеся вопросы на пути исследования регуляции физиологического состояния янтарной кислотой // Терапевтическое действие янтарной кислоты / Под ред. Кондрашовой В.Н. - Пущино, 1976. - С. 8-30.
- Кулинский В.И., Колесниченко Л.С. Структура, свойства, биологическая роль и регуляция глутатионпероксидазы // Успехи совр. биол. - 1993. - Т. 113, вып. 1. - C.107-122.
- Онуфриев М.В., Лазарева Н.А., Михалев С.Л. и др. Коррекция нарушений свободнорадикальных процессов в мозге крыс в постреанимационном периоде сукцинатом натрия // Бюл. эксперим. биологии и медицины. - 1994. - N2. - С. 214-215.
- Flohe L. Glutathione peroxidase brought into focus // Free Rad. Biol. - 1982. - Vol. 5. - P. 223-254.
- Liu H., Kehrer J.P. The reduction of glutathione disulfide produced by t-butyl hydroperoxide in respiring mitochondria // Free Radic. Biol. Med. - 1996. - Vol. 20, N3. - P. 433-442.
- Lu S.C., Kuhlenkamp J., Ge J.L., Sun W.M., Kaplowitz N. Specificity and directionality of thiol effects on sinusoidal glutathione transport in rat liver // Mol. Pharmacol. - 1994. - Vol. 46, N3. - P. 578-585.
- Noack H., Kube U., Augustin W. Relations between tocopherol depletion and coenzyme Q during lipid peroxidation in rat liver mitochondria // Free Radic. Res. - 1994. - Vol. 20, N6. - P. 375-386.
- Ray S.D., Fariss M.W. Role of cellular energy status in tocopheryl hemisuccinate cytoprotection against ethyl methanesulfonate-induced toxicity // Arch. Biochem. Biophys. - 1994. - Vol. 311, N1. - P. 180-190.
- Reilly P.M., Schiller H.J., Bulkley G.B. Pharmacologic approach to tissue injury mediated by free radicals and other reactive oxygen metabolites // Amer. Journ. Surg. - 1991. - Vol. 161, N4. - P. 488-503.
- Wang S.T., Kuo J.H., Chou R.G., Lii C.K. Vitamin E protection of cell morphology and protein thiols in rat hepatocytes treated with tert-butyl hydroperoxide // Toxicol. Lett. - 1996. - Vol. 89, N2. - P. 91-98.
Перечень сообщений, условных обозначений,
символов, единиц и терминов
АvDО2 - артериовенозная разница по кислороду
РаО2 - парциальное давление О2 в артериальной крови
РvО2 - парциальное давление О2 в смешенной венозной крови
VО2 - потребление кислорода в 1 мин (STPD)
ВГ - восстановленный глутатион
ГП – глутатион-пероксидаза
ГР - глутатион-S-трансфераза
Г-6-Ф ДГ - глюкозо-6-фосфатдегидрогеназа
ИИ - индекс интоксикеции
КИК - коэффициент использования кислорода
КУО2 коэффициент утилизации кислорода
МДА - малоновый диальдегид
ОДН - острая дыхательная недостаточность
ПОЛ - перекисное окисление липидов
СГ - сульф гидрильные группы белков
Ливанов Г.А., Батоцыренов Б.В., Глушков. С.И.,
*Белякова. В, Лодягин А.Н., Калмансон М.Л., Васильев С.А.
НИИ СП им. И.И. Джанелидзе, МАПО,
Институт токсикологии МЗ РФ, ВмедА, Санкт-Петербург,*ГНЦЭЛС,
Москва
Нарушение транспорта кислорода
при острых отравлениях нейротропными препаратами
и его метаболическая коррекция
при острых отравлениях нейротропными препаратами
и его метаболическая коррекция
Введение
Тяжесть состояния больных в токсикогенной фазе острых отравлений нейротропными ядами во многом обусловлена степенью нарушений кислородтранспортных систем и расстройствами метаболизма, то есть механизмами, определяющими, в конечном итоге, формирование необратимых нарушений [2, 3]. Следует добавить, что глубина гипоксических повреждений и связанных с ней расстройтв метаболизма зависят от экспозиции действия яда и глубины токсической энцефалопатии, сопровождающейся нарушенияем регулирующей функции ЦНС [5]. Разработка новых лекарственных препаратов для такого контингента больных, действующих на звенья нарушений транспорта кислорода представляет актуальную задачу. Появление отечественных доступных препаратов на основе янтарной кислоты в определенной мере может определить один из путей решения этой задачи [4].
Эффективными путями коррекции нарушений при тяжелых формах острых отравлений может быть проведение комплексной фармакотерапии с применением инфузионного антигипоксанта 1.5% Реамберина с добавлением ex tempore глюкозы, рибоксина, никотинамида и рибофлавина-мононуклеотида натрия.
Компоненты, входящие в состав комбинированного метаболический препарата влияют на различные звенья повреждений, в первую очередь, гипоксических. Никотинамид – витамин, входящий в структуру никотинамидадениннуклеотида (НАД), является простетической группой большого количества дегидрогеназ, играющих заметную роль в энергетическом обмене. Рибофлавин – структурный аналог простетической части флавопротеидов, содержащих в качестве коэнзима флавинмононуклеотид (ФМН) или флавинадениннуклеотид (ФАД). Помимо антигипоксантных эффектов сукцината действие препарата усиливается и наличием у сукцината антиоксидантных свойств, антитоксическим, гепатопротек-торным действием, способностью удалять избыток ацетил-СоА и тем самым снижать избыток липидов и их метаболитов. Таким образом, окисление сукцината вовлекает множество опосредованных, вторичных метаболических процессов, положительно влияющих не только на энергетический статус, но и на общий метаболизм организма [4].
Целью работы являлось исследование влияния комбинированного метаболического препарата на клиническое течение и показатели кислородотранспортных систем при острых тяжелых отравлениях нейротропными ядами.
Материалы и методы
Исследование проводилось в условиях отделения реанимации Центра лечения острых отравлений НИИ Скорой помощи им.И.И.Джанелидзе. Материалом настоящей работы послужили клинические исследования эффектов препарата на основные звенья, обусловливающие тяжесть состояния больных, то есть на гипоксию, при острых тяжелых отравлениях нейротропными ядами.
Комбинированный метаболический препарат приготовляли ex tempore, добавляя непосредственно перед инфузией на 400 мл Реамберина 50 мл 40% глюкозы, 20 мл 2% раствора рибоксина, 2 мл 5% раствора никитинамида и 2 мл 1% раствора рибофлавина мононуклеотида натрия.
Исследования проведены в процессе обследования и лечения 30 пациентов (14 мужчина и 16 женщин), поступивших с острыми отравлениями смесью нейротропных ядов (наркотики, снотворные, нейролептики, антидепрессанты, этанол и его суррогаты) в тяжелом и крайне тяжелом состоянии. Больные были разделены на 2 группы. I группа больных, в интенсивную терапию которых был включен комбинированный метаболический препарат (17 человек); II группа пациентов, лечение которых проводили по традиционной схеме (13 человек).
Рандомизация исследования осуществлялась путем:
1) случайного включения пациентов в I или IIгруппы;
2) в процессе исследования проводился двойной слепой метод -
назначение препаратов и плацебо (соответственно включение пациентов
в одну из исследуемых групп) и проведение исследований проводилось
различными исследователями.
Сопоставимость групп исследования обеспечивалась:
1) исключением из групп исследований пациентов, имеющих тяжелую
соматическую патологию (хроничес-кие заболевания сердечно-сосудистой
и дыхательной систем, патологию ЦНС);
2) Отсутствием достоверных различий между группами по возрасту (из
групп исключали пациентов моложе 18 и старше 60 лет).
Комбинированный метаболический препарат вводили 2 раза в день в течении 5 суток.
Параметры кислородного баланса определяли на момент поступления в отделение, на 2-е и 3-и сутки нахождения больных в стационаре. Определение парциального давления газов крови и показателей КОС производилось на газоанализаторе Stat Profile Ultra (Nova biomedical, США). Минутный объем дыхания определяли с помощью волюметра VEB MLW (Medinzintechnik). При проведении измерений больные вентилировались атмосферным воздухом.
Расчетные параметры газообмена, системы транспорта кислорода и КЩР получали используя формулы, приведенные в стандартах NCCLS, и в монографиях Г.А. Рябова (1988).
Полученные в процессе исследования результаты обрабатывались на ЭВМ типа IBM-PC c помощью программной системы STATISTICA for Windows (версия 5.5). Достоверность различий определяли непараметрическими методами (Р<0,05).
Результаты и их обсуждение
При поступлении тяжесть состояния больных была обусловлена глубокими токсическими пораженими головного мозга до комы II-III степени с нарушением регулирующей функции ЦНС. Всем больным проводилась ИВЛ в связи с нарушением функции внешнего дыхания. Тяжесть клинического течения острых отравлений во многом отягощалась длительностью пребывания больных в гипоксии, то есть времени с момента отравления до оказания медицинской помощи (Таблица 1).
Таблица 1. Клинические критерии эффективности
комбинированного препарата в группе больных
получавших метаболическую терапию (I) (n=17)
и в контрольной группе больных (II) (n=13) (М±m).
|
Показатель |
Больные получавшие комбинированный препарат (I) (n=17) |
Больные получавшие стандартную инфузионную терапию (II) (n=13) |
|
Возраст больных, годы |
34,65±0,64 |
31,75±2,66 |
|
Время экспозиции яда, часы |
14,94±1,23 |
17,1±2,72 |
|
Длительность выхода из комы, часы |
38,82±10,1 |
65,54±11,14** |
|
Частота развития пневмоний |
7 (41%) |
7 (63,6%) |
|
Длительность пребывания больных в ОРИТ, часы |
64,7±9,1 |
118,15±17,23** |
|
Число умерших |
1 |
6 |
Примечание - *p<0.05 между (I) и (II); **p<0.01 между (I) и (II).
В клинической картине отравлений в группе, в интенсивную терапию которых был включен комбинированный метаболический препарат, наблюдали следующие изменения: в неврологическом статусе отмечались в сокращение длительности коматозного состояния, которая у больных I группы составила 38,12±10,26 часа, тогда как в группе сравнения - 65,54±10,26 часа. Отличия также были выявлены по времени нахождения больных в отделении реанимации до перевода в общее отделение, что соответствовало стабилизации состояния до средней степени тяжести. У пациентов получавших комбинированный метаболический препарат длительность выхода из комы составила 64,7±9,16 часа, тогда как в группе сравнения - 118,15±17,23 часа. Развитие пневмоний в I группе наблюдалось у 41% (7 больных), во II группе - 63,6% (7 больных). В группе пролеченных комбинированный метаболический препаратом умер 1 больной, во II группе – 6 больных.
Таким образом, при включении комбинированного метаболического препарата в интенсивную терапию острыми тяжелыми отравлениями нейротропными ядами, отмечается уменьшение длительности коматозного состояния, снижение количества легочных осложнений и сокращение периода нахождения в критическом состоянии.
При исследовании показателей транспорта кислорода с момента поступления у всех исследуемых больных отмечались нарушения респираторного, объемного и тканевого компонентов. У всех больных наблюдалось повышение функционального мертвого пространства, вентиляционно-перфузионного отношения. Диффузионные расстройства проявлялись в повышении альвеолоартериальной разницы по кислороду, снижении отношения парциального напряжения кислорода в артериальной крови к альвеолярному напряжению кислорода и индекса оксигенации. В конечном счете, нарушения проявлялись увеличением фракции легочного шунтирования (Таблица 2), что вело к снижению кислородной емкости крови (снижение РО2 в артериальной крови до 68,5±4,3 мм рт. ст.) и доставки кислорода к тканям до 356,8±41,8 млм-1.
Длительность и глубина нарушений кислородотранспортных систем не могли не сказаться на процессы утилизации кислорода тканями, что проявлялось в снижении артериовезной разницы по кислороду, снижении коэффициента использования и коэффициента утилизации кислорода. Изменения кислородного баланса организма также свидетельствовали о наличии тяжелой гипоксии (Таблица 3).
При использовании комбинированного метаболического препарата отмечали более существенные положительные изменения в динамике показателей транспорта кислорода. В респираторном компоненте с 2-х суток проведения терапии отмечали уменьшение доли функционального мертвого пространства к дыхательному объему, нормализацию вентиляционо-перфузионного отношения, улучшение показателей, отражающих диффузионно-перфузионные нарушения легких (Таблица 2). Все вызванные изменения вели, в конечном счете, к уменьшению доли легочного шунтирования и увеличению кислородной емкости артериальной крови (в I группе PaO2 на 3-и сутки составил 79,2± 2,5 мм рт. ст. против РаО2 68,79±4,4 мм рт. ст. в группе сравнения).
Нормализация показателей респираторного компонента, на наш взгляд, связана с несколькими механизмами действия препарата. Во-первых, с улучшением метаболизма легочной ткани, где препарат выступает как энергосубстрат при существенном дефиците энергии. Во-вторых, нормализация вентиляционных и диффузионных показателей в значительной мере может быть связана с улучшением состояния поверхностно-активных веществ легких, так как эта система наиболее подвержена повреждениям при энергодефиците. В-третьих, антиоксидантные эффекты комбинированного метаболического препарата позволяют защитить легочную ткань от повреждений, связанных с активацией перекисного окисления липидов. В-четвертых, действие комбинированного метаболического препарата на снижение уровня эндотоксемии и восстановление детоксицирующих систем организма позволяет снизить метаболическую нагрузку на легкие, что проявляется дальнейшим улучшением как недыхательных, так и газообменных функций.
При исследовании показателей кислородного баланса организма при поступлении у всех больных наблюдали снижение потребления кислорода и коэффициента его использования, что свидетельствовало о глубоких гипоксических нарушениях (Таблица 3).
На 2-е сутки интенсивной терапии в I группе наблюдалось повышение потребления кислорода, коэффициента использования кислорода с отличиями от 2-х суток контрольной группы и исходного состояния. Во II группе на 2-е сутки исследования потребление кислорода и коэффициент его использования были снижены, что свидетельствовало сохраняющейся гипоксии тканей у данной категории больных. На 3-и сутки в контрольной группе показатель потребления кислорода и коэффициент его использования продолжали оставаться низкими. В I группе показатели находились в пределах нормальных величин (Таблица 3).
Из показателей тканевого компонента транспорта кислорода при поступлении было отмечено снижение коэффициента утилизации кислорода в I группе, что свидетельствовало о несоответствии потребностей тканей в кислороде и его доставки, во II группе этот показатель находился в пределах нормальных значений.
На 2-е сутки в группе с лечением комбинированным метаболическим препаратом было отмечено повышение коэффициента утилизации с отличием от 2-х суток контрольной группы. На 3-и сутки коэффициент утилизации в опытной группе находился в пределах верней границы нормы и был выше значений в контрольной группе. Улучшение тканевого компонента также регистрировалось повышением артериовенозной разницы по кислороду за счет снижения парциального напряжения кислорода в смешанной венозной крови (Таблица 3).
Таким образом, острые тяжелые отравления смесью нейротропных препаратов сопровождаются нарушениями транспорта кислорода, проявляющиеся, в конечном счете, в тканевой гипоксии и характеризуются сниженим показателей, свидетельствующих о нарушениях утилизации кислорода тканями организма, то есть потребления кислорода, коэффициента его использования и утилизации кислорода тканями. Наиболее полно антигипоксантные эффекты комбинированного метаболического препарата отразились на показателях кислородного баланса организма и проявлялись на тканевом уровне, что подтверждается ростом таких показателей как потребление кислорода, коэффициент его использования и утилизации, а также увеличением артериовенозной разницы по кислороду.
Таким образом, использование комбинированного метаболического препарата на основе 1.5% раствора Реамберина в программе интенсивной терапии острых тяжелых отравлений позволяют снизить степень нарушений кислородотранспортных систем за счет уменьшения тканевой гипоксии, нормализации утилизации кислорода в тканях уже перенесших гипоксию. Наряду с перечисленными выше механизмами лечебного действия можно считать установленным, что комбинированный метаболический препарат является при критических состояниях реальным донатором энергетического субстрата и средством восстановления энергетического статуса организма.
Выводы
- Применение комбинированный метаболический препарата, приготовленного ex tempore на основе 1.5% Реамберина у больных в критическом состоянии с острыми тяжелыми отравлениями смесью нейротропных препаратов ведет к уменьшению длительности коматозного состояния, снижению количества вторичных легочных осложнений и сроков пребывания больных в реанимационном отделении.
- Использование комбинированнного метаболического препарата в программе интенсивной терапии у больных с острыми тяжелыми отравлениями смесью нейротропнымх препаратов способствовало уменьшению проявлений нарушений транспорта кислорода в респираторном и тканевом компоненте и показателях кислородного баланса организма.
Список литературы
- Рябов Г.А. Гипоксия критических состояний. - М.: Медицина, 1988. - 288 с.
- Ильяшенко К.К. Токсическое поражение дыхательной системы при острых отравлениях и его лечение: Автореф. дис. д-ра мед. наук.- М., 1997.- 40 c.
- Калмансон М.Л. Гипоксия и ее коррекция у больных с острыми отравлениями ядами нейротропного действия: Автореф. дис.... д - ра мед. наук. - СПб., 2001. - 40 с.
- Лукьянова Л.Д. Гипоксия при патологиях. Молекулярные механизмы и принципы коррекции. //Перфторорганические соединения в биологии и медицине (сборник научных трудов). СПб, 2001. С.56-69.
- Лужников Е.А., Костомарова Л.Г. Острые отравления: Руководство для врачей. 2-е изд., перераб. и доп. - М.: Медицина, 2000. - 444 с.
Список основных обозначений и сокращений
AaDO2 – альвеолярно-артериальная разница по
кислороду
avDO2 – артериовенозная разница по
кислороду
DO2 – доставка кислорода
paO2 – парциальное давление О2 в
артериальной крови
Qsp/Qt – фракция шунтируемой крови
VA/Qt – вентиляционно-перфузионное отношение
Vd/Vt – отношение физиологического мертвого пространства к дыхательному
VO2 – потребление кислорода в 1 мин (STPD)
КИК – коэффициент использования кислорода
КОС – кислотно-основное состояние
КУО2 – коэффициент утилизации кислорода
ОДН – острая дыхательная недостаточность
ОЦК – объем циркулирующей крови
Румянцева С.А., Федин А.И., Гридчик И.Е., Евсеев В.Н.
РГМУ, ГКБ N15
Комплексная антиоксидантная терапия
Реамберином
у больных с критическими состояниями
различного
генеза
у больных с критическими состояниями
различного генеза
В основе неврологических расстройств у больных с критическими состояниями различного генеза лежат ишемические и гипоксические поражения головного мозга. На первое место ишемия выдвигается как при острых или хронических цереброваскулярных заболеваниях (инсульт, ДЭ, хроническая ишемия мозга), так практически при всех состояниях, ведущих к патологии церебрального кровоснабжения (гипоксия, травма, шок, нарушения системной гемодинамики, срывы ауторегуляции церебрального кровотока на фоне медиаторных цитокиновых повреждений). Патоморфологический каскад нейрональных расстройств прямо коррелирует со степенью снижения уровня мозгового кровотока : так, при снижении церебральной перфузии до 65 мл на 100 грамм мозговой ткани в минуту развивается первичная реакция в виде угнетения белкового синтеза, до 35 мл - имеет место активация анаэробного гликолиза, при снижении этого показателя до 20 мл формируется энергетическая недостаточность, дестабилизация мембран нейронов, выброс глутамата и аспартата, а развивающийся лактат-ацидоз способствует ферментативной глиальной гиперактивности с последующим формированием апоптоза и некроза.
Сложная динамика развития постгипоксических церебральных расстройств, вовлеченность в этот процесс широкого спектра функционально-метаболических систем объясняет сложность решения вопросов, связанных с антиоксидантной защитой организма.
При ишемических и гипоксических поражениях мозга происходят комплексные функционально-метаболические нарушения, в которых ведущую роль играет снижение уровня макроэргов - аденозинтрифосфата и креатинфосфата в организме. Изменения функций дыхательной цепи митохондрий начинается на субстратном участке, где происходит сначала усиление, а затем резкое снижение функциональной активности NADH-зависимого пути окисления, приводящее к нарушению переноса электронов на участке NADH - коэнзим Q и сопряженного с ним процесса окислительного фосфорилирования. Несмотря на нарушение активности NAD- зависимого окисления, на ранней стадии внутриклеточная концентрация макроэргов снижается незначительно, поскольку активируются альтернативные компенсаторные метаболические потоки, главным образом, сукцинатоксидазный путь окисления. При прогрессировании гипоксии блокируется терминальный цитохромный участок дыхательной цепи митохондрий. Таким образом, изменение метаболических потоков является одним из наиболее ранних признаков ишемии и гипоксии мозга. Изменения в содержании макроэргов кореллируются со значительными нарушениями параметров жизнедеятельности клеток, например, неспособности окислять энергетические субстраты даже при наличии их в среде.
В ходе ишемических расстройств отмечаются изменения и в гликолитическом пути образования АТФ. Усиление гликолиза является альтернативным окислительному фосфорилированию компенсаторным процессом. В начале происходит активация гликолиза и накопление молочной кислоты. Однако, даже когда гликолиз поставляет до 80% всей образующейся энергии, он удовлетворяет потребности обмена клеток лишь на одну треть, а если причины ишемии не устраняются, то наступает торможение гликолиза. Повреждение системы транспорта АТФ часто опережает нарушение его образования, вызывая разобщение синтеза и утилизации АТФ, объясняя возможность возникновения необратимых повреждений клеток мозга на фоне довольно высокого уровня АТФ. Наряду с угнетением синтеза АТФ при ишемии нарушается транспорт и утилизации этого макроэрга, что является ранним и тяжелым симптомом ишемии, поскольку значительная часть АТФ, синтезированного в митохондриях, утилизируется энергозависимыми системами, расположенными вне митохондрий. Энергодефицит является причиной подавления синтетических восстановительных процессов. Фактором, имеющим особое значение при ишемии и вторичной церебральной гипоксии, является "оксидантный стресс и большое число свободных радикалов. Источником генерации радикальных частиц служат либо митохондриальные ферменты, либо NADH-оксидаза наружной митохондриальной мембраны, не связанная с дыхательной цепью.
Головной мозг особенно чувствителен к гиперпродукции свободных радикалов, т. к. все факторы их инактивации находятся в крови, и в условиях ишемии не достигают нейрональных структур, в которых на фоне колоссального энергопотребления, обнаруживается наиболее высокое во всем организме содержание фосфолипидов - главного субстрата перекисного окисления, активирующегося при ишемии, а также олеиновой кислоты и железа, низкое содержание витамина А, каталазы и церулоплазмина, являющихся естественными антиоксидантами.
В силу этих причин именно окислительный стресс, ведущий к гиперпродукции свободных радикалов и деструкции мембран, в результате активации фосфолипазного гидролиза, играет в генезе ишемии мозга особенно значимую роль. Так, основным фактором, повреждающим митохондриальные, плазматические и микросомальные мембраны является высокоактивный гидроксильный радикал ОН. Повышенная продукция свободных радикалов, инициируемая при ишемии мозга арахидоновой кислотой, является одной из причин длительного спазма сосудов и срыва церебральной ауторегуляции, а также прогрессирования постишемического отека и набухания за счет дезинтеграции нейрональнойсинаптической активности и повреждения мембранных насосов.
Под воздействием оксидантного стресса резко возрастает проницаемость мембранных структур митохондрий, саркоплазматического ретикулума и лизосом за счет изменения свойств фосфолипидов мембран. Если в норме оксидантная система служит целям дезинтоксикации экзогенных и эндогенных токсинов, то в условиях прогрессирования ишемии неадекваность деятельности антиоксидантной системы ведет к нарастанию выраженности эндотоксикоза со вторичным повреждением мембран и прогрессированием постишемического отека-набухания мозга. При ишемии вследствие энергодефицита снижается активность ферментов антиоксидантной защиты: супероксиддисмутазы (СОД), осуществляющей восстановление кислорода до перекиси водорода, каталазы, обеспечивающей восстановление перекиси водорода до воды и глутатионпероксидазы (ГТП), отвечающей за нерадикальное разложение перекиси водорода и органических перекисей. Фармакологическая коррекция энергетических нейрональных нарушений, вызванных ишемией и гипоксией, должна включать либо восстановление NAD-зависимого участка, либо активацию альтернативных NAD-оксидазному пути метаболических потоков, обеспечивающих поступление электронов на терминальный цитохромный участок и поддерживающий способность к образованию энергии.
Существуют ли реальные - естественные или фармакологические, механизмы и средства предотвращения или уменьшения повреждающего влияния "оксидантного стресса"? Есть ли пути, обеспечивающие защиту мембран нейронов и глиальных элементов от повреждающего действия избытка свободных радикалов и цитокинов путем предотвращения действия прооксидантных факторов, гидролаз, органических и неорганических перекисей для сохранения целостности как отдельных мембран, так подержания объема и структур клеток в целом?
Наиболее быстрым альтернативным путем коррекции гипоксии является сукцинатоксидазное окисление. Активация сукцинатоксидазного окисления достигается через повышение активности сукцинатдегидрогеназы и улучшения проникновения экзогенного и эндогенного сукцината в митохондрии. Таким образом, наиболее эффективным путем коррекции гипоксических нарушений в организме является комплексная активация дыхательной цепи : активация альтернативного сукцинатоксидазного окисления, стимуляция NAD-зависимого окисления и подавление радикальных процессов в клетке.
В условиях гипоксии при резком снижении активности NAD-зависимых ферментов цикла Кребса, остро встает вопрос о необходимости активации альтернативных NAD метаболических потоков, и прежде всего, окисляющего янтарную кислоту сукцинатдегидрогеназного (СДГ) шунта, с целью активации антиоксидантных защитных систем.
Существующая в организме в норме физиологическая антиоксидантная система представляет собой совокупную иерархию защитных механизмов клеток, тканей, органов и систем, направленных на сохранение и поддержание в пределах нормы реакций организма, в том числе, в условиях ишемии и стресса. Она включает систему внутриклеточных антиокислительных ферментов, противодействующих окислительному стрессу и обезвреживающих активные формы кислорода. Однако, в условиях ишемии перекисное окисление липидов в фосфолипидных структурах биологических мембран плохо устраняется системой супероксиддисмутаза - каталаза. Детоксикация в этих структурах осуществляется главным образом ферментами системы глутатиона, прежде всего глутатионредуктазой, глутатионпероксидазой и глутатионтрансферазой. Наряду с антиоксидантными ферментами к числу высокомолекулярных антиоксидантов следует отнести также сывороточный альбумин, гаптоглобин, трансферрин, ферритин, связывающие высокоактивные ионы, но слабо проникающие через мембраны.
Контроль свободнорадикального окисления в головном мозге осуществляется также некоторыми нейропептидами. Так, введение АКТГ вызывает длительное снижение продуктов перекисного окисления липидов (ПОЛ) в мозгу и крови и активирует супероксидперехватывающие системы головного мозга. Основные механизмы действия антиоксидантов основаны на стимуляции естественных ферментных систем.
Известные к настоящему времени естественные и синтезированные антиоксиданты подразделяются на жирорастворимые и водорастворимые. Жирорастворимые антиоксиданты локализуются там, где расположены мишени атаки свободных радикалов и пероксидов, наиболее уязвимые для процессов перекисного окисления биологические структуры. К числу таких структур относятся прежде всего биологические мембраны и липопротеины крови, а основными мишенями в них являются ненасыщенные жирные кислоты. Среди жирорастворимых антиоксидантов наиболее известен альфа-токоферол, который взаимодействуя с гидроксильным радикалом ОН, оказывает подавляющее влияние на синглетный кислород. Среди водорастворимых антиоксидантов наиболее известным является глутатион, играющий ключевую роль в защите клеток от реакционно-способных интермедиатов кислорода. Второй по значимости среди водорастворимых антиоксидантных систем является система аскорбиновой кислоты.
Наиболее адекватным синергистом и практически повсеместным спутником аскорбиновой кислоты является система физиологически активных фенольных соединений. Количество известных фенольных соединений превышает 20000. В значительных количествах они встречаются во всех живых растительных организмах, составляя 1-2% биомассы и более и выполняя разнообразные биологические функции.
Наибольшим разнообразием химических свойств и биологической активности отличаются фенольные соединения с двумя и более гидроксильными группами в бензольном ядре в орто, пара-или рядовом положении. Эти классы фенольных соединений в физиологических условиях образуют буферную окислительно- восстановительную систему.
Антиоксидантные свойства фенолов связаны с наличием в их структуре слабых фенольных гидроксильных групп, которые легко отдают свой атом водорода при взаимодействии со свободными радикалами. В этом случае фенолы выступают в роли ловушек свободных радикалов, превращаясь сами в малоактивные феноксильные радикалы. Широко известные препараты со свойствами антиоксидантов в настоящее время применяются в клинической, в том числе в неврологической и нейрореанимационной практике. К препаратам с таким действием относится аскорбиновая кислота, церрулоплазмин, витамин Е, каротин, убихинон, эмоксипин, олифен. Все указанные препараты применяются достаточно давно, но они обладают недостаточно выраженной антиоксидантной фармакокинетикой.
В фармакологической и клинико-биохимической практике известно действие янтарной кислоты, ее солей и эфиров, представляющих собой универсальный внутриклеточный метаболит. Янтарная кислота, содержащаяся в органах и тканях, является продуктом пятой реакции и субстратом шестой цикла трикарбоновых кислот. Окисление янтарной кислоты в шестой реакции цикла Кребса осуществляется с помощью сукцинатдегидрогеназы, характерной особенностью которой является локализация на внутренней поверхности мембран митохондрий и независимость ее активности от концентрации окисленной и восстановленной формы НАД\НАДН, что позволяет сохранить энергосинтезирующую функцию митохондрий в условиях гипоксии и ишемии даже при нарушении НАД-зависимого дыхания клеток.
Выполняя каталитическую функцию по отношению к циклу Кребса, янтарная кислота снижает в крови концентрацию других интермедиатов данного цикла - лактата, пирувата и цитрата, накапливающихся в клетке наранних стадиях гипоксии. Феномен быстрого окисления янтарной кислоты сукцинатдегидрогеназой, сопровождающийся АТФ-зависимым восстановлением пула пиримидиновых динуклеитидов получил название "монополизация дыхательной цепи", биологическое значение которого заключается в быстром ресинтезе АТФ. В нервной ткани функционирует так называемый гамма-аминобутиратный шунт (цикл Робертса), в ходе которого янтарная кислота образуется из гамма-аминомасляной кислоты через промежуточную стадию янтарного альдегида. В условиях стресса и гипоксии образование янтарной кислоты возможно также в реакции окислительного дезаминирования альфа-кетоглутаровой кислоты в печени.
Антигипоксическое действие янтарной кислоты обусловлено ее влиянием на транспорт медиаторных аминокислот, а также увеличением содержания в мозге гамма-аминомасляной кислоты за счет шунта Робертса. Янтарная кислота в организме в целом нормализует содержание гистамина и серотонина и повышает микроциркуляцию в органах и тканях, прежде всего в тканях мозга, не оказывая влияния на артериальное давление и показатели работы сердца. Противоишемический эффект янтарной кислоты связан не только с активацией сукцинатдегидрогеназного окисления, но и с восстановлением активности ключевого окислительно-восстановительного фермента дыхательной митохондриальной цепи - цитохромоксидазы.
Использование препаратов - антиоксидантов - производных янтарной кислоты с целью уменьшения выраженности ишемических повреждений в лекарственной терапии острых сосудистых и диффузных постишемических поражений головного мозга до настоящего времени является недостаточно изученным, особенно в связи с появлением на фармакологическом рынке большого числа новых антиоксидантов.
Высокая активность янтарной кислоты нашла применение в растворе "Реамберин 1,5% для инфузий", в состав которого входят: активное вещество - смешанная натрий N -метилглюкаминовая соль янтарной кислоты, составляющая 1,5% раствор янтарной кислоты и микроэлементы в оптимальных концентрациях (магния хлорида 0,012%, калия хлорида 0,03% и NaCl 0,6% в инфузионной форме - 400 мл раствора во флаконе. Препарат содержит 142,4 ммоль натрия, 4,0 ммоль калия, 1,2 ммоль магния, 109,0 ммоль хлорида, 44,7 ммоль сукцината. Реамберин в виде 1,5% раствора является сбалансированным препаратом с осмолярностью, приближающейся к нормальной осмолярности плазмы крови человека, т. е. изотоническим слабощелочным в пределах нормальных значений рН крови, раствором. Препарат обладает выраженным антигипоксческим и антиоксидантным действием, оказывая положительное влияние на аэробные биохимические процессы в клетке в период ишемии и гипоксии, уменьшает продукцию свободных радикалов и восстанавливая энергетический потенциал клетки, инактивирует гиперферментативные процессы цикла Кребса и способствует утилизации жирных кислот и глюкозы клетками, нормализует кислотно-щелочной баланс и газовый состав крови.
В связи с этим препарат проявляет антиоксидантные и антирадикальные свойства, обладая широким спектром воздействия на различные механизмы регуляции метаболической активности клеток. Препарат не имеет аналогов в России и за рубежом.
Реамберин является антиоксидантом - ингибитором свободных радикалов, мембранопротектором, уменьшает активацию перикисного окисления липидов в условиях ишемии и гипоксии, повышает активность физиологической антиоксидантной системы в целом, активирует энергосинтезирующие функции митохондрий и улучшает энергетический обмен. Препарат обладает выраженным мембраностабилизирующим действием, оказывает модулирующее влияние на мембраносвязанные ферменты, ионные каналы - транспортеры нейромедиаторов, рецепторные комплексы, в том числе бензодиазепиновые, ГАМК и ацетилхолиновые, улучшает синаптическую передачу и, следовательно, взаимосвязь структур мозга, улучшает и стабилизирует мозговой метаболизм и кровоснабжение головного мозга, корригирует расстройства в регуляторной и микроциркуляторной системах, улучшает реологические свойства крови.
Таким образом, Реамберин, именно, в условиях ишемического поражения мозга обладает антигипоксическим и антиоксидантным действием. Препарат активизирует внутриклеточный синтез белка и нуклеиновых кислот, ферментативные процессы цикла Кребса, способствует утилизации глюкозы, синтезу и внутриклеточному накоплению АТФ, сниженный синтез которой в условиях ишемии и гипоксии является пусковым механизмом патоморфологических изменений в клетках мозга. Основной фармакологический эффект препарата обусловлен способностью усиливать компенсаторную активацию аэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата со стабилизацией клеточных мембран.
Критические состояния любого генеза достаточно часто ведут к формированию синдрома полиорганной недостаточности, развивающегося как проявление многокомпонентного воздействия агрессивных медиаторов и цитокинов, в том числе свободнорадикальной природы, на функциональную активность и структурную целостность всех жизнеобеспечивающих систем организма (легкие, желудочно-кишечный тракт, почки, нервная система и т. д.).
Возможности корекции полиорганной недостаточности прежде всего связаны с осуществлением эффективной программированной инфузионно-корригирующей терапии. Это положение является актуальным для больных с критическими состяниями и последующим развитием СПОН практически любой этиологии, поскольку борьба с агрессивными медиаторами критического состояния основана на поддержании эффективной органной перфузии, что становится возможным только при положительном водно-электролитном балансе. Использование электролитно-сбалансированного изотоничного раствора "Реамбрин 1,5% для инфузий" позволяет одномоментно с антиоксидантным воздействием на церебральные структуры, проводить и грамотную инфузионную коррекцию с целью стабилизации состояния больных и во избежания полипрагмазии.
В последние годы неоспоримым считается, что эндотоксикоз (ЭТ) и энцефолопатия являются наиболее яркими и информативными симптомами проявления СПОН. Снижение уровня эндогенной интоксикации и нормализация высшей нервной деятельности у больных с критическими состояниями как экстрацеребрального так и интрацеребрального генеза, носят благоприятный прогностический характер.
Выраженность постишемических и постгипоксических церебральных расстройств может определять тяжесть клинических проявлений и исходы тяжелых критических состояний внецеребрального генеза (панкреонекроз, перитонит, кровопотеря) и усугублять у больных данной группы тяжесть течения синдрома полиорганной недостаточности.
При интрацеребральных - ишемических сосудистых процессах, прежде всего при нарушениях мозгового кровообращения, синдром полиорганной недостаточности развивается вторично, в результате утраты мозгом регуляторно-трофических влияний. Он во многом обусловлен нарушенным органным метаболизмом, провоцирующим обратную симпатическую и парасимпатическую гиперафферентацию.
Оценка степени эндотоксикоза до сих пор представляет определенные трудности, несмотря на множество предложенных методов. Наиболее серьезные нарушения при ЭТ наблюдаются в показателях белкового обмена, что связано с угнетением синтеза белков и усилением их катаболизма. Важным звеном является альбумин - белок, выполняющий пластические и транспортные функции. Снижение содержания этого белка служит важнейшим прогностическим признаком степени интоксикации и выживаемости.
При тяжелом ЭТ в организме создаются условия для образования форм альбумина с измененными физико-химическими характеристиками, "перегруженного" лигандами, что препятствует обмену между тканями и сосудистым руслом, и транспорту токсинов к органам детоксикации-биотрансформации. Поэтому особый интерес вызывают методы, позволяющие судить не только о количестве, но и структуре и функциональной активности альбумина. Это стало возможным благодаря разработкам НИИ ФХМ РФ (Г.Е. Добрецов, Ю.А. Грызунов, Ю.И. Миллер) и НПО "Монокристалреактив" (Б.М. Красовицкий, г.Харьков). Был создан и внедрен в клиническую практику флуориметр АКЛ-01 и наборы реактивов "ЗОНД-Альбумин", позволяющие контролировать общую концентрацию альбумина (ОКА) в крови, эффективную концентрацию альбумина (ЭКА), его связывающую способность (РСА - резерв связывания альбумина) и рассчитывать производный показатель "индекс токсичности" (Т = ОКА/ЭКА - 1).
Использование этих показателей, наряду с общеизвестными клиническими тестами (клинический анализ крови, биллирубин, уровень трансаминаз и фосфатаз в крови, уровень молекул средней массы, уровень электролитов в плазме крови и моче, протеинограмму) позволяет оценить уровень ЭТ, а также по их изменениям оценить эффективность лечения.
Другим важным критерием уровня эндотоксемии является степень выраженности энцефолопатии. Важнейшим тестом при оценки выраженности энцефалопатии всегда являлась объективизация уровня состояния сознания и депресии электрогенеза головного моза.
В последние годы появились приборы, объективно оценивающие функциональную активность головного мозга в динамике, в том числе в режиме реального времени. Энцефалографический монитор фирмы Drager, Германия позволяет проводить длительное динамическое наблюдение всех стандарных парамтров энцефало-граммы по двум полушариям. При этом на экран монитора выводится нативная энцефалограмма по двум отведениям и одновременно производится компрес-сированный спектральный анализ энцефалограммы с выведением на экран монитора трендов спектра ЭЭГ по обоим полушариям в двух стандартных режимах (частоты и амплитуды составляющих спекрта ЭЭГ). Специально разработанное фирменное програмное обеспечение, позволяет длительно хранить и проводить анализ спектров ЭЭГ в режиме реального времени.
Динамика ЭЭГ, при визуальной оценке нативной ЭЭГ и, особенно, при количественном подсчете спектральных составляющих по амплитуде и частотам, явялется одним из наиболее аргументированных и достоверных методов оценки функциональной активности головного мозга.
Энцефалограмма, как конечная результирующая электрогенеза мозга, отражает как некоторые очаговые изменения, так и выраженность поражения мозга в целом. Как показано многочисленными исследованиями (Safar, 1976; Revers,1990; Sidi, 1990; Dick, 1992) параметры ЭЭГ и их динамика коррелирует с уровнем мозгового кровотока и определяется как его состоянием, так и газовым составом, притекающей к мозгу крови.
Таким образом, анализ ЭЭГ может служить объективным критерием состояния кислородного баланса и уровнем метаболитов мозга при различных патологических воздействиях.
Целью данной работы стало изучение клинической эффективности использования препарата "РЕАМБЕРИН 1,5% для инфузий" у больных реанимационного профиля с развитием синдрома полиорганной недостаточности как экстрацеребрального так и интрацеребрального генеза.
В группу исследования были включены больные с экстрацеребральным генезом энцефалопатии, как неврологического проявления синдрома полиорганной недостаточности, возникших у больных на фоне разлитого перитонита. Группу больных с интрацеребральным поражением составили пациенты с острыми нарушениями мозгового кровообращения ишемического и геморрагического характера, у которых также развился СПОН.
Комплексное клинико-лабораторное и интруметнальное обследование проводилось у больных с фоновым экстра и интрацеребральным поражением соответственно в 2 группах: контрольной - без применения препарата и основной - с применением препарата.
В обеих группах больным проводилась коплексная, принятая в отделении реанимции ГКБ 15 г. Москвы, инфузионно-коррегирующая терапия, направленная на лечение СПОН, развившегося в результате экстракраниального (перитонит) и интракраниального (острого нарушения мозгового кровообращения) поражения.
Обследование больных осуществляли в динамике в следующих в следующих временных интервалах:
- До начала лечения, в момент поступления больного в отделение реанимации.
- На следующий день после введения препарата.
- На 3, 5 и 8 сутки от начала лечения препаратом " РЕАМБЕРИН 1,5% для инфузий".
Эффективность лечения препаратом определялась по следующим показателям:
- клиническое состояние больного до и после лечения по параметрам неврологического и соматического статуса;
- динамика стандартных клинико-лаборатоных показателей в процессе лечения;
- динамика уровня ЭТ в процессе лечения; динамика спектра ЭЭГ в процессе лечения.
Сравнение полученных данных с аналогичными показателями у больных опытной и контрольной группы проводилось одномоментно.
Препарат "Реамберин" вводился внутривенно капельно в количестве 400 мл инфузионного раствора в сутки согласно инструкции по клиническому изучению в течении 7 дней, начиная со 2-го дня от поступления больного в отделение реанимации.
В исследование были включены две группы больных, разделенных по нозологическим факторам возникновения церебрального поражения:
- Больные с ПОН, обусловленной разлитым перитонитом 29 человек основной группы и 26 человек контрольной.
- Больные с ПОН, обусловленной органным поражением ЦНС (острым нарушением мозгового кровоообращения по ишемическому и геморагическому типу) 33 человека основной группы и 25 человек контрольной.
Средний возраст больных состовлял 52±3,1 года в первой группе и 63±4,3 года во второй группе.
Применяя синдромный подход к оценке тяжести состояниях больных, наиболее широко используемый в настоящее время в реаниматологии и интенсивной терапии, мы объединили в ходе данного исследования группы больных с различными этиологическими факторами возникновения критического состояния, оценивая у больных обоих групп сходную вараженность синдромов поражения тех или иных органных структур (поражение легких, печени, почек, и, главное - синдром энцефалопатии с расстройствами сознания и очаговой и рассеянной неврологической симптоматикой).
Клиническая оценка была основана на осмотре больного при поступлении больного в отделение реанимации, оценке уровня сознания по шкале Глазго, оценке общего состояния пациента по шкале SAPS.
В таблице 1 представлены основные причины разлитого перитонита у больных 1 группы.
Таблица 1. Причины разлитого перитонита
|
Характер основного заболевания |
Количество больных контрольной группы |
Количество больных опытной группы |
|
Гангренозный аппендицит |
10 |
10 |
|
Прободная язва |
10 |
10 |
|
Тупая травма живота |
6 |
9 |
|
Всего |
26 |
29 |
Всем больным проводились однотипные оперативные вмешательства, направленные на санацию и дренирование брюшной полости.
В таблице 2 представлены причины органных нарушений ЦНС у больных 2-ой группы.
Таблица 2. Нозологические формы и локализация поражений ЦНС
|
Характер и локализация инсульта |
Основная группа |
Контрольная группа |
|
Ишемический полушарный |
18 |
12 |
|
Ишемический стволовой |
5 |
6 |
|
Геморрагический полушарный |
7 |
6 |
|
Геморрагический стволовой |
3 |
1 |
Биохимические исследования включали в себя определение уровня калия и натрия в плазме, уровней билирубина, мочевины, креатинина, общего белка и альбумина, щелочной фосфатазы, трансаминаз, гаммаглютаматтрансфераз, сахара крови на биохимическом анализаторе Express 550, уровня МСМ по способу М.Я Малаховой (Малахова М.Я. и др., 1983, 1987, 1995 гг.), калия и натрия в эритроцитах методом пламенной фотометрии, осмолярность плазмы и мочи на осмометре производства ГДР; КОС на анализаторе Corning, уровни ОКА, ЭКА, РСА И Т определяли на отечественном приборе "ЗОНД", по методике предложенной НИИ ФХМ РАМН (Г.Е. Добрецов); ЭЭГ контроль осуществляли прикроватным электроэнцефалог-рафом фирмы Drager, Германия.
Оценивая тяжесть состояния больных по шкале SAPS было выявлено, что в обоих групах имела место сходная степень тяжесть состояния. Фоново уровень синдромной недостаточности составлял в среднем 14,2. Как видно из приведенной таблицы, все больные основных и контрольных групп, относились к тяжелым. Согласно правилам пользования системой SAPS к тяжелым относятся пациенты, набравшие более 12 баллов.
Клинические исследования показали, что на фоне применения "Реамберина" отмечено снижение уровня тяжести состояния пациентов по шкале SAPS как в группе больных с СПОН на фоне экстрацеребральной патологии, так и при интрацеребральных поражениях нервной системы.
В процессе лечения все больные, получавшие "Реамберин" в ходе терапии, были склонны к более выраженному купированию тяжелых синдромных расстройств, что выражалось в быстром уменьшении числа баллов по шкале SAPS.
Тяжесть состояния пациентов по шкале SAPS в группе больных с СПОН на фоне перитонита в динамике на фоне применения Реамберина представлена в таблице 3.
Таблица 3. Тяжесть состония больных СПОН по шкале SAPS
|
Группы больных |
Фон |
1 |
3 |
5 |
8 |
|
Больные СПОН экстрацеребрального генеза (основная) |
13,8 |
10,4 |
9,3 |
6,8 |
5,5 |
|
Больные СПОН экстрацеребрального генеза (контрольная) |
14,2 |
12,2 |
11,2 |
9,0 |
6,5 |
|
Больные с органическим поражением ЦНС (основная) |
14,8 |
12,4 |
10,3 |
7,8 |
6,7 |
|
Больные с органическим поражением ЦНС (контрольная) |
14,9 |
14,1 |
13,4 |
11,0 |
8,9 |
Это было отмечено в группах больных как с экстра так и с интрацеребральными поражениями. Полученные результаты убедительно свидетельствуют о положительном действии комплексной инфузионной терапии Реамберином даже при достаточно тяжелом течении критического состояния вне зависимости от исходного этиологического фактора его возникновения.
Анализ основных лабораторных тестов показал, что у больных обеих групп, на фоне введения препарата отмечается четкая тенденция к более быстрому купированию метаболического ацидоза, нормализации клеточного и плазменного калия, уменьшению уровней креатинина, билирубина, щелочной фосфатазы и АСТ, МСМ уже на следующий день после введения препарата. Однако статистически эти показатели, по сравнению с контрольной группой были недостоверны.
Анализ уровня токсемии по "альбуминовому тесту" выявил достоверные различия в основной и контрольной группах. В таблице 4 и таблице 5 представлены изменения "альбуминовых тестов" на фоне введения "Реамберина" у больных обоих групп.
У здоровых доноров ЭКА=ОКА, РСА =100%, Т= 0. Однако, даже в нормальных условиях это наблюдается крайне редко. Исследования О.А. Андреева с соавт., 1998 г. показали, что норма ЭКА = 29-54, ОКА=31-57, РСА= 71-98, Т=0,02-0,40.
Таким образом, из приведенных данных видно, что у всех больных в момент поступления в отделение реанимации имел место высокий уровень эндотоксемии. Применение в комплексной терапии препарата "Реамберин" позволяет быстрее, чем в контрольной группе, снизить уровень эндотоксикоза.
В таблице 5 представлены данные о динамике эндотоксикоза по данным "альбуминового" теста у больных с интрацеребральными поражениями ЦНС (с нарушениями мозгового кровобращения).
Как видно из данной таблицы в этой группе больных отмечается нарастание явлений эндотоксикоза в ходе развития заболевания, что согласуется с клиническими данными. У больных с органическими поражениями ЦНС острым периодом считается период до 3-х недель от начала заболевания, когда возможно прогрессирование симтоматики. Вместе с тем из таблицы видно, что у больных основной группы, получавших Реамберин, отмечено более медленное нарастание эндотоксикоза. Разницы в степени нарастания эндотоксемии у больных в зависимости от характера острого нарушения мозгового кровообращения не отмечалось.
Выраженность эндотоксемии зависела от исходной тяжести и локализации церебрального инсульта и была наиболее выраженной у больных с геморрагическими и ишемическими стволовыми инсультами.
Анализ летальности показал, что у больных с разлитым перитонитом не было значимых различий у больных контрольной и основной групп. У больных с заболеваниями ЦНС летальность в среднем составлет 67,3% в контрольной группе и 56,5 % в основной, т.е. на фоне комплексной терапии Реамберином имело место снижение летальности на 10,8%.
Всем больным всех указанных групп на фоне применения Реамберина проводился длительный комплексный нейромониторинг, включавший оценку динамики неврологического статуса, состояния сознания по шкале комы Глазго и оригинальной шкале авторов и длительный энцефалографический мониторинг.
Всем больным энцефалографический церебральный мониторинг проводили в динамике в следующие сроки; при поступлении в отделение реанимации, в первые сутки, на 3 сутки, на 7 сутки, у части больных исследования проведены на 10, 15, 20 и 45 сутки.
Характерными особенностями спектра ЭЭГ и нативной электроэнцефалограммы у больных с энцефалопатией на фоне СПОН при экстрацеребральном поражении при фоновом исследовании было грубое снижение амплитуды спектра (до 40 - 60% мощности) от стандартных параметров амплитуды у здоровых испытуемых. Характерным было также значительное нарастание частот в медленно - волновом диапазоне с преимущественной выраженностью дельта-волн, которые составляли от 50 до 80% общей мощности спектра. В стандартных условиях у здоровых испытуемых выраженность дельта-активности составляет не более 15% суммарной мощности спектра.
На фоне депрессии суммарной мощности спектра со сдвигом частот в медленно - волновую его составляющую, у больных с рассройствами сознания до комы 3 (3 больных) характерны были участки еще более грубой депрессии нативной ЭЭГ и ее спектра с последующим появлением нарастающих по амплитуде медленных волн. Частоты альфа-диапазона были представлены в среднем в объеме до 17 % мощности, частоты бетта - диапазона до 5% мощности. В двух случаях у больных с комой 4 отмечено появление только единичных медленных волн на фоне участков биоэлектрического молчания.
У 19% больных с разлитым перитонитом и развитием СПОН выявлялась электроэнцефалографическая картина церебрального гиперметаболизма с активацицией преимущественно медленноволновой части спектра ЭЭГ билатерально.
У больных с церебральными инсультами характерно было снижение суммарной мощности спектра ЭЭГ у 66 % больных, а также наличие межполушарной асимметрии со снижением суммарной мощности спектра в зоне соответствующем пораженному полушарию. У 34% больных характерно было наличие по фоновом исследовании явлений церебрального гиперметаболизма с активацией суммарной мощности спектра. Именно у больных с данной электроэнцефалографической картиной, выявленной при фоновом исследовании, в последующем течение острого нарушения мозгового кровообращения было наиболее тяжелым и неблагоприятным. Та же тенденция неблагоприятного течения заболевания на фоне фонового гиперметаболизма имела место и в группе больных с СПОН на фоне разлитого перитонита.
Рис. 1. Динамика спектра ЭЭГ.
- Активация альфа-диапазона спектра ЭЭГ до 24% от исходной
- Нарастание активности медленно волновой части спектра до 16% от исходной при более тяжелом течении
На рисунке 1 представлены диаграммы динамики суммарной мощности спектра ЭЭГ и частотных составляющих ЭЭГ у больных обоих групп фоново и после курса лечения Реамберином. Прослеживается активация частот альфа-диапазона спектра ЭЭГ у больных обоих групп, а также нарастание суммарной мощности спектра ЭЭГ после курса лечения Реамберином до 16% фоновой мощности при наиболее тяжелом течении заболевания.
Полученные данные мониторинга ЭЭГ у больных с энцефалопатиями различного генеза соответствуют данным литературы о характере депрессии церебрального метаболизма у больных на фоне токсического, циркуляторного и гипоксического поражения.
Получены новые данные о прямой коррелятивной связи фоновых явлений церебрального гиперметаболизма, отражающего уровень медиаторной цитокиновой церебральной агрессии в ходе СПОН экстра и интрацеребрального генеза, с особенно тяжелым и неблагоприятным течением основного заболевания.
Особенности состояния спектра ЭЭГ с постепенной депрессией его по амплитуде и увеличением представленности медленно волновой части спектра или с явлениями церебрального гиперметаболизма, практически не зависели от генеза поражения мозга, поскольку конечным пусковым механизмом повреждения всегда была гипоксия, но в большинстве случаев коррелировали с глубиной расстройств сознания.
Так, наиболее грубые нарушения амплитуды и частоты имели место у больных с расстройствами сознания до комы 2-3, у больных с фоновым уровнем сознания до глубокого сопора или сопора выраженность депрессии амплидуды была меньшей, хотя медленно-волновой сдвиг прослеживался практически во всех случаях.
В ходе клинического исследования прослежены следующие особенности состояния электроэнцефалографической активности по данным нативной ЭЭГ и при мониторировании ее спектра.
У 16 больных на фоне применения Реамберина (непосредственно в ходе внутривенного капельного введения препарата и после окончания введения препарата было отмечено нарастание амплитуды электроэнцефалограммы до 24% суммарной мощности от фоновой, за счет преимущественной активации частот дельта и тетта-диапазона. У 8 больных было отмечено нарастание суммарной мощности спектра ЭЭГ на 20% за счет активации частот альфа-диапазона. У данной группы больных нарастание мощности спектра ЭЭГ сопровождалось активацией состояния сознания до более выского уровня (практически во всех случаях от глубокого сопора до сопора или сонливости) на фоне применения Реамберина или через 2-3 часа после окончания инфузии. У больных с фоновым уровнем сознания кома 3-4 и наиболее грубой степенью депрессии энергетического метаболизма по данным спектрограмм ЭЭГ(снижение вольтажа ниже 70 - 80 % от стандартного), наличие практически только медленоволновой части спектра, наличие участков биоэлектрического молчания ) динамики спектрограмм на фоне применения Реамберина не было, активации состояния сознания не происходило, вс больные погибли в ближайший период. У 18 больных положительная динамика по данным КСА ЭЭГ и уровню состояния сознания была отмечена в отсроченный период - через 5 - 10 суток после окончания первого курса применения препарата. У остальных больных четкой коррелятивной устойчивой связи динамики нативной ЭЭГ и спектра ЭЭГ с применением Реамберина отмечено не было. Отрицательной динамики по данным КСА ЭЭГ, связанной с применением Реамберина у больных ни в одном случае отмечено не было. Отрицательной динамики на уровень расстройств сознания препарат не оказал ни в одном случае.
На рисунке 2 и 3 представлены спектрограммы ЭЭГ больного с СПОН на фоне разлитого перитонита в ходе применения терапии Реамберином. Выявляется низкий уровень фонового метаболизма с преимущественной представленностью частот медленноволновой части спектра (рис. 2) и значительным нарастанием суммарной мощности спектра, в том числе за счет частот альфа-диапазона после применния Реамберина (рис. 3). Активация суммарной мощности спектра сопровождалась активацией состояния сознания и последующим благоприятным течением заболевания.
Рис. 2.

Рис. 3.
Активация состояния сознания на фоне применения Реамберина и у больных с энцефалопатиями на фоне СПОН и в случаях интрацеребральных процессов (острые нарушения мозгового кровообращения) имела место у 18 больных, что, учитывая фоновую глубину расстройств сознания у больных данной группы может считаться хорошим показателем. У 4 больных с наиболее тяжелыми поражениями мозга было отмечено значительное увеличение сроков переживания (до 60 суток) по сравненю с больными аналогичной тяжести не получавшими терапию Реамберином.
Положительная динамика по данным спектрограмм при проведении мониторинга ЭЭГ у больных с тяжелыми энцефалопатиями, активация состояния сознания у части больных, увеличение сроков жизни у больных с тяжелейшими поражениями головного мозга, снижение летальности у больных указанных групп позволяют рекомендовать использование препарата Реамберин в клинической реанимационой и нейрореанимационной практике в качестве инфузионного нейрометаболического корректора. Препарат может быть использован в качестве энергокорректора у больных с первичными и вторичными ишемическими поражениями мозга, в том числе на фоне развития синдрома полиорганной недостаточности, при этом отмечено уменьшение выраженности эндотоксикоза и постишемических поражений как по клинико-лабораторным, так и по энцефалографическим показателям.
Комплексное использование антиоксидантов, том числе Реамберина - электролитно сбалансированного раствора янтарной кислоты в ранние сроки развития ишемических поражений мозга является одним из наиболее оптимальных методов патогенетической терапии.
Значение такой терапии возрастает по мере углубления тяжести состояния больного. Своевременное использование антиоксидантов, т. е. препаратов, нормализующих энергетику тканей и восстанавливающих баланс между прооксидантными и антиоксидантными системами, является оптимальной стратегией для восстановления жизнеспособности ишемизированных тканей, прежде всего церебральных корковых нейроглиальных комплексов, наименее резистентных к патобиохимических гостгипоксческим повреждениям, но наиболее важных для сохранения интегративной деятельности мозга, и мезодиенцефально-стволовых структур, целостность которых обеспечивает регуляторно-трофические церебральные влияния на всю соматическую сферу.
Эта терапия является особенно актуальной для сохранения структурной целостности и адекватной функциональной активности мозга при поражениях головного мозга любого генеза, возникающих в ходе критического состояния, в том числе при возникновении и развитии синдрома полиорганной недостаточности, обеспечивая и прямо направленное саногенетическое антиоксидантное действие и адекватную инфузионную коррекцию электролитно-сбалансированным раствором.
Румянцева С.А.
РГМУ, ГКБ N 15
Комплексная антиоксидантная терапия реамберином
у больных с
критическими состояниями
неврологического генеза
у больных с критическими состояниями
неврологического генеза
Ишемические и гипоксические поражения головного мозга лежат в основе неврологических расстройств у больных с критическими состояниями различного генеза. На первое место ишемия выдвигается при острых или хронических цереброваскулярных заболеваниях, но имеет место практически при всех состояниях, ведущих к патологии церебрального кровоснабжения или церебрального перфузионного давления (гипоксия, травма, шок, нарушения системной гемодинамики). Так, при снижении уровня мозгового кровотока до 65 мл на 100 мл в мин. развивается первичная реакция в виде угнетения белкового синтеза, до 35 мл в мин. имеет место активация анаэробного гликолиза, при снижении этого показателя до 20 мл на 100 г в минуту формируется энергетическая недостаточность, дестабилизация мембран нейронов и выброс нейротрансмиттера (глутамата), а развивающийся лактат-ацидоз способствует глиальной активации с последующим формированием некроза и апоптоза клеток в локальных или диффузных очагах ишемии. Сложная динамика развития постгипоксических церебральных расстройств, вовлеченность в этот процесс широкого спектра функционально-метаболических систем объясняет сложность решения вопросов, связанных с антиоксидантной защитой организма.
При ишемических и гипоксических поражениях мозга происходят комплексные функционально-метаболические нарушения, в которых ведущую роль играет снижение уровня макроэргов - аденозинтрифосфата и креатинфосфата в организме. Изменения функций дыхательной цепи митохондрий начинается на субстратном участке, где происходит сначала усиление, а затем резкое снижение функциональной активности NADH-зависимого пути окисления, приводящее к нарушению переноса электронов на участке NADH - коэнзим Q и сопряженного с ним процесса окислительного фосфорилирования. Несмотря на нарушение активности NAD - зависимого окисления, на ранней стадии внутриклеточная концентрация макроэргов снижается незначительно, поскольку активируются альтернативные компенсаторные метаболические потоки, главным образом, сукцинатоксидазный путь окисления. В более жестких условиях гипоксии блокируется терминальный цитохромный участок дыхательной цепи митохондрий. Таким образом, изменение метаболических потоков является одним из наиболее ранних признаков ишемии и гипоксии мозга. Изменения в содержании макроэргических соединений корреллируют со значительными нарушениями параметров жизнедеятельности клеток, например, неспособности окислять энергетические субстраты даже при наличии их в среде.
В процессе ишемии отмечаются изменения и в гликолитическом пути образования АТФ. Усиление гликолиза является альтернативным окислительному фосфорили-рованию компенсаторным процессом. В начале происходит активация гликолиза и накопление молочной кислоты. Однако, даже когда гликолиз поставляет до 80% всей образующейся энергии, он удовлетворяет потребности обмена клеток лишь на одну треть, если причины ишемии не устраняются, то наступает торможение гликолиза. Повреждение системы транспорта АТФ часто опережает нарушение его образования, вызывая разобщение синтеза и утилизации АТФ, объясняя возможность возникновения необратимых повреждений клеток мозга на фоне довольно высокого уровня АТФ.
Наряду с угнетением синтеза АТФ при ишемии нарушается транспорт и утилизации этого макроэрга, что является ранним и тяжелым симптомом ишемии, поскольку значительная часть АТФ, синтезированного в митохондриях, утилизируется энергозависимыми системами, расположенными вне митохондрий. Энергодефицит является причиной подавления синтетических восстановительных процессов.
Фактором, имеющим особое значение при ишемии и вторичной церебральной гипоксии, являются продукты свободнорадикальных реакций. Увеличение степени восстановления переносчиков дыхательной цепи и наличие высоких концентраций кислорода в окружающей среде создают особо благоприятные условия для их образования. Источником генерации радикальных частиц служат либо митохондриальные ферменты, либо NADH-оксидаза наружной митохондриальной мембраны, не связанная с дыхательной цепью. Под воздействием оксидантного стресса резко возрастает проницаемость мембранных структур митохондрий, саркоплазматического ретикулума и лизосом путем изменения свойств липидов. Кроме того, в норме, оксидантная система служит целям дезинтоксикации экзогенных и эндогенных токсинов, а в условиях ишемии активация антиоксидантной системы ведет к нарастанию выраженности эндотоксикоза со вторичным повреждением мембран и постишемического отека мозга. В процессе ишемии вследствие энергодефицита снижается активность ферментов антиоксидантной защиты: супероксиддисмутазы (СОД) (восстановление кислорода до перекиси водорода), каталазы (восстановление перекиси водорода до воды) и глутатионпероксидазы (нерадикальное разложение перекиси водорода и органических перекисей). Фармакологическая коррекция энергетических нейрональных нарушений, вызванных ишемией и гипоксией, должна включать либо восстановление NAD-зависимого участка, либо активацию альтернативных NAD-оксидазному пути метаболических потоков, обеспечивающих поступление электронов на терминальный цитохромный участок и поддерживающий способность к образованию энергии.
Наиболее быстрым альтернативным путем коррекции гипоксии является сукцинатоксидазное окисление. Активация сукцинатоксидазного окисления достигается через повышение активности сукцинатдегидрогеназы и улучшения проникновения экзогенного сукцината в митохондрии клетки. Таким образом, наиболее эффективным путем коррекции гипоксических нарушений в организме является комплексная активация дыхательной цепи: активация альтернативного сукцинатоксидазного окисления, стимуляция NAD-зависимого окисления и подавление радикальных процессов в клетке. В условиях гипоксии при резком снижении активности NAD-зависимых ферментов цикла Кребса, остро встает необходимость активации альтернативных NAD метаболических потоков, и прежде всего окисляющего янтарную кислоту сукцинатдегидрогеназного (СДГ) шунта.
Головной мозг весьма чувствителен к гиперпродукции свободных радикалов, к т. н. "окислительному стрессу", т. к. все факторы ему препятствующие находятся в крови и в условиях ишемии не достигают нейрональных структур, в которых на фоне колоссального энергопотребления, обнаруживается наиболее высокое во всем организме содержание фосфолипидов - главного субстрата перекисного окисления активирующегося при ишемии, олеиновой кислоты, железа, низкое содержание витамина А, отсутствие каталазы и церулоплазмина, о роли которых будет сказано ниже. В силу этих причин, именно окислительный стресс, ведущий к гиперпродукции свободных радикалов и деструкции мембран, в результате активации фосфолипазного гидролиза, играет в патогенетических влияниях ишемии мозга особенно значимую роль. Так, основным фактором, повреждающим митохондриальные, плазматические и микросомальные мембраны является высокоактивный гидроксильный радикал ОН. Повышенная продукция свободных радикалов, инициируемая арахидоновой кислотой при ишемии мозга, является одной из причин длительного спазма сосудов и срыва церебральной ауторегуляции, а также прогрессирования постишемического отека и набухания за счет дезинтеграции нейронов, и повреждения мембранных насосов.
Существуют ли реальные - естественные или фармакологические, механизмы и средства предотвращения или уменьшения повреждающего влияния оксидантного стресса? Есть ли пути, обеспечивающие защиту мембран нейронов и глиальных элементов от повреждающего действия избытка свободных радикалов и цитотоксинов путем предотвращения действия прооксидантных факторов, гидролаз, органических и неорганических перекисей для сохранения целостности как отдельных мембран, так подержания объема и структур клеток в целом?
Во-первых, необходимо сказать, что сохранение окислительно-антиоксидантного равновесия является важнейшим механизмом гомеостаза живых систем любой степени сложности. Это равновесие реализуется как в жидкостных средах организма (кровь, лимфа, межклеточная и внутриклеточная жидкость), так и в структурных элементах клетки-прежде всего в мембранных структурах (плазматических, эндоплазматических, митохондриальных, ядерных мембранах). Поддержание энергетического гомеостаза происходит при участии ряда саморегулирующих систем, поддерживающих баланс между энергозатратными и энергопродуцирующими процессами. Реализованный в клетках, в том числе и в нейронах, принцип сопряжения окисления и фосфорилирования с использованием мембран, на которых создается электрический потенциал, представляет собой преобразователь химической энергии в электрическую и осмотическую. В полном обьеме и с полной энергетической отдачей этот механизм может работать только в условиях адекватного кислородного баланса организма, т. е. при отсутствии гипоксии и ишемии.
Кислород для любой клетки, особенно для нейрона и популяций нейронов, является ведущим энергоакцептором в дыхательной митохондриальной цепи. Связываясь с атомом железа цитохромоксидазы, молекула кислорода подвергается четырехэлектронному восстановлению и превращается в воду. Но в условиях нарушения энергообразующих процессов дисбаланс энергетического метаболизма может негативно сказаться на клетке и даже привести ее к гибели. Главной причиной негативных последствий этих нарушений является образование при неполном восстановлении кислорода высокореакционных, а потому токсичных, свободных радикалов или продуктов, их генерирующих.
Относительная доступность и легкость образования свободных радикалов в условиях неполного восстановления кислорода связана с уникальными свойствами его молекул. В химических соединениях атомы кислорода двухвалентны. Простейшей иллюстрацией этого является всем извесная формула молекулы воды. Однако в молекуле кислорода оба атома соединены только одинарной связью, а остающиеся на каждом атоме кислорода по одному электрону остаются свободными.
Наличие в молекуле неспаренного электрона позволяет отнести ее к особому классу химических веществ - свободным радикалам. Именно наличие неспаренных электронов определяет возможность для кислорода эффективно связываться с цитохромоксидазой и реализовывать функцию конечного акцептора электронов, запускающего работу всей дыхательной цепи. При этом необходимо отметить, что основной устойчивой формой кислорода является так называемый "триплетный" кислород, в молекуле которого оба неспаренных электрона параллельны, но их спины (валентности) направлены в одну сторону. При разнонаправленном расположении спинов в молекуле кислорода он носит название синглетного и по своим химическим свойствам является нестабильным и токсичным для биологических субстанций.
Свободные радикалы представляют собой пеструю группу разнообразных по природе веществ, характеризующихся одним общим признаком - наличием на одном из атомов неспаренного электрона. Как правило такое состояние вещества является неустойчивым и свободные радикалы стремятся превратиться в стабильные продукты путем спаривания свободного электрона. Это достигается отрывом атома, чаще всего это атом водорода, от другого соединения и присоединением его к радикалу, либо за счет реакции рекомбинации, связанной с соединением двух радикалов в одну молекулу. Современные теории свободнорадикальнх цепных процессов учитывают влияние их на структурное состояние и функции прежде всего биологических мембран. В состав клеточных мембран входит большое количество фосфолипидов. При появлении в мембране свободного радикала вероятность его взаимодействия с жирной кислотой нарастает по мере увеличения числа кратных связей. Поскольку ненасыщенные жирные кислоты обеспечивают мембранам большую подвижность, то их изменения в результате процессов перекисного окисления липидов приводит как к увеличению вязкости мембран, так и к частичной утрате барьерных функций. В настоящее время не вызывает сомнения факт изменения функциональных свойств ряда ферментов, углеводов и белков, в том числе белков ДНК и РНК, под действием свободных радикалов, на фоне чего клеткой утрачиваются регуляторные функции, могут появляться аномальные белки, стимулироваться, помимо прямого подреждающего действия, вторичные деструктивные процессы. Однако, в процессе функционирования биологических обьектов вырабатываются вещества из групп радикалов, обладающие антиоксидантным действием, которые называют стабильными радикалами. Стабильные радикалы, появляющиеся в биологических обьектах, правильнее было бы называть условно стабильными. Такие радикалы не способны отрывать атомы водорода от большинства молекул, входящих в состав клетки. Но они могут совершать эту операцию с особыми молекулами, имеющими слабо связанные атомы водорода.
Этот класс химических соединений получил название антиоксидантов, поскольку механизм их действия основан на торможении свободнорадикальных процессов в тканях. Время жизни таких радикалов достаточно велико. В отличии от нестабильных свободных радикалов, оказывающих повреждающее действие на клетки, стабильные свободные радикалы тормозят развитие дектруктивных процессов. Существующая в организме физиологическая антиоксидантная система представляет собой совокупную иерархию защитных механизмов клеток, тканей, органов и систем, направленных на сохранение и поддержание в пределах нормы реакций организма, в том числе, в условиях ишемии и стресса. Она включает внутриклеточные антиокислительные ферментные системы, противодействующие окислительному стрессу и обезвреживающие активные формы кислорода. К антиокислительным внутриклеточным ферментам относятся: прежде всего супероксиддисмутаза, осуществляющая инактивацию супероксидного радикала и каталаза, разлагающая пероксид водорода.
Однако перекисное окисление липидов в фосфолипидных структурах биологических мембран плохо устраняется системой супероксиддисмутаза - каталаза. Детоксикация в этих структурах осуществляется главным образом ферментами системы глутатиона, прежде всего глутатионредуктазой, глутатионпероксидазой и глутатионтрансферазой. Наряду с антиоксидантными ферментами к числу высокомолекулярных антиоксидантов следует отнести также сывороточный альбумин, гаптоглобин, трансферрин, ферритин, связывающие высокоактивные ионы, но слабо проникающие через мембраны. Контроль свободнорадикального окисления в головном мозге осуществляется также некоторыми нейропептидами. Так, введение АКТГ вызывает длительное снижение продуктов перекисного окисления липидов (ПОЛ) в мозгу и крови и активирует супероксидперехватывающие системы головного мозга. Основные механизмы действия антиоксидантов основаны на стимуляции естественных ферментных систем.
Среди водорастворимых антиоксидантов наиболее известным является глутатион, играющий ключевую роль в защите клеток от реакционно-способных интермедиатов кислорода. Второй по значимости среди водорастворимых антиоксидантных систем является система аскорбиновой кислоты, играющей важную роль в антиоксидантной защите структур мозга в нормальных условиях, но резко снижающая свою антиоксидантную активность в условиях ишемии и гипоксии.
Наиболее адекватным синергистом и практически повсеместным спутником аскорбиновой кислоты является система физиологически активных фенольных соединений. Количество известных фенольных соединений превышает 20000. В значительных количествах они встречаются во всех живых растительных организмах, составляя 1-2% биомассы и более и выполняя разнообразные биологические функции.
Наибольшим разнообразием химических свойств и биологической активности отличаются фенольные соединения с двумя и более гидроксильными группами в бензольном ядре в орто, пара-или рядовом положении. Эти классы фенольных соединений в физиологических условиях образуют буферную окислительно- восстановительную систему.
Антиоксидантные свойства фенолов связаны с наличием в их структуре слабых фенольных гидроксильных групп, которые легко отдают свой атом водорода при взаимодействии со свободными радикалами. В этом случае фенолы выступают в роли ловушек свободных радикалов, превращаясь сами в малоактивные феноксильные радикалы.
Широко известные в настоящее время препараты со свойствами антиоксидантов в настоящее время применяются в клинической, в том числе в неврологической и нейрореанимационной практике. К препаратам с таким действием относится аскорбиновая кислота, церрулоплазмин, витамин Е, каротин, убихинон. Все указанные препараты применяются достаточно давно, но обладают недостаточно выраженной антиоксидантной фармакокинетикой.
В фармакологической и клинико-биохимической практике известно универсальное действие янтарной кислоты, ее солей и эфиров, представляющих собой универсальный внутриклеточный метаболит. Янтарная кислота, содержащаяся в органах и тканях, является продуктом пятой реакции и субстратом шестой цикла трикарбоновых кислот. Окисление янтарной кислоты в шестой реакции цикла Кребса осуществляется с помощью сукцинатдегидрогеназы, характерной особенностью которой является локализация на внутренней поверхности мембран митохондрий и независимость ее активности от концентрации окисленной и восстановленной формы НАД\НАДН, что позволяет сохранить энергосинтезирующую функцию митохондрий в условиях гипоксии и ишемии при нарушении НАД-зависимого дыхания клеток. Выполняя каталитическую функцию по отношению к циклу Кребса янтарная кислота снижает в крови концентрацию других интермедиатов данного цикла - лактата, пирувата и цитрата, накапливающихся в клетке наранних стадиях гипоксии. Феномен быстрого окисления янтарной кислоты сукцинатдегидрогеназой, сопровождающийся АТФ-зависимым восстановлением пула пиримидиновых динуклеитидов получил название "монополизация дыхательной цепи", биологическое значение которого заключается в быстром ресинтезе АТФ. В нервной ткани функционирует так называемый гамма-аминобутиратный шунт (цикл Робертса), в ходе которого янтарная кислота образуется из гамма-аминомасляной кислоты через промежуточную стадию янтарного альдегида. В условиях стресса и гипоксии образование янтарной кислоты возможно также в реакции окислительного дезаминирования альфа-кетаглутаровой кислоты в печени.
Антигипоксическое действие янтарной кислоты обусловлено ее влиянием на транспорт медиаторных аминокислот, а также за счет увеличения содержания в мозге гамма-аминомасляной кислоты за счет шунта Робертса. Янтарная кислота в организме в целом нормализует содержание гистамина и серотонина и повышает микроциркуляцию в органах и тканях, прежде всего в тканях мозга, не оказывая влияния н артериальное давление и показатели работы сердца. Противоишемический эффект янтарной кислоты связан не только с активацией сукцинатдегидрогеназного окисления, но и с восстановлением активности ключевого окислительно-восстановительного фермента дыхательной митохондриальной цепи - цитохромоксидазы.
Использование препаратов - антиоксидантов - производных янтарной кислоты с целью уменьшения выраженности ишемических повреждений в лекарственной терапии острых сосудистых постишемических поражений головного мозга до настоящего времени является недостаточно изученным, особенно в связи с появлением на фармакологическом рынке большого числа новых антиоксидантов, успешно апробированных в эксперименте, но пока не нашедших достаточно широкого применения в клинической практике.
При применении физиологических доз янтарной кислоты можно выделить две группы эффектов: а) прямое действие янтарной кислоты на клеточный метаболизм; б) влияние янтарной кислоты на транспорт свободного кислорода в ткани. Пополнение пула кислот цикла Кребса, нарушающееся при гипоксии, эндотоксикозах, ишемических расстройствах, является необходимым механизмом поддержания энергогомеостаза (Ленинджер А., 1966). Для пополнения пула всех органических кислот цикла Кребса оказалось достаточным экзогенное введение лишь одного сукцината (Кондрашова М.Н., 1976; 1979; 1996; Маевский Е.И., 1989; Жуков А.А., 1988; Раевский К.С., Георгиев В.П., 1986). Сукцинат является стимулятором синтеза восстановительных эквивалентов в клетке за счет феномена быстрого окисления его в цитоплазме, сопровождающегося быстрым ресинтезом АТФ, на чем и основано повышение антиоксидантной резистентности янтарной кислотой и ее производными. Кроме того, сукцинат положительно влияет на оксигенацию внутренней среды, стабилизирует структуру и функциональную активность митохондрий, является индуктором синтеза некоторых белков, влияет на ионный обмен в клетке (Кондрашева М.Н., 1976). Преимущества сукцината в скорости окисления перед другими субстратами клеточного дыхания наиболее выражено в условиях гипоксии, когда НАД-зависимый транспорт электронов в дыхательной цепи тормозится, а активность сукцинатдегидрогеназы и продукции эндогенного сукцината возрастает (Кондрашова Н.М., 1976, 1979, 1996; Гуляева Н.В., 1986). Исследования последних лет показали наличие у янтарной кислоты биологической активности с уникальным сочетанием проявлений: по отношению к здоровому организму сукцинаты выступают в роли адаптагенов и актопротекторов, а при наличии патологических проявлений проявляют нетипично высокий для адаптагенов терапевтический эффект. Перспективно лечебное применение сукцинатов при заболеваниях сердечно-сосудистой, дыхательной, эндокринной систем, при желудочно-секреторной недостаточности и поражениях печени различной этиологии, онкологических, психических заболеваниях, в качестве стимуляторов посттравматической регенерации; янтарная кислота используется в медицине для профилактики состояния пониженной иммунологической реактивности и для повышения адаптогенной устойчивости к стрессовым влияниям (Зозуля Ю.А., Барабой В.А., Сутковой Д.А., 2000; Исаков В.А., 2001; Романцов М.Г., 2000). При этом амплитуда и направленность модификаций под действием янтарной кислоты зависят от функционального исходного состояния тканей, а ее конечный результат выражается в оптимизации параметров их функционирования. Такие свойства позволяют отнести сукцинаты и, прежде всего фенольные производные янтарной кислоты, к лечебно-профилактическим препаратам нового поколения - к так называемым "умным лекарствам" (Кондрашева М.Н., 1976, 1979, 1996; Сергеев П.В., 1991; Скулачев В.П., 1989; Раевский К.С., 1986; Иваницкий Ю.Ю., 1996; Кулинский В.И., 1990; Лужников Е.А., 1994; Зозуля Ю.А., 2000). Учитывая уникальную разносторонность проявлений биологической активности янтарной кислоты, сфера ее применения в медицинской практике является пока еще чрезмерно узкой. Поэтому направление но созданию препаратов на основе янтарной кислоты и расширение сферы применения уже известных препаратов, является весьма перспективным.
Янтарная кислота, содержащаяся в органах и тканях, является продуктом пятой и субстратом шестой реакции цикла трикарбоновых кислот (Ленинджер А., 1966). Окисление янтарной кислоты в шестой реакции цикла Кребса осуществляется с помощью специфического фермента - сукцинатдегидрогеназы, характерной особенностью которой является локализация на внутренней мембране митохондрий и независимость её активности от концентраций окисленной и восстановленной форм НАД/НАДФ, что позволяет сохранить энергосинтезируюшую функцию митохондрий в условиях гипоксии при нарушении НАД-зависимого дыхания клеток; выполняя каталитическую функцию по отношению к циклу Кребса (Браун А.Д., 1977; Браунштейн А.Е., 1987), янтарная кислота снижает концентрацию в крови других интермедиатов цикла - лактата, пирувата и цитрата (Бариляк И.Р., 1980; Ленинджер А., 1966; Березов Т.Г., 1983; Маевский Е.И., Гришина Е.В., 1989; Раевский К.С., 1986).
Янтарная кислота в организме нормализует содержание гистамина и серотонина в крови и повышает микро циркуляцию в органах и тканях, не оказывая, влияния на артериальное давление и показатели работы сердца. Экзогенное поступление в организм янтарной кислоты, как показано экспериментальным путем, нормализует активность сукцинатдегндрогеназы, ограничивает зону некроза в миокарде, при этом усиливается биоэлектрическая активность сердца, улучшается геодинамика и увеличивается толерантность сердца к физическим нагрузкам (Исаков В.А., Коваленко А.Л., 2001; Батоцыренов Б.В., 1998; Жуков А.А., 1988; Ивницкий Ю.Ю., 1998; Кондрашова М.Н., 1979). Противоишемический эффект янтарной кислоты связан не только с активацией сукцинатдегидрогеназного окисления, но и с восстановлением активности ключевого окислительно - восстановительного фермента дыхательной цепи митохондрий клеток -цитохромоксидазы (Кондрашева М.Н., 1976, 1979, 1996; Гуляева Н.В., 1986; Самарченко Л.А., 1989; Меерсон Ф.З., 1984)
В условиях экспериментального шока, вызванного 10-минутной остановкой сердца, янтарная кислота снижала уровень свободно радикальных процессов в мозге и сыворотке крови, ослабляла деструкцию мембранных элементов нейронов и способствовала полному восстановлению функций и структуры мозга (Кондрашова М.Н., 1979; Ивницкий Ю.Ю., 1998; Гусев Е.И., Скворцова В.И., 2001). В постреанимационном периоде янтарная кислота способствовала нормализации функций центральной нервной системы, снижала чувствительность животных к стрессу, накопление свободно-радикальных продуктов и восстанавливала морфологические изменения в крови и головном мозге (Биленко М.В., 1989; Гуляева Н.В., 1986; Ивницкий Ю.Ю., 1996).
Янтарная кислота, проявляя антиоксидантные свойства (Кондрашева М.Н., 1996), ингибирует, индуцируемые ионами железа в условиях ишемии и гипоксии, процессы перекисного окисления липидов (Гусев Е.И., Скворцова В.И., 2001). В присутствии янтарной кислоты отмечается повышение усвояемости железа за счет образования хорошо растворимых в воде комплексов, которые быстро всасываются в тонком кишечнике, не разрушаясь и не образовывая не усваиваемых гидратов трехвалентной окиси железа (Ерюхин И.А., 1995; Кулинский В.И., 1990; Гуляева Н.В., 1986; Клименко В.Н., 1993).
Таким образом, янтарная кислота, являясь фармакологически высоко активным соединением, может быть использована для получения лекарственных препаратов с улучшенными фармакологическими свойствами истинных антиоксидантов, тем более, что зарегистрированных лекарственных форм, содержащих ее в качестве основного компонента, немного (Машковский 2000).
Использование современных нейропротекторов на основе фенольных производных янтарной кислоты в различных модификациях, обладающих многокомпонентным антигипоксическим, антиоксидантным, и вазо и реопротекторным и дезинтоксикационным действием становится целесообразным в условиях развития тканевых постгипоксических и эндотоксических церебральных расстройств, как это имеет место у больных синдромом полиорганной недостаточности, который может рассматриваться как универсальная модель комплексного (сосудистого макро и микроциркуляторного ишемическо-гипоксического поражения головного мозга в результате массивного цитокинового каскада с вторичным вовлечение в патологический процесс корковых, лимбико-ретикулярных, мезодиенцефальных и стволовых церебральных структур и развитием различных неврологических синдромов, таких как синдромы энцефалопатии, острого нарушения мозгового кровообращения, энцефалополинейропатии, миелоишемии, надсегментарной вегетативной дисфункции. В клинической неврологической, реанимации нейрореанимационной практике в последние годы описаны (Зильбер А.П., 1998; Румянцева С.А., 2001) как синдромы поражения структур центральной и периферической нервной системы при СПОН, так и различные степени тяжести сочетанных неврологических расстройств, оцениваемые по количественным шкалам неврологического дефицита.
Высокая активность янтарной кислоты нашла применение в дезинтоксикационном растворе "Реамберин 1,5% для инфузий", в состав которого входят: активное вещество - смешанная натрий N-метилглюкаминовая соль янтарной кислоты, составляющая 1,5% раствор янтарной кислоты и микроэлементы в оптимальных концентрациях (магния хлорида 0,012%, калия хлорида 0,03% и NaCl 0,6% в инфузионной форме 400 мл раствора во флаконе)
В комплексе терапии больных синдромом полиорганной недостаточности 1,5% раствор реамберина использовали в суточной дозе 400 - 800 мл раствора со скоростью 20-30 капель в минуту в течение 5-7 суток. Данная доза была клинически эффективной. В таблице 48 представлены данные динамики неврологического статуса и состояния сознания у больных СПОН на фоне применения реамберина. Препарат реамберин включали в комплекс интенсивной терапии больных СПОН со 2-3 суток диагностики данного синдрома вне зависимости от уровня депрессии сознания, в том числе на фоне проведения нейровегетатавной блокады. При анализе данных динамики неврологического статуса было отмечено положительное влияние комплексной интенсивной терапии с включением реамберина на такие показатели неврологического статуса как состояние сознания, расстройства мышечного тонуса, частоту возникновения и клинические проявления вторичного стволового синдрома, а также на частоту и характер развития вегетативно-трофических расстройств. Наиболее значимой была динамика состояния сознания у больных с синдромом энцефалопатии и энцефалополинейропатии при фоновой депрессии сознания до уровня комы 1, комы 1-2. При более глубоких расстройствах сознания динамика клинической симптоматики была незначительной. Наиболее эффективным было применение реамберина у больных СПОН, развившемся на фоне критических состояний, связанных с гипоксическими факторами (клиническая смерть, наркозные осложнения, циркуляторные гиповолемические расстройства со вторичной гипоксией). У двух больных при введении препарата в дозе 800 мл в сутки непосредственно после клинической смерти (в период первых 5 минут после успешных реанимационных мероприятий) была отмечена значительная положительная динамика в виде активации состояния сознания от комы 4 до сопора, быстрое восстановление самостоятельного дыхания, быстрая стабилизация параметров системного гомеостаза, уменьшение выраженности расстройств мышечного тонуса и значительное уменьшение выраженности вегетативно-трофических нарушений, имевших место у больных со сходной фоновой тяжестью состояния после клинической смерти.
На рисунке 1 представлены спектрограммы ЭЭГ больного А., 40 лет сразу после успешных реанимационных мероприятий после клинической смерти (у больного имел место СПОН в результате массивного желудочно-кишечного кровотечения из язвы желудка, был оперирован, язва ушита, на фоне циркуляторной анемии у больного через 2 суток после операции развилась клиническая картина полиорганной дисфункции с острой дыхательной недостаточностью и клинической смертью). На рисунке 2 представлены спекрограммы того же больного через 40 минут после введения 800 мл реамберина. Прослеживается значительное нарастание суммарной мощности спектра ЭЭГ преимущественно за счет частот альфа и дельта- диапазонов. На рисунке 3 спектрограмма больного А. через 3 суток на фоне продолжения терапии реамберином, при хорошей клинической динамике состояния больного: депрессия сознания до уровня сонливости, незначительное диффузное снижение тонуса, отсутствие патологических стопных знаков и признаков вторичного стволового синдрома, самостоятельное дыхание, суммарная оценка по шкале полиорганной дисфункции - 4 балла, суммарная оценка по шкале неврологического статуса 35 баллов. Прослеживается дальнейшее нарастание мощности спектра ЭЭГ за счет нарастания частот альфа и бета-диапазона.
Рис. 1.
Рис. 2.
Рис. 3.
Количественная оценка тяжести неврологических расстройств при СПОН на фоне применения реамберина у больных при различных степенях тяжести неврологических расстройств представлена в таблице 1.
Помимо положительного влияния на отдельные параметры неврологического статуса у больных на фоне применения реамберина было отмечено снижение летальности на 7 % при 1 степени тяжести неврологических расстройств, на 6% - при 2 степени тяжести, на 3 % при 3 степени тяжести, и на 2 % при 4 степени тяжести неврологических расстройств. Постепенное снижение влияния массивных доз антиоксидантной терапии реамберином на уровень летальности больных СПОН при увеличении степени тяжести неврологических расстройств может быть, как и при использовании других видов нейропротективной терапии, связано с крайне тяжелыми степенями поражения церебральных структур.
В таблице 2 представлена количественная оценка тяжести неврологических расстройств при СПОН на фоне стандартной терапии у больных при различных степенях тяжести неврологических расстройств.
При включении реамберина в комплексную терапию положительное влияние препарата, отмечавшееся по данным динамики неврологического статуса и снижения летальности подтверждалось при проведении электроэнцефа-лографического мониторинга нативных электроэнцефалограмм и спектрального анализа ЭЭГ.
В таблице 3 представлены данные динамики суммарной мощности и частотного распределения спектрально-энергетических характеристик ЭЭГ у больных на фоне применения реамберина. При этом у 30% больных СПОН при применении реамберина отмечалось нарастание суммарной мощности спектров ЭЭГ в среднем на 20-25% от фоновой мощности спектров непосредственно после инфузии препарата при его использовании у больных с различными уровнями фоновой суммарной мощности спектров ЭЭГ в том числе со средним и высоким; на 2-3 сутки от начала применения у больных СПОН при его использовании у больных с исходно низким и средним уровнем суммарной мощности спектра ЭЭГ эта тенденция сохранялась. При повторных введениях препарата суммарная мощность спектра ЭЭГ увеличивалась в среднем на 25-30% от фоновой и сохранялась весь период применения препарата (в среднем 5-10 суток) и после окончания его инфузий, что совпадало с улучшением клинической симптоматики, прежде всего с активацией состояния сознания у больных СПОН, а также с уменьшением выраженности вегетативных расстройств и системных расстройств гомеостаза. На фоне фонового церебрального гиперметаболизма и очень высоких фоновых уровней спектральной мощности ЭЭГ (выше 80 мвк2) положительная динамика состояния спектральной активности ЭЭГ, проявлявшаяся в снижении выраженности представленности медленно-волнового диапазона спектра ЭЭГ и нарастании мощности частот альфа-диапазона отмечалась у 10% больных. У данной группы больных нарастание мощности спектра ЭЭГ сопровождалось активацией состояния сознания до более высокого уровня (практически во всех случаях от глубокого сопора до сопора или сонливости) на фоне применения реамберина или через 2-3 часа после окончания инфузии. У остальных пациентов динамики состояния функциональной активности мозга на фоне применения реамберина не отмечалось.
На рисунках представлены графики динамики суммарной мощности ЭЭГ и частотно-энергетического распределения в дельта и альфа-диапазонах до и после применения реамберина при различной степени тяжести СПОН.
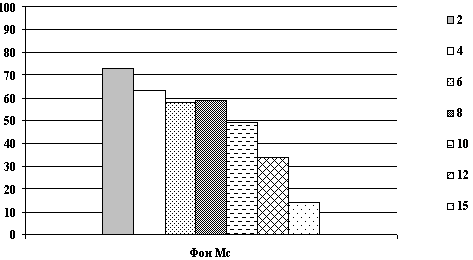
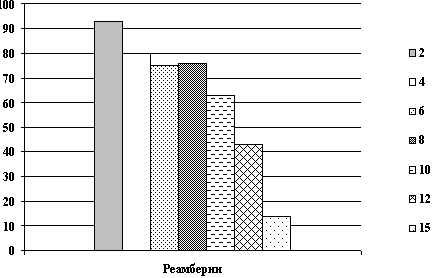
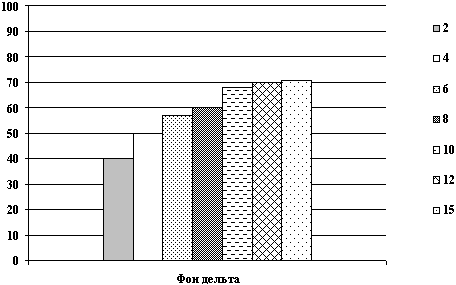
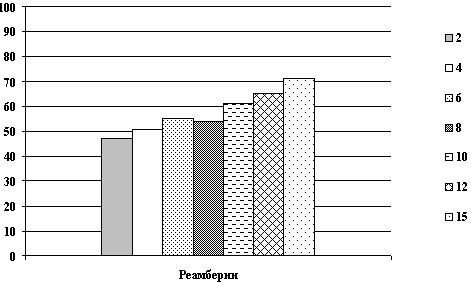
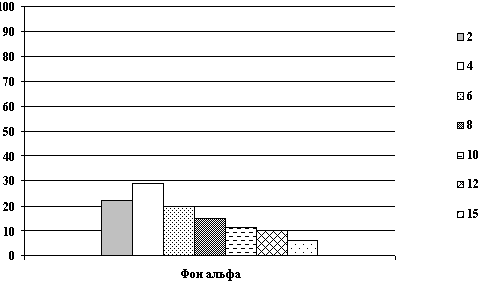
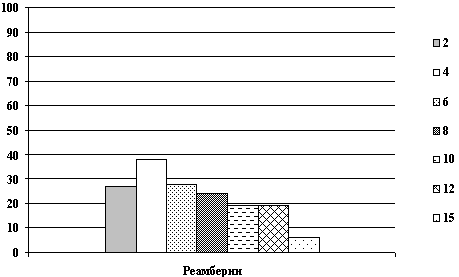
Все энцефалографические исследования проводились в динамике до, после введения препарата (через 30 минут после окончания инфузии), на 2, 5, 7 и 10 сутки после применения препарата. В ходе клинического применения препарата реамберин было выявлено несомненное положительное его влияние на течение неврологических расстройств у больных СПОН. Оно проявлялось прежде всего в активации состояния сознания у 65% больных с синдромом энцефалопатии, у 2-х больных с нарушением мозгового кровообращения и у 28% больных с явлениями энцефаломиелополинейропатии. У 8% больных положительная динамика по данным КСА ЭЭГ и уровню состояния сознания была отмечена в отсроченный период - через 5 - 10 суток после окончания первого курса применения препарата. Активация состояния сознания у больных с энцефалопатией является несомненным положительным прогностическим признаком и свидетельствует о стимуляции нейротрофических процессов в ретикулярной формации ствола головного мозга и в корковых структурах.
Отсутствие динамики состояния сознания в группе больных с крайне выраженным уровнем угнетения сознания имело место у больных с 4 степенью тяжести неврологических расстройств на фоне грубых морфологических изменений в мозге, подтвержденных впоследствии при патологоанатомических исследованиях, и свидетельствовало о невозможности вообще какого-либо нейропротективного фармакологического воздействия на структуры мозга вследствие запредельного угнетения рецепторной синаптической активности. Активизация состояния сознания у больных на фоне лечения реамберином корреллировала с активацией функциональной активности головного мозга по данным мониторинга ЭЭГ. Отмеченное нарастание представленности частот быстро волновой части спектра ЭЭГ по сравнению с медленно волновой, что несомненно является благоприятным электрофизиологическим признаком и свидетельствует о нормализации рецепторной активности коры и подкорково-стволовых образований.
Включение реамберина в комплексную терапию постгипоксических расстройств у больных, перенесших критическое состояние, несомненно способствует повышению резистентности к гипоксии и снижению выраженности клинических проявлений синдрома полиорганной недостаточности, и, в частности, энцефалопатии.
Комплексное использование антиоксидантов, в том числе реамберина, в ранние сроки развития ишемических, гипоксических и токсических поражений мозга является одним из наиболее оптимальных методов патогенетической терапии, значение такой терапии возрастает по мере углубления тяжести состояния больного.
Преимущества реамберина перед антиоксидантами и нейропротекторами других групп заключается как в высокой антиоксидантной активности данного препарата, так и в одномоментном проведении сбалансированной инфузионной терапии, учитывая готовую инфузионную форму данного препарата. Помимо этого данный препарат, как показывают данные электроэнцефалографического мониторинга, может быть использован в ранние сроки критических состояний, в том числе, одномоментно с проведением нейровегетативной блокады, поскольку стабилизирует функциональное состояние головного мозга при фоново низких, средних и даже при фоново высоких уровнях церебрального метаболизма, что свидетельствует о благоприятном влиянии антиоксиданта реамберина на структурно-морфологическое и, следовательно, функциональное состояние ритикуло-стволовых и корковых церебральных структур.
Своевременное использование антиоксидантов, т. е. препаратов, нормализующих энергетику тканей и восстанавливающих баланс между прооксиднтными и антиоксидантными системами, является оптимальной стратегией для восстановления жизнеспособности ишемизированных тканей, что является особенно актуальным для сохранения структурной целостности и адекватной функциональной активности мозга при сосудистых поражениях.
Литература
- Алабовский В.В., Хамбуров В.В., Винокуров А. Ослабление реперфузионного повреждения с помощью системы Na/Ca - обмена. Нейрохимия, 1996, т. 13, N4, с. 320-327.
- Александрова А.Е., Болдина И.Г., Болдышева А.В. и др. Эффективность совместного применения антигипоксантов и антиоксидантов при туберкулезе. Проблемы туберкулеза, 1988, N6, с. 62-65.
- Андросов K.A., Варфоломеев H.А., Воробьев Р.Л. и др. Эффективность антигипоксантов и антиоксидантов при воздействии низкочастотного акустического шума. Антигипоксанты и актопротекторы. Итоги и перспективы. -СПб., 1994, с. 11.
- Антипенко А.Е., Красовская И.Е., Диже Г.П. и др. Взаимное влияние фосфорилирования, окисления и протеолиза на транспорт кальция в саркоплазматическом ретикулуме сердца и сосудов; //Докл. АН, 1992, т. 326, N5, с. 920-923.
- Антоненкова Е.В. Сравнительная фармакологическая характеристика антигипоксантов олифена и амтизола как средств патогенетической терапии туберкулеза. Автореф. дис. канд. мед. наук. -СПб 1996, 20 с.
- Биленко М.В. Ишемические и реперфузионные поражения органов (Молекулярные механизмы, пути предупреждения и лечения).-М.: Медицина, 1989.- 386 с.
- Воронина Т.А. с соавт. Механизм действия и обоснование применения препарата мексидол в неврологии. Материалы научно-практической конференции по неврологии. М., 2000. - 14 с.
- Гуляева Н.В. Перспективы создания лекарственных препаратов на основе карнозина. Биохимия. 1992. т. 57, N9. стр. 1398 -1403.
- Гусев Е.И. с соавт. Механизмы повреждения ткани мозга на фоне острой фокальной ишемии мозга. Журнал невропатологии и психиатрии им. С.С. Корсакова.-1999.-т. 99, N2. с. 65 -70.
- Дюмаев К.М. с соавт. Антиоксиданты в профилактике и терапии патологии ЦНС.-М.: Издание института биомед. химии РАМН, 1995. 272 с.
- Береговая Е.Д. Фармаклогия и токсикология.-1990. т. 53.5, с. 34-37.
- Березов Т.Т. Биологическая химия. М. Медицина, 1983.-с. 597.
- Бариляк И.Р. Действие сукцината натрия на развитие крыс. М., 1980. Рукопись депонирована в ВИНИТИ.
- Башкатова В.Г., Раевская К. С. Оксид азота в механизмах повреждения мозга, обусловленных нейротоксическим действием глутамата// Биохимия, 1998, т. 63, вып. 7, с. 1020-1028.
- Белоусова В.В., Дудченко А. М., Лукьянова Л. Д. Роль гликолиза в подержании энергетических функций гепатоцитов. //Бюлл. эксп. биол. и мед., 1995, т. 119, N1, с. 28-32.
- Биленко М.В. Ишемическое и реперфузионное повреждение органов: молекулярные механизмы, пути предупреждения и лечения. -М.: Медицина, 1989. –367 с.
- Болдина И.Г., Миловский В. Г. Перспективы использования антигипоксантов при коррекции нарушения энергооброзования при эндогенной интоксикации. // Антигипоксанты и антиоксиданты. Итоги и перспективы.- СПб., 1994, с. 19.
- Бровкович В.М. Влияние тотальной ишемии на Са-транспортирующую активность саркоплазматического ретикулума миокарда крыс//Укр. биохим. журн., 1990, т. 62, N4, с. 72-76.
- Брюно Б., Сандау К., фон Кнетен А. Апоптотическая гибель клеток и окись азота: механизмы активации и антагонистические сигнальные пути. Биохимия, 1998, т. 63, вып. 7, с. 966-975.
- Бурлакова Е.Б., Храпова Н.Г. Перекисное окисление липидов мембан и природные антиоксиданты. Успехи химии, 1985, т. 54, N9, с. 1540-1558.
- Бурлакова Е.Б. Биоантиоксиданы: новые идеи и повторение пройденного //Биоантиоксидант. Междунар. симп. в рамках между нар. выставки "Медицина и охрана здоровья" (Тюмень, 16-19 сентября 1997 г.): Изд-во Тюменьского гос. Университета, 1997, с. 3-4.
- Ванин А.Ф. Окись азота в биологии: история, состояние и перспективы исследования//Биохимия, 1998, т. 63, вып. 7, с. 867-869.
- Владимиров Ю.А. Арчаков А.К. Перикисное окисление липидов в биологических мембранах. -М.;Наука, 1972, 252с.
- Волин М.С., Дэ видео н К. А., Камински П. М.и др. Механизм передачи сигнала оксидант - оксид азота в сосудистой ткани//Биохимия, 1998, т. 63, вып. 7, с. 958-965.
- Волков Н.И., Хоронюк С.Л. Применение антиоксиданов полифенольного ряда для коррекции тканевой гипоксиии при мышечной деятельности .Антигипоксанты и актопротекторы. Итоги и перспективы,- СПб., 1994, с. 180.
- Гайнуллин Р.3., Медвинский А.Б., Кожура А.Ф. и др. Электрофизиологическое исследование антиаритмического действия антиоксиданта ионола . Бюлл. эксп. биол. и мед.1991. т, 112, N8, с. 167-169.
- Гацура В.В., Смирнов Л.Д. Кардиотропные свойства некоторых синтетических антиоксидантов // Хим.-фарм. жури., 1992, т. 26, N11-12, с. 10-15.
- Глубокий Ю.И., Курский М.Д., Задорина О.В. и др.Транспорт кальция в эндоплазматическом ретикулуме печени крыс при активации перекисного окисления липидов //Биохимия, 1995, т. 55, вып. 1. с. 12-21.
- Гуляев а Н.В., Ерин А.Н. Роль свободонорадикальных процессов в развитии нейродегенеративных заболеваний// Нейрохимия, 1995, т. 12, вып. 2, с. 3-10.
- Гусаков И.В., Голубев А.Г., Опарина Т.И. и др. Исследование эффекта антигипоксантов на различных моделях эпилепсии // Антигипоксанты и актопротекторы. Итоги и перспективы. -СПб., 1994, с. 34.
- Душкин М.И. Биологическая роль окисленных производных холестерина в клетках млекопитающих //Успехи сов. биол., 1991, т. 111, вып. 6, с. 845-857.
- Ерин А.Н., Гуляева Н.В., Никушкин Е.В. Свободонорадикальные механизмы в церебральных патологиях// Бюлл. совр. биол. и мед., 1994, т. 118, N10, с. 343-348.
- Зенков Н.К., Меньшикова Е.Б. Окислительная модификация липопротеинов низкой плотности.Успехи совр. биол., 1996, т. 116, вып. 6, с. 729-738.
- Исаков В.А., Туркин В.В., Киселев О.И. и др. Использование антиоксидантов в терапии гриппа.- СПб.: НИИ гриппа. 1996,49 с.
- Киселев О.И., Шаронов Б.П.. Смородинцева О.М. Развитие гриппозной инфекции и токсичность молекулярного кислорода. Клиника, патогенез и лечении гриппа и других ОРЗ. -Л., 1989, с. 63-75.
- Крылов Ю.Ф. Любимов А.Б., Мулер А.Г. Перспективы использования эйкозапентаеновой и докозагексаеновой кислот как лекарственных средств// Хим.-фарм. жури., 1991, т. 25, N9, с. 4-10.
- Кузтина Е.Н., Глушенко Н.Н. Влияние железа, цинка, меди на процесс перекисного окисления липидов печени in vivo //Биохимия, 1996, т. 61, вып. 6, с. 993-997.
- Кулинский В.И., Колесниченко Л.С. Биологическая роль глутатиона//Успехи совр. биол., 1990, т. 110, вып. 1, с. 20-32.
- Лукьянова Л.Д. Биоэнергетическая гипоксия: понятие, механизмы и способы коррекции. Бюлл. эксп. биол. и мед., 1997, т. 124, N9, с. 244-254.
- Машковский М.Д. Лекарственные средства. В двух томах, т. 2. Изд. 13-е, новое.-Харьков: Торсинг, 1997, с. 88-89.
- Меньшикова Е.Б., Зенков Н.К. Антиоксиданты и ингибиторы радикальных окислительных процессов. Успехи совр. биол., 1991, т. 113, вып. 4, с. 442-455.
- Меньшикова Е.В., 3енков Н.К. Окислительный стресс при воспалении. Успехи совр. биол., 1997, т. 117, вып. 2, с. 155-171.
- Меньшикова Е.В., Зенков Н.К., Сафина А.Ф. Механизмы развития окислительного стресса при ишемическом и реперфузионном повреждении миокарда /Успехи совр. биол, 1997, т. 117, вып. 3, с. 362-373.
- Мусил Я. Основы биохимии патологических процессов. - М.: Медицина, 1985, 432 с.
- Пауков В.С., Проценко Д.Д. Рекомбинационные преобразования митохондрий в поврежденных кардиомиоцитах. Бюлл. эксп. биол. имед, 1998, т. 125, N3, с. 244-250.
- Полинг Л. Витамин С и здоровье. - М.: Наука, 1975,80 с.
- Рубин А.Б., Шинкарев В.П. Транспорт электронов в биологических системах. -М.: Наука, 1984. с. 6-21.
- Сазонтова Т.Г., Белкина Л.М., Сянцунь Фу и др. Са-транспортирующая система и повреждение мембран саркоплазматического ретикулума левого желудочка сердца крысы при ишемии и реперфузии//Бюлл. эксп. биол. и мед., 1994, т. 121, N2, с. 1335.
- Северина И.С. Растворимая гуанилатциклаза в молекулярном механизме физиологических эффектов оксидов азота. Биохимия, 1998, т. 63, вып. 7, с. 939-947.
- Селищева А.А., Козлов Ю.П. Метаболизм фосфолипидов и биологические мембраны. -Иркутск: Изд-во Иркутского университета, 1988, 88 с.
- Скоричев В., Конь И.Я. Биологическая роль жирорастворимых витаминов. Итоги науки и техники. Сер. физиологи) человека и животных. /АН. ВИНИТИ. -М.: 1989,т. 37,225 с.
- Скулачев В.П. Нефосфорилирующее дыхание как механизм предотвращения образования активных форм кислорода. Молекуляр. биол., 1995, т. 29, вып. 6, с. 1199-1209.
- Скулачев В.П. Соотношение окисления и фосфолированн в дыхательной цепи. - М.: Изд-во АН СССР, 1962, 156 с.
- Скулачев В.П. Старение организма - основная биологическая функция, а не результат поломки сложной живой системы. Химическо обоснование гипотезы Вейсмана//Биохимия, 1997, т. 62, вып. 11, с. 1994-1999.
- Скулачев В.П. Трансформация энергии в биомембранах. -М.: Наука, 1972, 197 с.
- Скулачев В.П. Энергетика биологических мембран. -М.: Наука. 1989, 564 с.
- Тейлор Б.С., Алерсон Л.Х., Биллиар Т.Р. Индуцибельная синтаза окиси азота в печени: регуляция и функции//Биохимия, 1998, т. 63, вып. 7, с. 905-923.
- Тимошин А.А., Лакомкин В.А., Рууге Э.К. Свободно-радикальные центры в тканях изолированного сердца крысы в норме, при ишемии и реперфузии//Биофизика, 1993, т. 38, вып. 1, с. 179-185.
- Третьякова Л.3. Окислительная модификация цитохрома Р-450 при его работе. 1. Сравнительные исследования инактивации цитохрома Р-450 L M2 в различных системах. Биохимия, т. 56, вып. 7, с. 1190-1199.
- Труфанов В.А., Кичатикова С.В., Шатилов В.Р. и др. Ферменты тиол-дисульфидного обмена белков. Прикл. биохимия и микробиол., 1990, т. 26, вып. 1, с. 3-10.
- Тулупов А.Н. Патогенез и коррекция гемореологических нарушений у больных сепсисом. Автореф. дис. докт. мед. наук. -СПб.: ВМедА.,1991, 46 с.
- Федоров Б.М. Стресс и система кровообращения. - М.: Медицина, 1991, с. 5-31.
- Фананашвили Я.А., Демидов А.А. Корректирующее влияние эмоксина и олифена на развитие артериальной гипертензии и церебральных нарушений у спонтанно гипертензивных крыс. Биоантиоксидант. Междунар. симп. в рамках междунар. выставки "Медицина и охрана здоровья" (Тюмень, 16-19 сент. 1997г. ): Изд-во Тюменского гос. Университета, 1997, с. 78.
- Xеифман Л. Смертность и бессмертие на клеточном уровне. Биохимия, 1997, т. 62, вып. 11, с. 1380-1393.
- Чудакова В.В.,3ахарова В.И.,Алексеев С.М.и др. Образование комплекса между α-токоферолом и гидроперикисями жирных кислот в гомогенных растворителях. Докл. АН, 1992, т. 322, N4, с. 773-775.
- Шутенко Ж. В. Поиск антидиабетических и кардио-протекторных средств среди ингибиторов р-окисления. Хим.-фарм. журн., 1991, т. 25, N7, с. 4-11.
- Реамберин в терапии критических состояний. Руководство для врачей. СПб.2001, 157 стр.
- Эмануэль Н.М. Окисление углеводородов в жидкой фазе. -М.: Изд-во Акад. наук, 1959, 334 с.
- Яльченко Н.А. Клиническая характеристика отдельных компонентов системы антиоксиданов в процессе комплексной терапии больных раком желудка. Эксп. онкология, 1996, т. 18, N 1, с. 59-63.
- Appleman M.M., Araino M. A., Takemoto D.J., Whitsоn R. H. Cyclic Nucleotide Phosphodiesterases //Cyclic Nucleotides/Eds. J.A. Nathanson, J. W. Kabalian.-Berlin: Springer-Verlag, 1982, vol.1, p. 261-300.
- Вisbу R.H. Interactions of vitamin E with free radicals and membranes//Free Rad. Res. Comms.. 1990, vol. 8, N4-6, p. 299-306.
- Jaite M., Emilio deJ., InmacaladaS. Oxigen - induced mitochrondrial damage and aging//Free radicals and aging. /Eds. J. Emerit, B. Chance. - Basel: Birkhauser, 1992, p. 47-57.
- Lenaz G., De Santis A., A survey of the Function and specificity ofUbiquinone in the Mitochrondrial respiratory chain//Cocnzyme Q / Ed. G. Lenaz.- Chichester Wiles, 1985, p. 165-199.
- Mitchell P. Possible molecular mechanisms of the protonmetive function of cytocrome systems//J. Theor. BioL, 1976, vol. 62, p. 327-367.
- Mitсhеll P. Coupling of phosphorylation to electron and hydrogen transfer by a chemiosmotic type of mechanism//Nature, 1961, vol. 191, p. 144-148.
- Ozawa T. Formation of oxygen radicals in the electron transfer chain and antioxydant properties ofcoenzyme Q//Coenzyme Q. /Ed. G. Lenaz.-ChichesterWiles.. 1985, p. 441-457.
- Riсhtеr С. Do mitohondrial DNA fragment promote cancer and aging 7//FEBS Lett., 1988, vol. 241, p. 1-5.
- Floyd R. Role of oxygen free radicals in brain ishemia FASEB.-1990. 4, N 9., p 2587-2597.
- Fragata М .Model of singlet oxygen scavenging by α-tocoferol in biomembrans. Chem. and Phis. Lipids. 1990. 27. n. 2. p. 93-99.
- Nakachima M. Involvement of free radicals in cerebral vascular reperfushion injury evaluated in a trancient focal cerebral ishemia model of rats Free. Radic. Biol. Med. -1999.-26 N 5-6, p 722-729.
Ливанов Г.А., Батоцыренов Б.В.,
Белякова Н.В, Глушков С.И., Лодягин А.Н.,
Калмансон М.Л., Васильев С.А.
НИИ СП им. И.И. Джанелидзе, МАПО, Институт токсикологии МЗ РФ,
ВмедА, Санкт-Петербург, ГНЦЭЛС, Москва
Комбинированный метаболический
антигипоксант
в интенсивной терапии
тяжелых отравлений
нейротропными ядами
в интенсивной терапии тяжелых отравлений
нейротропными ядами
Введение
Тяжесть состояния больных, находящихся в критическом состоянии обусловлена расстройствами метаболизма в связи с дефицитом кислорода, эндотоксикозом и глобальным иммунологическим конфликтом в организме, то есть механизмами, определяющими, в конечном итоге, формирование необратимых нарушений [1]. Это же положение справедливо для больных реанимационного профиля с острыми тяжелыми отравлениями, следует добавить, что к вышеперечесленным нарушениям здесь присоединяются специфические механизмы действия токсического вещества - развитие тяжелой токсической энцефалопатии, сопровождающейся нарушенияем регулирующей функции ЦНС [4]. Разработка новых лекарственных препаратов для такого контингента больных, действующих универсально на различные звенья патологического процесса представляет актуальную задачу. Появление отечественных доступных препаратов на основе янтарной кислоты в определенной мере может определить один из путей решения этой задачи [3].
Эффективными путями коррекции нарушений при тяжелых формах острых отравлений может быть проведение комплексной фармакотерапии с применением комбинированного препарата на основе 1.5% Реамберина для инфузий с добавлением ex tempore глюкозы, рибоксина, никотинамида и рибофлавина.
Компоненты, входящие в состав комплексоного метаболического препарата влияют на различные звенья повреждений, в первую очередь, гипоксических. Никотинамид - витамин, входящий в структуру никотинамидадениннуклеотида (НАД), является простетической группой большого количества дегидрогеназ, играющих заметную роль в энергетическом обмене. Рибофлавин - структурный аналог простетической части флавопротеидов, содержащих в качестве коэнзима флавинмононуклеотид (ФМН) или флавинадениннуклеотид (ФАД). Помимо антигипоксантных эффектов сукцината действие препарата усиливается и наличием у сукцината антиоксидантных свойств, антитоксическим, гепатопротекторным действием, способностью удалять избыток ацетил-СоА и тем самым снижать избыток липидов и их метаболитов. Таким образом, окисление сукцината вовлекает множество опосредованных, вторичных метаболических процессов, положительно влияющих не только на энергетический статус, но и на общий метаболизм организма [3].
Целью работы явилось исследование влияния комплнксной метаболической терапии на клиническое течение, показатели кислородотранспортных систем и эндотоксикоза при острых тяжелых отравлениях нейротропными ядами.
Материалы и методы
Исследование проводилось в условиях отделения реанимации Центра лечения острых отравлений НИИ Скорой помощи им.И.И.Джанелидзе. Материалом настоящей работы послужили клинические исследования эффектов препарата на основные звенья, обусловливающие тяжесть состояния больных, то есть на гипоксию и эндотоксикоз при наиболее тяжелых формах острых тяжелых отравлений нейротропными ядами.
Исследования проведены в процессе обследования и лечения 30 пациентов (14 мужчина и 16 женщин), поступивших с острыми отравлениями смесью нейротропных ядов (наркотики, снотворные, нейролептики, антидепрессанты, этанол и его суррогаты) в тяжелом и крайне тяжелом состоянии. Больные были разделены на 2 группы. I группа больных, в интенсивную терапию которых был включен комплексный метаболический препарат (17 пациентов); II группа, лечение которых проводили по традиционной схеме (13 пациентов).
Комбинированный метаболический препарат приготовляли ex tempore, добавляя непосредственно перед инфузией в раствор 400 мл Реамберина 50 мл 40% глюкозы, 20 мл 2% раствора рибоксина, 2 мл 5% раствора никитинамида и 2 мл 1% раствора рибофлавина мононуклеотида натрия.
Рандомизация исследования осуществлялась путем: Случайного включения пациентов в I или II группы; В процессе исследования проводился двойной слепой метод - назначение препаратов и плацебо (соответственно включение пациентов в одну из исследуемых групп) и проведение исследований проводилось различными исследователями.
Сопоставимость групп исследования обеспечивалась: Исключением из групп исследований пациентов, имеющих тяжелую соматическую патологию (хронические заболевания сердечно-сосудистой и дыхательной систем, патологию ЦНС); Отсутствием достоверных различий между группами по возрасту (из групп исключали пациентов моложе 18 и старше 60 лет).
Комплексный препарат вводили капельно 2 раза в день в течении 5 суток.
Параметры кислородного баланса определяли на момент поступления в отделение, на 2-е и 3-и сутки нахождения больных в стационаре. Определение парциального давления газов крови и показателей КОС производилось на газоанализаторе Stat Profile Ultra (Nova biomedical, США). Минутный объем дыхания определяли с помощью волюметра VEB MLW (Medinzintechnik). При проведении измерений больные вентилировались атмосферным воздухом.
Расчетные параметры газообмена, системы транспорта кислорода и КЩР получали используя формулы, приведенные в стандартах NCCLS, и в монографиях Г.А. Рябова (1988).
Уровень эндогенной интоксикации оценивали путем определения ВНСММ и ОП в плазме и на эритроцитах артериальной и смешанной венозной крови и в моче по М.Я. Малаховой (1995).
Концентрацию α-2-макроглобулина в сыворотке крови определяли с использованием тест-системы фирмы Immun Diagnostik (Германия).
Полученные в процессе исследования результаты обрабатывались на ЭВМ типа IBM-PC c помощью программной системы STATISTICA for Windows (версия 5.5). Достоверность различий определяли непараметрическими методами (Р<0,05).
Результаты и их обсуждение
При поступлении тяжесть состояния больных была обусловлена глубокими токсическими пораженими головного мозга до комы II-III степени с нарушением регулирующей функции ЦНС. Всем больным проводилась ИВЛ в связи с нарушением функции внешнего дыхания. Тяжесть клинического течения острых отравлений во многом отягощалась длительностью пребывания больных в гипоксии, то есть времени с момента отравления до оказания медицинской помощи (Таблица 1).
В клинической картине отравлений в группе, в интенсивную терапию которых был включен комплексный препарат, наблюдали следующие изменения: в неврологическом статусе отмечались в сокращение длительности коматозного состояния, которая у больных I группы составила 38,12±10,26 часа, тогда как в группе сравнения - 65,54±10,26 часа. Отличия также были выявлены по времени нахождения больных в отделении реанимации до перевода в общее отделение, что соответствовало стабилизации состояния до средней степени тяжести. У пациентов получавших комплексный препарат длительность выхода из комы составила 64,7±9,16 часа, тогда как в группе сравнения - 118,15±17,23 часа. Развитие пневмоний в I группе наблюдалось у 41% (7 больных), во II группе - 63,6% (7 больных). В группе пролеченных комплексным препаратом умер 1 больной, во II группе - 6 больных.
Таблица 1. Клинические критерии эффективности
комплексного препарата в группе больных
получавших метаболическую терапию (I) (n=17)
и в контрольной группе больных (II) (n=13) (М±м).
|
Показатель |
Больные получавшие комплексный препарат (I) (n=17) |
Больные, получавшие базисную терапию (II) (n=13) |
|
Возраст больных, годы |
34,65±0,64 |
31,75±2,66 |
|
Время экспозиции яда, часы |
14,94±1,23 |
17,1±2,72 |
|
Длительность выхода из комы, часы |
38,82±10,19 |
65,54±11,14** |
|
Частота развития певмоний |
7 (41%) |
7 (63,6%) |
|
Длительность пребывания больных в ОРИТ, часы |
64,7±9,16 |
118,15±17,23** |
|
Число умерших |
1 |
6 |
Примечание - *p<0.05 между (I) и (II); **p<0.01 между (I) и (II).
Таким образом, при включении комплексного препарата в интенсивную терапию острыми тяжелыми отравлениями нейротропными ядами, отмечается уменьшение длительности коматозного состояния, снижение количества легочных осложнений и сокращение периода нахождения в критическом состоянии.
При исследовании показателей транспорта кислорода с момента поступления у всех исследуемых больных отмечались нарушения респираторного, объемного и тканевого компонентов. У всех больных наблюдали повышение функционального мертвого пространства, вентиляционно-перфузионного отношения. Диффузионные расстройства проявлялись в повышении альвеолоартериальной разницы по кислороду, снижении отношения парциального напряжения кислорода в артериальной крови к альвеолярному напряжению кислорода и индекса оксигенации. В конечном счете, нарушения проявлялись увеличением фракции легочного шунтирования (Таблица 2), что вело к снижению кислородной емкости крови (снижение РО2 в артериальной крови до 68,5±4,3 мм. рт. ст.) и доставки кислорода к тканям до 356,8±41,8 мл*м-1. Длительность и глубина нарушений кислородотранспортных систем не могли не сказаться на процессы утилизации кислорода тканями, что проявлялось в снижении артериовезной разницы по кислороду, снижении коэффициента использования и коэффициента утилизации кислорода. Изменения кислородного баланса организма также свидетельствовали о наличии тяжелой гипоксии (Таблица 3).
При использовании комплексного препарата отмечали более существенные положительные изменения в динамике показателей систем транспорта кислорода. В респираторном компоненте с 2-х суток проведения терапии отмечали уменьшение доли функционального мертвого пространства к дыхательному объему, нормализацию вентиляционо-перфузионного отношения, улучшение показателей, отражающих диффузионно-перфузионные нарушения легких (Таблица 2). Вызванные изменения вели к уменьшению доли легочного шунтирования и увеличению кислородной емкости артериальной крови (в I группе PaO2 на 3-и сутки составил 79,2±2,5 мм рт. ст. против РаО2 68,79±4,4 мм рт. ст. в группе сравнения).
Следующим этапом исследования была оценка влияния комплексного препарата на течение эндотоксикоза при острых тяжелых отравлениях. Одним из ведущих факторов формирования эндотоксикоза является развитие процессов "неуправляемого" протеолиза [5]. При исследовании концентрации олигопептидов у всех поступивших больных было отмечено их повышение, причем более выраженное в артериальной крови в сравнении с венозной. Это подтверждает факт первичного повреждения легких при острых отравлениях. Параллельно с поражением газообменных функций легких вследствии нарушения регуляторной функции ЦНС угнетаются их метаболические функции (Таблица 4).
Были выявлены положительные эффекты при включении в программу интенсивной терапии комплексного препарата, что подтверждает известное мнение, что развитие эндотоксикоза в значительной степени связано с длительностью и глубиной гипоксических повреждений.
Таблица 4. Изменения концентрации олигопептидов
у больных с острыми отравлениями на фоне проводимого лечения
комплексным препаратом (I) (n=17)
в сравнении
с контрольной группой (II) (n=13) (М±м)
|
Показа-тель |
Норма |
|||
|
Норма |
1-е сутки |
2-е сутки |
3-и сутки |
|
|
ОП вена пл. (I) |
0,22±0,05 |
0,29±0,02# |
0,26±0,02## |
0,23±0,02# |
|
ОП вена пл. (II) |
0,22±0,05 |
0,34±0,03## |
0,37±0,02## |
0,34±0,02## |
|
ОП вена эр. (I) |
0,27±0,02 |
0,51±0,03## |
0,44±0,02## |
0,39±0,02# |
|
ОП вена эр. (II) |
0,27±0,02 |
0,55±0,03## |
0,56±0,03## |
0,55±0,03## |
|
ОП арт.пл. (I) |
0,2±0,04 |
0,3±0,02## |
0,28±0,02## |
0,21±0,01# |
|
ОП арт.пл. (II) |
0,2±0,04 |
0,35±0,03## |
0,38±0,03## |
0,38±0,03## |
|
ОП арт.эр. (I) |
0,24±0,03 |
0,54±0,04## |
0,42±0,02## |
0,36±0,02# |
|
ОП арт.эр. (II) |
0,24±0,03 |
0,58±0,03## |
0,61±0,03## |
0,59±0,04## |
|
ОП моча (I) |
0,3±0,1 |
0,24±0,03 |
0,45±0,04* |
0,43±0,02* |
|
ОП моча (II) |
0,3±0,1 |
0,28±0,04 |
0,32±0,05 |
0,33±0,04 |
I группа - больные, получавшие комплексный препарат,
II группа -
больные, получавшие стандартную интенсивную терапию;
# - различия с
нормой достоверны (P<0,05),
* - различия с исходными данными
достоверны (P<0,05),
- - различия (I) группы от (II).
Отмечали снижение в венозной и артериальной крови концентрации олигопептидов, положительной артериовенозной разницы, что являлось свидетельством восстановления метаболических функций легких (Таблица 4). Из белков, относящихся к регулятором протеолиза относят альфа-2-макроглобулин. Альфа-2-макроглобулин наиболее универсальный ингибитор протеиназ, регулирующий внеклеточные протеолитические системы тканей [2].
При поступлении было выявлено резкое повышенное содержание альфа-2-макроглобулина до 4,39±0,25 в I группе и 3,82±0,42 г/л в контрольной группе (норма - 2,15±0,65 г/л). В обеих группах отмечались изменения, проявлявшиеся в тенденции к повышению в группе пролеченных комплексным препаратомдо 4,52±0,26 г/л и тенденцией к снижению в группе с традиционной интенсивной терапией до 3,31±0,37 г/л, как результат истощения антипротеолитических систем на фоне нарастания концентрации олигопептидов.
Таким образом, использование препаратов сукцината в программе интенсивной терапии острых тяжелых отравлений позволяют снизить степень эндотоксикоза за счет уменьшения степени тканевой гипоксии, нормализации процессов утилизации кислорода в тканях уже перенесших гипоксию, повышения антипротеолитического потенциала и более быстрого восстановления систем естественной детоксикации.
Именно влияние комплексного препарата на взаимообусловленность и взаимоотягощение процессов нарушений транспорта кислорода и эндотоксикоза позволяет улучшить качество лечения больных в критическом состоянии с острыми отравлениями нейротропными ядами. На наш взгляд, это связано с несколькими механизмами действия препарата.
Во-первых, с улучшением метаболизма тканей, где препарат выступает как энергосубстрат при существенном дефиците энергии. Во-вторых, нормализация вентиляционных и диффузионных показателей в значительной мере может быть связана с улучшением состояния поверхностно-активных веществ легких, так как эта система наиболее подвержена повреждениям при гипоксии. В-третьих, с антиоксидантные свойствами комплексного препарата. В-четвертых, действие комплексного препарата на снижение уровня эндотоксемии и восстановление детоксицирующих систем организма позволяет снизить метаболическую нагрузку на системы естественной детоксикации, в первую очередь легких, что проявляется дальнейшим улучшением как недыхательных, так и их газообменных функций.
Наряду с перечисленными выше механизмами лечебного действия можно считать установленным, что комплексный препарат на основе 1.5% Реамберина для инфузий является при критических состояниях реальным донатором энергетического субстрата и средством восстановления энергетического статуса организма.
Выводы
- Применение 1.5% Реамберина в комбинации с глюкозой, рибоксином, никотинамидом и рибофлавином в программе интенсивной терапии у больных в критическом состоянии с острыми тяжелыми отравлениями смесью нейротропных препаратов ведет к уменьшению длительности коматозного состояния и проявлений нарушений транспорта кислорода в респираторном и тканевом компоненте и показателях кислородного баланса организма, снижению количества вторичных легочных осложнений и сроков пребывания больных в реанимационном отделении.
- Включение комплексного препарата на основе 1.5% Реамберина для инфузий в программу интенсивной терапии у больных с острыми тяжелыми отравлениями нейротоксическими ядами позволило существенно снизить проявления эндотоксикоза за счет уменьшения гипоксических повреждений, реабилитации систем естественной детоксикации, восстановления тканевого и системного метаболизма.
Литература
- Рябов Г.А. Гипоксия критических состояний. - М.: Медицина, 1988. - 288 с.
- Ерюхин И.А., Шашков Б.В. Эндотоксикоз в хирургической клинике. - СПб: "Logos", 1995. - 304 с.
- Лукьянова Л.Д. Гипоксия при патологиях. Молекулярные механизмы и принципы коррекции. //Перфторорганические соединения в биологии и медицине (сборник научных трудов). СПб, 2001. С.56-69.
- Лужников Е.А., Костомарова Л.Г. Острые отравления: Руководство для врачей. 2-е изд., перераб. и доп. - М.: Медицина, 2000. - 444 с.
- Малахова М.Я. Метод регистрации эндогенной интоксикации. - СПб.: МАПО, 1995. - 33 с.
Список основных обозначений и сокращений
|
AaDO2 |
- |
альвеолярно-артериальная разница по кислороду |
|
AvDO2 |
- |
Артериовенозная разница по кислороду |
|
A-2-МГ |
- |
Альфа-2-макроглобулин |
|
DO2 |
- |
доставка кислорода |
|
paO2 |
- |
парциальное давление О2 в артериальной крови |
|
PaO2/FiO2 |
- |
респираторный индекс |
|
Qsp/Qt |
- |
фракция шунтируемой крови |
|
VA/Qt |
- |
вентиляционно-перфузионное отношение |
|
Vd/Vt |
- |
отношение физиологического мертвого пространства к дыхательному объему |
|
VO2 |
- |
потребление кислорода в 1 мин (STPD) |
|
КИК |
- |
коэффициент использования кислорода |
|
ВНСММ |
- |
вещества низкой и средней молекулярной массы |
|
КОС |
- |
кислотно-основное состояние |
|
КУО2 |
- |
коэффициент утилизации кислорода |
|
ОДН |
- |
острая дыхательная недостаточность |
|
ОП |
- |
олигопептиды |
|
СИ |
- |
сердечный индекс |
|
УИ |
- |
ударный индекс |
Дрогомирецкая Е.И., Балашов В.К., Кокая А.А.,
Тихановская Е.О.,
Васильев А.Н.
Санкт-Петербургская государственная медицинская академия
им.
И.И. Мечникова, кафедра хирургических болезней N1
Клиническая эффективность Реамберина
у больных с механической желтухой
и бактериальным холангитом
у больных с механической желтухой
и бактериальным холангитом
Особенностью клинического течения механической желтухи при доброкачест-венном поражении желчных протоков является неразрывная связь ее с бакте-риальным холангитом. Комплекс патобиохимических и патофизиологических изменений при этих осложнениях затрагивает большинство систем организма и требует своевременной и полной коррекции [1].
Современные требования к лечению включают, наряду с декомпрессией желчных протоков, применение средств, связывающих и элиминирующих биологически активные вещества и токсины, антигипоксантов, антиоксидантов, макроэргических соединений.
В настоящее время особую значимость приобретает разработка и внедрение в клиническую практику недорогих отечественных препаратов, сочетающих в себе дезинтоксикационные и метаболические свойства.
Реамберин представляет собой сбалансированный изотонический раствор, содержащий 1-(1-дезокси-d-глюцитол-1-ил)-N-метиламмония, натрия сукцинат (1,5%), хлорид калия (0,015%) и хлорид магния (0,006%). Препарат прошел полный курс доклинических исследований в соответствии с требованиями Фармакологического комитета МЗ РФ, которые показали отсутствие токсического, мутагенного и других побочных воздействий на организм. Установлено, что реамберин обладает антигипоксическим действием, оказывая положительный эффект на биохимические процессы в клетке, уменьшая продукцию свободных радикалов и восстанавливая энергетический потенциал клеток. Препарат активирует ферментативные процессы цикла Кребса и шунта Робертса, способствует утилизации жирных кислот и глюкозы клетками, нормализует кислотно-щелочной баланс и газовый состав крови, стабилизирует основные гемореологические параметры крови, стимулирует метаболические реакции в печени и почках, выведение токсинов из организма.
Цель работы
Заключалась в оценке клинической эффективности реамберина у больных с механической желтухой и бактериальным холангитом.
Задачи исследования
- Изучение влияния реамберина на клиническое течение и на динамику лабораторных показателей у больных механической желтухой доброка-чественного генеза в раннем послеоперационном периоде.
- Выявление возможных побочных эффектов, аллергических и других реакций при применении реамберина.
Материал и методика исследования
Клинические исследования проводились по методу мультицентрового испытания. Исследование открытое, контролируемое, рандомизированое. В основной группе (50 человек) реамберин вводился внутривенно капельно по 400 мл в течение 10-12 дней со дня поступления больного, в контрольной группе (26 человек) больные не получали метаболической терапии.
Все больные были оперированы в клинической больнице Петра Великого за период с января 1999 по май 2001 г. и Дорожной клинической больнице ОЖД за период с марта 2000 по май 2001 г. по поводу различных заболеваний, осложненных механической желтухой и бактериальным холангитом (табл. 1). Всем больным в первые пять суток после поступления были выполнены оперативные вмешательства, направленные на устранение причины обтурации желчных протоков и санацию очага инфекции (табл. 2).
Таблица 1. Причины механической желтухи
и бактериального
холангита
|
Причина |
Контрольная группа |
Основная группа |
||
|
n |
% |
n |
% |
|
|
Холедохолитиаз, в том числе резидуальный |
17 |
65,4 |
36 |
72,0 |
|
Билиодигестивные анастомозы |
7 |
26,9 |
9 |
18,0 |
|
Рубцовые стриктуры гепатикохоледоха |
2 |
7,7 |
5 |
10,0 |
|
Всего больных |
26 |
100 |
50 |
100 |
Таблица 2. Характер оперативных вмешательств
|
Оперативное вмешательство |
Контрольная группа |
Основная группа |
||
|
n |
% |
n |
% |
|
|
Холедохолитотомия, дренирование холедоха |
13 |
50,0 |
26 |
52,0 |
|
Холедохолитотомия, дренирование холедоха, трансдуоденальная папиллосфинктеропластика |
2 |
7,7 |
7 |
14,0 |
|
Холедоходуоденостомия или холедохо- гепатикоэнтеростомия |
11 |
42,3 |
17 |
34,0 |
|
Всего операций |
26 |
100 |
50 |
100 |
Среди больных контрольной группы женщин 18 (69,2%), умерла 1, мужчин 8 (30,7%), умер 1. Средний возраст мужчин составил 62±1 года, женщин 63±3 года. Средний койко-день 19,9±2,5. Длительность желтухи до поступления в стационар колебалась от 1 до 16 дней и в среднем составила 5,5±3,7. Среди больных основной группы женщин 28 (56,0%), умерли 2, мужчин 22 (44,0%), умерших 1. Средний возраст мужчин составил 69±2 лет, женщин 68±3 лет. Средний койко-день 14,7±2,6. Длительность желтухи до поступления в стационар колебалась от 1 до 28 дней и в среднем составила 9,7±2,8.
Исследование больного включало клинические, лабораторные и инструментальные методы, определялся иммунный статус, уровень и характер эндогенной интоксикации, состояние антиоксидантных систем. Использованы данные 5 аутопсий.
Результаты исследований и их обсуждение
I. Неосложненное течение послеоперационного периода наблюдалось у 14 (53,8%) больных контрольной группы и 32 (64,0%) больных основной группы. Устранение причины обтурации приводило к быстрому уменьшению клинических симптомов и положительной динамике лабораторных показателей в обеих группах (табл. 3). При использовании реамберина нормализация основных показателей происходила к 7 суткам после операции. Уровень эндогенной интоксикации наиболее быстро снижался при проведении дренирующей операции и применении реамберина. Реакция иммунной системы не выходила за рамки защитной в обеих группах. Выздоровление больных происходило к 10-14 суткам после операции и сроки выписки из стационара лимитировались сроками удаления дренажа из желчных протоков.
II. Осложненное течение послеоперационного периода с благоприятным исходомнаблюдалось у 10 (38,5%) больных контрольной группы и 15 (30,0%) больных основной группы. В клинической картине преобладал синдром эндогенной интоксикации, обусловленный гнойной интоксикацией, желтухой и острой почечной недостаточностью. Уровень эндогенной интоксикации был крайне высок в обеих группах (табл. 3). В то же время более быстрая положительная динамика изменений этих показателей в группе больных, получавших реамберин. Необходимо отметить высокую эффективность препарата как профилактического средства у больных с явлениями почечной дисфункции или недостаточности до операции. Вторичный иммунодефицит, в нашем представлении был связан с уровнем эндотоксикоза. Этим, а также непосредственным влиянием компонентов реамберина на метаболизм клетки можно объяснить нормализацию функциональной и метаболической активности лейкоцитов у больных основной группы.
III.Осложненное течение послеоперационного периода с летальным исходом наблюдалось у 2 (7,7%) больных контрольной группы и 3 (6,0%) больных основной группы. Уровень эндогенной интоксикации высокий в обеих группах, связь осложнений с нарушенной резистентностью несомненна (табл. 3). В контрольной группе смерть двух больных находилась в прямой связи с развившейся тяжелой острой почечной недостаточностью и прогрессировавшей желтухой, связанными с гнойно-резорбтивным поражением нефро- и гепатоцитов. В основной группе непосредственной причиной смерти явилась декомпенсация сопутствующих сосудистых заболеваний у больных старческого возраста.
Выявленные дополнительные клинически значимые особенности действия реамберина:
- У больных старческого возраста с сахарным диабетом 2 типа на фоне применения реамберина в 2 случаях наблюдалось развитие гипогликемических состояний (сахар крови ниже 1,5 ммоль) через 4-6 часов после введения препарата. В последующем реамберин всем больным вводился после препаратов глюкозы.
- У 2 больных старческого возраста, получавших реамберин 7 дней в связи с тяжелой гнойной интоксикацией на 2 сутки после отмены препарата развилось острое желудочное кровотечение легкой и средней степени тяжести из эрозий и острых язв желудка и 12-перстной кишки. В дальнейшем, при применении профилактических доз противоязвенных препаратов и продлении сроков введения препарата, подобных осложнений не наблюдалось.
- Аллергических реакций на реамберин не отмечено, однако у 6 больных при быстром введении наблюдалось чувство жара и нехватки воздуха, прошедшие при медленном введении (до 40 капель в минуту) и не потребовавшие отмены препарата.
Выводы
- Реамберин обладает выраженными дезинтоксикационными и метаболическими свойствами.
- Применение препарата до, во время и после операции на желчных протоках у больных с механической желтухой и бактериальным холангитом позволяет уменьшить вероятность возникновения осложнений, напрямую связанных с эндогенной интоксикацией и метаболическими нарушениями.
Литература
- Резолюция VII Международной конференции хирургов-гепатологов России и стран СНГ. Смоленск, Россия, 14-16 октября 1999 г. // Анналы хирургической гепатологии.- 2000.- т. 5.- N1.- с. 140-144.
Т.В. Сологуб, М.Г. Романцов, А.Л. Коваленко,
Г.Ю. Мельникова, Е.В. Карнаухов
Санкт-Петербургская государственная академия им.
И.И. Мечникова,
Научно-технологическая фармацевтическая фирма "Полисан".
Опыт использования комплексной этапной
индивидуальной терапии
вирусных гепатитов В и С
индивидуальной терапии вирусных гепатитов В и С
Предложен метод этапной индивидуализированной терапии вирусных гепатитов В и С. Подбор препарата и его дозы осуществлялся на основании изучения состояния тиолдисульфидного равновесия in vitro.
Вирусные гепатиты в последнее десятилетие сохраняют прочные позиции среди наиболее актуальных проблем современной медицины. Многолетний собственный опыт лечения больных острыми и хроническими диффузными заболеваниями печени, а также данные литературы, позволяют предложить программу комплексной терапии вирусных гепатитов, включающую 3 этапа. 1-й этап соответствует острому периоду ВГ или обострению ХВГ, когда задачей первостепенной важности является снижение эндогенной интоксикации и купирование явлений печеночной недостаточности. 2-й этап - это период ранней реконвалесценции и стихания основных клинических симптомов болезни, где ключевым звеном терапии можно считать восстановление компенсаторно-адаптационных функций организма, а также прекращение репликации вируса и снижение вирусной нагрузки. 3-й этап - завершающий, направлен на закрепление достигнутых результатов.
Неукоснительное соблюдение принципов преемственности этапной терапии, на наш взгляд, должно сочетаться с индивидуальным подходом к каждому больному, включая не только выбор препаратов, продолжительность лечения, но и дозу лекарственного вещества.
Задачей нашего исследования была оценка эффективности этапной комплексной терапии больных острыми и хроническими вирусными гепатитами на основании изучения индивидуальной чувствительности к различным лекарственным препаратам по состоянию тиолдисульфидного равновесия [6].
Было проведено тестирование крови больных вирусными гепатитами С и В с определением чувствительности к Неовиру (20 больных), Циклоферону (50 больных), Реамберину (80 больных), комбинированному метаболическому антигипоксанту (60 больных) и препаратам ИФН-2α. Положительный ответ на различные дозы ИФН отмечался только у 37,5% больных хроническим вирусным гепатитом С, тогда как у остальных были получены отрицательные результаты на используемые дозы. Установлено, что стандартная доза (3-5 млн. МЕ ИФН-2α) является положительно действующей (с точки зрения SH/SS-равновесия) только у 12% пациентов, что и обуславливает, по нашему мнению, низкую эффективность монотерапии ИФН в указанных дозах [1].
Чувствительность больных к стандартным дозам Неовира и Циклоферона была достаточно высокой (59,1% и 74,5% соответственно).
При тестировании больных отмечалась высокая чувствительность к реамберину (92,6%) и цитофлавину (93,4%).
Схема назначения данных препаратов с учетом вышеупомянутой этапной терапии была следующей: на 1 этапе наряду с общепринятой базисной терапией внутривенно капельно назначались растворы Реамберина 1,5% - 400,0 курсом от 5 до 10 инъекций. Известно, что указанный препарат обладает дезинтоксикационным, антигипоксическим, антиоксидантным и гепатопротекторным действием, улучшает дезинтоксикационную функцию печени, способствует регенерации гепатоцитов.
Под влиянием реамберина у больных вирусными гепатитами отмечалась положительная динамика клинико-лабораторных показателей тиолдисульфидного равновесия (увеличение содержания SH-групп и увеличение коэффициента SH/SS), (таблица 1).
У 60 пациентов в схему лечения 1 этапа включали цитофлавин, основным действующим компонентом которого является янтарная кислота - универсальный источник энергии в организме, что определяет широкий диапазон терапевтического действия янтарной кислоты и ее производных. На фоне внутривенного введения цитофлавина у больных достоверно снижались уровни АЛТ и билирубина и возрастали показатели тиолдисульфидного равновесия (табл. 2).
На 2 этапе проведено лечение 75 больных ХВГ по индивидуальным программам с использованием препаратов ИФН (Реаферон, Интрон А, Реальдирон, Реаферон ОЧБ, СПб) и индукторов ИФН Неовира и Циклоферона. Все больные по результатам ПЦР были ВГС-позитивными до начала терапии. 26 больных лечили только ИФН, 20 - Циклофероном, 20 - Неовиром, у 9 ИФН и Неовир применялись поочередно. Ранее установлено, что оптимальными дозами препаратов ИФН были 0,5; 1,0 и 2,0 млн. МЕ [3], которыми и проводили лечение в традиционном режиме - 3 раза в неделю в/м. Циклоферон и Неовир применялись в стандартной дозировке в/м через день.
Контроль эффективности препаратов in vitro проводили до лечения и через 1, 3, 6 и 9 месяцев после начала (при стабильной чувствительности к одной и той же дозе препарата после повторных исследований), а при необходимости (при изменении оптимальных доз или смене препарата) - ежемесячно.
По нашему мнению положительный ответ in vitro на препараты - увеличение величины SH/SS в крови приводит к биостимулирующему (в том числе иммуно-стимулирующему) эффекту, отрицательный ответ - уменьшение величины SH/SS крови - характерен для цитотоксического (в том числе иммунодепрессивного) эффекта препаратов.
Чувствительность к Неовиру существенно не отличалась в группах больных с генотипом 1b и с другими генотипами. В тоже время чувствительность к ИФН существенно зависела от генотипа и была более чем в 4 раза ниже в группе пациентов с генотипом 1b.
При назначении препаратов ИФН и Циклоферона по индивидуальной программе частота вирусологического ответа по негативации ПЦР-ВГС составила 80% (32/40) при лечении в течение 1 месяца и 85% (34/40) при 3-месячной терапии.
Основным механизмом реализации противовирусной активности индукторов интерферонов при ХГС считается интерферон-индуцированная противовирусная активность [2,5]. Преимущество Циклоферона и Неовира по сравнению с рекомбинантными ИФН заключается в том, что под их влиянием вырабатываются все виды эндогенных ИФН, а также другие цитокины (в частности, ИЛ-1 и ИЛ-2), которые не являются чужеродными для организма. Отсюда - гораздо меньшая частота побочных реакций по сравнению с ИФН в стандартных дозах.
Очевидным является представление об отсутствии четких границ между этапами, а значит последовательное применение группы ИФН, цитокинов при наличии установленных показаний пролонгируется на 3-й этап.
Таким образом, выбор препарата, его дозы и продолжительность лечения должен проводится индивидуально, что позволяет существенно повысить эффективность терапии, свести до минимума частоту побочных эффектов и в 5 - 6 раз снизить ее стоимость.
Литература
- McHutchison J.G., Gordon S.C., Schiff E.R., et al. Interferon alfa-2balone or in combination with ribavirin for chronic hepatitis C. N Eng J Med 1998, 339: 1485-92.
- SologubT.V., Romantsov M.G., Grigoryeva T.D., Arinenko R.Y. Infliuence of Cycloferone treatment of hepatitis C on interferon status of patients. 10th International Symposium of Viral Hepatitis and Liver Disease, Atlanta, 9-13 April 2000 (in press).
- Волчек И.В., Сологуб Т.В., Белозерова Л.А. и соавт. Возможности индивидуальной биологически активной терапии вирусных гепатитов. Terra Medica nova 1999, N1, 6-9.
- Волчек И.В., Сологуб Т.В., Белозерова Л.А. и соавт. Возможности использования Неовира в программе индивидуальной терапии хронических вирусных гепатитов В и С. Terra Medica nova 1999, N1, 7-10.
- Горячева Л.Г., Тихонова В.А., Рогозина Н.В. и соавт. Отечественный индуктор интерферона - циклоферон в терапии вирусных гепатитов В и С у детей. Terra Medica nova 1999; (1): 6-9.
- Способ скрининга лекарственных препаратов (патент РФ N2150700).
В.Г. Радченко, Г.А. Баскович, В.В. Стельмах, А.Л. Коваленко
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова, НТФФ "Полисан", Санкт-Петербург
Применение реамберина в комплексной терапии
хронических гепатитов
хронических гепатитов
Заболевания печени остаются серьезной социально-экономической и клинико-эпидемиологической проблемой здравоохранения всех стран мира. Хронические вирусные гепатиты (ХВГ) и циррозы печени занимают значительное место в структуре заболеваний органов пищеварения. По данным ВОЗ в мире насчитывается более 2 млрд. людей, имеющих признаки текущей или завершившейся инфекции вирусом гепатита В, более 170 млн. больных хроническим гепатитом С. В Европе наиболее высокая заболеваемость хроническими гепатитами встречается в Молдове, Венгрии, Италии, Германии и Франции, где уровни смертности от данных заболеваний колеблются от 32,7 (Франция) до 127,4 (Молдова) на 100000 населения. По нашим данным, в Ленинграде - Санкт-Петербурге многолетняя динамика регистрируемой заболеваемости имеет тенденцию к росту с 1,0 в 1962 г., до рекордной цифры 29,3 в 1995 г. на 100000 населения. Рост заболеваемости в 1990-е годы обусловлен в основном за счет вирусного гепатита В и вирусного гепатита С [1].
Общепризнанно, что лечение больных хроническими вирусными гепатитами В, С (ХВГ В, С) представляет довольно сложную задачу для практического врача, требует от него профессиональных навыков ведения таких больных, дифференцированного подхода в зависимости от клинической формы заболевания, а также от состояния иммунной системы пациента. В терапии ХВГ В, С используют противовирусные препараты, иммуномодуляторы, интерфероны и их индукторы, антиоксиданты в различных сочетаниях. Приходиться констатировать, что даже комплексная терапия больных ХВГ В, С в большинстве случаев, к сожалению, не приводит к желаемым результатам [7, 9, 10, 11, 12].
В последние годы доказана важная роль процессов свободно-радикального окисления липидов клеточных мембран в развитии гепатоцеллюлярного повреждения [6, 7]. По результатам многих экспериментальных и клинических исследований, увеличение признаков мезенхимального воспаления в печени, а также выраженность гепатоцеллюлярной недостаточности ассоциируется с активацией процессов перекисного окисления липидов и дисбалансом некоторых неферментных систем антиоксидантной защиты сыворотки крови при хронических вирусных гепатитах. Активность протекания свободно-радикальных реакций и тяжесть эндогенной интоксикации взаимосвязаны, и в значительной степени определяют адаптационно-компенсаторные возможности организма [6, 8].
Для инактивации негативного воздействия продуктов ПОЛ на клетки и ткани организма в последнем существует система антиоксидантной защиты (АОЗ). Наряду с супероксиддисмутазой (СОД) активными компонентами АОЗ являются: система глутатиона, аскорбиновая и мочевая кислоты, каталаза, некоторые металлоферменты печени [3].
При ХВГ наблюдаетсятся длительная активация системы мононуклеарных фагоцитов, сопровождающаяся гиперпродукцией активных форм кислорода, что следует рассматривать в качестве факторов риска развития антиоксидантной недостаточности, которая во многом определяет характер и тяжесть течения заболевания. В ряде случаев при ХВГ активация макрофагов имеет защитный характер и нуждается в восполнении резервов антиоксидантной защиты [4].
Клиническая значимость указанных систем, их связь с морфо-функциональным состоянием печени, все больше находит отражение в усовершенствовании патогенетических методов лечения, воздействующих на молекулярные основы патологии гепатоцитов.
Терапия хронических вирусных гепатитов в настоящее время разрабатывается в двух направлениях:
- усовершенствование патогенетических методов, направленных на профилактику затяжных и хронических форм заболевания,
- поиск противовирусных методов лечения.
В настоящее время в гепатологии все больше находят применение лекарственные препараты, обладающие антиоксидантным, цитопротективным действием.
Отечественный препарат Реамберин, разработанный НТФФ "Полисан" (Санкт-Петербург), применялся в комплексной терапии больных хроническими гепатитами. Реамберин представляет собой раствор для инфузий на основе 1,5% раствора соли янтарной кислоты с N-метилглюкамином и сбалансированного набора микроэлементов - калия, натрия и магния. Активным веществом препарата является янтарная кислота, обладающая прямым модифицирующим действием на клеточный метаболизм, благодаря чему происходит активация аэробного гликолиза, снижается степень угнетения окислительных процессов в цикле Кребса, в дыхательной цепи митохондрий клеток с увеличением внутриклеточного фонда макроэргических соединений. Это обусловливает прямое энергизирующее действие препарата. Известно об антигипоксантных и цитопротекторных свойствах янтарной кислоты. Препарат обладает антиоксидантным, антигипоксантным, дезинтоксикационным, гепато-, нефро- и кардиопротекторными свойствами. Взаимодействуя с окислительно-восстановительными ферментами в дыхательной цепи митохондрий клеток, Реамберин поддерживает эффективность аэробных процессов, нормализует процессы энергообразования в клетках, повышает их антивирусную устойчивость.
Целью исследования являлось изучение клинической эффективности Реамберина в качестве дезинтоксикационного, антигипоксантного средства в комплексной терапии больных, страдающих хроническими вирусными гепатитами.
Больные и методы
В данное исследование было включено 57 пациентов с хроническим вирусным гепатитом (ХВГ), среди которых ХВГ В верифицирован у 18 чел. (31,6%); ХВГ С - 32 чел. (56,1%); хронический микст-гепатит (ХВГ В+С) - 7 чел. (12,3%). Из них мужчины составляли 52,3%, женщины - 47,7%. Средний возраст больных: 42±11 лет. Этиологически больные были разделены на 3 группы. Группу сравнения составили 30 больных, сопоставимых по нозологической принадлежности, полу и возрасту, выраженности активности и стадии фиброзирования в печени, получавших базисную дезинтоксикационную терапию.
Диагноз верифицировался вирусологически: больным определялись HBsAg, анти-HBsAB, HBeAg, анти-HBeAB, анти-HBcorAB, анти-HCV-АВ, проводилось морфологическое исследование печени по Мангини. Перед назначением препарата и в динамике оценивались: биохимические показатели крови, клинический анализ крови, иммунограмма (оценивалось количество лимфоцитов и их субпопуляции методом моноклональных антител), показатели интерферонового статуса (сывороточный интерферон (ИФН), индуцированная продукция ИФН-a/b, ИФН-g), определялась функциональная активность моноцитов (НСТ-тест), коагулограмма.
Выраженность процессов свободно-радикального окисления у больных ХВГ оценивалась по степени пероксидации липидных и белковых молекул. Из параметров антиоксидантной защиты изучались: супероксиддисмутаза (СОД), каталаза (КАТ), аскорбатная система, система глутатиона. При иследовании клинической эффективности Реамберина проводилось сопоставление показателей ПОЛ и АОЗ сыворотки крови больных хроническими вирусными гепатитами с основными клинико-морфологическими критериями заболевания (этиологией, функциональным состоянием печени, выраженности процессов фиброзирования), определялось их диагностическое значение.
Результаты и обсуждение
Реамберин применялся в качестве дезинтоксикационного, антигипоксантного средства в инфузионной терапии больных с хроническими вирусными гепатитами. Инфузионная терапия Реамберином предшествовала проведению этиотропной противовирусной терапии с использованием интерферонов, индукторов интерферона.
Показаниями для проведения курса терапии Реамберином явились:
- наличие выраженных клинико-лабораторных, иммунологических показа-телей и морфологических признаков активного патологического процесса,
- недостаточность ферментативного и неферментного звена антиоксидант-ной системы сыворотки крови,
- выраженные процессы липопероксидации.
При исследовании параметров антиоксидантной защиты и степени пероксидации липидных и белковых молекул у больных хроническими вирусными гепатитами наблюдалось снижение мощности ферментативного звена антиоксидантной системы, сдвиг окислительно-восстановительного потенциала в тиол-дисульфидной системе в сторону окиления, повышение пероксидации белков.
У больных ХВГ при прогрессировании заболевания наблюдалось нарастание продуктов перекисного окисления липидов, что влекло за собой прогрессивное снижение активности ферментов антиоксидантной системы (график 1). Применение Реамберина оптимизировало реакцию антиоксидантной системы: повышение показателей СОД, тиол-дисульфидного соотношения после курса терапии, что свидетельствовало об активном включении данных механизмов в ограничение стадии инициирования свободно-радикального окисления липидов (график 2, 3).
Наблюдалась положительная динамика биохимических показателей, заключающаяся в уменьшении выраженности синдрома цитолиза. Наиболее выраженное снижение цитолитического синдрома при назначении Реамберина наблюдалось у больных ХВГ С с умеренной и выраженной степенью активности (график 4).
Для хронических вирусных инфекций (гепатит В, С, герпес), а также некоторых заболеваний невирусной природы характерно выраженное подавление интерфероногенеза. Система интерферона осуществляет не только первую линию защиты организма от инфекций, когда иммунная система еще не успевает отреагировать, но и участвует в дальнейших, уже иммунных, процессах в уничтожении чужеродных объектов. Если иммунная система отвечает за неизменность белкового состава организма, то система ИФН следит за поддержанием генетическогого гомеостаза, т. е. за сохранением постоянства состава организма на уровне генома [6]. С целью объективной оценки состояния системы ИФН в клинической практике используют понятие "интерферонового статуса", который включает ряд показателей:
- содержание различных типов ИФН в сыворотках крови (sИФН);
- способность лейкоцитов крови к продукции различных типов ИФН (продукция ИФН-α/β, ИФН-γ).
Полученные результаты лабораторных обследований свидетельствуют о диссонансе системы ИФН при всех формах ХВГ: во всех случаях отмечалось повышение сывороточного ИФН и снижение индуцированной in vitro продукции ИФН-α/β и ИФН-γ по сравнению с нормой. При этом более значительно продукция ИФН подавлена у больных с тяжелым течением хронического заболевания.
На фоне проводимой терапии Реамберином в 47% наблюдалось достоверное снижение сывороточного ИФН с (27.3±1.02 до 18.1±0.83 МЕ/мл, p<0.05), сопровождающееся тенденцией к повышению продукции ИФН-α/β. Эти изменения наблюдались у больных ХВГ умеренной и выраженной активностью.
Изменения реологических свойств крови, возникающие на фоне лечения Реамберином имеют неоднозначный характер: у больных ХВГ с умеренной и выраженной активностью, и у больных ХВГ на стадии цирроза печени наблюдается тенденция к гипокоагуляции, выражающаяся в снижении протромбинового индекса в среднем на 13.9% удлинением протромбинового времени в среднем на 9.3%, повышением фибринолитической активности сыворотки крови. Наблюдаемая гипокоагуляция устраняется изменением схемы леченияРеамберином: препарат рекомендуется назначать в той же дозе, через день.
Проведенные клинические исследования позволяют констатировать, что включение Реамберина в базисную инфузионную терапию больных данной патологией повышает антиоксидантный потенциал сыворотки крови. Таким образом использование Реамберина в лечении больных с хроническими вирусными гепатитами способствует повышению неспецифической резистентности организма, что важно для излечения от вирусной инфекции.
Как показали проведенные исследования, использование Реамберина в инфузионной терапии больных с ХВГ приводило к более быстрому уменьшению проявлений астено-вегетативного, диспепсического синдромов. Применение препарата благоприятно отражалось на показателях периферической крови: наблюдалось повышение абсолютного количества лимфоцитов, тромбоцитов, функциональной активности моноцитов, оцениваемой в НСТ-тесте.
Таким образом, анализ результатов клинических данных применения Реамберина в гепатологии позволяет констатировать:
- Реамберин эффективен в лечении больных с хроническими вирусными
гепатитами, хорошо сочетается с применяемыми инфузионными
лекарственными средствами в гепатологии.
Препарат способствует быстрому уменьшению астено-вегетативного, диспепсического синдромов у больных ХВГ. - Наиболее выраженное снижение цитолитического синдрома при назначении Реамберина наблюдалось у больных ХВГ С с умеренной и выраженной степенью активности.
- Включением Реамберина в базисную инфузионую терапию больных ХВГ проводится коррекция недостаточности системы антиоксидантной защиты и снижение интенсивности процессов липопероксидации.
- Цитопротективный эффект Реамберина на содержание форменных элементов периферической крови отмечался после курса инфузионной терапии: (повышение абсолютного количества лимфоцитов, тромбоцитов, функциональной активности моноцитов). У 47% больных ХВГ после проведения курса терапии Реамберином достигался положительный иммуномодулирующий эффект, заключавшийся в снижении концентрации сывороточного интерферона, повышении индуцированной продукции ИФН-α/β; у 34% больных наблюдалось повышение Т-лимфоцитов, их субпопуляций.
Реамберин 1,5% раствор 400 мл. рекомендуется вводить 1-2 раза в сутки по 400 мл. внутривенно, капельно, ежедневно, или через день в сочетании с традиционной базисной инфузионной терапией.
Выводы
Анализ литературных данных и результатов собственных исследований свидетельствует о том, что использование Реамберина в комплексной терапии больных ХВГ:
- способствует улучшению основных клинико-лабораторных показателей,
- увеличивает эффективность базисной терапии,
- корректирует недостаточность системы антиоксидантной защиты,
- приводит к снижению интенсивности процессов липопероксидации.
Не наблюдалось никаких серьезных побочных эффектов. В отдельных случаях при внутривенных введениях препарата возможно развитие преходящей гиперемии кожных покровов лица, верхней половины туловища, устраняемой замедлением скорости внутривенной инфузии препарата.
Проведенные исследования и их динамика при лечении показывают преимущество применения лекарственных средств с антигипоксантными свойствами, по сравнению с традиционной инфузионной терапией для лечения больных с хроническими заболеваниями печени. Реамберин эффективен в лечении больных с хроническими вирусными гепатитами, хорошо сочетается с применяемыми инфузионными лекарственными средствами в гепатологии.
Реамберин рекомендуется включать как обязательное патогенетическое средство в комплексную терапию больных с различными формами ХВГ.
Литература
- Радченко В.Г., Шабров А.В., Нечаев В.В. Хронические заболевания печени. СПб., 2000, 190 с.
- Стельмах В.В., Коваленко А.Л. Изучение клинической эффективности Реамберина при хронических вирусных гепатитах. Актуальные вопросы внутренних болезней: материалы науч. конференции. СПб., 2000: 28-30.
- Исаков В.А., Борисова В.В., Исаков Д.В. Герпес: патогенез и лабораторная диагностика. СПб., 1999, 190 с.
- Лукина Е.А. Система мононуклеарных фагоцитов и биологические эффекты провоспалительных цитокинов. Росс. журнал гастроэнтерол., гепатол., колопроктол. 1998; (5): 7-13.
- Ершов Ф.И. Система интерферона в норме и при патологии. М., 1996, 240 с.
- Romero F.J.; Bosch-Morell-F; Romero M.J.; Jareno-E.J.; Romero-B.; Marin N.; Roma J., Lipid peroxidation products and antioxidants in human disease. Environ-Health-Perspect. 1998 Oct; 106 Suppl 5: 1229-34.
- Look M.P.; Gerard A.; Rao G.S.; Sudhop T.; Fischer H.P.; Sauerbruch T.; Spengler U. Interferon/antioxidant combination therapy for chronic hepatitis C-a controlled pilot trial. Antiviral Res. 1999 Sep; 43 (2): 113-22.
- Boya P.; de la Pena A.; Beloqui O.; Larrea E.; Conchillo M.; Castelruiz Y.; Civeira M.P.; PrietoJ. Antioxidant status and glutathione metabolism in peripheral blood mononuclear cells from patients with chronic hepatitis C.J. Hepatol. 1999 Nov; 31 (5): 808-14.
- Testa R, Giannini E., Picciotto A., Risso D., Caglieris S., Fasoli A., Lantieri P.B., Icardi G.C., Lapertosa G., Celle G. Probability of non-response during interferon therapy in patients with chronic hepatitis C. Hepatogastroenterology 1999 May-Jun; 46 (27): 1928-36.
- Pol S., Couzigou P., Bourliere M., Abergel A., Combis J.M., Larrey D., Tran A., Moussalli J., Poupon R., Berthelot P., Brechot C. A randomized trial of ribavirin and interferon-alpha vs. interferon-alpha alone in patients with chronic hepatitis C who were non-responders to a previous treatment. J Hepatol 1999 Jul; 31(1): 1-7.
- Maddrey W.C. Safety of combination interferon alfa-2b/ribavirin therapy in chronic hepatitis C-relapsed and treatment-naive patients. Semin Liver Dis 1999; 19 Suppl 1:67-75
- Carreno V., Marcellin P., Hadziyannis S., Salmeron J., Diago M., Kitis G.E., Vafiadis I., Schalm S.W., Zahm F., Manzarbeitia F., Jimenez F.J., Quiroga J.A. Retreatment of chronic hepatitis B e antigen-positive patients with recombinant interferon alfa-2α. Hepatology 1999 Jul; 30 (1): 277-82.
Л.Д. Тищенко, Ф.И. Ершов,
А.Л. Тищенко, Г.В. Малахов, Ф.С. Халаф,
А.Л. Савастенко, Н.С. Сергеева
Российский Университет дружбы народов, Москва
Реамберин-эффективное средство
лечения хронической
крапивницы
лечения хронической крапивницы
Цель и задачи
Изучение эффективности реамберина при лечении хронической крапивницы, включая комплекс реамберина с пиридоксальфосфатом, при лечении больных хронической крапивницей, сопровождающейся отеком Квинке, и изучение статуса пиридоксина в крови и пиридоксальфосфата в сыворотке крови при этом заболевании.
Материалы и методы
Под наблюдением было 56 больных хронической крапивницей в возрасте от 35 до 49 лет, включая 25 больных, у которых при обострении заболевания развивался отек Квинке. У больных проводилось изучение терапевтической эффективности реамберина (31 человек) и комплекса реамберина с пиридоксальфосфатом (25 человек). При обследовании больных применялась методика микробиологического определения свободной, связанной с белками (коферментной) и общей формы пиридоксина в крови (методика Н.А. Помошниковой в модификации Е.М. Рахмалевич и Л.Д. Тищенко, 1963), а также биохимическая методика определения пиридоксальфосфата в сыворотке крови (методика В.С. Асатиани, 1969).
Результаты и их обсуждение
Как известно, крапивница является аллергическим заболеванием, которое характеризуется образованием на коже и слизистых оболочках волдырей. В патогенезе крапивницы большую роль играют такие биологически активные медиаторы воспаления, как гистамин, брадикинин, серотонин и др. Роль аллергенов при этом заболевании могут играть не расщепленные белки и разнообразные эндогенные токсические вещества. Допускается возможность аутосенсибилизации под воздействием собственного инсулина, эндотоксина и калликреина. Возможно, что в возникновении этого заболевания определенную роль играет окись азота, которая образуется в клетках и выполняет важную роль газового (небелкового) медиатора. В клетках здорового человека окись азота сохраняется очень короткое время (около 10 секунд), после чего превращается в нитриты и нитраты. Наиболее тяжелым осложнением этого заболевания является отек Квинке. Клинически при этом развивается ограниченный отек кожи, слизистых оболочек и подкожной жировой клетчатки. Отек, развивающийся в области гортани, может привезти к асфиксии и гибели больного. В настоящее время при лечении отека Квинке, в основном, используются кортикостероидные препараты, антигистамины, препараты кальция, адреналин и мочегонные средства.
Для лечения больных хронической крапивницей нами применялся реамберин, который, как известно, обладает антигипоксическим и антиоксидантным действием, оказывает положительный эффект на аэробные биохимические процессы в клетке и восстанавливает энергетический потенциал клеток. Он улучшает тканевое дыхание и повышает детоксицирующую функцию печени. Реамберином лечился 31 больной хронической крапивницей. Препарат вводился этим больным ежедневно внутривенно капельно со скоростью не более 90 кап/мин (4,0-4,5 мл/мин), до 400 мл в сутки. В зависимости от степени тяжести заболевания и выраженности симптомов интоксикации курс лечения составлял 7-10 дней. Положительный терапевтический эффект наблюдался у 30 (96,7%) больных. При этом у больных к концу лечения полностью прекращалось появление новых уртикарных высыпаний на коже. У больных улучшалось общее самочувствие, аппетит, сон и настроение.
Кроме того, реамберином лечилось 13 больных хронической крапивницей, у которых при обострении заболевания наблюдались признаки нарастания отека слизистых дыхательных путей (отек Квинке). Положительный терапевтический эффект при лечении этих больных одним реамберином наблюдался только у 7 (53,8%) человек. Благодаря введению реамберина у этих больных удалось купировать развитие отека слизистых дыхательных путей и остановить к концу 1-го сеанса (на 2-ом часу лечения) нарастание приступа удушья. Несмотря на то, что в последующие дни обострения крапивницы повторялись, интенсивность развития отечности дыхательных путей (на 2-ой, 3-ий и 4-ый день лечения) продолжала значительно уменьшаться. Полное прекращение развития отека Квинке при обострении хронической крапивницы наблюдалось у этих больных после 4-5-го введения реамберина. При этом изменялась клиника крапивницы. Уртикарные высыпания на коже с каждым последующим обострением заболевания становились менее распространенными и менее выраженными. Значительно уменьшились (у 3-х больных) и полностью исчезали (у 4-х больных) такие субъективные ощущения, как зуд, жжение и болезненность в области высыпаний. Реамберин оказался неэффективным только у 6 (46,2%) больных с отеком Квинке. Несмотря на продолжающееся в течение более 2-х часов введение реамберина, развитие отека у этих больных не прекращалось. Затруднения дыхания продолжали нарастать, в связи, с чем эти больные были переведены на лечение кортикостероидными и антигистаминными препаратами.
При обострении крапивницы у этих больных появлялись некоторые нехарактерные для этого заболевания жалобы. Эти больные указывали на определенные симптомы, которые они расценивали в качестве предвестников очередного приступа крапивницы. Перед началом приступа крапивницы у этих больных ухудшалось общее состояние, развивалась депрессия, исчезал аппетит и появлялась тошнота. Накануне, преимущественно в ночное время, у них появлялись судороги в области икроножных мышц. Их беспокоили также головные боли, головокружения, общая слабость, мучительные, "кошмарные" сновидения и ноющие боли в области зубов. В течение нескольких дней, предшествующих обострению заболевания, у них, преимущественно на коже лица, появлялся себорейный дерматит, напоминающий периорбикулярную эритему по типу "очков", усиливалась перхоть и зуд волосистой части головы и появлялось отвращение к куриным яйцам. Все эти симптомы были ранее известны, как симптомы указывающие на недостаточность витамина В6 (пиридоксина). В связи с этим было решено у больных хронической крапивницей, сопровождающейся развитием отека Квинке, изучить статус витамина В6.
Как известно содержание свободной формы пиридоксина в крови у взрослых, здоровых людей составляет 13,0±0,6 мкг%, общей формы - 26,0±0,9 мкг% и связанной с белками (коферментной) формы - 13,0±0,6 мкг%. Содержание пиридоксальфосфата в сыворотке крови у здоровых людей составляет 9,8±1,2 мкг%.
Сравнительные результаты исследований содержания в крови связанной с белками формы пиридоксина, полученные с помощью микробиологической методики исследования, и результаты исследования содержания пиридоксальфосфата, полученные с помощью биохимической методики у больных у больных крапивницей, сопровождающейся отеком Квинке представлены в таблице 1.
Таблица 1. Сравнительные результаты лабораторных исследований
содержания (мкг%) связанной с белками (коферментной) формы
витамина
В6 и пиридоксальфосфата в крови больных
хронической крапивницей
|
Диагноз |
Коли-чество |
Форма вит. В6, сдвиг (во сколько раз) |
|
|
Связанная с белками форма (микробиоло-гическая методика) |
Пиридоксаль-фосфат (биохимическая методика) |
||
|
Хроническая крапивница (вне обострения) |
25 |
13,7±1,1 |
9,9±1,1 |
|
Хроническая крапивница (при обострении заболевания + отек Квинке) |
14 |
5,2±0,3 |
4,1±1,0 |
|
Норма (здоровые) |
27 |
13,0±0,6 |
9,8±1,2 |
Как видно из материалов, приведенных в таблице 1, у больных хронической крапивницей в крови при обострении заболевания, сопровождающемся отеком Квинке, имеют место однонаправленные сдвиги в показателях, отражающих содержание связанной с белками формы пиридоксина и пиридоксальфосфата. Полученные результаты вполне сопоставимы. На основании этих показателей, повидимому, в равной степени можно судить о наличии дефицита витамина В6 у больных хронической крапивницей.
При вяло текущих формах хронической крапивницы, не сопровождающихся отеком Квинке, уровень содержания в крови связанной с белками формы пиридоксина и пиридоксальфосфата не изменялся и варьировал в пределах нормы. И все же оставалось неясным, почему при отсутствии потребности в витамине В6 применение пиридоксина гидрохлорида (некоферментная форма витамина) при лечении хронической крапивницы оказывается весьма эффективным. Частичное объяснение этого несоответствия нам удалось получить при исследовании у этих больных свободной формы пиридоксина в крови.
Таблица 2. Содержание свободной, связанной с белками
и общей формы пиридоксина в крови (мкг%)
у больных крапивницей,
сопровождающейся отеком Квинке
|
Диагноз |
Кол-во |
Форма вит. В6, сдвиг (во сколько раз) |
||
|
Свободная |
Связанная с белками |
Общая |
||
|
Хроническая крапивница (вне обострения) |
25 |
7,6±0,8 |
13,7±1,1 |
21,3±3,9 |
|
Хроническая крапивница (при обострении заболевания + отек Квинке) |
14 |
24,7±3,7 |
5,2±0,3 |
29,9±4,1 |
|
Норма (здоровые) |
27 |
13,0±0,6 |
13,0±0,6 |
26,0±0,9 |
Как видно из таблицы 2, при более углубленном исследовании статуса пиридоксина у больных хронической крапивницей при относительно спокойном течении заболевания в периоде ремиссии обнаружено снижение свободной формы пиридоксина в крови. Повидимому именно этим обстоятельством можно объяснить определенную эффективность пиридоксина на этом этапе заболевания. В то же время при обострении заболевания, сопровождающемся развитием отека Квинке, в крови больных наблюдается значительное (в 1,9 раза) повышение свободной формы и снижение в 2,5 раза связанной с белками, коферментной формы витамина В6.
Можно согласиться с мнением академика Т.Т. Березова, который считает, что при таких заболеваниях, как псориаз, экзема, атопический дерматит и хроническая крапивница в основе развития иммунных нарушений, приводящих к обострению заболевания, лежит один и тот же механизм - утрата функции биотрансформации витаминов. При этом создается ситуация, когда в организме имеется избыток пиридоксина в виде его свободной формы, но эта форма витамина не переходят в свое активное, коферментное состояние. Нарушаются процессы биотрансформации, вследствие чего этот витамин не способен осуществлять свою функцию в регуляции обмена веществ. Возникает своеобразная ситуация, когда в организме больных на фоне избытка свободной формы пиридоксина одновременно развивается клиника недостаточности связанной с белками (коферментной) формы этого витамина. Повидимому у больных хронической крапивницей при относительно спокойном течении заболевания (при отсутствии отека Квинке), а также в периоде ремиссии при отсутствии уртикарных высыпаний (профилактическое лечение), следует применять некоферментные формы витамина В6 - пиридоксина гидрохлорид, а при обострении заболевания, сопровождающемся развитием отека Квинке, необходимо использовать готовые коферментные формы витамина В6 - пиридоксальфосфат или пиридитол.
Необходимо отметить, что при изучении содержания витамина В6 исследование только одной свободной или одной связанной с белками формы витамина В6 не позволяет выявить всей полноты нарушений статуса этого витамина. Ориентируясь только на этот показатель можно придти к ошибочному выводу об отсутствии каких-либо значительных нарушений в статусе пиридоксина при этом заболевании. Снижение свободной формы пиридоксина в крови указывает на ранние изменения витаминного статуса. Формирование тяжести патологического процесса и, вероятно, развитие соответствующей клинической симптоматики, наблюдаемой при обострении крапивницы, включая и отек Квинке, находится в определенной зависимости от нарушений функции биотрансформации пиридоксина и сопровождается значительным снижением содержания связанной с белками (коферментной) формы витамина В6 в крови. При этом уровень содержания свободной формы пиридоксина в крови значительно возрастает. Следовательно, таким больным с признаками отека Квинке или угрозой его развития противопоказано введение пиридоксина гидрохлорида (некоферментной формы). Эти больные нуждаются в введении коферментных форм витамина В6. Известно, что коферментной формой витамина В6 являются пиридоксальфосфат и пиридитол. В организме человека они осуществляют декарбоксилирование и переаминирование аминокислот: триптофана, метионина, цистеина, глютаминовой кислоты и др. Они благоприятно влияет на содержание холестерина и липидов, увеличивают количество гликогена в печени, улучшают ее детоксицирующие свойства, участвуют в обмене гистамина в роли коэнзима гистаминазы и восстанавливают активность трансаминаз.
В свете вышеизложенных фактов было решено при лечении отека Квинке применить комбинацию реамберина с пиридоксальфосфатом. Под нашим наблюдением было 12 больных хронической крапивницей, у которых во время обострения заболевания наблюдалось развитие отека Квинке и которых лечили реамберином по указанной выше схеме одновременно с внутримышечным введением пиридоксальфосфата. Для парентерального введения раствор пиридоксальфосфата готовился непосредственно перед инъекцией (содержимое ампулы - 0,01 растворяли в 1-2 мл воды для инъекций).
В результате проведенного комплексного лечения реамберином и пиридоксальфосфатом положительный клинический результат в виде купирования отека Квинке наблюдался у всех больных, леченных данной комбинацией. На фоне внутривенного капельного введения реамберина в ближайшие 10-15 минут после внутримышечного введения 10 мг пиридоксальфосфата у этих больных прекращалось нарастание клинических проявлений отека Квинке. При этом отек слизистой дыхательных путей уменьшался. Дыхание у больных становилось более глубоким и свободным. Полное разрешение отека Квинке при этом наблюдалось в течение 1-го часа от начала лечения у 7 (58,3%) и к концу 2-го часа лечения - у 4 (33,3%) больных. Значительное улучшение отмечалось у 1 (8,4%) больных.
Выводы
- Реамберин является высокоэффективным средством лечения хронической крапивницы, не сопровождающейся отеком Квинке.
- У больных хронической крапивницей, у которых при обострении заболевания наблюдался отек Квинке, в периоде ремиссии обнаружен дефицит свободной формы пиридоксина, что указывает на целесо-образность использования комплекса реамберина с пиридоксином гидрохлорида в качестве профилактического лечения.
- При обострении заболевания патогенетически обоснованным и высоко-эффективным средством лечения отека Квинке у больных хронической крапивницей является комплекс реамберина с пиридоксальфосфатом.
М. С. Тищенко*, М. Ю. Серебряков*, В. А. Беляева *,
Л. И. Медведева*, Т. Н. Мельцер**, И. М. Панина**,
А. Б. Жидков**, В. Т. Рулева**, А. А. Горбачевский**
Карельский республиканский центр по профилактике и борьбе со
СПИД*,
Республиканская инфекционная больница**, г. Петрозаводск
Применение реамберина
в клинике инфекционных болезней
в клинике инфекционных болезней
Одной из самых важных проблем современной медицины является борьба с интоксикацией и тканевой гипоксией в клинике инфекционных болезней. Получение новых лекарственных препаратов, направленных на борьбу с интоксикацией и устранением тканевой гипоксии является чрезвычайно актуальным. Одним из новых препаратов, способствующих устранению интоксикации и тканевой гипоксии, является реамберин (НТФФ «Полисан»). Препарат реамберин содержит янтарную кислоту, которая является универсальным промежуточным метаболитом, образующимся при взаимопревращении углеводов. При использоании янтарной кислоты улучшается транспорт свободного кислорода в ткани, что нормализует аэробную фазу тканевого дыхания [5].
Показаниями к назначению препарата являются гипоксия, интоксикация, иммуносупрессия.
Целью нашего исследования явилась оценка эффективности использования реамберина у больных инфекционными заболеваниями.
Материалы и методы
Объективная оценка тяжести интоксикации и тканевой гипоксии затруднена, и в настоящее время нет общепризнанных объективных критериев оценки выраженности интоксикации и тканевой гипоксии. Следует отметить, что по своей природе интоксикация различна при различных инфекционных заболеваниях (бактериальные инфекции, вирусные гепатиты, ГИ и пр.), так как в генезе интоксикации принимают участие различные токсические вещества - бактериальные токсины, продукты метаболизма, обломки вирусных частиц, иммунные комплексы и др. В литературе описаны различные методы оценки степени выраженности интоксикации [1-4], однако они не получили широкого распространения в практической медицине и поэтому практикующий врач оценивает степень интоксикации в основном по клиническим симптомам (уровень арте-риального давления, частота пульса, дыхания, степень угнетения сознания и пр.).
Нами на базе Карельского республиканского центра по профилактике и борьбе со СПИД и отделения для взрослых больных вирусными гепатитами Республиканской инфекционной больницы пролечено 30 больных острым вирусным гепатитом (ОВГ) В и С и 15 больных хроническим вирусным гепатитом (ХВГ) В и С в стадии обострения. Пролечено также 10 больных герпетической инфекцией (ГИ) в стадии обострения. Реамберин применяли также в реанимационном отделении Республиканской инфекционной больницы у детей до 3 лет с синдромами дыхательной недостаточности, судорожным синдромом различного генеза, нейроинфекционными заболеваниями.
Оценка степени выраженности интоксикации проводилась по клиническим и биохимическим критериям.
Реамберин назначали взрослым больным в виде 1,5% раствора внутривенно со скоростью не более 20-30 кап/мин в течение 5-10 дней ежедневно. У новорожденных, недоношенных детей и детей до 3 лет реамберин вводили через «линеомат» в дозе 5-10 мл/кг/сут со скоростью 5-0 мл/час.
Обсуждение результатов
У больных вирусными гепатитами при использовании реамберина
отмечалось более быстрое улучшение общего состояния, уменьшение анорексии, снижение уровня билирубина, снижение или нормализация показателей цитолитического синдрома.
У больных герпетической инфекцией наблюдалось уменьшение слабости и вялости, наблюдался более выраженный эффект от применения противовирусной терапии (ацикловир в комбинации с циклофероном).
У новорожденных, недоношенных детей и детей раннего возраста реамберин назначали в первые трое суток до устранения причины гипоксии в дозе 8-10 мл/кг 1 раз в сутки с целью профилактики гипоксического поражения ЦНС, отека набухания головного мозга. У всех детей отмечено уменьшение признаков интоксикации и гипоксии головного мозга.
У двух взрослых больных при более быстром введении реамберина отмечалась гиперемия лица и некоторое снижение артериального давления, что быстро проходило после прекращения или замедления введения препарата.
Выводы и практические рекомендации
Реамберин является современным и высокоэффективным средством для борьбы с интоксикацией и тканевой гипоксией.
Реамберин может быть рекомендован для широкого внедрения в практику лечения больных вирусными гепатитами, ГИ и у детей с неотложными состояниями.
Литература
- Гринев М.В., Цыбин Ю.К., Тарелкина М.Н. Интоксикация при шокогенной травме и методы ее коррекции // Детоксикационная терапия при травме, болезни и остр. хир. забол. Респ. сб. науч. Тр. Л.: Лен-НИИ-СП им. Джанелидзе, 1989. С. 4-9.
- Ерюхин И.А, Белый В.Я., Ханевич М Д. и др. Роль молекул средней массы в патогенезе эндотоксикоза при перитоните // Вести. Хир. 1987, № 5. С. 5-9.
- Калъ-Калиф Я.Я. О лейкоцитарном индексе интоксикации и его практическом значении // Врач. Дело. 1941, № 1. С. 31-35.
- Оболенский С.В., Малахова М.Я. Лабораторная диагностика интоксикации в практике интенсивной терапии: Учебное пособие. СПб., 1993, 16 с.
- Оболенский С.В. Реамберин - новое средство для инфузионной терапии в практике медицины критических состояний. Методические рекомендации. СПб., 2001, 20 с.
М.Г. РОМАНЦОВ
НТФФ "ПОЛИСАН", Санкт-Петербург
Реамберин для онкологии:
возможности применения
возможности применения
Общая характеристика препарата
и механизм фармакологического действия
и механизм фармакологического действия
Реамберин - препарат, на основе янтарной кислоты, обладающий дезинтокси-кационным действием.
Основной фармакологический эффект препарата обусловлен способностью усиливать компенсаторную активацию аэробного гликолиза, снижать степень угнетения окислительных процессов в цикле Кребса и дыхательной цепи митохондрий клеток с увеличением внутриклеточного фонда макроэргических соединений аденозинтрифосфата и креатинфосфата со стабилизацией клеток организма.
Препарат 1.5% раствор для инфузий - реамберин удовлетворительно переносится пациентами и не приводит к развитию осложнений и побочных эффектов при его пролонгированном использовании. Не обнаружено токсического воздействия реамберина на функционирование основных жизненно-важных систем организма: сердечно-сосудистую, дыхательную, выделительную, а также на показатели гомеостаза.
У онкологических больных с выраженными явлениями интоксикации при наличии механической желтухи, при опухолях гепатобиллиарной системы, перитонитах, при острых и хронических вирусных поражениях печени, а также при наличии метастатических процессов показано применение реамберина в качестве дезинтоксикационного средства.
Раствор реамберина также показан онкологическим больным при гипоксических состояниях миокарда, истощенным пациентам, а также целесообразно его применение для снятия явлений интоксикации при лучевой и полихимиотерапии.
Применение реамберина показано как для предоперационной подготовки больных, так и для проведения интенсивной терапии в послеоперационном периоде.
Экспериментальные исследования
эффективности
янтарной кислоты при опухолях
(исследования выполнялись
под руководством профессора В.Н. Анисимова)
янтарной кислоты при опухолях
(исследования выполнялись
под руководством профессора В.Н. Анисимова)
В таблице представлены данные по группам животных, проживших более 470 дней.
Влияние янтарной кислоты на продолжительность жизни
и частоту возникновения опухолей у мышей
|
Показатель |
Контрольная группа животных (Ф.Р) |
Опытная группа животных (ЯК) |
|
Спонтанная продолжительность |
570 |
638 |
|
Число мышей с опухолями (%) |
100.0 |
18.0 |
|
Аденокарцинома молочной |
75.0 |
18.0 |
|
Лейкоз (%) |
4.0 |
- |
|
Максимальная продолжительность |
643 |
839 |
Совокупность проведенных исследований, проведенных под руководством профессора В.Н. Анисимова (НИИ онкологии МЗ РФ) позволяет предполагать, что соль янтарной кислоты, используемая в реамберине может быть эффективным противоопухолевым средством, поскольку при введении янтарной кислоты экспериментальным животным наблюдалось уменьшение частоты спонтанных опухолей и у мышей увеличивалась максимальная продолжительность жизни до 840 дней в опытной группе животных, против 643 дней в контрольной группе животных, в 2 раза снизилась частота развития новообразований (у 39.0% - в опытной группе, против 80.0% - в контрольной группе животных).
Частота спонтанных аденокарцином молочной железы составила 36.0% у мышей, которым вводилась янтарная кислота, против 63.0% мышей контрольной группы, а частота лейкозов соответственно 0% и 16.0%.
Эффект янтарной кислоты на продолжительность жизни и развитие спонтанных новообразований выражен в субпопуляции долгоживущих мышей. Под влиянием ЯК не изменялась средняя продолжительность жизни мышей и не изменялся наклон линейной анаморфозы кривой их выживания, что требует специального объяснения и может быть обусловлено неодинаковостью эффекта янтарной кислоты на животных разного возраста и различным временем возникновения у них опухолей молочной железы. В возрасте 470 дней жизни наблюдался излом линейной анаморфозы выхода опухолей молочной железы, примерно в этот же период отмечен перекрест кривых смертности животных в опытных и контрольных группах. Рассмотрение причин гибели животных до и после этого срока позволяет выявить ряд различий в действии янтарной кислоты на две условно разделенные субпопуляции животных. В субпопуляции кортокоживужих животных (менее 470 дней) наблюдается сокращение средней продолжительности жизни, что обусловлено увеличением частоты пневмоний, а частота возникновения опухолей у них уменьшалась. В субпопуляции долгоживущих мышей (более 470 дней) оба эффекта янтарной кислоты более выражены. Так, на 68 дней увеличилась средняя продолжительность жизни животных и более чем в 5 раз снизилась частота новообразований. Необходимо учесть, что в долгоживущей субпопуляции животных из контрольной группы в 100.0% случаев причиной гибели были опухоли, тогда как в группе животных, получавших янтарную кислоту, они развивались значительно реже и с меньшей множественностью.
Одной из причин отчетливо тормозящего действия возникновения опухолей молочной железы у мышей может быть нормализующее влияние на энергетику митохондрий, пораженных патологическим процессом.
Существенную роль играет нормализующее действие сукцината (ЯК) на энергообеспечение центров нейроэндокринной системы (ЯК способна снижать порог чувствительности гипоталамо-гипофизарной системы к гомеостатическим сигналам). Ряд факторов свидетельствует и в пользу того, что возрастное повышение порога чувствительности гипоталамуса к гомеостатическим стимулам лежит в основе нейроэндокринной программы развития старения и формирования возрастной патологии, включая возникновение опухолей. В пользу этого предположения, свидетельствуют данные В.Н. Анисимова об аналогичном действии ЯК на продолжительность жизни и частоту спонтанных опухолей под влиянием фенформина и дефенина, также обладающих свойством снижать порог чувствительности гипоталамуса к действию эстрогенов.
В.А. Исаков, А.Л. Коваленко, В. Д. Евграфов
НИИ пульмонологии ГМУ им. акад. И.П. Павлова, НТФФ «Полисан»,
НИИ гриппа
РАМН, Санкт-Петербург, Россия
Реамберин в терапии тяжелых форм гриппа
В период эпидемий гриппа, особенно вызванных новыми
разновидностями вирусов, регистрируется значительное число больных
тяжелыми и осложненными формами заболевания, что требует
своевременного проведения комплекса
организационно-противоэпидемических, профилактических и экстренных
лечебных мероприятий. Бесспорно, имеет большое значение разумная
тактика врача на догоспитальном этапе, когда важно правильно
оценить состояние больного, а также как можно раньше выделить
ведущие (или ведущий) клинические синдромы, определяющие тяжелое
течение болезни. Это позволит оказать рациональную медицинскую
помощь (начать проведение патогенетической терапии) и своевременно
госпитализировать больного в стационар.
Больные с тяжелыми формами гриппозной инфекции должны
госпитализироваться в специальные палаты или отделения интенсивной
терапии и реанимации, в которых обеспечивается постоянное врачебное
наблюдение и техническое слежение за функциональным состоянием
жизненно важных органов (определение показателей газов крови и
кислотно-щелочного состояния, гематокрита, электролитов, сахара и
мочевины, свертывающей и противосвертывающей систем крови,
центрального венозного давления и объема циркулирующей крови), а
также вирусологическое, серологическое, бактериологическое,
рентгенологическое и электрокардиографическое исследования [3,
4].
В связи с установленными при гриппе повышенным образованием
активных форм кислорода (АФК) и накоплением продуктов ПОЛ,
нарушением равновесия в системе протеолитического контроля,
развитием вторичного иммунодефицита (в т. ч. интерферонодефицита)
и, как следствие этого, появлением осложнений при гриппозной
инфекции, настоящая статья посвящена совершенствованию методов
комплексной терапии тяжелых форм гриппа, осложненных пневмонией, а
также поражениям нервной системы при вирусных инфекциях.
Лечение больных тяжелыми формами гриппа и ОРЗ представляет
большие трудности: помимо противогриппозных препаратов
(ремантадин, арбидол, полирем), специфических иммуноглобулинов,
препаратов интерферонов, антибиотиков, гормонов, оно включает ряд
других патогенетических средств, действие которых направлено на
коррекцию нарушенных функций организма [1, 5, 6]. Особое
внимание уделялось использованию в комплексной терапии тяжелых и
крайне тяжелых форм гриппа препаратов с антипротеазной и
антиоксидантной активностью, а также средств, повышающих
иммунобиологическую резистентность организма.
В последние годы доказана длительная бессимптомная
перисистенция вируса гриппа А в лейкоцитах крови и носовых
секретах больных людей от 3 недель до 1,5-3 месяцев
[2,3], Эти данные заставляют пересмотреть нашу прежнюю
тактику назначения ремантадина в первые 3 дня болезни. Считаем
возможным использование у таких больных специфических
противогриппозных препаратов (ремантадин, арбидол, рибавирин и др.)
в период разгара заболевания совместно с антибиотиками и другими
патогенетическими средствами [3].
В период эпидемий гриппа при обследовании 24 здоровых лиц и 56
больных с различными формами гриппа А и В (14 - неосложненный
грипп, 28 - грипп, осложненный пневмонией средней тяжести, 14 -
тяжелое течение болезни) была впервые выявлена активация
калликреин-кининовой системы, повышение готовности к коагуляции и
угнетение фибринолитической системы. В остром периоде болезни у
больных обнаружена гиперфибриногенемия и тенденция к
гипотромбоцитемии. Всем больным в комплексную терапию было
назначено внутривенное капельное введение 10000-20000 БД
контрикала. Причем группе больных с среднетяжелым течением
осложненного гриппа биохимическое обследование проведено до
введения контрикала и через 1 час после начала инфузии препарата.
Контрикал способствовал уменьшению спонтанной эстеразной
активности плазмы (СЭАП) в 2 раза, значительному уменьшению
активности прекалликреина и уровня ингибиторов калликреина,
снижал активность плазминогена и повышал уровень
ингибиторов плазмина. Результаты проведенных исследований
свидетельствуют о заинтересованности всех трех систем крови,
ответственных за поддержание гомеостаза как у больных
неосложненным, так особенно осложненным пневмонией гриппом.
Химиотерапия и химиопрофилактика вирусных инфекций является
перспективной и быстроразвивающейся областью вирусологии. Теперь
уже ясно, что с помощью только средств специфической профилактики и
терапии (вакцины, сывороточные препараты, узкоспецифические
противовирусные средства) мы не сможем эффективно бороться не
только против многочисленной группы острых респираторных вирусных
инфекций, но и против гриппа. Поэтому возникла необходимость в
создании высокоэффективных препаратов с широким спектром
антивирусного действия. Этого можно достигнуть, если идти по пути
«нетрадиционной химиотерапии вирусных инфекций» [1].
Препаратами, способными существенно нормализовать
функционально-метаболические нарушения при гриппе, следует
считать, в первую очередь, лекарственные средства с антипротеазной
и антиоксидантной активностью [3-5].
Для инактивации негативного воздействия АФК организм человека
располагает сложной системой антиоксидантной защиты (АОЗ),
состоящей из неферментных и ферментных звеньев. Основным ферментом
специфической АОЗ является супероксиддисмутаза (СОД). Наряду с СОД
активными компонентами АОЗ считают церулоплазмин (ЦП), трансферрин
(ТФ), лактоферрин (ЛФ), которые еще являются факторами
неспецифической резистентносте организма [4].
Новый отечественный антиоксидант реамберин (РБ, НТФФ «Поли-сан»,
Санкт-Петербург) представляет собой 1,5% раствор для инфузий на
основе раствора янтарной кислоты с N-метилглюкамином и
сбалансированного набора микроэлементов - калия, натрия и магния.
Реамберин активирует АО систему ферментов и тормозит процессы ПОЛ
в ишемизированных органах, оказывая мембраностабилизирующее
действие на клетки головного мозга, сердечной мышцы, печени и
почек. РБ обладает выраженным антигипоксантным, детоксицирующим,
антиоксидантным, кардио- и гепатопротекторным действием [5].
Проведена клиническая апробация РБ, который вводили по 300-400 мл
внутривенно капельно 3-5 дней подряд 37 больным неосложненными и
осложненными формами гриппа и ОРЗ. 2 мл 7% раствора олифена (Ол)
вводили 21 больному внутривенно капельно на 400 мл 5% глюкозы 1
раз в сутки 3-5 дней. 20 больных получали витамин Е по 1 капсуле 3
раза в день в течение 8-10 дней, а 18 больных находились на
базисной терапии (БТ).
84% больных гриппом перенесли заболевание в среднетяжелой форме,
а 16% - болели тяжело. Патологический процесс локализовался в
правом легком в 64%, в левом - в 23% двустороннее поражение отмечено в 13%, причем только у тяжелых
больных. Пациенты хорошо переносили инфузии 1,5% раствора
реамберина. Лишь 2 больных пожаловались на легкое преходящее
головокружение, РБ не оказывал негативного воздействия на функции
печени и почек. После 3-5 дней терапии РБ отмечалось выраженное
клиническое улучшение больных по сравнению с Ол, витамином Е и БТ,
синдромы интоксикации и катаральные явления прошли на фоне РБ.
Однако РБ не влиял на продолжительность менингеального синдрома и
рентгенологических изменений в легких.
Впервые в России и СНГ для изучения состояния антиоксидантной
системы (АОС) у больных гриппом и ОРЗ предложено определять
содержание основных металлопротеидов в сыворотке крови - ТФ, ЦП,
ЛФ и СОД. Эти же показатели использовали для оценки эффективности
проводимой специфической антиоксидантной терапии (АОТ) [3,4]. В
наших исследованиях показатели ТФ были снижены во всех группах
больных (1,38-1,40 г/л, см. таблицу). Наиболее высокая амплитуда
повышения ТФ отмечена после применения инфузий РБ и олифена (39,4 и
33,5% соответственно), нежели после витамина Е и БТ (26,3 и 24,2%
соответственно), причем эти различия достоверны (р<0,05). При
обследовании до лечения уровень ЛФ был умеренно повышен в
сыворотках крови всех больных. Применение РБ и Ол способствовало
достоверному снижению ЛФ до нормы. Меньшую АО активность проявляли
витамин Е и БТ.
Содержание сывороточных металлопротеидов у больных неосложненным
и осложненным гриппом с учетом вида терапии показоно в таблице.
В остром периоде показатели ЦП были повышены во всех группах.
Назначение РБ и Ол сопровождалось достоверным и более существенным
снижением ЦП в сыворотках больных. Уровень ЦП оставался повышенным
после лечения у больных III-IV групп, что характеризует
продолжающееся «напряжение» системы АОЗ. Уровень СОД был повышен
до лечения в сыворотках всех групп больных. Повышение ЦП и СОД в
остром периоде болезни указывает на серьезный оксидативный стресс,
потребовавший включения ферментативной АОС, ключевым компонентом
которой является СОД. Изученные антиоксиданты оказывали одинаковое
влияние на показатели СОД.
Активность процессов ПОЛ регистрировали по образованию
вторичных продуктов ПОЛ - малонового диальдегида (МДА). Показано,
что в острый период болезни активность ПОЛ была достаточно
высокой. Терапия РБ, Ол и, меньше, витамином Е приводила к
снижению показателей МДА у больных по сравнению с БТ
(р<0,05).
Таким образом, новый антиоксидант 1,5% раствор реамберина
обладал антиоксидантним и дезинтоксикационным действием,
стабилизировал антиоксидантний потенциал сыворотки крови,
способствовал более легкому течению основного заболевания. В связи
с вышеизложенным реамберин рекомендуется как базовый
патогенетический препарат в комплексной терапии тяжелых больных
вирусными инфекциями.
Литература
- Букринская А.Г., Жданов В.М. Молекулярные основы
патогенности вирусов. М.: Изд-во Медицина, 1991. 255 с.
- 3уeв В.А., Медленные вирусные инфекции человека и
животных. М.: Изд-во Медицина, 1988. 250 с.
- Исаков В.А., Тяжелые формы гриппа (клиника и система
этапного лечения): Автореф. дисс. д-ра мед.наук. СПб., 1996. 46
с.
- Исаков В.А., Туркин В.В., Киселев О.И. и др.
Использование антиоксидантов в терапии гриппа и ОРЗ: Рекомендации для
врачей. СПб., 1996. 51 с.
- Исаков В.А., Сологуб Т.В., Коваленко А.Л., Романцов М.Г.,
Реамберин в терапии критических состоянии. СПб.: Изд-во СП
Минимакс, 2001. 156 с/
- Приказ № 101/46 от 19 апреля 1995 г. О защите населения
от гриппа и других острых респираторных заболеваний. М., 1995. 90
с.
В.А. Исаков, А.Л. Коваленко, Ю.В. Аспель, Г.С. Архипов
НИИ пульмонологии ГМУ им. акад. И.П. Павлова,
НТФФ «Полисан»
(Санкт-Петербург),
ИМО НовГУ им. Ярослава Мудрого (Великий
Новгород), Россия
Современные антиоксидантные препараты
в терапии вирусных инфекций
Процессы воспаления характеризуются значительной миграцией
нейтрофилов в очаг воспаления, «дыхательным взрывом» с
образованием высоких концентраций активных форм кислорода (АФК),
которые являются неспецифическими окислителями [1, 2]. Для
уменьшения неативного влияния оксидативного стресса используют
антиоксиданты. Новый отечественный комплексный состав с
нейропротекторным действием на основе реамберина, содержащий
рибоксин (2%), никотинамид (1%), рибофлавина мононуклеотид натрия
(0,2%), обладает анти-оксидантным и антигипоксическим действием,
оказывая положительный эффект на энергообразованис в клетке,
уменьшая продукцию свободных радикалов, и восстанавливает
активность ферментов антиоксидантной (АО) защиты; активирует
окислительно-восстановительные ферменты дыхательной цепи
митохондрий, ресинтез макроэргов, способствует утилизации глюкозы
и жирных кислот. Препарат обладает антиишемическим действием,
улучшает коронарный и мозговой кровоток, ограничивает зону некроза
и улучшает метаболические процессы в ЦНС, восстанавливая сознание,
рефлекторные нарушения и расстройства чувствительности. В работе
изучали терапевтическую эффективность состава в комплексном
лечении нейроинфекцнй у взрослых.
Клинически, рентгенологически обследованы 45 больных
нейроинфекциями (НИ), госпитализированных в больницу № 2 г.
Великий Новгород, а также 35 допоров. Больные осмотрены
невропатологом, ЛОР-врачом и окулистом.
Электроэнцефалографию (ЭЭГ) мозга проводили на 16-канальном
компьютерном энцефалографе с картированием ЭЭГ трехкратно (при
поступлении, на 5-й и 10-й дни терапии ЦФЛ). Уровень основных
металлопротеидов (МП) в сыворотке крови (СК) и цереброспинальной
жидкости (ЦСЖ) - трансферрина (ТФ), лактоферрина (ЛФ),
церулоплазмина (ЦП) изучали методом радиальной
иммунодуф-фузии в агаровом геле по Манчини (1965), исследовали
содержание СОД плазмы [2].
В основной группе (ОГ) было 25 больных от 18 до 55 лет, которым
кроме базисной терапии (БТ) вводили внутривенно капельно по 10 мл
стерильного раствора, приготовленного ex tempore, на основе
реамбери-на в 200-300 мл 5% глюкозы 1 раз в день 10 дней подряд. 20
больных контрольной группы (КГ) получали лишь БТ. Инъекции
комбинированного состава хорошо переносились больными, побочных
реакций не было, достоверно быстрее проходили основные клинические
симптомы болезни по сравнению с КГ, быстрее санировалась ЦСЖ,
меньше было осложнений ЭЭГ: положительная динамика отмечалась уже
на 5-й день терапии и дальнейшее улучшение функционального
состояния мозга было на 10-й день лечения по сравнению с КГ
(р<0,05). Таким образом, препарат способствует благоприятному
течению и исходу НИ, достоверно повышает антиоксидантный потенциал
потенциал СК и ЦСЖ, а также иммунобиологическую резистентность
организма и может быть рекомендован в комплексной терапии НИ
различной этиологии [2, 4].
Новый отечественный препарат реамберин (РБ, НТФФ «Полисан»)
представляет собой солевой плазмозамещающий раствор на основе
раствора янтарной кислоты с N-метилглюкамином и сбалансированного
набора микроэлементов - натрия, калия и магния [3, 4]. Под
наблюдением находилось 207 больных вирусными гепатитами (ВГ), в
том числе: острый ВГС - 38 человек, хронический ВГС - 32, острый
микст-гепатит В+С - 23 человека, острый ВГВ - 25, ВГ в сочетании с
тяжелой наркоманией - 12, контрольная группа без РБ - 50 больных в
возрасте от 16 до 40 лет обоего пола. Препарат назначали по 300-400
мл внутривенно капельно 1 раз в день 7-10 дней подряд. Проведено
клиническое, биохимическое обследование, определяли содержание
сывороточных металлопротеидов, коэффициент SH/SS (норма 2,5) для
выяснения влияния РБ на АО потенциал сыворотки крови [3, 5].
К 3-5-му дню терапии улучшалось настроение, повышалось качество
жизни и исчезали диспептические явления. К моменту выписки
нормализация размеров печени была у 45% больных (все пациенты на
фоне базисной терапии (БТ) выписались с явлениями гепатомегалии).
Назначение РБ больным острым ВГС к 8-10-му дню лечения
сопровождалось исчезновением желтухи (билирубин общий - 52,2 мкм/л
по сравнению с исходным уровнем 231 мкм/л), а также отмечалась
положительная динамика размеров печени (у 87% против 60% в
контроле). Быстрее нормализовались показатели АлАТ, билирубина,
щелочной фосфатазы, трансферрина (ТФ) и церулоплазмина (ЦП),
уровень SH/SS-rpynn.
На фоне РБ отмечалось улучшение общего самочувствия больных,
уменьшалась интоксикация и у 80% лиц к 5-6-му терапии улучшалось
настроение, повышалось качество жизни и исчезали диспептические
явления. К моменту выписки нормализация размеров печени
креатини-на, а также SH-, SS-групп была у 45% больных. Применение
РБ сопровождалось достоверным увеличением уровня сывороточного ТФ
по сравнению с контролем (на 40 и 26% соответственно),
достоверным снижением концентрации ЦП, что указывает на уменьшение
напряжения ферментативного звена АО системы. Включение инфузий РБ
при лечении 12 больных ВГС на фоне тяжелой наркомании приводило к
стабилизации клинического состояния. Выраженность симптомов
интоксикации значительно уменьшилась. Так, аппетит нормализовался
у 70% (улучшение у 30%), тошнота и рвота исчезли у 88% (стали менее
выражены у 12%), слабость исчезла у 75% (менее выражена у 25%),
сон нормализовался у всех больных. Под влиянием РБ достоверно было
снижение уровня билирубина у 82% больных, повышение билирубина
отмечено у 9% и без динамики показатели билирубина были у 9%
лиц.
Таким образом, РБ оказывал выраженное дезинтоксикационное,
ан-тиоксидантное, гепато- и нефропротекторное действие. Инфузий
1,5% раствора РБ хорошо переносятся больными с различными формами
вирусных гепатитов В и С (аллергических реакций не было). Отмечены
высокая терапевтическая эффективность РБ в комплексной терапии
тяжелых больных ВГ, сокращение сроков госпитализации и уменьшение
числа случаев использования гормонов у пролеченных больных по
сравнению с группой клинического контроля. Использование РБ в
терапии тяжелых больных ВГ наркоманов сопровождалось отчетливым
де-зинтоксикационным эффектом с благоприятным исходом крайне
тяжелых состояний (печеночной комы). В заключение следует
отметить, что инфузий РБ рекомендуется включать как обязательное
патогенетическое средство в комплексную терапию тяжелых больных
различными формами ВГВ и ВГС, а также больных с признаками
полиорганных поражений вследствие экзо-, эндогенного токсикоза
[3].
Была изучена терапевтическая эффективность реамберина при
лечении взрослых больных гриппом и ОРЗ, осложненными
пневмонией. Объектом исследования были больные в возрасте от 18 до
60 лет, госпитализированные в специализированное отделение
респираторных вирусных инфекций взрослых в инфекционных
стационарах Санкт-Петербурга и Великого Новгорода. Всего
обследовано 96 больных. Впервые в эпидемический подъем по гриппу в
1998-1999 гг. применялся реамберин (РБ) при лечении 37 больных
гриппом и ОРЗ, осложненными пневмонией, в дозе 300 мл внутривенно
капельно медленно 1 раз в день, 3-5 дней подряд. При этом 84%
больных перенесли заболевание в среднетяжелой форме и только 16% -
в тяжелой форме (на фоне применения РБ). 21 больной получали кроме
базисной терапии (БТ) олифен, а 20 человек - витамин Е. В группе
клинического контроля на базисной терапии было 18 человек с
аналогичной патологией [2, 3].
Препарат РБ назначался в остром периоде в первые 2-3 дня
госпитализации. Все больные переносили препарат хорошо, кроме
двух пациентов (5,4%), у которых отмечалось легкое головокружение и
чувство тепла, которые вскоре проходили. У одного из этих больных
был отягощенный аллергологический анамнез. Клинико-лабораторные
показатели оценки функции печени и почек (определение сывороточных
АлаТ, АсаТ, билирубина, щелочной фосфатазы, креатинина, мочевины)
были практически сопоставимы с аналогичными показателями в группе
клинического контроля и не указывали на функциональные нарушения
данных органов и систем. До применения препарата больные
жаловались на лихорадку, 37,3-38,3 С° слабость, головную боль,
осиплость голоса, насморк, кашель с мокротой и без, у двоих
наблюдались явления дыхательной и сосудистой недостаточности
(больные с тяжелой формой). После 5 дней курсового применения
препарата РБ большинство больных жалоб не предъявляли,
самочувствие улучшалось, синдромы интоксикации и катаральных
явлений прошли. Однако у 5 больных сохранилась слабость,
катаральные явления, субфебрилитет, сниженный аппетит
Ауекультативно у части больных выслушивались сухие хрипы на фоне
жесткого дыхания, у троих - единичные влажные хрипы. На основании
полученных данных можно сказать, что применение РБ способствовало
уменьшению лихорадки до 7,6 дня, головной боли, в целом - симптомы
интоксикации до 9,8 дня (см. таблицу). Однако применение данного
препарата достоверно не уменьшило продолжительность ме-нингеального
синдрома, рентгенологических изменений в легких (по сравнению с
больными на БТ).
Продолжительность клинических симптомов
у больных гриппом,
осложненным пневмонией
Симптомы
и синдромы
Вид терапии и продолжительность симптомов (в днях)
реамберин
(n=37)
базисная терапия (n=18)
Лихорадка
7,6
9,7*
Интоксикация
9,8
13,2*
Головные боли
3,3
5,0*
Менингеальный синдром
2,5
2,9
Катаральный синдром
10,8
12,7
Продолжительность болезни
23,6
25,4
Примечание: * - р < 0,05.
Преимущественная генерация при гриппе гипохлорида, который
является мощным и неспецифическим окислителем, способным окислять
не только липиды, но и белки, требует переоценки стратегии
антиоксидантной (АО) терапии при гриппе. Классические АО
(а-токоферол и другие) уже применялись ранее, и показан
положительный, но умеренный эффект от их использования. Очевидно,
относительно слабый эффект этих АО обусловлен тем, что они
ингибируют терминальный этап процессов окисления - процессы ПОЛ, и
не могут снизить интенсивность окислительного стресса в целом,
который определяется в основном нейтрофилами. Таким образом,
отмечена хорошая клиническая переносимость и безвредность, а также
высокая терапевтическая эффективность нового отечественного
препарата реамберина при лечении гриппа и ОРЗ, осложненных
пневмонией.
Изучено влияние реамберина и других антиоксидантов на
функциональные изменения миокарда и легких. Во II группе
получавших реам-берин (37 человек) мышечные изменения имелись у 15
человек (40%), нарушения ритма - у 8 человек (20%), сочетанные
нарушения у 3 человек (6,6%). Ухудшение показателей наблюдалось у
3 человек (8,5%), без динамики - 16 человек (43,5%). Восстановление
измененных функций отмечено у 18 человек (48% от всех
обследованных). Показано, что РБ способствовал достоверно более
частой положительной динамике и реже отмечалась негативная
тенденция при анализе изученных показателей. В III группе (9
человек, получавших витамин Е) у 2 человек (22,2%) были изначально
нормальные показатели. Почти у половины (4 человека) были изменения
трофики миокарда, а у 2 - стабильные изменения. В трех случаях
(33,3%) изменения ухудшились к периоду ранней
реконвалесценщш, а у 4 больных (41,7%) - остались без динамики.
Восстановление функций произошло у 2 человек-(25%) из
обследованных больных этой группы. Резюмируя вышесказанное,
следует, что:
- почти у 50% больных (во всех группах) имеются изменения
трофических функций миокарда, а нарушения ритма встречаются
значительно реже;
- самый высокий процент восстановления функций миокарда
встречается в I и II группах, где больные получали олифен и
реамберин. Эти данные свидетельствуют о положительном влиянии
антиоксидантов на восстановление функций миокарда;
- вирус гриппа не всегда вызывает изменения в сердечной
деятельности, т. к. во всех группах почти у трети больных
показатели были нормальными и не менялись с течением
болезни.
При исследовании функции внешнего дыхания (ФВД) показано, что в
I группе (17 человек лечились олифеном) в 2 случаях (11,7%) были
изначально нормальные показатели, у 14 человек (82,3%) было
снижение вентиляционной способности легких (ВСЯ), а 9 человек
(52,9%) имели еще и нарушения со стороны бронхов. Изолированные
нарушения бронхиальной проводимости не встречались. У 3 человек
снижение ВСЛ сочеталось с генерализованной обструкцией. Несмотря на
большое число изменений, значительное улучшение или нормализация
наблюдались у 14 человек (82,3%), и только в 1 случае (5,8%)
отмечали отрицательную динамику.
Во II группе (37 человек - получали РБ) у 12 пациентов (33,3%)
имели место изначально нормальные показатели, 19 человек (53,3%)
-снижение ВСЛ, 12 человек (33,3%) - нарушение проходимости
бронхов. Эти изменения, как правило, были сочетанными, причем
генерализованной обструкции не наблюдалось. К периоде ранней
реконвалесценции ВСЛ восстанавливалась у 22 человек (60% от
обследованных). Лишь у 2 человек (6,6%) имелась отрицательная
динамика. Следовательно, можно отметить положительное влияние РБ и
Ол на восстановление ВСЛ и бронхиальной проходимости (более
короткие сроки) по сравнению с группой клинического контроля
(р<0,05).
Литература
- Исаков В.А. Тяжелые формы гриппа (клиника и система
этапного лечения): Автореф. дисс. д-ра мед. наук. СПб., 1996. 46
с.
- Исаков В.А., Коваленко А.Л., Турки н В.В., Аспель Ю.В. Применение новых иммунотропных и антиоксидантных средств в
терапии гриппа и ОРЗ: Руководство для врачей. СПб-В. Новгород, 2001.
74 с.
- Исаков В.А., Сологуб Т.В., Коваленко А.Л., Романцов М.Г. Реамберин в терапии критических состояний. СПб.: Изд-во СП
Мини-макс, 2001. 156 с.
- Ромапцов М.Г., Сологуб Т.В., Коваленко А.Л.
Реамберин 1,5% для инфузий - применение в клинической практике:
Руководство для врачей. СПб.: Изд-во СП Минимакс, 2000. 97 с.
В период эпидемий гриппа, особенно вызванных новыми разновидностями вирусов, регистрируется значительное число больных тяжелыми и осложненными формами заболевания, что требует своевременного проведения комплекса организационно-противоэпидемических, профилактических и экстренных лечебных мероприятий. Бесспорно, имеет большое значение разумная тактика врача на догоспитальном этапе, когда важно правильно оценить состояние больного, а также как можно раньше выделить ведущие (или ведущий) клинические синдромы, определяющие тяжелое течение болезни. Это позволит оказать рациональную медицинскую помощь (начать проведение патогенетической терапии) и своевременно госпитализировать больного в стационар.
Больные с тяжелыми формами гриппозной инфекции должны госпитализироваться в специальные палаты или отделения интенсивной терапии и реанимации, в которых обеспечивается постоянное врачебное наблюдение и техническое слежение за функциональным состоянием жизненно важных органов (определение показателей газов крови и кислотно-щелочного состояния, гематокрита, электролитов, сахара и мочевины, свертывающей и противосвертывающей систем крови, центрального венозного давления и объема циркулирующей крови), а также вирусологическое, серологическое, бактериологическое, рентгенологическое и электрокардиографическое исследования [3, 4].
В связи с установленными при гриппе повышенным образованием активных форм кислорода (АФК) и накоплением продуктов ПОЛ, нарушением равновесия в системе протеолитического контроля, развитием вторичного иммунодефицита (в т. ч. интерферонодефицита) и, как следствие этого, появлением осложнений при гриппозной инфекции, настоящая статья посвящена совершенствованию методов комплексной терапии тяжелых форм гриппа, осложненных пневмонией, а также поражениям нервной системы при вирусных инфекциях.
Лечение больных тяжелыми формами гриппа и ОРЗ представляет большие трудности: помимо противогриппозных препаратов (ремантадин, арбидол, полирем), специфических иммуноглобулинов, препаратов интерферонов, антибиотиков, гормонов, оно включает ряд других патогенетических средств, действие которых направлено на коррекцию нарушенных функций организма [1, 5, 6]. Особое внимание уделялось использованию в комплексной терапии тяжелых и крайне тяжелых форм гриппа препаратов с антипротеазной и антиоксидантной активностью, а также средств, повышающих иммунобиологическую резистентность организма.
В последние годы доказана длительная бессимптомная перисистенция вируса гриппа А в лейкоцитах крови и носовых секретах больных людей от 3 недель до 1,5-3 месяцев [2,3], Эти данные заставляют пересмотреть нашу прежнюю тактику назначения ремантадина в первые 3 дня болезни. Считаем возможным использование у таких больных специфических противогриппозных препаратов (ремантадин, арбидол, рибавирин и др.) в период разгара заболевания совместно с антибиотиками и другими патогенетическими средствами [3].
В период эпидемий гриппа при обследовании 24 здоровых лиц и 56 больных с различными формами гриппа А и В (14 - неосложненный грипп, 28 - грипп, осложненный пневмонией средней тяжести, 14 - тяжелое течение болезни) была впервые выявлена активация калликреин-кининовой системы, повышение готовности к коагуляции и угнетение фибринолитической системы. В остром периоде болезни у больных обнаружена гиперфибриногенемия и тенденция к гипотромбоцитемии. Всем больным в комплексную терапию было назначено внутривенное капельное введение 10000-20000 БД контрикала. Причем группе больных с среднетяжелым течением осложненного гриппа биохимическое обследование проведено до введения контрикала и через 1 час после начала инфузии препарата. Контрикал способствовал уменьшению спонтанной эстеразной активности плазмы (СЭАП) в 2 раза, значительному уменьшению активности прекалликреина и уровня ингибиторов калликреина, снижал активность плазминогена и повышал уровень ингибиторов плазмина. Результаты проведенных исследований свидетельствуют о заинтересованности всех трех систем крови, ответственных за поддержание гомеостаза как у больных неосложненным, так особенно осложненным пневмонией гриппом.
Химиотерапия и химиопрофилактика вирусных инфекций является перспективной и быстроразвивающейся областью вирусологии. Теперь уже ясно, что с помощью только средств специфической профилактики и терапии (вакцины, сывороточные препараты, узкоспецифические противовирусные средства) мы не сможем эффективно бороться не только против многочисленной группы острых респираторных вирусных инфекций, но и против гриппа. Поэтому возникла необходимость в создании высокоэффективных препаратов с широким спектром антивирусного действия. Этого можно достигнуть, если идти по пути «нетрадиционной химиотерапии вирусных инфекций» [1]. Препаратами, способными существенно нормализовать функционально-метаболические нарушения при гриппе, следует считать, в первую очередь, лекарственные средства с антипротеазной и антиоксидантной активностью [3-5].
Для инактивации негативного воздействия АФК организм человека располагает сложной системой антиоксидантной защиты (АОЗ), состоящей из неферментных и ферментных звеньев. Основным ферментом специфической АОЗ является супероксиддисмутаза (СОД). Наряду с СОД активными компонентами АОЗ считают церулоплазмин (ЦП), трансферрин (ТФ), лактоферрин (ЛФ), которые еще являются факторами неспецифической резистентносте организма [4].
Новый отечественный антиоксидант реамберин (РБ, НТФФ «Поли-сан», Санкт-Петербург) представляет собой 1,5% раствор для инфузий на основе раствора янтарной кислоты с N-метилглюкамином и сбалансированного набора микроэлементов - калия, натрия и магния. Реамберин активирует АО систему ферментов и тормозит процессы ПОЛ в ишемизированных органах, оказывая мембраностабилизирующее действие на клетки головного мозга, сердечной мышцы, печени и почек. РБ обладает выраженным антигипоксантным, детоксицирующим, антиоксидантным, кардио- и гепатопротекторным действием [5]. Проведена клиническая апробация РБ, который вводили по 300-400 мл внутривенно капельно 3-5 дней подряд 37 больным неосложненными и осложненными формами гриппа и ОРЗ. 2 мл 7% раствора олифена (Ол) вводили 21 больному внутривенно капельно на 400 мл 5% глюкозы 1 раз в сутки 3-5 дней. 20 больных получали витамин Е по 1 капсуле 3 раза в день в течение 8-10 дней, а 18 больных находились на базисной терапии (БТ).
84% больных гриппом перенесли заболевание в среднетяжелой форме, а 16% - болели тяжело. Патологический процесс локализовался в правом легком в 64%, в левом - в 23% двустороннее поражение отмечено в 13%, причем только у тяжелых больных. Пациенты хорошо переносили инфузии 1,5% раствора реамберина. Лишь 2 больных пожаловались на легкое преходящее головокружение, РБ не оказывал негативного воздействия на функции печени и почек. После 3-5 дней терапии РБ отмечалось выраженное клиническое улучшение больных по сравнению с Ол, витамином Е и БТ, синдромы интоксикации и катаральные явления прошли на фоне РБ. Однако РБ не влиял на продолжительность менингеального синдрома и рентгенологических изменений в легких.
Впервые в России и СНГ для изучения состояния антиоксидантной системы (АОС) у больных гриппом и ОРЗ предложено определять содержание основных металлопротеидов в сыворотке крови - ТФ, ЦП, ЛФ и СОД. Эти же показатели использовали для оценки эффективности проводимой специфической антиоксидантной терапии (АОТ) [3,4]. В наших исследованиях показатели ТФ были снижены во всех группах больных (1,38-1,40 г/л, см. таблицу). Наиболее высокая амплитуда повышения ТФ отмечена после применения инфузий РБ и олифена (39,4 и 33,5% соответственно), нежели после витамина Е и БТ (26,3 и 24,2% соответственно), причем эти различия достоверны (р<0,05). При обследовании до лечения уровень ЛФ был умеренно повышен в сыворотках крови всех больных. Применение РБ и Ол способствовало достоверному снижению ЛФ до нормы. Меньшую АО активность проявляли витамин Е и БТ.
Содержание сывороточных металлопротеидов у больных неосложненным и осложненным гриппом с учетом вида терапии показоно в таблице.
В остром периоде показатели ЦП были повышены во всех группах. Назначение РБ и Ол сопровождалось достоверным и более существенным снижением ЦП в сыворотках больных. Уровень ЦП оставался повышенным после лечения у больных III-IV групп, что характеризует продолжающееся «напряжение» системы АОЗ. Уровень СОД был повышен до лечения в сыворотках всех групп больных. Повышение ЦП и СОД в остром периоде болезни указывает на серьезный оксидативный стресс, потребовавший включения ферментативной АОС, ключевым компонентом которой является СОД. Изученные антиоксиданты оказывали одинаковое влияние на показатели СОД.
Активность процессов ПОЛ регистрировали по образованию вторичных продуктов ПОЛ - малонового диальдегида (МДА). Показано, что в острый период болезни активность ПОЛ была достаточно высокой. Терапия РБ, Ол и, меньше, витамином Е приводила к снижению показателей МДА у больных по сравнению с БТ (р<0,05).
Таким образом, новый антиоксидант 1,5% раствор реамберина обладал антиоксидантним и дезинтоксикационным действием, стабилизировал антиоксидантний потенциал сыворотки крови, способствовал более легкому течению основного заболевания. В связи с вышеизложенным реамберин рекомендуется как базовый патогенетический препарат в комплексной терапии тяжелых больных вирусными инфекциями.
Литература
- Букринская А.Г., Жданов В.М. Молекулярные основы патогенности вирусов. М.: Изд-во Медицина, 1991. 255 с.
- 3уeв В.А., Медленные вирусные инфекции человека и животных. М.: Изд-во Медицина, 1988. 250 с.
- Исаков В.А., Тяжелые формы гриппа (клиника и система этапного лечения): Автореф. дисс. д-ра мед.наук. СПб., 1996. 46 с.
- Исаков В.А., Туркин В.В., Киселев О.И. и др. Использование антиоксидантов в терапии гриппа и ОРЗ: Рекомендации для врачей. СПб., 1996. 51 с.
- Исаков В.А., Сологуб Т.В., Коваленко А.Л., Романцов М.Г., Реамберин в терапии критических состоянии. СПб.: Изд-во СП Минимакс, 2001. 156 с/
- Приказ № 101/46 от 19 апреля 1995 г. О защите населения от гриппа и других острых респираторных заболеваний. М., 1995. 90 с.
В.А. Исаков, А.Л. Коваленко, Ю.В. Аспель, Г.С. Архипов
НИИ пульмонологии ГМУ им. акад. И.П. Павлова,
НТФФ «Полисан»
(Санкт-Петербург),
ИМО НовГУ им. Ярослава Мудрого (Великий
Новгород), Россия
Современные антиоксидантные препараты
в терапии вирусных инфекций
Процессы воспаления характеризуются значительной миграцией
нейтрофилов в очаг воспаления, «дыхательным взрывом» с
образованием высоких концентраций активных форм кислорода (АФК),
которые являются неспецифическими окислителями [1, 2]. Для
уменьшения неативного влияния оксидативного стресса используют
антиоксиданты. Новый отечественный комплексный состав с
нейропротекторным действием на основе реамберина, содержащий
рибоксин (2%), никотинамид (1%), рибофлавина мононуклеотид натрия
(0,2%), обладает анти-оксидантным и антигипоксическим действием,
оказывая положительный эффект на энергообразованис в клетке,
уменьшая продукцию свободных радикалов, и восстанавливает
активность ферментов антиоксидантной (АО) защиты; активирует
окислительно-восстановительные ферменты дыхательной цепи
митохондрий, ресинтез макроэргов, способствует утилизации глюкозы
и жирных кислот. Препарат обладает антиишемическим действием,
улучшает коронарный и мозговой кровоток, ограничивает зону некроза
и улучшает метаболические процессы в ЦНС, восстанавливая сознание,
рефлекторные нарушения и расстройства чувствительности. В работе
изучали терапевтическую эффективность состава в комплексном
лечении нейроинфекцнй у взрослых.
Клинически, рентгенологически обследованы 45 больных
нейроинфекциями (НИ), госпитализированных в больницу № 2 г.
Великий Новгород, а также 35 допоров. Больные осмотрены
невропатологом, ЛОР-врачом и окулистом.
Электроэнцефалографию (ЭЭГ) мозга проводили на 16-канальном
компьютерном энцефалографе с картированием ЭЭГ трехкратно (при
поступлении, на 5-й и 10-й дни терапии ЦФЛ). Уровень основных
металлопротеидов (МП) в сыворотке крови (СК) и цереброспинальной
жидкости (ЦСЖ) - трансферрина (ТФ), лактоферрина (ЛФ),
церулоплазмина (ЦП) изучали методом радиальной
иммунодуф-фузии в агаровом геле по Манчини (1965), исследовали
содержание СОД плазмы [2].
В основной группе (ОГ) было 25 больных от 18 до 55 лет, которым
кроме базисной терапии (БТ) вводили внутривенно капельно по 10 мл
стерильного раствора, приготовленного ex tempore, на основе
реамбери-на в 200-300 мл 5% глюкозы 1 раз в день 10 дней подряд. 20
больных контрольной группы (КГ) получали лишь БТ. Инъекции
комбинированного состава хорошо переносились больными, побочных
реакций не было, достоверно быстрее проходили основные клинические
симптомы болезни по сравнению с КГ, быстрее санировалась ЦСЖ,
меньше было осложнений ЭЭГ: положительная динамика отмечалась уже
на 5-й день терапии и дальнейшее улучшение функционального
состояния мозга было на 10-й день лечения по сравнению с КГ
(р<0,05). Таким образом, препарат способствует благоприятному
течению и исходу НИ, достоверно повышает антиоксидантный потенциал
потенциал СК и ЦСЖ, а также иммунобиологическую резистентность
организма и может быть рекомендован в комплексной терапии НИ
различной этиологии [2, 4].
Новый отечественный препарат реамберин (РБ, НТФФ «Полисан»)
представляет собой солевой плазмозамещающий раствор на основе
раствора янтарной кислоты с N-метилглюкамином и сбалансированного
набора микроэлементов - натрия, калия и магния [3, 4]. Под
наблюдением находилось 207 больных вирусными гепатитами (ВГ), в
том числе: острый ВГС - 38 человек, хронический ВГС - 32, острый
микст-гепатит В+С - 23 человека, острый ВГВ - 25, ВГ в сочетании с
тяжелой наркоманией - 12, контрольная группа без РБ - 50 больных в
возрасте от 16 до 40 лет обоего пола. Препарат назначали по 300-400
мл внутривенно капельно 1 раз в день 7-10 дней подряд. Проведено
клиническое, биохимическое обследование, определяли содержание
сывороточных металлопротеидов, коэффициент SH/SS (норма 2,5) для
выяснения влияния РБ на АО потенциал сыворотки крови [3, 5].
К 3-5-му дню терапии улучшалось настроение, повышалось качество
жизни и исчезали диспептические явления. К моменту выписки
нормализация размеров печени была у 45% больных (все пациенты на
фоне базисной терапии (БТ) выписались с явлениями гепатомегалии).
Назначение РБ больным острым ВГС к 8-10-му дню лечения
сопровождалось исчезновением желтухи (билирубин общий - 52,2 мкм/л
по сравнению с исходным уровнем 231 мкм/л), а также отмечалась
положительная динамика размеров печени (у 87% против 60% в
контроле). Быстрее нормализовались показатели АлАТ, билирубина,
щелочной фосфатазы, трансферрина (ТФ) и церулоплазмина (ЦП),
уровень SH/SS-rpynn.
На фоне РБ отмечалось улучшение общего самочувствия больных,
уменьшалась интоксикация и у 80% лиц к 5-6-му терапии улучшалось
настроение, повышалось качество жизни и исчезали диспептические
явления. К моменту выписки нормализация размеров печени
креатини-на, а также SH-, SS-групп была у 45% больных. Применение
РБ сопровождалось достоверным увеличением уровня сывороточного ТФ
по сравнению с контролем (на 40 и 26% соответственно),
достоверным снижением концентрации ЦП, что указывает на уменьшение
напряжения ферментативного звена АО системы. Включение инфузий РБ
при лечении 12 больных ВГС на фоне тяжелой наркомании приводило к
стабилизации клинического состояния. Выраженность симптомов
интоксикации значительно уменьшилась. Так, аппетит нормализовался
у 70% (улучшение у 30%), тошнота и рвота исчезли у 88% (стали менее
выражены у 12%), слабость исчезла у 75% (менее выражена у 25%),
сон нормализовался у всех больных. Под влиянием РБ достоверно было
снижение уровня билирубина у 82% больных, повышение билирубина
отмечено у 9% и без динамики показатели билирубина были у 9%
лиц.
Таким образом, РБ оказывал выраженное дезинтоксикационное,
ан-тиоксидантное, гепато- и нефропротекторное действие. Инфузий
1,5% раствора РБ хорошо переносятся больными с различными формами
вирусных гепатитов В и С (аллергических реакций не было). Отмечены
высокая терапевтическая эффективность РБ в комплексной терапии
тяжелых больных ВГ, сокращение сроков госпитализации и уменьшение
числа случаев использования гормонов у пролеченных больных по
сравнению с группой клинического контроля. Использование РБ в
терапии тяжелых больных ВГ наркоманов сопровождалось отчетливым
де-зинтоксикационным эффектом с благоприятным исходом крайне
тяжелых состояний (печеночной комы). В заключение следует
отметить, что инфузий РБ рекомендуется включать как обязательное
патогенетическое средство в комплексную терапию тяжелых больных
различными формами ВГВ и ВГС, а также больных с признаками
полиорганных поражений вследствие экзо-, эндогенного токсикоза
[3].
Была изучена терапевтическая эффективность реамберина при
лечении взрослых больных гриппом и ОРЗ, осложненными
пневмонией. Объектом исследования были больные в возрасте от 18 до
60 лет, госпитализированные в специализированное отделение
респираторных вирусных инфекций взрослых в инфекционных
стационарах Санкт-Петербурга и Великого Новгорода. Всего
обследовано 96 больных. Впервые в эпидемический подъем по гриппу в
1998-1999 гг. применялся реамберин (РБ) при лечении 37 больных
гриппом и ОРЗ, осложненными пневмонией, в дозе 300 мл внутривенно
капельно медленно 1 раз в день, 3-5 дней подряд. При этом 84%
больных перенесли заболевание в среднетяжелой форме и только 16% -
в тяжелой форме (на фоне применения РБ). 21 больной получали кроме
базисной терапии (БТ) олифен, а 20 человек - витамин Е. В группе
клинического контроля на базисной терапии было 18 человек с
аналогичной патологией [2, 3].
Препарат РБ назначался в остром периоде в первые 2-3 дня
госпитализации. Все больные переносили препарат хорошо, кроме
двух пациентов (5,4%), у которых отмечалось легкое головокружение и
чувство тепла, которые вскоре проходили. У одного из этих больных
был отягощенный аллергологический анамнез. Клинико-лабораторные
показатели оценки функции печени и почек (определение сывороточных
АлаТ, АсаТ, билирубина, щелочной фосфатазы, креатинина, мочевины)
были практически сопоставимы с аналогичными показателями в группе
клинического контроля и не указывали на функциональные нарушения
данных органов и систем. До применения препарата больные
жаловались на лихорадку, 37,3-38,3 С° слабость, головную боль,
осиплость голоса, насморк, кашель с мокротой и без, у двоих
наблюдались явления дыхательной и сосудистой недостаточности
(больные с тяжелой формой). После 5 дней курсового применения
препарата РБ большинство больных жалоб не предъявляли,
самочувствие улучшалось, синдромы интоксикации и катаральных
явлений прошли. Однако у 5 больных сохранилась слабость,
катаральные явления, субфебрилитет, сниженный аппетит
Ауекультативно у части больных выслушивались сухие хрипы на фоне
жесткого дыхания, у троих - единичные влажные хрипы. На основании
полученных данных можно сказать, что применение РБ способствовало
уменьшению лихорадки до 7,6 дня, головной боли, в целом - симптомы
интоксикации до 9,8 дня (см. таблицу). Однако применение данного
препарата достоверно не уменьшило продолжительность ме-нингеального
синдрома, рентгенологических изменений в легких (по сравнению с
больными на БТ).
Продолжительность клинических симптомов
у больных гриппом,
осложненным пневмонией
Симптомы
и синдромы
Вид терапии и продолжительность симптомов (в днях)
реамберин
(n=37)
базисная терапия (n=18)
Лихорадка
7,6
9,7*
Интоксикация
9,8
13,2*
Головные боли
3,3
5,0*
Менингеальный синдром
2,5
2,9
Катаральный синдром
10,8
12,7
Продолжительность болезни
23,6
25,4
Примечание: * - р < 0,05.
Преимущественная генерация при гриппе гипохлорида, который
является мощным и неспецифическим окислителем, способным окислять
не только липиды, но и белки, требует переоценки стратегии
антиоксидантной (АО) терапии при гриппе. Классические АО
(а-токоферол и другие) уже применялись ранее, и показан
положительный, но умеренный эффект от их использования. Очевидно,
относительно слабый эффект этих АО обусловлен тем, что они
ингибируют терминальный этап процессов окисления - процессы ПОЛ, и
не могут снизить интенсивность окислительного стресса в целом,
который определяется в основном нейтрофилами. Таким образом,
отмечена хорошая клиническая переносимость и безвредность, а также
высокая терапевтическая эффективность нового отечественного
препарата реамберина при лечении гриппа и ОРЗ, осложненных
пневмонией.
Изучено влияние реамберина и других антиоксидантов на
функциональные изменения миокарда и легких. Во II группе
получавших реам-берин (37 человек) мышечные изменения имелись у 15
человек (40%), нарушения ритма - у 8 человек (20%), сочетанные
нарушения у 3 человек (6,6%). Ухудшение показателей наблюдалось у
3 человек (8,5%), без динамики - 16 человек (43,5%). Восстановление
измененных функций отмечено у 18 человек (48% от всех
обследованных). Показано, что РБ способствовал достоверно более
частой положительной динамике и реже отмечалась негативная
тенденция при анализе изученных показателей. В III группе (9
человек, получавших витамин Е) у 2 человек (22,2%) были изначально
нормальные показатели. Почти у половины (4 человека) были изменения
трофики миокарда, а у 2 - стабильные изменения. В трех случаях
(33,3%) изменения ухудшились к периоду ранней
реконвалесценщш, а у 4 больных (41,7%) - остались без динамики.
Восстановление функций произошло у 2 человек-(25%) из
обследованных больных этой группы. Резюмируя вышесказанное,
следует, что:
- почти у 50% больных (во всех группах) имеются изменения
трофических функций миокарда, а нарушения ритма встречаются
значительно реже;
- самый высокий процент восстановления функций миокарда
встречается в I и II группах, где больные получали олифен и
реамберин. Эти данные свидетельствуют о положительном влиянии
антиоксидантов на восстановление функций миокарда;
- вирус гриппа не всегда вызывает изменения в сердечной
деятельности, т. к. во всех группах почти у трети больных
показатели были нормальными и не менялись с течением
болезни.
При исследовании функции внешнего дыхания (ФВД) показано, что в
I группе (17 человек лечились олифеном) в 2 случаях (11,7%) были
изначально нормальные показатели, у 14 человек (82,3%) было
снижение вентиляционной способности легких (ВСЯ), а 9 человек
(52,9%) имели еще и нарушения со стороны бронхов. Изолированные
нарушения бронхиальной проводимости не встречались. У 3 человек
снижение ВСЛ сочеталось с генерализованной обструкцией. Несмотря на
большое число изменений, значительное улучшение или нормализация
наблюдались у 14 человек (82,3%), и только в 1 случае (5,8%)
отмечали отрицательную динамику.
Во II группе (37 человек - получали РБ) у 12 пациентов (33,3%)
имели место изначально нормальные показатели, 19 человек (53,3%)
-снижение ВСЛ, 12 человек (33,3%) - нарушение проходимости
бронхов. Эти изменения, как правило, были сочетанными, причем
генерализованной обструкции не наблюдалось. К периоде ранней
реконвалесценции ВСЛ восстанавливалась у 22 человек (60% от
обследованных). Лишь у 2 человек (6,6%) имелась отрицательная
динамика. Следовательно, можно отметить положительное влияние РБ и
Ол на восстановление ВСЛ и бронхиальной проходимости (более
короткие сроки) по сравнению с группой клинического контроля
(р<0,05).
Литература
- Исаков В.А. Тяжелые формы гриппа (клиника и система
этапного лечения): Автореф. дисс. д-ра мед. наук. СПб., 1996. 46
с.
- Исаков В.А., Коваленко А.Л., Турки н В.В., Аспель Ю.В. Применение новых иммунотропных и антиоксидантных средств в
терапии гриппа и ОРЗ: Руководство для врачей. СПб-В. Новгород, 2001.
74 с.
- Исаков В.А., Сологуб Т.В., Коваленко А.Л., Романцов М.Г. Реамберин в терапии критических состояний. СПб.: Изд-во СП
Мини-макс, 2001. 156 с.
- Ромапцов М.Г., Сологуб Т.В., Коваленко А.Л.
Реамберин 1,5% для инфузий - применение в клинической практике:
Руководство для врачей. СПб.: Изд-во СП Минимакс, 2000. 97 с.
в терапии вирусных инфекций
Процессы воспаления характеризуются значительной миграцией нейтрофилов в очаг воспаления, «дыхательным взрывом» с образованием высоких концентраций активных форм кислорода (АФК), которые являются неспецифическими окислителями [1, 2]. Для уменьшения неативного влияния оксидативного стресса используют антиоксиданты. Новый отечественный комплексный состав с нейропротекторным действием на основе реамберина, содержащий рибоксин (2%), никотинамид (1%), рибофлавина мононуклеотид натрия (0,2%), обладает анти-оксидантным и антигипоксическим действием, оказывая положительный эффект на энергообразованис в клетке, уменьшая продукцию свободных радикалов, и восстанавливает активность ферментов антиоксидантной (АО) защиты; активирует окислительно-восстановительные ферменты дыхательной цепи митохондрий, ресинтез макроэргов, способствует утилизации глюкозы и жирных кислот. Препарат обладает антиишемическим действием, улучшает коронарный и мозговой кровоток, ограничивает зону некроза и улучшает метаболические процессы в ЦНС, восстанавливая сознание, рефлекторные нарушения и расстройства чувствительности. В работе изучали терапевтическую эффективность состава в комплексном лечении нейроинфекцнй у взрослых.
Клинически, рентгенологически обследованы 45 больных нейроинфекциями (НИ), госпитализированных в больницу № 2 г. Великий Новгород, а также 35 допоров. Больные осмотрены невропатологом, ЛОР-врачом и окулистом. Электроэнцефалографию (ЭЭГ) мозга проводили на 16-канальном компьютерном энцефалографе с картированием ЭЭГ трехкратно (при поступлении, на 5-й и 10-й дни терапии ЦФЛ). Уровень основных металлопротеидов (МП) в сыворотке крови (СК) и цереброспинальной жидкости (ЦСЖ) - трансферрина (ТФ), лактоферрина (ЛФ), церулоплазмина (ЦП) изучали методом радиальной иммунодуф-фузии в агаровом геле по Манчини (1965), исследовали содержание СОД плазмы [2].
В основной группе (ОГ) было 25 больных от 18 до 55 лет, которым кроме базисной терапии (БТ) вводили внутривенно капельно по 10 мл стерильного раствора, приготовленного ex tempore, на основе реамбери-на в 200-300 мл 5% глюкозы 1 раз в день 10 дней подряд. 20 больных контрольной группы (КГ) получали лишь БТ. Инъекции комбинированного состава хорошо переносились больными, побочных реакций не было, достоверно быстрее проходили основные клинические симптомы болезни по сравнению с КГ, быстрее санировалась ЦСЖ, меньше было осложнений ЭЭГ: положительная динамика отмечалась уже на 5-й день терапии и дальнейшее улучшение функционального состояния мозга было на 10-й день лечения по сравнению с КГ (р<0,05). Таким образом, препарат способствует благоприятному течению и исходу НИ, достоверно повышает антиоксидантный потенциал потенциал СК и ЦСЖ, а также иммунобиологическую резистентность организма и может быть рекомендован в комплексной терапии НИ различной этиологии [2, 4].
Новый отечественный препарат реамберин (РБ, НТФФ «Полисан») представляет собой солевой плазмозамещающий раствор на основе раствора янтарной кислоты с N-метилглюкамином и сбалансированного набора микроэлементов - натрия, калия и магния [3, 4]. Под наблюдением находилось 207 больных вирусными гепатитами (ВГ), в том числе: острый ВГС - 38 человек, хронический ВГС - 32, острый микст-гепатит В+С - 23 человека, острый ВГВ - 25, ВГ в сочетании с тяжелой наркоманией - 12, контрольная группа без РБ - 50 больных в возрасте от 16 до 40 лет обоего пола. Препарат назначали по 300-400 мл внутривенно капельно 1 раз в день 7-10 дней подряд. Проведено клиническое, биохимическое обследование, определяли содержание сывороточных металлопротеидов, коэффициент SH/SS (норма 2,5) для выяснения влияния РБ на АО потенциал сыворотки крови [3, 5].
К 3-5-му дню терапии улучшалось настроение, повышалось качество жизни и исчезали диспептические явления. К моменту выписки нормализация размеров печени была у 45% больных (все пациенты на фоне базисной терапии (БТ) выписались с явлениями гепатомегалии). Назначение РБ больным острым ВГС к 8-10-му дню лечения сопровождалось исчезновением желтухи (билирубин общий - 52,2 мкм/л по сравнению с исходным уровнем 231 мкм/л), а также отмечалась положительная динамика размеров печени (у 87% против 60% в контроле). Быстрее нормализовались показатели АлАТ, билирубина, щелочной фосфатазы, трансферрина (ТФ) и церулоплазмина (ЦП), уровень SH/SS-rpynn.
На фоне РБ отмечалось улучшение общего самочувствия больных, уменьшалась интоксикация и у 80% лиц к 5-6-му терапии улучшалось настроение, повышалось качество жизни и исчезали диспептические явления. К моменту выписки нормализация размеров печени креатини-на, а также SH-, SS-групп была у 45% больных. Применение РБ сопровождалось достоверным увеличением уровня сывороточного ТФ по сравнению с контролем (на 40 и 26% соответственно), достоверным снижением концентрации ЦП, что указывает на уменьшение напряжения ферментативного звена АО системы. Включение инфузий РБ при лечении 12 больных ВГС на фоне тяжелой наркомании приводило к стабилизации клинического состояния. Выраженность симптомов интоксикации значительно уменьшилась. Так, аппетит нормализовался у 70% (улучшение у 30%), тошнота и рвота исчезли у 88% (стали менее выражены у 12%), слабость исчезла у 75% (менее выражена у 25%), сон нормализовался у всех больных. Под влиянием РБ достоверно было снижение уровня билирубина у 82% больных, повышение билирубина отмечено у 9% и без динамики показатели билирубина были у 9% лиц.
Таким образом, РБ оказывал выраженное дезинтоксикационное, ан-тиоксидантное, гепато- и нефропротекторное действие. Инфузий 1,5% раствора РБ хорошо переносятся больными с различными формами вирусных гепатитов В и С (аллергических реакций не было). Отмечены высокая терапевтическая эффективность РБ в комплексной терапии тяжелых больных ВГ, сокращение сроков госпитализации и уменьшение числа случаев использования гормонов у пролеченных больных по сравнению с группой клинического контроля. Использование РБ в терапии тяжелых больных ВГ наркоманов сопровождалось отчетливым де-зинтоксикационным эффектом с благоприятным исходом крайне тяжелых состояний (печеночной комы). В заключение следует отметить, что инфузий РБ рекомендуется включать как обязательное патогенетическое средство в комплексную терапию тяжелых больных различными формами ВГВ и ВГС, а также больных с признаками полиорганных поражений вследствие экзо-, эндогенного токсикоза [3].
Была изучена терапевтическая эффективность реамберина при лечении взрослых больных гриппом и ОРЗ, осложненными пневмонией. Объектом исследования были больные в возрасте от 18 до 60 лет, госпитализированные в специализированное отделение респираторных вирусных инфекций взрослых в инфекционных стационарах Санкт-Петербурга и Великого Новгорода. Всего обследовано 96 больных. Впервые в эпидемический подъем по гриппу в 1998-1999 гг. применялся реамберин (РБ) при лечении 37 больных гриппом и ОРЗ, осложненными пневмонией, в дозе 300 мл внутривенно капельно медленно 1 раз в день, 3-5 дней подряд. При этом 84% больных перенесли заболевание в среднетяжелой форме и только 16% - в тяжелой форме (на фоне применения РБ). 21 больной получали кроме базисной терапии (БТ) олифен, а 20 человек - витамин Е. В группе клинического контроля на базисной терапии было 18 человек с аналогичной патологией [2, 3].
Препарат РБ назначался в остром периоде в первые 2-3 дня госпитализации. Все больные переносили препарат хорошо, кроме двух пациентов (5,4%), у которых отмечалось легкое головокружение и чувство тепла, которые вскоре проходили. У одного из этих больных был отягощенный аллергологический анамнез. Клинико-лабораторные показатели оценки функции печени и почек (определение сывороточных АлаТ, АсаТ, билирубина, щелочной фосфатазы, креатинина, мочевины) были практически сопоставимы с аналогичными показателями в группе клинического контроля и не указывали на функциональные нарушения данных органов и систем. До применения препарата больные жаловались на лихорадку, 37,3-38,3 С° слабость, головную боль, осиплость голоса, насморк, кашель с мокротой и без, у двоих наблюдались явления дыхательной и сосудистой недостаточности (больные с тяжелой формой). После 5 дней курсового применения препарата РБ большинство больных жалоб не предъявляли, самочувствие улучшалось, синдромы интоксикации и катаральных явлений прошли. Однако у 5 больных сохранилась слабость, катаральные явления, субфебрилитет, сниженный аппетит Ауекультативно у части больных выслушивались сухие хрипы на фоне жесткого дыхания, у троих - единичные влажные хрипы. На основании полученных данных можно сказать, что применение РБ способствовало уменьшению лихорадки до 7,6 дня, головной боли, в целом - симптомы интоксикации до 9,8 дня (см. таблицу). Однако применение данного препарата достоверно не уменьшило продолжительность ме-нингеального синдрома, рентгенологических изменений в легких (по сравнению с больными на БТ).
Продолжительность клинических симптомов
у больных гриппом,
осложненным пневмонией
|
Симптомы |
Вид терапии и продолжительность симптомов (в днях) |
|
|
реамберин |
базисная терапия (n=18) |
|
|
Лихорадка |
7,6 |
9,7* |
|
Интоксикация |
9,8 |
13,2* |
|
Головные боли |
3,3 |
5,0* |
|
Менингеальный синдром |
2,5 |
2,9 |
|
Катаральный синдром |
10,8 |
12,7 |
|
Продолжительность болезни |
23,6 |
25,4 |
Примечание: * - р < 0,05.
Преимущественная генерация при гриппе гипохлорида, который является мощным и неспецифическим окислителем, способным окислять не только липиды, но и белки, требует переоценки стратегии антиоксидантной (АО) терапии при гриппе. Классические АО (а-токоферол и другие) уже применялись ранее, и показан положительный, но умеренный эффект от их использования. Очевидно, относительно слабый эффект этих АО обусловлен тем, что они ингибируют терминальный этап процессов окисления - процессы ПОЛ, и не могут снизить интенсивность окислительного стресса в целом, который определяется в основном нейтрофилами. Таким образом, отмечена хорошая клиническая переносимость и безвредность, а также высокая терапевтическая эффективность нового отечественного препарата реамберина при лечении гриппа и ОРЗ, осложненных пневмонией.
Изучено влияние реамберина и других антиоксидантов на функциональные изменения миокарда и легких. Во II группе получавших реам-берин (37 человек) мышечные изменения имелись у 15 человек (40%), нарушения ритма - у 8 человек (20%), сочетанные нарушения у 3 человек (6,6%). Ухудшение показателей наблюдалось у 3 человек (8,5%), без динамики - 16 человек (43,5%). Восстановление измененных функций отмечено у 18 человек (48% от всех обследованных). Показано, что РБ способствовал достоверно более частой положительной динамике и реже отмечалась негативная тенденция при анализе изученных показателей. В III группе (9 человек, получавших витамин Е) у 2 человек (22,2%) были изначально нормальные показатели. Почти у половины (4 человека) были изменения трофики миокарда, а у 2 - стабильные изменения. В трех случаях (33,3%) изменения ухудшились к периоду ранней реконвалесценщш, а у 4 больных (41,7%) - остались без динамики. Восстановление функций произошло у 2 человек-(25%) из обследованных больных этой группы. Резюмируя вышесказанное, следует, что:
- почти у 50% больных (во всех группах) имеются изменения трофических функций миокарда, а нарушения ритма встречаются значительно реже;
- самый высокий процент восстановления функций миокарда встречается в I и II группах, где больные получали олифен и реамберин. Эти данные свидетельствуют о положительном влиянии антиоксидантов на восстановление функций миокарда;
- вирус гриппа не всегда вызывает изменения в сердечной деятельности, т. к. во всех группах почти у трети больных показатели были нормальными и не менялись с течением болезни.
При исследовании функции внешнего дыхания (ФВД) показано, что в I группе (17 человек лечились олифеном) в 2 случаях (11,7%) были изначально нормальные показатели, у 14 человек (82,3%) было снижение вентиляционной способности легких (ВСЯ), а 9 человек (52,9%) имели еще и нарушения со стороны бронхов. Изолированные нарушения бронхиальной проводимости не встречались. У 3 человек снижение ВСЛ сочеталось с генерализованной обструкцией. Несмотря на большое число изменений, значительное улучшение или нормализация наблюдались у 14 человек (82,3%), и только в 1 случае (5,8%) отмечали отрицательную динамику.
Во II группе (37 человек - получали РБ) у 12 пациентов (33,3%) имели место изначально нормальные показатели, 19 человек (53,3%) -снижение ВСЛ, 12 человек (33,3%) - нарушение проходимости бронхов. Эти изменения, как правило, были сочетанными, причем генерализованной обструкции не наблюдалось. К периоде ранней реконвалесценции ВСЛ восстанавливалась у 22 человек (60% от обследованных). Лишь у 2 человек (6,6%) имелась отрицательная динамика. Следовательно, можно отметить положительное влияние РБ и Ол на восстановление ВСЛ и бронхиальной проходимости (более короткие сроки) по сравнению с группой клинического контроля (р<0,05).
Литература
- Исаков В.А. Тяжелые формы гриппа (клиника и система этапного лечения): Автореф. дисс. д-ра мед. наук. СПб., 1996. 46 с.
- Исаков В.А., Коваленко А.Л., Турки н В.В., Аспель Ю.В. Применение новых иммунотропных и антиоксидантных средств в терапии гриппа и ОРЗ: Руководство для врачей. СПб-В. Новгород, 2001. 74 с.
- Исаков В.А., Сологуб Т.В., Коваленко А.Л., Романцов М.Г. Реамберин в терапии критических состояний. СПб.: Изд-во СП Мини-макс, 2001. 156 с.
- Ромапцов М.Г., Сологуб Т.В., Коваленко А.Л. Реамберин 1,5% для инфузий - применение в клинической практике: Руководство для врачей. СПб.: Изд-во СП Минимакс, 2000. 97 с.