ВВЕДЕНИЕ
По данным экспертов ВОЗ (1992) от 25 до 33% населения земного
шара страдают аллергическими заболеваниями. Среди аллергических
заболеваний преобладает кожная патология, которая представлена
атопическим дерматитом, имеющим постоянную тенденцию к росту
заболеваемости (А.А. Антонов, К.Н. Суворова, 1985; М.Я. Студеникин,
Т.С. Соколова, 1986; И.И. Балаболкин, 1991; Н.J. Neijens, S. Dreborg, 1995).
В настоящее время атопический дерматит (АД) является одним из
наиболее распространенных и тяжело протекающих дерматозов у детей.
По данным J.M. Hanifin (1987) атопическим дерматитом страдает до
10% детского населения.
Актуальность проблемы определяется не только неуклонным ростом
этого заболевания, но и противоречивостью в оценке различных
патогенетических механизмов его развития и, как следствие, не
всегда эффективными, а подчас неудовлетворительными результатами
лечения (Н.Г. Короткий и соавт., 1996; Y. Hanifin et al., 1996; С. Hauser, 2000).
Считается общепризнанным, что основным механизмом развития
атопического дерматита является иммунный механизм. Однако, атопия
не сводится только к иммунной патологии, а представляет собой
более широкий феномен, который включает как специфические (Ig Е –
опосредованные), так и неспецифические (неиммунные) механизмы
развития (В.И. Пыцкий и соавт., 1999; Н.Г. Короткий и соавт.,
2000). Независимо от степени участия иммунных и неиммунных
механизмов, у больных атопическим дерматитом отмечается
расстройство общего и местного кровообращения. Наличие длительного
спазма артериол и венозного застоя (Ю.К. Скрипкин и соавт., 1986;
М.Л. Юдина, 1997) приводит к выраженным нарушениям
капиллярно-тканевой диффузии, накоплению недоокисленных продуктов в
очагах поражения, способствуя поддержанию воспаления и хроническому
течению заболевания (И.И. Мавров, Б.И. Каруна, 1985; В.А. Волнухин,
1992).
Нарушение микроциркуляции при атопическом дерматите приводит к
недостаточной оксигенации тканей. В этих условиях резко снижается
энергетика клеток и их функциональное состояние. Помимо различных
нарушений на клеточном уровне, происходит активация эндогенных
протео- и липолитических ферментов, усиление процессов перекисного
окисления липидов (ПОЛ) и напряжение антиоксидантных защитных
механизмов. Некоторые авторы (С.С. Жихарев, 1994; Л.М. Леина, 1994)
полагают, что снижение компонентов антиоксидантнои системы может
служить надежным признаком атопического характера заболевания.
Противоречивые результаты некоторых исследований, посвященных
изучению отдельных показателей ПОЛ и АО С при атопическом
дерматите, дают основание провести комплексную оценку этих
механизмов и оценить их роль в патогенезе длительного хронического
воспаления при атопическом дерматите, требующего включения в
комплекс терапевтических мероприятий антигипоксантных и
антиоксидантных препаратов.
Препарат реамберин, в состав которого входит янтарная кислота в
виде N-метиламмония натрия сукцината и сбалансированный набор
микроэлементов – натрия, калия и магния, обладает антиоксидантным и
мембранстабилизирующим действием, причем его активность
значительно возрастает в условиях гипоксии (Е.А. Косенко, 1994;
Ю.Ю. Ивницкий и соавт., 1998).
С учетом вышеизложенного целью исследования явилась комплексная
оценка участия гипоксии в формировании дисбаланса в системе
оксидантной защиты и повреждениях при атопическом дерматите у детей
и корригирующего влияния антиоксидантного и антигипоксантного
препарата реамберин на нарушения многокомпонентной метаболической
системы; разработка показаний и противопоказаний в комплексной
терапии атопического дерматита.
НЕКОТОРЫЕ АСПЕКТЫ
ЭТИОЛОГИИ И ПАТОГЕНЕЗА
АТОПИЧЕСКОГО ДЕРМАТИТА
Наиболее часто аллергические заболевания кожи выявляются в
экологически неблагополучных районах. Вредные вещества,
присутствующие в атмосферном воздухе городов, способствуют росту
заболеваемости, формированию более тяжелой сенсибилизации и
хронизации кожного процесса. Предрасполагающее влияние химических
поллютантов к возникновению аллергических заболеваний, в т.ч.
атопического дерматита, связано с изменением метаболической
активности, снижением барьерной функции внутренних органов по
отношению к чужеродным в антигеном отношении субстанциями,
изменением функционирования иммунной и нейроэндокринной систем,
(И.И. Балаболкин, В.Н. Гребенюк, 1999).
Атопический дерматит по своей сути – аллергическое воспаление
кожи, в основе которого лежит наследственная предрасположенность к
аллергии и Ig Е-опосредованный механизм развития, характеризующийся
стадийной возрастной эволюцией, клиническим полиморфизмом,
склонностью к хроническому течению, обычно с сезонными
обострениями, и развитием сопутствующей патологии, изменений в
различных органах и системах организма.
Если возникновение АД в основном связывают с генетической
обусловленностью и иммунными нарушениями, то клинический
полиморфизм этого заболевания и особенность его течения, названные
факторы хотя и не объясняют, но существенно влияют на них. Выделяют
триаду наиболее значимых патогенетических факторов при АД у
детей:
- нарушение функции центральной и вегетативной нервной систем;
- иммунный дисбаланс;
- нарушение процессов пищеварения и всасывания при изменении
бактериальной микрофлоры и паразитарной инвазии (Н.П. Торопова,
О.А. Синявская, 1993).
Значение пищевой аллергии в развитие атопического дерматита
подтверждается у 87% страдающих им детей, а у 30% детей,
страдающих атопическим дерматитом, выявляется поливалентная
сенсибилизация (И.И. Балаболкин, 1996).
Острые формы атопического дерматита, развивающиеся у 75-82%
детей с наследственной предрасположенностью к атопии, с одной
стороны, являются следствием патофизиологических процессов, а с
другой, пораженные воспалительным процессом участки кожи служат
дополнительным источником образования эндотоксинов, особенно при
осложненной вторичной инфекцией на фоне атопического дерматита. При
хроническом течении атопического дерматита у подростков кожа
служит депо для эндотоксинов.
Н.И. Кузнецов и соавторы (1997) считают, что одним из важных
патогенетически значимых механизмов, обусловливающих тяжесть и
длительность течения атопического дерматита, является синдром
эндогенной интоксикации, который не только сопровождает течение
этого заболевания, но и выступает поддерживающим, усугубляющим
моментом его развития, оказывая повреждающее действие на ткани,
определяя прогноз и исход заболевания. Синдром эндогенной
интоксикации общепатологический синдром с клиническими проявлениями
интоксикации при состояниях, обусловленных накоплением в тканях и
биологических жидкостях продуктов, образующихся в результате
реагирования на повреждающий фактор.
В возникновении и развитии синдрома экзогенной интоксикации
участвуют патогенетические факторы: гипоксия, расстройство
микроциркуляции, накопление метаболитов извращенного обмена
веществ, воздействие эндогенных и бактериальных токсинов,
биологически активных веществ и факторов воспаления. У больных АД
сенсибилизация организма и иммунологические нарушения нередко
развиваются на фоне функциональных изменений центральной нервной
системы, которая оказывает модулирующее влияние на процессы
иммуногенеза (А.М. Черных, Е.П. Фролов, 1982).
Атопический дерматит патогенетически связан с суперактивацией
В-системы иммунитета и ее дисфункцией, выражающейся в
преимущественной секреции антител класса G, не способных давать
протективный эффект, а длительная и стойкая персистенция ЦИК,
образованных низкоавидными антителами, ведет к сенсибилизации
организма и дисфункции Т-хелперов (В.В. Лебедев, 2001).
У детей с атопической конституцией выявлены признаки
дезинтеграции нейроэндокринной регуляции, некоторое снижение
функции гипофизарно-надпочечниковой системы и повышением
функциональной активности щитовидной железы. Эти изменения в
системе нейроэндокринной регуляции сопровождаются нарушением
структурно-функциональных свойств биологических мембран, снижение
соотношения цАМФ/цГМФ в биологических средах и клеточных структурах
за счет уменьшения активности аденилатциклазы и увеличения
активности цАМФ-зависимой фосфодиэстеразы, изменения уровня ПГЕ и
ПГА2α в сыворотке крови, приводящем к изменению
нормального соотношения, указанных простогландинов. Заболевание
характеризуется более упорным течением, происходит неравномерное
увеличение роста, развитие органов и систем, выраженная
перестройка эндокринного аппарата. Усиливается гормональная функция
гипоталамуса, гипофиза, щитовидной железы. Вилочковая. железа
заканчивает свою инволюцию, интенсивнее становится функция половых
желез, гормоны которых начинают подавлять деятельность щитовидной
железы. Развивается адреналиновая система надпочечников,
усиливается функция островкового аппарата поджелудочной железы. В
этот период у мальчиков активизируется синтез андрогенов. У девочек
усиливаются нейроэндокринные влияния центров гипоталамуса, которые
через либерины стимулируют синтез и освобождение гонадотропных
гормонов и гипофиза, обнаруживается активация эстрогенообразования
в яичниках.
Вероятно, именно эта наивысшая напряженность нейросекреторных
процессов в гипоталамусе (по сравнению с другими периодами жизни
женщины) объясняет более высокую заболеваемость и более торпидное
течение атопического дерматита у девочек в этом возрасте.
ФАРМАКОЛОГИЧЕСКАЯ АКТИВНОСТЬ
1,5% РАСТВОРА РЕАМБЕРИНА
НА ОСНОВЕ ЯНТАРНОЙ КИСЛОТЫ
Реамберин 1,5% раствор для инфузий – сбалансированный
изотонический детоксицирующий инфузионный раствор с
антигипоксическим действием. Оказывает положительный эффект на
аэробные биохимические процессы в клетке и восстанавливает
энергетический потенциал клеток. Препарат активирует
ферментативные процессы цикла Кребса, улучшает тканевое дыхание и
повышает детоксицирующую функцию печени, нормализует
кислотно-щелочной баланс и газовый состав крови.
Основным активным компонентом реамберина является N-метиламмония
натрия сукцинат. В физиологических условиях ЯК диссоциирована,
поэтому название ее аниона – сукцинат, часто применяют как синоним
термина «янтарная кислота». Янтарная кислота, ее соли и эфиры –
сукцинаты представляют собой универсальный внутриклеточный
метаболит, участвующий в обменных реакциях организма, являясь
малотоксичным соединением, не обладающим мутагенным и тератогенным
действием.
Превращение ЯК в организме связано с продукцией энергии,
необходимой для обеспечения жизнедеятельности. При возрастании
нагрузки на любую из систем организма, поддержание ее работы
обеспечивает преимущественно за счет окисления ЯК. Мощность
системы энергопродукции, использующей ЯК, в сотни раз превосходит
все другие системы энергообразования организма. Это и
обеспечивает широту диапазона неспецифического терапевтического
действия ЯК и ее солей.
Биологическое значение феномена быстрого окисления сукцината в
цитоплазме клеток заключается в быстром ресинтезе клетками АТФ и в
повышении их антиоксидантной резистентности.
Кроме того, сукцинат положительно влияет на оксигенацию
внутренней среды, стабилизирует структуру и функциональную
активность митохондрий, являясь индуктором синтеза некоторых
белков, влияя на ионный обмен в клетке.
Исследования показали наличие у янтарной кислоты биологической
активности с уникальным сочетанием проявлений: по отношении к
здоровому организму сукцинаты выступают в роли адаптагенов и
актопротекторов, а при наличии патологических проявлений нетипично
высокий для адаптагенов терапевтический эффект.
Окисление ЯК в реакции цикла Кребса осуществляется с помощью
специфического фермента – сукцинат дегидрогеназы, характерной
особенностью которой является локализация на внутренней мембране
митохондрий и независимость ее активности от концентрации
окисленной и восстановленной форм НАДН+/НАД, что позволяет
сохранить энергосинтезирующую функцию митохондрий в условиях
гипоксии при нарушении НАД-зависимого дыхания клеток; выполняя
каталитическую функцию по отношению к циклу Кребса ЯК снижает
концентрацию в крови интермедиатов цикла – лактата, пирувата и
цитрата, накапливающихся в клетках на ранних стадиях гипоксии.
Янтарная кислота нормализует содержание гистамина и серотонина в
крови и повышает микроциркуляцию в органах и тканях Экзогенное
поступление в организм ЯК нормализует активность сукцинат
дегидрогеназы, Противоишемический эффект ЯК связан не только с
активацией сукцинат дегидрогеназного окисления, но и с
восстановлением активности ключевого фермента дыхательной цепи
митохондрий цитохромоксидазы.
ЯК снижает уровень свободно радикальных процессов в мозге и
сыворотке крови, ослабляет деструкцию мембранных элементов нейронов
и способствует восстановлению функций мозга.
Повышение трансмебранного градиента концентрации кислорода и
снижение оксигенации ядра и цитоплазмы свидетельствует о
способности ЯК интенсифицировать диффузию кислорода в различные
ткани и органы, стимулируя при этом клеточное дыхание (так прирост
скорости потребления кислорода клетками печени при добавлении ЯК
увеличивается в 60 раз) Способность ЯК интенсифицировать
утилизацию кислорода тканями и восстановление НАД-зависимого
клеточного дыхания характеризуют ее антигипоксическое действие.
Восстановление пула пиримидиновых динуклеотидов приводит к
увеличению концентрации восстановленного глутатиона и усилению
устойчивости митохондрий к перекисной деградации,
стимулированной ксенобиотиками, при этом, ЯК под действием
сублетальных доз активного генератора радикальных частиц – нитрита
натрия полностью нивелирует блокирование дыхательной цепи
митохондрий.
Характеристика препарата
Реамберин
Реамберин – 1,5% р-р для инфузий представляет собой хорошо
сбалансированный полиионный раствор с добавлением янтарной кислоты
содержащий:
- натрия хлорида - 6,00 г
- калия хлорида - 0,3 г
- магния хлорида - 0,12 г
- N-метиламмония натрия сукцината - 15,0 г
- вода для инъекций - до 1 л
Ионный состав раствора:
- натрия ммоль - 142,4
- калия ммоль - 4,0
- магния ммоль - 1,2
- хлорида ммоль - 109,0
- сукцината N-метилглюкаммония - 44,7 ммоль
Осмолярность и рН 1,5% раствора реамберина
Нормальная осмолярность плазмы крови человека колеблется от 275
до 310 мосм/кг, составляя в среднем – 290 мосм/кг. Реамберин в
виде 1,5% раствора является сбалансированным препаратом
с осмолярностью, приближенной к нормальной осмолярности плазмы
крови человека, т. е. изотоническим раствором и слабощелочным, в
пределах нормальных значений рН для крови.
Основной фармакологический эффект препарата обусловлен
способностью усиливать Компенсаторную активацию аэробного
гликолиза, снижать степень угнетения окислительных процессов в
цикле Кребса в дыхательной цепи митохондрий клеток с увеличением
внутриклеточного фонда макроэргических соединений АТФ и
креатинфосфата.
Натрия хлорид – оказывает дезинтоксикационное и
регидратирующее действие. Ионы натрия и хлора поддерживают
соответствующее осмотическое давление плазмы крови и внеклеточной
жидкости. Изотонический раствор восполняет дефицит жидкости в
организме при дегидратации.
Магния хлорид – магний в межклеточной жидкости регулирует
нервно мышечную проводимость и влияет на передачу импульса от нерва
на мышцу, участвует в синтезе ацетилхолина и при уменьшение его
количества возникает повышенная нервно-мышечная раздражимость
(магниевая тетания).
Калия хлорил – калий является основным внутриклеточным
ионом, подобно тому, как главным внеклеточным ионом является
натрий. Взаимодействие этих ионов имеет важное значение в
поддержании изотоничности клеток.
Калий участвует в процессе проведения нервных импульсов и
передачи их на иннервируемые органы.
Калий необходим также для осуществления сокращений скелетных
мышц.
Калия хлорид оказывает умеренное диуретическое
действие.
Антигипоксическое действие реамберина
Сукцинат натрия (янтарная кислота) по клинической классификации
относится к субстратным антигипоксантам.
Повышение устойчивости к гипоксии проявляют
энергообеспечивающие интермедиаты цикла Кребса – фумаровая,
лимонная и янтарная кислоты. Включаясь в энергетический обмен как
субстраты, они направляют процессы окисления по наиболее
экономичному пути.
При гистотоксической гипоксии, вызванной фторидом натрия,
происходит блокада гликолиза, но при этом дыхательная – цепь
продолжает функционировать. Реамберин, как субстрат цикла Кребса,
активирует процессы окисления, поставляющие электроны для
дыхательной цепи митохондрий. Реамберин удлиняет продолжительность
жизни животных, находящихся в условиях гистотоксической гипоксии,
обеспечивая необходимый для жизнедеятельности клеток синтез
макроэргов.
Антитоксическое действие реамберина
Одним из ведущих синдромов интоксикации является гипоксия,
поэтому изучение антигипоксантов в качестве средств
патогенетической терапии экзогенной и эндогенной интоксикации
актуально.
Реамберин оказывает гепатозащитное действие, сопоставимое с
эффектами известного гепатопротектора карсила, снижает
продолжительность процессов ПОЛ, препятствует истощению запасов
гликогена в гепатоцитах и препятствует повышению концентрации
билирубина в сыворотке крови, что свидетельствует о защитном
действии реамберина на микросомальную ферментативную систему
печени.
Фармакокинетика
Изучение фармакокинетики 1,5% раствора реамберина показало, что
при внутривенном введении препарата, в дозе 5 мг/кг (янтарной
кислоты) массы тела, максимальный уровень препарата в крови
наблюдается на первой минуте после введения, со снижением (до
уровня 9-10 мкг/мл), а через 40 минут после введения концентрация
препарата в крови возвращается к значениям близким к фоновым (от 1
до 6 мкг/мл янтарной кислоты).
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
БОЛЬНЫХ АТОПИЧЕСКИМ ДЕРМАТИТОМ
Под наблюдением в отделении дерматоаллергологии Российской
детской клинической больницы находилось 112 детей, страдающих
атопическим дерматитом, в возрасте от 10 до 15 лет. У всех детей
диагноз «атопический дерматит» был поставлен на основании
совокупности диагностических критериев, сформулированных и
основанных на работах Hanifin и Rajka (1980), дополненных и
признанных как международные Британской группой специалистов в
1994 году.
У всех детей заболевание носило упорный, хронически
рецидивирующий характер. Пациенты с давностью заболевания более 3,5
лет неоднократно получали традиционное лечение в амбулаторных
условиях и стационарах, которое включало антигистаминные препараты
(супрастин, тавегил, кларитин), гипосенсибилизирующие средства
(препараты кальция, тиосульфат натрия), седативные препараты
(седативные микстуры, ново-пассит, нередко – транквилизаторы),
ферментные препараты (фестал, мезим – форте, панзинорм),
витаминотерапию. Наружно использовались мази и пасты с ихтиолом,
нафталаном, различные смягчающие и увлажняющие кремы, а также мази
и кремы, содержащие стероидные препараты.
Однако, проводимая терапия в большинстве случаев была
малоэффективной, и вскоре после окончания лечения наступали
рецидивы заболевания.
Средняя продолжительность ремиссии до 1 месяца была
констатирована у 24,1%, от 1 до 3 месяцев – у 61,6%, а от 4 до 6
месяцев – у 10,7% , пациентов, более 6 месяцев лишь – у 3,6%
больных. У 71,4% больных – обострения наступали в осенне-зимний и
зимне весенний периоды с более или менее выраженным улучшением
кожного процесса в летнее время. Ухудшение атопического дерматита
в летний период было отмечено в 28,6% случаев. Длительный,
непрерывно – рецидивирующий характер течения заболевания наблюдался
у 21% подростков. Первые проявления атопического дерматита у 68,7%
больных возникли на 1-м году жизни, а у 31,3% только после
окончания грудного возраста.
У большинства наблюдаемых детей (62,6%) был выявлен
положительный семейно – наследственный анамнез по атопии: по линии
матери – в 25% случаев, по линии отца – в 17,9%, по линии обоих
родителей – в 13,4%, а по линии братьев и сестер – у 6,3%
наблюдаемых, у ближайших родственников – у 8,9% пациентов.
Сопутствующие заболевания отмечены у 82,1% обследуемых детей.
Среди них чаще всего встречались заболевания желудочно-кишечного
тракта – в 68,8% случаев, невротические реакции и вегето-сосудистые
расстройства – у 59,8% наблюдаемых, бронхиальная астма – у 29,8%
пациентов, эндокринопатии – в 10,7% случаев, риниты и
конъюнктивиты – в 9,8% случаев.
Группу больных – группу с легкой степенью тяжести течения
заболевания (kS до 20) – составили 24 больных детей (14 мальчиков
и 10 девочек), со средним значением kS = 17 в целом по группе.
Во II группу вошли 51 пациент со средней степенью тяжести
кожного процесса (kS от 20 до 40). Количество девочек здесь
составило 34, а мальчиков – 17 человек, что вместе составило 45,5%
от общего числа наблюдаемых нами детей. Значение kS в среднем по
группе равно 38. 37 человек (10 мальчиков и 27 девочек) составили
III группу больных с тяжелым течением заболевания (kS > 40).
Среднее значение kS в этой группе равнялось 69.
Таблица 1. Возможные причины развития заболевания
атопическим дерматитом у детей
|
Возможные причины заболевания
|
Возраст
|
Всего
|
|
До 1 года
|
Старше года
|
|
Абс.
|
%
|
Абс.
|
%
|
Абс.
|
%
|
|
Искусственное вскармливание или введение прикорма
|
59
|
52,7
|
-
|
-
|
59
|
52,7
|
|
Профилактические прививки
|
8
|
7,1
|
2
|
1,8
|
10
|
8,9
|
|
Перенесенные заболевания и медикаментозная терапия
|
7
|
6,3
|
7
|
9,8
|
18
|
16,1
|
|
Нервно-конфликтные (стрессовые) ситуации
|
-
|
-
|
13
|
11,6
|
13
|
11,6
|
|
Неустановленные причины
|
5
|
3
|
7
|
7,5
|
12
|
10,7
|
|
Всего
|
79
|
68,7
|
33
|
31,3
|
112
|
100
|
Для объективной оценки степени тяжести течения заболевания и
эффективности проводимой терапии использован коэффициент SCORAD,
учитывающий площадь поражения кожи, степень выраженности
объективных и субъективных симптомов.
В соответствии с полученными значениями коэффициента SCORAD
наблюдаемые больные разделены на 3 группы (табл. 2) по степени
тяжести течения кожного процесса.
Таблица 2. Распределение больных
по степени тяжести атопического дерматита (SCORAD)
|
Группы больных / Степень тяжести забо-
левания (kS)
|
Ср. знач. kS по груп-
пе
|
Мальчики
|
Девочки
|
Кол-во больных в группе
|
|
Абс.
|
%
|
Абс.
|
%
|
Абс.
|
%
|
|
I
Легкая
(0-20)
|
17
|
14
|
12,5
|
10
|
8,9
|
24
|
21,4
|
|
II
Средняя
(20-40)
|
38
|
17
|
15,2
|
34
|
30,4
|
51
|
45,5
|
|
III
Тяжелая (>40)
|
69
|
10
|
8,9
|
27
|
24,1
|
37
|
33,1
|
|
Общее количество больных АД
|
41
|
366
|
71
|
63,4
|
112
|
100
|
Проведенное обследование больных, включающее углубленный сбор
аллергологического анамнеза, клинический осмотр, оценку тяжести
течения заболевания (коэффициент SCORAD), позволило выделить
общепринятые клинические формы атопического дерматита:
эритемо-сквамозная с лихенификацией – 55 человек (49,1%) и
лихеноидная – 32 человек (28,6%) формы атопического дерматита.
Таблица 3. Распределение больных атопическим дерматитом
по степени тяжести заболевания
Результаты изучения процессов ПОЛ
и компонентов антиоксидантной системы
у больных атопическим дерматитом
Одним из важных патогенетических механизмов атопического
дерматита являются нарушения кровообращения и микроциркуляции с
формированием спазма артериол, венозного застоя, нарушением
транскапиллярного обмена. По напряжению кислорода в коже, скорости
его доставки и утилизации можно судить о степени развития гипоксии
и прогнозировать степень дальнейшего повреждения (Л.В. Епишева,
1992; Е.Т. Маруденко, 1998).
Оценивался кислородный режим в очагах поражения и в
непораженной коже у детей с различной степенью тяжести
атопического дерматита. У больных атопическим дерматитом исходное
напряжение кислорода (рО2 исх.) в очагах поражения и в
непораженной коже было достоверно ниже, чем у детей в контрольной
группе.
Анализ полученных данных свидетельствовал о развитии
генерализованной гипоксии у больных атопическим дерматитом,
причем развитие гипоксического состояния сопровождалось
уменьшением доставки кислорода, снижением способности к его
утилизации. Тяжесть гипоксии также зависела от рО2 и
коррелировала с тяжестью течения атопического дерматита. При
тяжелом течении атопического дерматита у больных не выявлено
статистически достоверных различий показателей в очагах поражения и
в непораженной коже, свидетельствуя в пользу развития
генерализованной гипоксии.
Таким образом, наличие гипоксии в коже, коррелирующее со
степенью тяжести атопического дерматита, может служить одним из
ключевых факторов активации процессов ПОЛ, приводящим к
значительным повреждениям.
Перекисное окисление липидов – универсальный механизм
повреждения клеток; играет ключевую роль в патогенезе многих
заболевании, в том числе и атопического дерматита (Е.И. Прахин и
соавт., 1997).
Таблица 4. Результаты полярографического исследования
кислородного режима кожи у детей различной степени тяжести
атопического дерматита после проведенной терапии реамберином
Состояние процессов ПОЛ оценивалось по степени окисленности
липидов, содержанию первичных (диеновых конъюгатов – ДК) и
вторичных продуктов (малонового диальдегида – МДА) ПОЛ в сыворотке
крови у детей, больных атопическим дерматитом различной степени
тяжести.
У всех детей с различной степенью тяжести атопического
дерматита степень окисленности липидов, а также содержание
диеновых конъюгатов и малонового диальдегида выше, по сравнению с
контрольными значениями (табл. 5). Следовательно, у больных
атопическим дерматитом процессы перекисного окисления липидов
протекают значительно интенсивнее, чем у здоровых детей той же
возрастной группы, свидетельствуя о высокой активности липидной
пероксидации при атопическом дерматите.
Таблица 5. Оценка интенсивности процессов ПОЛ
у детей с различной степенью тяжести атопического дерматита
|
Группа и число больных
|
СО
(усл. ед.)
|
Дк
(Д233/мл.мг)
|
МДА
(нмоль/мл)
|
|
I группа,
n = 24
|
0,64 ± 0,04*
|
1,31 ± 0,04*
|
2,71 + 0,06*
|
|
II группа,
n = 51
|
0,83 ± 0,04* **
|
1,60 ± 0,07* **
|
2,87 ± 0,04* **
|
|
III группа,
n = 37
|
0,97 ± 0,03* **
|
1,73 ± 0,03* **
|
2,96 ± 0,05* **
|
|
Контроль,
n = 40
|
0,54 ± 0,02
|
0,62 ± 0,03
|
1,24 ± 0,07
|
Р1 < 0,05 - по сравнению с контролем;
** р2 < 0,05 - по сравнению с I группой.
Оценка состояния некоторых
компонентов
антиоксидантной системы
у больных с различной степенью тяжести
атопического дерматита
Важнейшим представителем АОС является жирорастворимый
антиоксидант α-токоферол, эффективно ингибирующий процессы
перекисного окисления липидов. Одним из основных сывороточных
антиоксидантов (АО), предотвращающих неконтролируемую
липопероксидацию является церулоплазмин. Общая антиокислительная
активность (АОА) сыворотки также отражает состояние антиоксидантной
защиты организма. Эти показатели изучены у больных с различной
степенью тяжести атопического дерматита и проведен анализ степени
дисбаланса в системе ПОЛ/АОЗ, с применением интегрального
показателя К.
Содержание ±-ТФ, ЦП и общей АОА сыворотки у больных II группы
(средняя степень тяжести) было ниже, чем в контрольной группе и
ниже, чем у больных I группы с легкой степенью тяжести. Коэффициент
К превышала контрольные значения в 4,4 раза (табл. 6).
У больных III группы (тяжелое течение) уровни ±-ТФ и ЦП были
ниже, чем у больных в контрольной группы, а среди больных I и II
группы, показатель общей АОА сыворотки – в 1,4 раза ниже уровня
контрольных значений, при этом коэффициент К в 6,2 раза превышает
уровень нормы.
Таблица 6. Результаты исследования
компонентов антиоксидантной системы у больных
атопическим дерматитом различной степени
|
Группа и число больных
|
α-ТФ
(мкг/мл мг)
|
ЦП
(мг/100 мл)
|
Общая АОА
(мМ, аск.ед)
|
К
(усл. ед.)
|
|
I группа,
n=24
|
4,01 + 0,48
|
28,81 ± 1,9
|
1,10 + 0,11
|
2,98 ± 0,16*
|
|
II группа,
n=51
|
2,1 ± 0,09* ***
|
25,26 ± 1,3* ***
|
0,71 ± 0,08* ***
|
4,86 ± 0,19*
|
|
III группа,
n=37
|
1,7 + 0,19* **
|
24,32 ± 2,2* **
|
0,64 + 0,09* **
|
6,91 ± 0,08*
|
|
Контроль,
n=40
|
3,24 + 0,35
|
31,80 + 2,1
|
0,91 ± 0,09
|
1,12 + 0,10
|
* р1 < 0,05 различия достоверны по сравнению с
контролем;
** р2< 0,05 по сравнению с I и II группой;
*** р3< 0,05 по сравнению с I группой.
Таким образом, установлено снижение антиоксидантных механизмов
у больных атопическим дерматитом с выраженным дисбалансом в
системе ПОЛ/АОС (К) при средней степени тяжести и тяжелом течении
дерматоза.
Клиническая эффективность реамберина
в терапии атопического дерматита
Учитывая результаты исследований кислородного режима кожи,
процессов ПОЛ и состояния АО С у больных атопическим дерматитом
различной степени тяжести, применение реамберина было
патогенетически обосновано и направлено на коррекцию метаболических
нарушений.
Схема применения 1,5% раствора реамберина
Препарат вводился внутривенно капельно, 1-я и 2-я инфузии –
через день, затем – 2 раза в неделю. Всего 5 инфузий. Доза
препарата назначалась из расчета 10 мл 1,5% раствора
натрий-метилглюкаминовой соли янтарной кислоты на килограмм массы
ребенка.
Все дети получали следующее лечение: гипоаллергенная диета,
антигистаминные препараты (супрастин, тавегил, фенкарол) 1-2 раза в
день в течение всего времени пребывания в стационаре.
Наружно на очаги поражения наносили индифферентные и смягчающие
кожу кремы – крем Унны, крем «Роса», «Тик-Так».
Оценивалась динамика клинических проявлений SCORAD у детей с
различной степенью тяжести атопического дерматита в процессе
проводимой терапии на 5-й, 10-й, 15-й и 20-й день лечения.
После первой инфузии у всех детей (I группа KS = 17)
практически полностью прекратился зуд в дневное время, и
значительно уменьшилась его интенсивность в ночное время.
После второй инфузии на коже отсутствовали следы расчесов и
геморрагические корочки, побледнела эритема. После пятой инфузии
полностью прекратилось шелушение, уменьшилась сухость кожи,
отсутствовала инфильтрация, улучшилось настроение и аппетит.
Констатирована клиническая ремиссия у 24 детей I группы.
В группе больных средней степени тяжести атопического дерматита
также наблюдалась положительная динамика на фоне проводимой
терапии. У 42 больных из 51 после двух инфузий реамберина зуд в
дневное время полностью прекратился, значительно побледнела
эритема и уменьшилось шелушение. После третьей инфузии реамберина
у 38 больных на коже не было следов расчесов, эритема полностью
разрешилась, при этом сохранялись очаги лихенификации, а также
небольшая сухость кожи и шелушение в периорбитальных областях,
нормализовался сон.
Клиническая ремиссия констатирована у 33 детей со средней
степенью тяжести атопического дерматита (II группа больных), кожа
была чистой, зуд не беспокоил.
У 13 больных этой группы наблюдалось значительное улучшение
(нормализация сна, отсутствие зуда, регресс воспалительных
инфильтрированных очагов, но сохранялась пигментация в
периорбитальных областях, а в бывших очагах поражения отмечалось
легкое шелушение).
У 5 больных отмечено улучшение (прекращение зуда, исчезновение
воспалительных явлений в очагах поражения, уменьшении сухости и
шелушения, но сохранялась легкая инфильтрация в области
лучезапястных суставов и явления хейлита).
В III группе (n = 37) больных (тяжелое течение, kS = 69),
применение реамберина привело к интенсивному снижению kS и
клинических проявлений атопического дерматита.
После двух инфузий реамберина значительно уменьшился зуд и
эритема, улучшился сон у 33 из 37 больных. После третьей инфузий
отмечалось уменьшение сухости кожи и шелушения.
Констатирована клиническая ремиссия у 23 из 37 больных. У 10
отмечено значительное улучшение (полностью прекратился зуд, исчезла
инфильтрация, но сохранялось легкое шелушение на месте бывших
высыпаний, заслуживает факт более быстрого регресса на фоне
применения реамберина клинических проявлений атопического
дерматита в тех случаях, когда течение воспалительного процесса
сопровождалось бактериальными осложнениями). Лечение реамберином
одного ребенка с тяжело протекающим атопическим дерматитом не
сопровождалось выраженной динамикой клинических проявлений. Однако
и в этом случае улучшился сон, и несколько уменьшилась
интенсивность зуда.
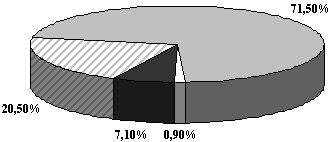
Рис. 1. Клиническая эффективность реамберина
Лечение реамберином привело к клинической ремиссии у 80 больных
(71,5%), значительное улучшение отмечено у 23 больных (20,5%), у 8
детей (7,1%) констатировано улучшение в течении заболевания и лишь
у 1 ребенка (0,9%) выраженного эффекта от проведенной терапии не
было.
Таким образом, продемонстрирована высокая клиническая
эффективность реамберина. Терапия не сопровождалась осложнениями
и побочными явлениями, хорошо переносилась больными.
Влияние реамберина на показатели
напряжения кислорода
и состояние АОС у больных атопическим дерматитом
Изучена динамика показателей кислородного режима кожи, процессов
ПОЛ и АОС после проведенной терапии реамберином.
У детей I и II группы РО2 после проведенной терапии повысилось
и не отличалось от контрольных значений. В III группе напряжение
кислорода под влиянием реамберина также увеличилось, по сравнению
исходным уровнем, но оставалось несколько ниже контрольного.
Скорость доставки кислорода (Vt) у детей I группы превышала
значение этого показателя до лечения и у детей в контрольной
группе, а у больных III-й группы скорость доставки кислорода
повысилась в 1,4 раза, но оставалась ниже, чем у больных в
контрольной группе.
Скорость потребления кислорода (V2) после лечения реамберином у
больных I группы превышала уровень контрольных значений. Во II
группе этот показатель под влиянием терапии нормализовался. После
проведенной терапии у больных III группы скорость утилизации
кислорода имела тенденцию к нормализации, но не достигла
контрольного уровня.
Таким образом, изменение кислородного режима кожи под влиянием
реамберина подтверждает его корригирующее влияние на доставку и
утилизацию кислорода в коже.
Степень окисленности липидов у детей I группы после проведенной
терапии нормализовалась, а уровень ДК и МДА снизился в 2 раза, по
сравнению с исходными значениями и практически нормализовался.
Во II группе отмечали нормализацию показателей СО, ДК и МДА
после лечения реамберином.
У детей с тяжелым течением атопического дерматита (III группа)
среднее значение показателей степени окисленности липидов, под
влиянием антиоксидантного и антигипоксантного лечения снизилось в
1,5 раза, по сравнению с исходным уровнем, при этом уровень ДК и
МДА практически нормализовался.
Исходный уровень α-ТФ, ЦП, общей АОА и интегрального показателя
К до лечения у детей с различной степенью тяжести АД
свидетельствовал о значительном напряжении защитного механизма АОС
на фоне интенсификации процессов ПОЛ и коррелировал со степенью
тяжести АД.
Повышение уровня ЦП, под влиянием терапии реамберином, отмечено
у больных I группы – в 1,1 раза; у больных II группы в 1,2 раза и в
1,4 раза у больных III группы. Эти показатели близки к уровню –
контрольных значений у больных I и II групп, а у детей с тяжелым
течением уровень ЦП превышал контрольную величину.
Весьма значимыми были отличия общей АОА сыворотки до и после
лечения (Таблица 9.).
Вместе с тем, анализ целостной взаимосвязанной системы ПОЛ-АОС
приобретает особое значение при оценке эффективности экзогенных
антиоксидантов в коррекции ПОЛ при атопическом дерматите, когда
дисбаланс процессов липопероксидации обусловлен как усилением ПОЛ,
так и низким содержанием α-токоферола и ЦП (В.А. Волнухин, 1992;
П.И. Герасимов и соавт., 1998).
К – интегральный показатель, до начала лечения был достоверно
выше контрольного значения: в I группе – в 2,6 раза, во II группе –
в 4,3 раза и в III группе – в 5,3 раза, соответственно.
После проведенной терапии реамберином интегральный показатель К
у всех больных не отличался от нормальных значений.
Таблица 7. Динамика уровня ПОЛ после терапии реамберином
у детей с различной степенью тяжести атопического дерматита
Таблица 8. Показатели α-ТФ и ЦП
после проведенной терапии реамберином
|
Группа
и число больных
|
Значения
α-токоферола
|
Значения
церуллоплазмин
|
|
До
лечения
|
После
лечения
|
До
лечения
|
После
лечения
|
|
I группа,
n = 24
|
4,01 ± 0,48
|
3,04 ± 0,12
|
28,81 ± 1,9
|
29,4 ± 2,3
|
|
II группа,
n = 51
|
2,1 ± 0,09
|
3,01 ± 0,17
|
26,26 ± 1,7
|
32,04 ± 1,6**
|
|
III группа,
n= 37
|
1,7 ± 0,19
|
2,9 ± 0,14*
|
24,32 ± 2,2
|
35,07 ± 1,1* **
|
|
Контроль,
n = 40
|
3,24 ± 0,15
|
31,8 ± 2,10
|
* р1 < 0,05 - различия достоверны по
сравнению с контролем;
** р2 < 0,05 - различия достоверны по сравнению с
показателями до лечения.
Таблица 9. Динамика показателей АОС(общей ДОС и К)
после проведенной терапии реамберином у детей
с различной степенью тяжести атопического дерматита
|
Группа
и число больных
|
Общая АОА
|
К
|
|
До
лечения
|
После
лечения
|
До
лечения
|
После
лечения
|
|
I группа,
n = 24
|
1,12 ± 0,10
|
0,81 ± 0,1
|
2,9 ± 0,16
|
1,10 ± 0,1**
|
|
II группа,
n = 51
|
0,71 ± 0,08
|
0,84 ±0,06
|
4,8 ± 0,19
|
1,10 ± 0,09**
|
|
III группа,
n = 37
|
0,64 ± 0,09
|
0,88 ± 0,06**
|
6,01 ± 0,08
|
1,2 ± 0,1**
|
|
Контроль,
n = 40
|
0,91 ± 0,09
|
1,12 ± 0,1
|
* р1 < 0,05 - различия достоверны по сравнению с
контролем
** р2 < 0,05 - различия достоверны по сравнению с
показателями до лечения.
Таким образом, патогенетически обоснованная антиоксидантная и
антигипоксантная терапия реамберином повышает способность сыворотки
крови больных тормозить процесс пероксидации собственных липидов,
повышает защитные возможности АОС, устраняя дисбаланс в системе
ПОЛ/АОС.
ЗАКЛЮЧЕНИЕ
Терапия атопического дерматита включает в себя меры,
направленные на предупреждение контакта с причинными факторами,
используется широкий спектр медикаментозных препаратов, аппаратных
и физиотерапевтических, психотерапевтических и санаторно-курортных
методов.
На фоне полипрагмазии и повышенной сенсибилизации особую
актуальность приобретают методы лечения с учетом неспецифических
механизмов развития атопического дерматита.
В результате проведенного лечения у 71,5% больных атопическим
дерматитом констатирована клиническая ремиссия.
Значительное улучшение отмечено у 20,5% пациентов (прекращен
зуда, улучшилось самочувствие, повысилась активность и
нормализовался сон, отмечен регресс воспалительных
инфильтрированных очагов, при сохранении легкого шелушения и
пигментации). У 7,1% после проведенной терапии полностью
прекратился зуд, исчезли воспалительные явления в очагах поражения,
но сохранялась легкая инфильтрация в области лучезапястных
суставов и явления хейлита.
Лишь у 1 ребенка (0,9%) выраженного эффекта от проведенной
терапии отмечено не было, но улучшилось самочувствие,
нормализовался сон и аппетит.
После проведенной терапии отмечалось повышение напряжения
кислорода в коже у больных с легким и среднетяжелым течением
атопического дерматита. У больных с тяжелой степенью заболевания в
результате проведенной терапии напряжение кислорода в коже
повысилось в 1,5 раз по сравнению с исходным уровнем.
Скорость доставки и скорость утилизации кислорода практически
нормализовалась у всех больных атопическим дерматитом.
Использование реамберина снижало степень активации процессов
ПОЛ, что выражалось в снижении степени окисленности липидов у всех
больных атопическим дерматитом.
У пациентов с легкой и средней степенью тяжестью течения
заболевания после лечения уровень ДК и МДА нормализовался.
Лечение реамберином оказало положительное влияние и на
показатели антиоксидантной системы. Уровень ±-ТФ у всех больных
атопическим дерматитом нормализовался. Содержание ЦП под влиянием
терапии возросло в 1,1-1,4 раза по сравнению с исходным уровнем и
не отличался от уровня нормальных значений у больных контрольной
группы.
Под влиянием проведенной терапии нормализовался баланс в системе
ПОЛ/АОС.
Таким образом, у больных атопическим дерматитом развивается
состояние гипоксии, влечет активацию процессов ПОЛ и снижение
параметров антиоксидантной системы. Степень гипоксического
состояния коррелирует со степенью тяжести атопического дерматита и
активностью процессов ПОЛ и требует коррекции. Применение
реамберина в терапии детей, страдающих атопическим дерматитом
различной степенью тяжести, продемонстрировало его высокую
клиническую эффективность, хорошую переносимость с отсутствием
побочных эффектов и осложнений.
Таким образом,
- гипоксия является триггерным фактором в активации процессов
перекисного окисления липидов и истощении антиоксидантной системы,
о чем свидетельствует накопление промежуточных и конечных
продуктов ПОЛ – диеновых конъюгатов и малонового диальдегида в
сыворотке крови, больных атопическим дерматитом.
- степень дисбаланса в системе ПОЛ/АОС коррелирует с напряжением
кислорода в коже и с тяжестью течения атопического дерматита,
играя важную роль в развитии и поддержании аллергического
воспаления.
Практические рекомендации
- Показатели перекисного окисления липидов и антиоксидантной
системы сыворотки крови (уровень ДК и МДА, общей АОА сыворотки и
степень дисбаланса в системе ПОЛ/АОС) больных атопическим
дерматитом могут быть использованы в качестве прогностических
критериев и для оценки эффективности проводимой терапии.
- Включение в комплексную терапию 1,5% раствора реамберина,
обладающего антигипоксантным, антиоксидантным,
дезинтоксикационным действием, значительно повышает
фармакотерапевтическую эффективность атопического дерматита,
особенно у больных с тяжелыми формами заболевания: клиническая
ремиссия отмечена у 72% больных, значительное улучшение у 21%, а
улучшение состояния у 7,2% при отсутствии эффекта в 1% случаев.
- Лечение Реамберином в составе комплексной терапии проводится
внутривенно капельно через день № 5 в разовой дозе 10 мг/кг веса
ребенка.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
- Балаболкин И.И., Гребенюк В.Н. Атопический дерматит у детей. М.,
1999. С. 13-55.
- Ивницкий Ю.Ю., Головко А.И., Софронов Г.А. Янтарная кислота в
системе средств метаболической коррекции функционального состояния
и резистентности организма. СПб., 1998.
- Куликова О.Д. Коррекция реамберином гипоксических состояний и
факторов антиоксидантной защиты при атопическом дерматите у детей
// Автореф. дис....к. м. н. М., 2000.
- Маевский Е.И., Гришина Е.В., Окон И.С. Фармакологическая
коррекция гипоксических состояний // В сб. НИИ фармакологии АМН
СССР. 1989. С 80-82.
- Прохоренко В.И., Куртасова Л.М, Савченко А.А., Чесноков А.Б.,
Шмидт А.Р. // Вестник дерматологии и венерологии. 2001. № 6. С.
31-33.
- Трофимова И.Б., Мишурис Л.А., Гевондян В.С, Гевондян Н.М.,
Лебедев В.В. // Вестник дерматологии и венерологии. 2001. № 2. С
9-13.
Таблица 3. Распределение больных атопическим дерматитом
по степени тяжести заболевания
|
Клинические формы заболевания
|
Степень тяжести заболевания
|
Всего
|
|
Легкая
|
Средняя
|
Тяжелая
|
|
Абс.
|
%
|
Абс.
|
%
|
Абс.
|
%
|
Абс.
|
%
|
|
Эритемо-сквамозная
|
5
|
4,5
|
8
|
7,1
|
12
|
10,7
|
25
|
22,3
|
|
Эритемо-сквамозная с лихенификацией
|
11
|
9,8
|
27
|
24,1
|
17
|
15,3
|
55
|
49,1
|
|
Лихеноидная
|
4
|
6
|
13
|
19,4
|
8
|
11,9
|
32
|
28,6
|
|
Всего
|
24
|
21,4
|
51
|
45,5
|
37
|
33,1
|
112
|
100
|
Таблица 4. Результаты полярографического исследования
кислородного режима кожи у детей различной степени тяжести
атопического дерматита
после проведенной терапии реамберином
|
Параметры
|
I группа
(n = 14)
|
II группа
(n = 17)
|
III группа
(n = 11)
|
Контроль
(n = 15)
|
|
До лечения
|
После лечения
|
До лечения
|
После лечения
|
До лечения
|
После лечения
|
|
РО2,
мм рт. ст.
|
46,32 ± 0,59
|
49,21 ± 0,68*
|
37,21 ± 0,48
|
48,32 ± 0,54*
|
28,74 ± 0,63
|
43,21 ± 0,31
|
48,84 ± 0,56
|
|
L, сек
|
27,12 ± 0,84*
|
22,46 ± 0,84
|
31,85 ± 0,64
|
28,41 ± 0,65**
|
37,76 ± 0,51
|
30,46 ± 0,28
|
26,4 ± 0,65
|
|
V1, мм рт. ст./сек
|
47,85 ± 0,28
|
49,22 ± 0,36**
|
40,28 ± 0,36
|
47,38 ± 0,84*
|
29,21 ± 0,36
|
39,96 ±0,84
|
46,74 ± 0,49
|
|
V2, мм рт. ст./сек
|
48,08 ± 0,64*
|
50,01 ± 0,84**
|
39,89 ± 0,48
|
46,95 ± 0,45*
|
28,48 ± 0,52
|
40,84 ± 0,86
|
47,02 ± 0,45
|
* Р1 > 0,05 – различия недостоверны по сравнению с
показателями в контрольной группе
** Р2 < 0,05 – различия достоверны по сравнению с
показателями до лечения
Таблица 7. Динамика уровня ПОЛ после терапии реамберином
у детей с различной степенью тяжести атопического дерматита
|
Группа и число больных
|
СО
|
ДК
|
МДА
|
|
До
лечения
|
После лечения
|
До
лечения
|
После лечения
|
До
лечения
|
После лечения
|
|
I группа,
n = 24
|
0,64±0,04
|
0,51±0,05**
|
1,31±0,04
|
0,67 ± 0,03**
|
2,71±0,06
|
1,30 ± 0,08**
|
|
II группа,
n = 51
|
0,83±0,04
|
0,54±0,04**
|
1,60±0,07
|
0,70 ± 0,06**
|
2,87±0,04
|
1,12 ± 0,07**
|
|
III группа,
n = 37
|
0,97±0,03
|
0,61±0,07**
|
1,73±0,03
|
0,71 ± 0,04* **
|
2,96+0,05
|
1,38 ± 0,06* **
|
|
Контроль,
n = 40
|
0,54±0,02
|
0,62±0,03
|
1,24±0,07
|
* р1 < 0,05 - различия достоверны по
сравнению с контролем;
** р2 < 0,05 - различия достоверны по сравнению с
показателями до лечения.
