Источник: Острые и неотложные состояния в практике врача,
2012 – №2-3 – 25-33
ГУ «Институт неотложной и восстановительной хирургии
им. В.К. Гусака НАМН Украины», г. Донецк
Нужно ли усовершенствовать технологии кровезамещения?
В.П. Шано, И.В. Гуменюк, И.В. Струкова, Е.З. Губиева
«Показания к трансфузии аллогенной крови и её
компонентов,
бесспорно, содержат драму в наше время
и наверняка будут исключены в будущем»
Соnzаllо Н. 2004
Устранение кровопотери и её последствий – во многом не решенная
и сложная проблема современной анестезиологии, трансфузиологии и
интенсивной терапии. На сегодняшний день эта проблема включает
не только медицинскую и экономическую, но и социально-этическую
ответственность.
Несмотря на то, что современные банки донорской крови и её
препаратов обеспечивают высокую инфекционную безопасность, риск
летальных осложнений даже спустя год после аллотрансфузии
составляет около 25%.
Обеспечение условно безопасной аллотрансфузии требует больших
материальных затрат в связи с необходимостью соблюдения
международных стандартов контроля, заготовки и хранения крови и её
препаратов (GМР, GLР, GSР). В то же время, банки крови испытывают
дефицит доноров, так как только 5% населения могут быть таковыми.
Общая сумма хронических неинфекционных заболеваний населения
Украины составляет 80%. Возбудители гемотрансмиссивных инфекций
могут стать причиной эндогенного заражения бактериями (сифилис,
бруцеллез, сальмонеллез, иерсиниоз), риккетсиями, паразитами
(малена), вирусами (гепатиты, иммунодефицит типа I и II,
заболевания, связанные с вирусами Эпштейна–Барр, цитомегаловирусом,
Т-лимфотропными вирусами человека), белковыми частицами (болезнь
Крейтцфельта–Якоба, энцефалит) и др.
Гемотрансфузионные осложнения иммунного генеза определяются не
менее чем 600 различными антигенами клеток крови – эритроцитов,
тромбоцитов, лейкоцитов; 250 эритроцитарных антигенов насчитывают
11 337 408 групп крови, иммуногенные эритроциты системы АВО,
резус-, hеll-антиген, лейкоцитарные антигены системы НLА.
Опасность аллотрансфузии определяет не только иммунная
несовместимость, но и метаболическое несовершенство. Так, в
консервированных эритроцитах повышены уровни калия, аммония,
содержится свободный гемоглобин, повышена кислотность; не менее
30% мембран эритроцитов оказываются разрушенными,
2,3-дифосфоглицерат (2,3-ДФГ) полностью исчезает в течение
14-дневного хранения; в 1 мл консервированных эритроцитов в первый
день содержится около 200, при двухнедельном хранении – около 20
000, позже – около 20 млн. агрегатов и сгустков фибрина до 200 мкм
диаметром.
Осложнения аллотрансфузии – непосредственные и отдаленные –
включают иммунные и неиммунные проявления: внутрисосудистый
гемолиз, гемолитическая неинфекционная гипертермия, крапивница,
некардиогенный отек легких, синдром капиллярной «утечки», сепсис,
активация опухолевого процесса, гнойно-септические осложнения,
дыхательный дистресс-синдром, аллоиммунизация антителами
эритроцитов, тромбоцитов, лейкоцитов, бактериальный и
геморрагический шок, гемосидероз, острая нефропатия.
Эти осложнения, можно надеяться, способствовали отказу от таких
так называемых стандартов кровезамещения, как введение цельной
крови, в том числе «универсального донора», а также «капля за
каплю» и «введение теплой донорской крови» — прямое переливание
(рис. 1).

Рис. 1. «Золотые стандарты» крововосполнения
(Калеко С.П. и др.,
2001; Haljamae H., Lindgren S., 2000; Nishimura M. 2006).
Несомненно, сегодня устранение кровопотери приобрело особое
значение как проблема национальной безопасности государства в
связи с техногенными и природными катастрофами и террористическими
актами, при тяжелых травмах, обширных онкологических операциях, при
трансплантациях органов, массивных кровотечениях в акушерстве,
урологии, пульмонологии. Это ситуации, при которых альтернативы
аллотрансфузии нет. При этом стоимость препаратов крови высокая, а
лечение осложнений аллотрансфузии – не только «затратное», но и
малоэффективное. Так, стоимость 1 л эритромассы составляет 477
грн., свежезамороженной плазмы (СЗП) – 573,79 грн., антисинегнойной
плазмы – 875,3 грн., альбумина 10% – 2789 грн.
Главным камнем преткновения идеологии современного восполнения
кровопотери с идеологией прошлого является представление о
толерантности к анемии-гипоксии.
Идеология традиционного восполнения кровопотери основана на
представлении о необходимости доставки кислорода с помощью
аллотрансфузии эритроцитов до достижения показателей гемоглобина
100 г/л и более. Это определяет так называемый либеральный способ,
эмпирически представленный более 70 лет тому назад.
Современный подход к восполнению кровопотери включает
необходимость предупреждения её последствий и базируется на
представлении о толерантности к анемии-гипоксии и рестриктивной
технологии (рис. 2). Установлено, что повреждающее действие
геморрагии определяется не только дефицитом доставки кислорода, но
и, главным образом, потреблением кислорода тканями. Увеличение
доставки кислорода с помощью донорских эритроцитов не определяет
способность потреблять кислород тканями: при уровнях гемоглобина
100 г/л и 60 г/л отсутствует различие в потреблении кислорода.
Поскольку доставка кислорода в 4 раза больше потребления –
коэффициент утилизации составляет не менее 30%, то снижение
содержания гемоглобина вплоть до 50 г/л может быть вполне
достаточным для удовлетворения потребности тканей в кислороде.
Неадекватный адаптационный ответ системы доставка/ потребление
кислорода (DO2/VO2) на гипоксию
сопровождается тем, что увеличение эритроцитарной доставки
кислорода не корригирует его потребление тканями, что усугубляется
дефицитом 2,3-ДФГ вводимых донорских эритроцитов и сдвигом кривой
диссоциации оксигемоглобина влево.
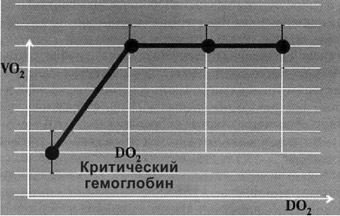
Рис. 2. Зависимость потребления кислорода
от критического гемоглобина
(Erber W.N., 2002; Habler O.P., 2005; Pape A., 2005; Herbert J.M., 2005)
Это подтверждается и установленным фактом: потеря 50%
эритроцитов не является смертельно опасной, тогда как потеря 30%
объема крови – опасна для жизни. Таким образом, определяется
значение первой составляющей восполнения кровопотери – обеспечение
объема циркулирующей крови (ОЦК), но не за счет введения плазмы и
эритромассы, а благодаря гемодилюции. Гемодилюция и искусственная
вентиляция легких (ИВЛ), даже при понижении уровня гемоглобина до
30 г/л, увеличивает долю растворенного в плазме кислорода
приблизительно до 70% от потребляемого тканями.
Гемодилюция может быстро восполнить ОЦК и определенным образом
компенсирует циркуляторную гипоксию, обусловленную гиповолемией.
Однако при этом следует учитывать возможность гемодилюционной
анемии: компенсированной – не требующей введения эритроцитов или
некомпенсированной – такого уровня анемии, которым не
обеспечивается кислородный режим. При компенсированной гемодилюции
снижение вязкости крови, вазомоторного тонуса и венозного
сопротивления обеспечивает венозный возврат, снижение
постнагрузки, повышение сердечного выброса и минутного объема.
Поэтому, хотя кислородная емкость может снижаться на 30%, системный
транспорт кислорода и его потребление сохраняются. Предельно
допустимой считают гемодилюцию при показателе гематокрита 20% и
гемоглобине 70 г/л, так как при этих показателях
компенсаторно-приспособительные механизмы уже не обеспечивают
кислородный баланс, и требуется введение эритроцитарных
переносчиков кислорода. Таким образом, гемодилюция, с одной
стороны, устраняет циркуляторную гипоксию, с другой – может
приводить к анемической гипоксии. Это требует дифференцированного
подхода к выбору объема гемодилюции и определению сред для её
восполнения.
Одним из популярных общепринятых показателей для определения
объема гемодилюции считают показатель гематокрита, изменение
которого в диапазоне 25-45% обеспечивает удовлетворительную
тканевую доставку кислорода, а при гематокрите ниже 25% и выше 45%
– доставка уменьшается.
Это определило представление об оптимальном показателе
гематокрита 30%. Однако даже при снижении гематокрита до 14% и
содержании гемоглобина 47 г/л потребление кислорода тканями
сохраняется на уровне 120 мл/м2 в 1 мин, а доставка
кислорода существенно не страдает. Следовательно, показатель так
называемого критического гематокрита 30% не всегда и не полностью
отражает зависимость потребления кислорода от его доставки. Поэтому
при проведении гемодилюции следует учитывать уровень сердечного
выброса, показатель доставки и потребления кислорода, интенсивность
сосудисто-тканевого транспорта кислорода и артериовенозную
разницу.
Соответственно объему кровопотери разработаны рекомендации
применения трансфузионных сред, включая солевые растворы,
коллоиды, альбумин, СЗП, донорскую эритромассу, тромбоциты (табл.
1-5).
Таблица 1. Идеология восполнения кровопотери
с помощью аллотрансфузии (Городецкий В.М., Воробьёв А.И., 2002)
|
Объём кровопотери
|
Трансфузионные среды, мл
|
|
мл
|
% ОЦК
|
Солевые растворы
|
Коллоиды
|
Альбумин 10%
|
СЗП
|
Донорская эритромасса
|
Тромбоциты
|
|
<750
|
<15
|
2000
|
-
|
-
|
-
|
-
|
-
|
|
750-1500
|
15-30
|
1500-2000
|
600-800
|
-
|
-
|
-
|
-
|
|
1500-2000
|
30-40
|
1500-2000
|
800-1200
|
100-200
|
1000-1500
|
По показа телям либерального способа
|
-
|
|
>2000
|
>40
|
1500-2000
|
1200-1500
|
200-300
|
1500-2000
|
400-600
|
4-6 доз
|
Таблица 2. Взаимосвязь объёма кровопотери и объёма
трансфузии
(цит. Ярочкин В.С., 2004)
|
Объём кровопотери от ОЦК, % (мл)
|
Объём инфузии от объёма кровопотери, %
|
Структура преператов
|
|
<10 (500)
|
200-250
|
Кристаллоиды
|
|
10-30 (1500)
|
130-150
|
Коллоиды, кристаллоиды
|
|
30-50 (2500)
|
130-150
|
Коллоиды, кристаллоиды, эритроциты 2 дозы, СЗП 10-20 мл/кг
|
|
<100 (5000)
|
130
|
Коллоиды, кристаллоиды, эритроциты СЗП 1:3
|
|
>100% (>5000)
|
130
|
СЗП, кристаллоиды, эритроциты, альбумин, тромбоциты
|
Таблица 3. Восполнение кровопотери с помощью аллотрансфузии
(Городецкий В.М., Воробьёв А.И., 2002)
|
Объём кровопотери от ОЦК, % (мл)
|
Объём инфузии от объёма кровопотери, % (мл)
|
|
10-15 (500-700)
|
150-200 (750-1400): коллоиды 0,25:
кристаллоиды 0,75
|
|
16-25 (1000-1500)
|
200-250 (2000-3750): коллоиды 0,3:
кристаллоиды 0,5: эритроцитная масса 0,2
|
|
25-40 (1500-2000)
|
300 (4500-6000): коллоиды 0,2: кристаллоиды 0,6: эритроцитная
масса 0,2
|
|
>40 (>2000)
|
Эритроцитная масса 500, плазма 1000, NaCl 7% 200, крахмал
200-500 мл, раствор Рингера 4000
|
Таблица 4. Схема замещения кровопотери по П.Г. Брюсову с
дополнением Е.Н. Клигуненко (2002)
|
Уровень замещения
|
Объём кровопотери
от ОЦК, %
|
Общий объём трансфузии,
%
|
Компоненты кровезамещения
и их соотношение
|
|
1
|
>10
|
200-300
|
Кристаллоиды – монотерапия, Кристаллоиды 0,7 : коллоиды 0,3
|
|
2
|
11-20
|
200
|
Кристаллоиды 0,5 : коллоиды 0,5
|
|
3
|
21-40
|
180
|
Эритромасса 0,4 : плазма 0,1 : коллоиды 0,3 кристаллоиды 0,3
|
|
4
|
41-70
|
170
|
Эритромасса 0,4 : плазма 0,1 : коллоиды 0,25 : кристаллоиды
0,25
|
|
5
|
71-100
|
150
|
Эритромасса 0,5 : альбумин 0,1 или плазма 0,1 : коллоиды 0,2 :
кристаллоиды 0,2
|
Таблица 5. Классификация показаний при кровопотере
|
Класс 1
Кровопотеря >750 мл
|
Класс 2
Кровопотеря 1500-2000 мл
|
Класс 3
Кровопотеря >2000 мл
|
Класс 4
Кровопотеря >2500 мл
|
|
Крахмал
6% 750 мл
или 10% 500 мл
Рингер-лактат
500 мл
Перфторан
не показан
|
Крахмал
6% 1000 мл
или 10% 500 мл
Рингер-лактат
500-1000 мл
Перфторан
2-4 мл/кг
|
Крахмал
6% 1500 мл
или 10% 1000мл
Рингер-лактат
1500 мл
Перфторан 4-7 мл/кг
|
Крахмал
6% 1500 мл
или 10% 1300мл
Рингер-лактат
1500 мл
Эритромасса СЗП
Перфторан
4-7 мл/кг
|
Несмотря на то, что кристаллоиды (Лактосол, раствор Хартмана,
Дисоль, Трисоль, Ацесоль, Хлосоль, Квинтасоль, раствор Дарроу)
обеспечивают доставку электролитов и воды, корригируют
кислотно-основное состояние, 70% введенных растворов «покидают»
сосудистое русло в течение 4-6 часов, что требует увеличения в
3-4 раза объема их введения в сравнении с объемом кровопотери.
Известно, что для восполнения 1 литра внутрисосудистого объема
необходимо 14 л 5% раствора глюкозы; или 8,5 л 5% раствора глюкозы
с 0,9% раствором NаСl; или 4,7 л раствора Рингер-лактата; или 4,3 л
0,9% раствора NaCl. Применение таких доз опасно в связи с риском
развития гипергидратации, накопления «излишка» ионов Сl,
формирования отеков вследствие нарушения гидростатического и
онкотического давления между артериальным, интерстициальным и
венозным отделами микроциркуляции. Это требует модификации
инфузионной терапии, включая использование гипертонического
раствора NaCl в сочетании с коллоидами, но исключая коллоидные
изотонические соединения, такие как альбумин и препараты желатина.
Так, в принципах терапии синдрома капиллярной утечки (рекомендации
1998-2004 гг.) наряду с ликвидацией причин синдрома,
стабилизацией микроциркуляции эндотелия модификация инфузионной
терапии предусматривает применение гидроэтилкрахмалов вместо
альбумина.
Альтернативой уменьшения объема кристаллоидов может быть
«малообъёмная инфузия» с применением гиперосмолярных растворов
NaCl. Преимущество этого метода заключается в быстрой мобилизации
эндогенной жидкости и как следствие – увеличении внутрисосудистого
объема, улучшении тканевой перфузии и повышении рН клеток,
уменьшении отека кровяных клеток и клеток сосудистого эндотелия,
предупреждении реперфузионных повреждений, апирогенности,
восстановлении самостоятельной вазомоторной активности артериол,
уменьшении агрегации эритроцитов, а также выгодном экономическом
эффекте. В то же время, недостатками метода «малообъемной инфузии»
являются: недолговременное повышение осмолярности плазмы;
необходимость сочетать этот метод с введением коллоидов с целью
продления гемодинамической стабильности. Кроме того, этот метод
противопоказан при дегидратации тяжелой степени; гиперосмолярных
состояниях; гипокалиемии и гипернатриемии; опасности развития
гемолиза и гипокоагуляционного состояния.
Для срочной коррекции показателей гемодинамики и стабилизации
состояния больного при опасности «перегрузки» объемом и наличии
синдрома капиллярной утечки в режиме так называемой «малообъемной»
объемозамещающей терапии целесообразно использование препарата
Гиперхаес.
Гиперхаес включает комбинацию 7,2% NaCl и 6%
гидроксиэтилкрахмала (ГЭК) 200/0,5 объемом 250,0. Быстрая инфузия
(в/в болюсная инъекция в течение 2-5 минут) в объеме 4 мл/кг
обеспечивает перемещение жидкой части крови из интерстиция в
сосудистое русло и гарантирует 450% волемический эффект при малом
объеме введения. Это способствует уменьшению за короткий промежуток
времени внутричерепного давления, снижению адгезии лейкоцитов на
эндотелии, восстановлению перфузии и оксигенации тканей,
нормализации давления заклинивания легочных капилляров и
сердечного выброса.
Использование растворов глюкозы, в том числе как источника
энергии, в условиях нарушения перфузии и оксигенации тканей
приводит к накоплению лактата, что важно в развитии энцефалопатии и
способствует нарастанию ацидоза. Однако нецелесообразно
отказываться от современных сбалансированных растворов, играющих
важную роль в клеточном метаболизме, регулируя внутриклеточное
осмотическое давление, уменьшая кардиотоксические эффекты,
обеспечивая метаболизм гипоксически поврежденного миокарда,
устраняя высвобождение свободных жирных кислот как «неэффективного»
источника энергии. Это уменьшает ишемические повреждения,
ограничивает зону инфаркта и постишемическую дисфункцию при
стенокардии, а показатели подвижности стенки левого желудочка и
пиковой систолической скорости сопоставимы с введением добутамина.
Такой метаболический раствор для инфузий – ГИК – содержит главный
внутриклеточный катион калий 0,5% на 5% растворе глюкозы.
Эффективным источником энергии является ксилат, основной его
компонент – ксилит, высвобождает не менее 35 экв АТФ, что
превышает выработку энергии на 10% больше, чем у глюкозы. Поэтому
ксилит является не только эффективным источником энергии (4,06
ккал/г), в отличие от фруктозы и сорбита он не вызывает снижения в
печени уровней АТФ, АДФ, АМФ. Не менее 85% ксилита быстро,
пассивно, вне зависимости от специфических гормональных и
ферментативных транспортных путей, включая инсулин, проникают в
клетки печени, почек, миокарда. Очень важно, что уровень малата при
этом не увеличивается, что обеспечивает антикетогенный эффект.
Второй важной составляющей ксилата является ацетат натрия,
обладающий ощелачивающим эффектом, он корригирует метаболический
ацидоз без резкого колебания рН, не повышая опасность
внутриклеточного отека мозга, агрегацию тромбоцитов. Таким образом,
ксилит легко включается в метаболизм цикла Кребса, обеспечивает
детоксикацию, азотсохраняющий и антикетогенные эффекты, улучшает
микроциркуляцию, предотвращает гиперкатаболизм. Гемодинамический
эффект ксилита обеспечивает гиперосмолярность раствора, что
способствует перераспределению эндогенной жидкости из ткани в
кровоток.
Наиболее эффективными плазмозаменителями можно считать
сорбитолы. Сорбилакт (1670 мосм/л) и реосорбилакт (900 мосм/л),
являясь гиперосмолярными в сравнении с плазмой соответственно в
5,5 и 3 раза, обеспечивают поступление жидкости из межклеточного
пространства в сосудистое русло, что способствует увеличению
объема циркулирующей крови, улучшению её реологических свойств и
микроциркуляции, нормализации кислотно-основного состояния и
перфузии тканей. Кроме того, сорбитол обладает мощным
осмодиуретическим эффектом, а также, метаболизируясь до фруктозы,
нормализует углеводный и энергетический обмен, в том числе в
гепатоцитах, обеспечивая в них депо гликогена, восстановление
детоксикационного потенциала. Наряду с улучшением функционального
состояния печени и почек лактат-анион как составляющая часть
сорбилакта, реосорбилакта улучшает показатели кислотно-основного
равновесия и реакции углеводно-энергетического обмена,
восстанавливая функции клеток ретикулоэндотелиальной системы.
Такое многоплановое действие позволяет использовать сорбилакт и
реосорбилакт как дезинтоксикационные средства с реологическим,
диуретическим, противошоковым, энергосберегающим,
микроциркуляторным эффектами.
Таким образом, сорбилакт и реосорбилакт обеспечивают улучшение
показателей центральной гемодинамики, повышая щелочной резерв,
энергетический потенциал, диурез, оказывая нефропротекторное
действие, способствуют детоксикации, обладают противошоковым
свойством. Важно, что эти препараты, улучшая микроциркуляцию,
предупреждают контаминацию из пищевого канала и нарушение
спланхнического кровотока.
Из состава гемодилюции целесообразно исключить такие декстраны,
как реополиглюкин и полиглюкин, имеющие ряд ограничений для их
использования. Полиглюкин, имея коллоидно-осмотическое давление
55 мм рт.ст. и волемический коэфициент 130%, является
гиперосмолярным – 315 мосм/л, что определяет длительность его
объемного эффекта 4-6 часов при дозе 1,2 г/кг в сутки. При этом
дальнейшее увеличение дозы препарата сопровождается снижением
DO2, на 15% и более, VO2 – не менее чем на 10%. Наряду с
этим декстраны вызывают повышение вязкости плазмы, кумулируясь в
сосудистом русле; негативно влияют на иммунокомпетентные клетки;
обладают выраженным аллергенным действием, что способствует
развитию анафилактических реакций; оказывают прямое повреждающее
действие на сеть легочных капилляров и почечных канальцев.
Реополиглюкин в дозе более 0,4 г/кг нарушает механодинамические
свойства кровяного сгустка, усиливает угрозу развития кровотечения.
Препарат обладает кумулятивным свойством, повышая вязкость и
агрегацию крови, оказывает прямое повреждающее действие на
эндотелий капилляров легких и сосудов, негативно влияет на
иммунокомпетентные клетки. Поэтому использование декстранов
требует дополнительного введения плазмы и/или эритромассы, что
увеличивает их общий объем применения не менее чем в 1,5-2
раза.
Желатин имеет низкий (0,8) в сравнении с крахмалами (1,0)
волемический коэффициент, поэтому для стабилизации показателей
гемодинамики и удовлетворительного уровня артериального давления
не менее чем у 80% больных требуется поддержка симпатомиметиками
(дофамин 2-3 мг/кг в 1 мин), а снижение преднагрузки требует
дополнительной инфузионной терапии. Желатиноль вызывает
значительное угнетение агрегационной способности тромбоцитов,
провоцирует кровоточивость, что требует после операции применения
донорской плазмы и тромбоцитов. Частицы желатина включаются в
образующиеся сгустки крови, нарушая функции фибриногена.
Введение желатинов может моделировать синдром Виллебранда. Кроме
этого, введение желатина не исключает угрозу, связанную с
возбудителем трансмиссивной спонгиформной энцефалопатии крупного
рогатого скота (бешенство коров), не инактивируемого обычной
стерилизацией.
Наряду с этим даже одна аллотрансфузия плазмы не исключает
контаминацию вирусами гепатита, иммунодефицита; может
сопровождаться аллергическими и анафилактическими реакциями,
гемолитической и негемолитической лихорадкой, развитием расстройств
дыхания во сне, синдромом «капиллярной утечки», реакцией
«трансплантат против хозяина». В развитии перечисленных осложнений
основную роль играет то, что с вводимой плазмой пациент получает
донорские лейкоциты и их фрагменты, которые являются причиной
НLА-аллоиммунизации. В то же время, анти-НLА-антитела реципиента
способствуют развитию рефрактерности к трансфузии донорских
тромбоцитов, а взаимодействуя с соответствующими НLА-антигенами
донорских лейкоцитов вызывают фебрильные негемолитические реакции.
Этому способствуют также цитокины и анафилотоксины, освобождающиеся
при разрушении лейкоцитов уже к концу первых суток хранения
донорской плазмы. Наряду с этим «сохраняющимися» тромбоцитами
«выбрасываются» в плазму агонист агрегации тромбоцитов и
антигепариновый фактор, активность которых приводит к образованию
микроагрегатов, предрасполагающих вместе с биологически активными
веществами к развитию респираторного дистресс-синдрома. Кроме того,
введение донорской плазмы, содержащей лимфоциты, способствует
развитию реакции «трансплантат против хозяина». Учитывая
вышеизложенное, плазма не рассматривается в качестве
плазмозамещающего средства и источника белка, а единственным
показанием для её применения является коагулопатия. требующая
доставки плазменных факторов свертывания. Однако сегодня
альтернативой введения плазмы следует считать применение
октаплекса, содержащего факторы свертывания II, VII, IX, X. Вводят
внутривенно 1 мл в минуту, а затем 2-3 мл в минуту. Разовая доза до
3000 ЕД. Контроль действия – протромбиновый индекс, международное
нормализованное отношение (МНО).
При кровотечении, не контролируемом хирургическим
вмешательством, целесообразно своевременно использовать
рекомбинантный фактор VIIа, инициирующий гемостаз в месте
кровотечения, так как формирует комплексы с тканевым фактором
поврежденных тканей, вызывает синтез тромбина, активирует
тромбоциты. Новосевен применяют при кровотечениях, резистентных к
гемостатической терапии. При массивной кровопотери, требующей
введения эритромассы в объеме 10-12 мл/кг и плазмы 15-18 мл/кг,
введение препарата новосевен в дозе 60-114 мкг/кг однократно
способствовало снижению необходимого объема гемодилюции не менее
чем в 2,5 раза, темп кровопотери уже через 15 минут после введения
препарата снижался до 1,5-2,0 мл/кг за 12 часов.
Тем не менее, идеология восстановления сосудистого объема путем
введения как плазмы, так и альбумина, завоевала роль «золотого»
стандарта. Однако сегодня этот стандарт подвергнут сомнению из-за
отсутствия достоверных данных об улучшении результатов лечения с
использованием альбумина, который, кроме того, относится к
инфекционно опасным средам. Наряду с этим используемый 5% альбумин
является изоонкотическим, он покидает сосудистое русло при
неповрежденном эндотелии, не привлекает в сосудистое русло воду и
не повышает плазматический объем. При наличии синдрома капиллярной
утечки альбумин проникает в интерстиций с привлечением воды,
увеличивая отек, в том числе легких, ухудшая газообмен. Донорский
альбумин и плазма всегда инициируют продукцию системного
воспаления, являясь мощным антигеном, усиливают тромбообразование,
повышают активность ферментов и уровень «шлаков» в плазме
реципиента. Поэтому рандомизированные исследования не подтверждают
несомненную полезность альбумина, а современные инфузионные среды
полностью могут заменить сто гсмодинамические, метаболические,
иммунологические эффекты при повышении безопасности лечения и
значительной экономической выгоде. Поэтому абсолютным показанием
для назначения альбумина считают снижение его содержания в
сыворотке крови менее 25 г/л, общего белка – менее 50 г/л, хотя
еще много проблем при использовании альбумина остаются нерешенными.
Это определяется, в первую очередь, конфликтом интересов
производителей и потребителей альбумина – дороговизна производства
и неубедительный лечебный эффект. Так, в большинстве стационаров
затраты на приобретение альбумина достигают 30% бюджетных средств,
выделяемых на приобретение всех препаратов, а сокращение
использования альбумина только лишь в 7-коечном отделении
интенсивной терапии может сэкономить несколько тысяч долларов в
месяц. При этом конфликт интересов производителя и потребителя
проявляется также в том, что финансирование интернациональных
программ по промоции альбумина производителями плазмы до 2000 года
составляли более 1млн британских фунтов стерлингов.
Тем не менее, и сегодня в мире используется 300-400 тонн
альбумина, хотя он не увеличивает объем циркулирующей плазмы, а
длительность внутрисосудистой циркуляции составляет 1,5 часа;
введение альбумина не исключает инфицирование гепатитами, вызывает
аллергические реакции, сопровождается развитием дилюционной
коагулопатии и интерстициального отека легких.
В Украине альтернативой 5-10% раствору альбумина можно считать
препарат комплексного действия лактопротеин-С, содержащий 5%
альбумин, лактат натрия и микроэлементы. Преимуществом препарата
является наличие сорбитола, быстро включающегося в метаболизм
фруктозы, обеспечивая энергетические потребности; также, обладая
дезагрегантными свойствами, он улучшает микроциркуляцию, а лактат
натрия обеспечивает коррекцию метаболического ацидоза в течение
20-30 минут после введения. Наряду с этим препарат быстро
обеспечивает волемический эффект, не требует введения больших
объемов.
Фармакоэкономический анализ использования альбуминов различных
фирм-производителей свидетельствуете значительных затратах при
использовании альбумина с реосорбилактом в сравнении с
применением лактопротеина-С.
Таким образом, отказываясь от применения плазмы и альбумина для
обеспечения гемодилюции, препаратами выбора следует считать
гидроксиэтилкрахмалы (ГЭК), которые уменьшают степень повреждения
эндотелия, ингибируют выброс фактора Виллебранда, экспрессию
Р-селектина, снижают проницаемость эндотелия и предупреждают
развитие синдрома капиллярной утечки. Кроме того, применение ГЭК
позволяет предотвратить синдром системного воспалительного ответа
путем уменьшения адгезии лейкоцитов к эндотелию; улучшить
показатели центральной гемодинамики (УО, СИ, ФВ) за счет увеличения
венозного возврата; нормализовать доставку кислорода за счет
улучшения реологических свойств крови и перфузии тканей; не
нарушает систему гемокоагуляции. Возможность использовать 20-50
мл/кг в сутки этих препаратов позволяет отказаться от применения
других коллоидных растворов для гемодилюции. Сегодня в клинической
практике допустимы коллоиды разных поколений ГЭК: стабизол I
поколения (450/0,7), препараты II поколения (200/0,5/5:1) –
ХАЕС-стерил 10%, рефортан, рефортан плюс, гестар 6% и 10%.
Путем создания препаратов III поколения реализована цель
сведения к минимуму побочных эффектов при сохранении
гемодинамической эффективности, сопоставимой с ГЭК II поколения.
Волювен – ГЭК III поколения Теtrastarch (130/0,4/9:1),
изготовленный из кукурузного крахмала, обладает улучшенными
фармакокинетическими параметрами: оптимизированный метаболизм,
выведение препарата, распределение молекулярного веса. Это
обусловило отсутствие нефротоксичности, накопления в плазме и
тканях, негативного влияния на гемостаз.
Весьма важным в выборе препарата для гемодилюции является учет
влияния на систему гемостаза. Это касается, в первую очередь,
влияния на три основных фактора гомеостаза: VIII фактор,
фибронектин, плазмин. Влияние на VIII фактор определяется входящим
в него протеином-С (прокоагулянт, антигемофильный глобулин),
который ускоряет активацию IX фактора и фактора Виллебранда,
ответственных за тромбоцитарный гемостаз благодаря снижению
агрегации тромбоцитов. Фибронектин определяет образование связей
между молекулами фибрина и молекулой коллоида, формирует рыхлый,
хорошо поддающийся деструкции тромб. Плазмин также подвергается
влиянию коллоидов, вызывая активацию фибринолиза, ослабляя действие
естественных антифибринолитиков.
Из всех ГЭК наименьшим модифицирующим действием на гемостаз
обладает ГЭК 130/0,4 (волювен). Это касается меньшей выраженности
гипокоагуляционного и дезагрегационного действия в сравнении с
другими среднемолекулярными крахмалами. Волювен является
препаратом выбора у пациентов с патологией гемостаза, а также в
клинических ситуациях, когда влияние инфузионной терапии на
систему гемостаза должно быть строго ограничено.
Важной характеристикой любого ГЭК является его
молекулярно-массовое распределение (доля молекул с массой, отличной
от средней в растворе, и их разброс по молекулярной массе).
Присутствие более крупных или мелких молекул может значимо
изменить свойства препарата. Содержание фракций с молекулярным
весом ниже порога почечной проницаемости должно быть как можно
ниже в готовом препарате, поскольку неоправданно повышает нагрузку
на кровеносную систему и почки. Показано, что именно фракции ГЭК в
области между 70 000 и 200 000 дальтон участвуют в восстановлении
«порозных» стенок капилляров при остром травматическом поражении
тканей и массивной кровопотере. Только эти фракции эффективно
блокируют потерю альбумина и жидкости из внутрисосудистого
пространства в интерстициальное в участках повышенной
проницаемости стенок капилляров.
У больных с острым повреждением легких введение ГЭК
(130/0,4/9:1) волювена, не проникающего через сосудистый эндотелий,
снижает проявления интерстициального отека легких. Использование
ГЭК (130/0,4/9:1) у таких пациентов в объеме до 14 мл/кг является
безопасным и не приводит к увеличению содержания воды в
легких.
Для коррекции показателей кислородного бюджета, метаболических и
энергетических процессов, а также предупреждения формирования
циркуляторной гипоксии в составе гемодилюции целесообразны
антигипоксанты, антиоксиданты, стимуляторы эритропоэза,
железосодержащие препараты. Это позволяет обеспечить качественно
новое свойство гемодилюции – антигипоксическое. Перечень лекарств
с антигипоксическим действием включает достаточное число
препаратов (табл. 6).
Показано использование так называемых «умных» лекарств с
уникальной биологической активностью, модулирующих процессы
тканевого метаболизма благодаря наличию янтарной кислоты. Они
обеспечивают «монополизацию дыхательной цепи» в цикле Кребса, ,
влияние на транспорт медиаторных аминокислот, содержание
гамма-аминомасляной кислоты через шунт Робертса в мозге;
интенсификацию диффузии кислорода в ткани с приростом скорости
потребления кислорода, увеличивая его утилизацию; инсулинотропный
эффект, не зависящий от концентрации глюкозы; противоанемический
эффект.
Таблица 6. Лекарственные препараты
антигипоксического действия
|
Препарат
|
Доза в сутки
|
Длительность приёма
|
|
Актовегин (солкосерил)
|
1-2 драже – 2-3 раза в сутки
|
2-6 недель
|
|
Бемитил
|
0,25 – 2 раза
|
3-5 дней
|
|
Глютаминовая кислота
|
0,5 – 3 раза
|
3-4 недели
|
|
Демифосфон
|
30 мг/кг
|
3-4 недели
|
|
Кавинтон (винпосетин)
|
1 таб 2-3 раза
|
2-3 недели
|
|
Кофермент Q10
|
30-40 мг 3 раза
|
1-3 недели
|
|
Милдронат
|
2 капсулы 2 раза
|
2 недели
|
|
Нейробутал
|
0,25 г 1-3 раза
|
2 недели
|
|
Неотон (фосфокреатин)
|
1 г на 15 кг массы тела
|
5-10 дней
|
|
Предуктал (триметазидин)
|
40-60 мг 2-3 раза
|
2 недели
|
|
Рибоксин
|
0,2 г 2-3 раза
|
2-3 недели
|
|
Цитохром С
|
15 мг 1-2 раза
|
10 дней
|
|
Реамберин
|
200-400 мг 1 раз
|
1-5 дней
|
Одним из главных механизмов лечебного действия Реамберина
является влияние его на транспорт и потребление кислорода тканями.
Это обеспечивается благодаря «легкости» окисления янтарной
кислоты в цикле Кребса, три- и дикарбоновых кислот вследствие
низкой чувствительности системы окисления этой кислоты и недостатку
кислорода. Это приводит к повышению трансмембранного градиента
концентрации кислорода, активации аэробного метаболизма,
интенсивности сосудисто-тканевого транспорта кислорода. Особое
значение этот механизм имеет при кардиоваскулярной патологии,
требующей повышения доставки и потребления кислорода в миокарде,
быстрого ресинтеза АТФ и увеличения уровней креатинфосфата и
макроэргов в миокарде, печени, головном мозге (рис. 3).
С этой целью целесообразно использовать 1,5% Реамберин –
сбалансированный полиионный раствор, содержащий 44,7 ммоль
сукцината и 15,0 N – метиламмония натрия сукцината, благодаря чему
Реамберин обладает антигипоксическим и антиоксидантным
действием. Кроме того, он обладает гепато-, нефро-,
кардиопротекторным действием благодаря способности активировать
антиоксидантную систему ферментов и угнетать процессы перекисного
окисления липидов в ишемизированных тканях. Наряду с этим Реамберин
улучшает микроциркуляцию и реологические свойства крови.
Применение антигипоксантов, антиоксидантов и стимуляторов
естественного гемопоэза позволяет говорить о так называемой
антигипоксической гемодилюции, что предусматривает введение
Реамберин 5 мл/кг, рекомбинантного эритропоэтина или эпобиокрина 4
– 10 000 ЕД и фолиевой кислоты 200 мкг. Это обеспечивает
антигипоксический, антиоксидантный, гепато- и нефропротекторный
эффекты, оптимизацию тканевого метаболизма, что улучшает
показатели доставки и потребления кислорода, а также показатель
транскапиллярного обмена. Наряду с этим стимуляция пролиферации,
дифференцировки созревания эритроцитов, синтеза гемоглобина и
обеспечение эффективного эритропоэза за счет устранения «прескока»
эритроцитов создает новый уровень устранения анемии-гипоксии.

Рис. 3. Идеология современного крововосполнения
Целесообразность использования рекомбинантного человеческого
эритропоэтина (рЧЭПО) обусловлена способностью препарата
стимулировать пролиферацию и созревание ранних и промежуточных
эритропоэтинчувствительных клеток в отделе эритроидных
клеток-предшественниц, индуцировать терминальную дифференциацию
поздних эритропоэтинчувствительных клеток в проэритробласты,
повышать количество митозов за единицу времени у делящихся клеток
эритрона и ускорять созревание неделящихся нормобластов и
ретикулоцитов, стимуляцию синтеза гемоглобина, исключая одно или
несколько обязательных промежуточных митотических делений
(«перескок» делений). При этом известно, что если уровень
эндогенного эритропоэтина низкий, введение рЧЭПО приводит к
увеличению общего уровня гормона, действующего на эритроидный
росток. Это увеличивает продукцию костным мозгом эритроцитов за
счет большей выживаемости колониеформирующих эритроидных единиц,
что важно в послеоперационный период. В то же время, если уровень
эндогенного эритропоэтина соответствует степени анемии, то при
введении рЧЭПО количество гормона в костном мозге увеличивается,
что способствует выживанию всех колониеформирующих единиц.
Этим определяется такое основное лечебное свойство, как
антианемическое, а также ликвидация зависимости от трансфузий
аллогенной крови и потребности в них. Следствием этого является
нормализация иммунного ответа, снижение опасности острых
инфекционных осложнений и белкового катаболизма. Устранение
последствий гипоксии-анемии определяется и такими эффектами
использования эпобиокрина, как нормализация индекса массы левого
желудочка и сердечного индекса, в сравнении с таковыми у больных, у
которых эпобиокрин не применяли.
Фолиевая кислота способствует созреванию мегалобластов и
образованию нормобластов, стимулирует эритропоэз, участвует в
синтезе аминокислот, нуклеиновых кислот, пуринов и
пиримединов.
Кроме эпрекса можно использовать рекормон, трехразовое
применение которого по 6000-9000 МЕ предотвращает развитие
анемии.
Эритростим – это очищенный рекомбинантный эритропоэтин, по
биологическим свойствам идентичный естественному гормону. В дозе
250-500 ЕД/кг обеспечивает профилактику анемии.
В качестве альтернативы донорским эритроцитам следует
использовать как гемоглобиновые, так и негемоглобиновые переносчики
кислорода: перфторуглеводы и растворы модифицированного
гемоглобина. Эти препараты не требуют серологического подбора,
практически инфекционно безопасны, а также, что принципиально
важно, обеспечивают доставку кислорода тканям независимо от
нарушения кровотока в них, так как имеют низкий размер частиц
(150-260 кД).
К таким препаратам относятся геленпол, одна доза которого
содержит 4 г полимеризованного гемоглобина человека. Быстро
увеличивая насыщение артериальной крови кислородом, уменьшая
гемическую гипоксию, геленпол улучшает кровообращение, коронарный
кровоток, позволяет в 2 раза уменьшить объем трансфузии
аллоэритроцитов, в том числе благодаря стимуляции гемопоэза.
Перфторуглеводы в отличие от гемоглобина не образуют соединений
с кислородом, а растворяют его соответственно парциальному
давлению, не метаболизируются, быстро удаляются из сосудистого
русла в течение 12 часов после внутривенного введения эмульсии,
могут накапливаться в легких и селезенке. Перфторан повышает
транспорт O2, таким образом устраняя тканевую гипоксию,
улучшая газотранспортную функцию обеспечивает гемодинамический,
детоксикационный и иммунокорригирующий эффекты, что позволяет в 2
раза уменьшить использование гемоглобиновых источников
кислорода.
Перфторан как пассивный переносчик кислорода обеспечивает также
возможность свободного «прохождения» газов через ткани и
определяет «демпер-подпор» для кислорода.
Таким образом, технология современного кровезамещения включает
изменение тактики: замена либеральной трансфузии и «критического»
показателя гематокрита и гемоглобина рестриктивной инфузией.
показателями DO2/VO2, и оптимизация сердечного выброса
(рис. 3).
В трансфузионное сопровождение целесообразно включать следующие
мероприятия: уменьшение кровопотери, оптимизацию толерантности к
гипоксии-анемии, альтернативу аллотрансфузии.
Выводы
Выбор тактики восполнения кровопотери должен предусматривать
толерантность к гипоксии-анемии.
Гемодилюция при устранении кровопотери является одной из
важнейших составляющих лечения и профилактики последствий
кровопотери, должна включать современные плазмонаполнители и
препараты, обладающие антигипоксическими и антиоксидантными
свойствами. Наряду с эритроцитарными донаторами кислорода
целесообразно использование рекомбинантного эритропоэтина или
эпобиокрина с фолиевой кислотой.
При кровопотерях, резистентных к общепринятой гемостатической
терапии, следует использовать рекомбинантный фактор свертывания
новосевен.
При коагулопатических кровотечениях как альтернативу введения
плазмы следует применять октоплекс – донатор факторов свертывания
(II, VII, IX, X).
Современное трансфузионное сопровождение
|
Уменьшение кровопотери
|
Оптимизация толерантности
к гипоксии
|
Альтернатива аллотрансфузии
(Г.И. Козинец, Д.Д. Проценко и др. 2005; Sachs U.J., Hattar K., et
al., 2006)
|
- предоперационное резервирование крови
- аутологическая гемотрансфузия
- Novo Seven
- транексамовая кислота
- экзацил (acid)
- октаплекс
- Cell Saver
|
- рестриктивная стратегия
- оптимизация сердечного выброса
-
оптимизация вентиляции
и оксигенации
- антиоксиданты
- антигипоксанты
- нормоволемическая гемодилюция
- оптимизация гемопоэза:
- эритропоэтин
- фолиевая кислота
- венофер
|
- реинфузия крови
- импровизированная
- аппаратная
- внутриоперационное резервирование цельной крови
-
предоперационное резервирование компонентов аутокрови за 3 суток
до операции
|
Литература
-
Березницький Я.С, Бойко В.В., Брусницина М.П. и др.
Стандарти організації та професійно орієнтовані протоколи надання
невідкладної допомоги хворим з хірургічною патологією органів
живота та грудної клітки. – К., 2008. – С 42-109.
-
Брюсов П.Г. Гемотрансфузионная терапия при
кровопотере. – M.. 1998. 197 c.
-
Бубнов В.А. Протокол восполнения интраоперационной
кровопотери компонентами аутокрови с использованием системы «Redax
Dreutech Surgical». Курс лекций. – 2006. – С. 294-296.
-
Буланов А.Ю., Городецкий В.М., Серебрийский И.И.
Объемозамещаемые растворы в протоколах интенсивной тера пии:
принципы выбора препаратов // Вестник интенсивной медицины. – 2005.
– №3 – С. 104-106.
-
Буланов А.Ю., Городецкий В.М., Шумутко Е.М.
Протокол терапии острой кровопотери // Вестник интенсивной терапии.
– 2004. N s5. C. 193-216.
-
Городецкий В.М. Метаболические нарушения при
массивных трансфузиях. Новости для специалистов, пациентов,
доноров. – ГНУ РАМН. 2007.
-
Гринь В.К., Шано В.П. и др. Технологии
аутотрансфузии длявосполнения кровопотери. – Донецк, 2009. – 263
с.
-
Жибурт Е.Б. Принципы безопасной трансфузии.
Учебно-метод. рекомендации. – М.: Элви Интертрейл, 2007. – 25
с.
-
Кемминг Т. Анемия в интенсивной терапии: лечить или
выжидать? Курс лекций, 1991-2006. - С. 170-175.
-
Клигуненко Е.Н. Острая кровопотеря //Лікування та
діагностика. – 2002. – №3. – С. 20-28.
-
Кожура В.Л., Новодержник Н.С., Кирсанова А.К.
Острая массивная кровопотеря: механизмы компенсации //
Анестезиология и реаниматология. – 2002. – №6. – С. 9-13.
-
Козинец Г.И. Практическая трансфузиология. – М. :
Медицина, 2005. – С. 137-139.
-
Лазоришенец В.В., Лоскутов О.П., Дружина А.Н.
Основные принципы проведения кардиохирургических операций с
использованием кровосберегающих методик: Метод, рекомендации. –
K.. 2006.
-
Маджпур К., Спан Д.Р. Новое в переливании
компонентов красной крови // Актуальные проблемы анестезиологии и
реаниматологии // Освежающий курс лекций. – 2005. – Вып. П.
Euroanaesthesia. – C. 208-2l5.
-
Пепе А., Мейер И., Цвислер Б., Хаблер О. Как вести
пациента с массивной кровопотерей // Освежающий курс лекций. –
2007.c. 82-91.
-
Пинк Э., Прейзер Ж. Когда переливать кровь
критическим
больным? // Освежающий курс лекций. – 2004. С.195-199.
-
Рагимов А.А. Избранные лекции по частной
трансфузиологии. – М., 2007. – С. 229.
-
Рейнхарт К., Блус Ф. Транспорт кислорода и
оксигенация тканей у пациентов отделения интенсивной терапии //
Освежающий курс лекций. – 2005. –
С. 188-194.
-
Усенко С.В., Шифрин Г.А. Интенсивная терапия при
кровопотере. – Днепропетровск. 2007. – 290 с.
-
Черний В.И., Шлапак И.П., Хизжняк А.А., Городник
Г.А. и др. Место современных многоатомных спиртов (реосорбилакт.
сорбилакт, ксилат) в медицине критических состояний (неотложная
хирургия, педиатрия, нейрохирургия, парентеральное питание) :
Метод. рекомендации. – К., 2006. – 29 с.
-
Шандлей А. Толерантность анемии: стратегия
бескровной хирургии // Бескровная хирургия. Coвременные концепции
гемотрансфузионной терапии. – Львов : НВП «Цель». 2000. – С.
1-6.
-
Шифрин ГА. Восстановление биоустойчивости к
кровопотере. – Запорожье, 2007. – 211 с.
-
Якоб С. Транспорт кислорода при критических
состояниях на глобальном и регионарном уровнях // Евроанестезия. –
2006.c. 196-198.
-
Ярочкин B.C., Панов В.П., Максимов П.И. Острая
кровопотеря. – МИА, 2004. – С. 362.
-
Anemia and Blood Transfusion in Critically ill
Patients, American medical association. All rights reserved. –
2002, – V. l2. _ P. l499-l507.
-
Boldt J., Priebe H.J. Intravascular volume
replacement therapy with synthetic colloids: is there an influence
on renal function? // Anaest. Analg. - 2003. - v 96(2). – P.
376-382.
-
Gorwin H.T., Ciettinger A., Pearl R.G. at al. The
CR1T Study: anemia and blood transfusion in the critically ill
current Clinical practice in the United States // Crit. Care Med.
– 2004. V. 32. – P. 39-52.
-
Dr. Enzo Saek Herrera. Introduction to the use of
blood in Emergency Situation // Alternative Transfusion Practices
in Emergency Situations. – 2004. – Second Edition. October. – P.
7.
-
Gohel M.S. Bulbulia R.A.' Slim F.J. et
al. How to approach major surgery where patients refuse blood
transfusion // Aun.R.Coll. Surg. Eugl. – 2005. – v 87. – P.
3-14.
-
Gonzalo Cardemil Herrera. Editorial. Alternatives
to the use of blood and derivatives // Alternative Transfusion
Practices in Emergency Situation. – 2004. Second Edition. October.
– P. 19-23.
-
Gonzalo Cardemil Herrera. Editoria // Alternative
Transfusion. Practices in Emergency Situation. – 2004. – Second
Edition. October. – P. 5.
-
Goodnough Г.Т., Skikne B., Brungnara С.
Erythropoetin, iron
and erythropoesis // Blood. – 2000. – V. 96. – P. 823-833.
-
Fower R.A., Berenson M. Blood conservation in the
intensive care unit / /Crit. Care Med. - 2003. - v 3l (l2suppl.).–
P. 715-720'
Полный список литературы, включающий 46 пунктов, находится в
редакции.