Широкий диапазон неспецифического лечебного действия янтарной
кислоты и её солей обусловлен биологической ролью во
внутриклеточном метаболизме. Янтарная кислота служит продуктом
пятой и субстратом шестой реакции в биохимическом цикле Кребса [5,
11, 12]. Энергоёмкость системы, использующей янтарную кислоту, в
сотни раз превосходит все другие системы образования энергии в
организме [2, 3, 11]. Использование физиологических доз янтарной
кислоты позволяет выявить две главные группы эффектов: 1)
непосредственное (прямое) влияние янтарной кислоты на клеточный
обмен; 2) влияние янтарной кислоты на транспорт свободного
кислорода в ткани.
Для пополнения пула всех органических кислот цикла Кребса у
человека достаточным оказалось экзогенное введение лишь одного
сукцината, который является стимулятором синтеза восстановительных
эквивалентов в клетке. Биологическое значение данного явления
заключается в быстром ресинтезе клетками АТФ и в повышении их
антиоксидантной резистентности. Преимущества сукцината перед
другими субстратами клеточного дыхания наиболее выражены в
условиях гипоксии. В основе лечебно-профилактического действия
янтарной кислоты и её соединений находится сложное
трансформирующее влияние на процессы тканевого метаболизма –
клеточное дыхание, ионный транспорт и синтез белков. В таких
условиях выраженность и направленность модификаций определяется
исходным функциональным состоянием тканей, а конечный результат
этих превращений выражается в оптимизации параметров их
функционирования. Именно эти возможности и уникальные эубиотические
свойства позволяют отнести янтарную кислоту к
лечебно-профилактическим препаратам нового поколения – к так
называемым «умным лекарствам» [8]. Особенно эффективно
использование препаратов янтарной кислоты в комплексном лечении
критических состояний, учитывая их патогенетическую
направленность, сопровождающихся гипоксией, эндогенной
интоксикацией, полиорганной дисфункцией и иммуносупрессией [5, 6,
8, 9].
Учитывая, что гипоксия и интоксикация взаимосвязаны и
взаимообусловлены («эффект взаимного потенцирования или
отягощения»), и являются основными факторами патогенеза и
танатогенеза тяжёлых интраабдоминальных инфекционных процессов, то
изучение антигипоксического и антитоксического действия
препаратов янтарной кислоты, а также и их влияния на органы и
системы человека, является важной задачей клиницистов и
фармакологов [3, 5, 7, 9, 11, 12].
Целью настоящего исследования явилось изучение
антигипоксического и антитоксического действия 1,5% раствора
Реамберина у больных с тяжёлыми интраабдоминальными инфекционными
процессами.
Материалы и методы. Проведена комплексная оценка
результатов лечения 59 пациентов с тяжёлыми интраабдоминальными
инфекционными процессами (табл. 1). У 52 (88,1%) больных
диагностированы тяжёлый абдоминальный сепсис или септический шок.
Всем пациентам выполнены оперативные вмешательства, направленные
на устранение источника интраабдоминального инфекционного
процесса, проводилось комплексное антибактериальное,
иммунотропное, симптоматическое лечение, коррекция нарушений
гомеостаза. Основную группу составили 29 пациентов, в комплексное
лечение которых был включен 1,5% раствора Реамберина (НТФФ
«Полисан», Санкт – Петербург, Россия), представляющий собой
сбалансированный полиионный раствор с добавлением янтарной
кислоты. Препарат содержит: натрия хлорида – 6,0 г; калия хлорида
– 0,3 г; магния хлорида – 0,12 г; N- (1-дезокси-D-глюцитол-1ил) -
'N-метиламмония натрия сукцината - 15,0 г; вода для инъекций - до
1 л. Ионный состав раствора: натрия 142,4 ммоль; калия 4,0 ммоль;
магния 1,2 ммоль; хлорида 109,0 ммоль; сукцината 44,7 ммоль;
'N-метилг-люкаммония - 44,7 ммоль. Препарат вводили от 400 до 800
мл в сутки со скоростью до 90 капель в минуту (4-4,5 мл/мин) на
протяжении 7-12 дней.
Таблица 1. Исследуемые группы
больных.
|
Заболевания
|
Основная группа
(n = 29)
|
Группа сравнения
(n = 30)
|
|
Общее число больных
|
Наличие сепсиса или септического шока
|
Общее число больных
|
Наличие сепсиса или септического шока
|
|
Деструктивный панкреатит с гнойно-некротической секвестрацией
поджелудочной железы
|
7
(24,1%)
|
6
(85,7%)
|
9
(30%)
|
8
(88,9%)
|
|
Деструктивный холецистит, гнойной холангит, абсцессы печени
|
4 (13,8%)
|
4
(100%)
|
5 (16,6%)
|
5
(100%)
|
|
Перитонит различного генеза (воспалительный, перфоративный,
травматический, послеоперационный)
|
12 (41,4%)
|
11
(91,7%)
|
14
(46,7%)
|
12 (85,7%)
|
|
Тяжелая механическая кишечная непроходимость
|
6
(20,7%)
|
5
(83,3%)
|
2
(6,7%)
|
1
(50%)
|
|
Всего:
|
29 (100%)
|
26 (89,7%)
|
30 (100%)
|
26 (86,7%)
|
Основная группа и группа сравнения были идентичны в соответствии
со шкалами АР АС-НЕ-П, SAPS-II и АС («абдоминальный сепсис»), У
всех пациентов регистрировали частоту сердечных сокращений (ЧСС),
частоту дыхания (ЧД) в 1 минуту, артериальное (АД), центральное
венозное давление (ЦВД). Среднее артериальное давление (САД)
рассчитывали по формуле Хикема [1]. Системную гемодинамику
исследовали методом эхокардиографии. При этом определяли ударный
(УдО) и минутный объемы сердца (МОС), ударный (УИ) и сердечный
индексы (СИ), рассчитывали общее периферическое сопротивление
сосудов (ОПСС) [10]. Параметры газового состава и
кислотно-основного состояния (КОС) крови, показателей общего и
биохимического анализов крови оценивали с помощью автоматических
анализаторов. Степень эндогенной интоксикации определяли путем
оценки уровня молекул средней массы (МСМ) в сыворотке крови по
методу Н.И. Габриэляна и др. (1983); подсчета лейкоцитарного
индекса интоксикации (ЛИИ) по способу Я.Я. Каль-Калифа (1941), а
также путем вычисления лейкоцитарного индекса сдвига по Н.И.
Ябучинскому (ЛИЯ) (1983) [4]. Полученные данные обрабатывали
статистически с помощью прикладных компьютерных программ.
Результаты и обсуждение. Исходно у исследуемых пациентов
отмечалось достоверное повышение ЧСС, САД, ОПСС по сравнению с
контролем, (р < 0,05) при снижении ЦВД, УдО и МОС, что
свидетельствовало о явлениях гиповолемии и систолической дисфункции
миокарда в обеих группах (табл. 2). Стабилизация САД достигалась
за счет существенного повышения ОПСС (в 1,47 и 1,48 раз
соответственно р < 0,05). Данные нарушения коррелировали с
выраженностью тахипноэ, снижением рН, и уменьшением BE, что
указывало на развитие острой дыхательной недостаточности и
прогрессирование метаболического ацидоза. У пациентов основной
группы на седьмые сутки послеоперационного периода (рис. 1а)
отмечена тенденция стабилизации основных показателей
гемодинамики, (р > 0,05). Показатели ЦВД указывали на не
полностью восстановленные гиповолемические нарушения, что
подтверждалось также сниженными (по отношению к норме)
показателями ударного и минутного объема сердца (в 1,09 и 1,02 раз
соответственно) на фоне несколько сниженного ОПСС. На 7-е сутки
после операции у пациентов основной группы отмечены: нормализация
частоты дыхания; относительная стабилизация рН сыворотки
крови.
У больных группы сравнения на седьмые сутки после операции (рис.
16) сохранялись гиповолемия; снижение ЦВД (в 1,67 раза по
отношению к норме; р < 0,05), УО и МОС (в 1,17 и 1,04 раза по
отношению к норме, соответственно; р < 0,05), которые
компенсировались за счет умеренно выраженной тахикардии.
Стабилизация САД достигалась увеличением ОПСС в 1,32 раза (по
отношению к норме) (р<0,05). Расстройствам системной
гемодинамики соответствовали умеренное тахипноэ, метаболический
ацидоз, снижение уровней рН и BE.
Применение реамберина у пациентов основной группы к седьмым
суткам послеоперационного периода способствовало уменьшению
уровня эндогенной интоксикации и воспалительного синдрома
(снижение МСМ в 1,96 раз, р < 0,05), ЛИЯ в 2,49, р < 0,01)
(табл. 3). При этом оба этих показателя были ниже данных группы
сравнения на 29,7% и 26,7%, хотя и превышали норму на 8,3% и
22,9%, соответственно.
Механизм детоксикационного действия реамберина достаточно
сложен. Исходя из того, что одним из ведущих синдромов интоксикации
является тканевая гипоксия, можно полагать, что выраженное
антигитоксическое влияние препарата на органы и ткани (в первую
очередь, систем естественной детоксикации - печени, почек, ЖКТ),
позволяет повысить дезинтоксикационный потенциал систем
естественного обезвреживания избыточных продуктов метаболизма и
токсических веществ [1, 3, 5, 6, 8, 9].
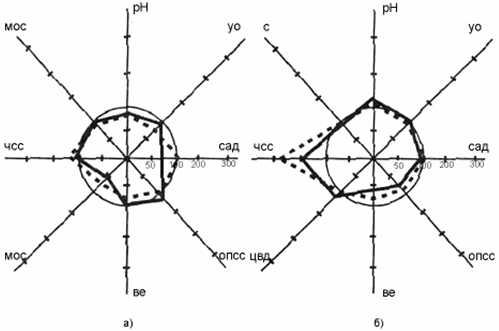
Рис. 1. Изменения показателей системной
гемодинамики
и КОС у больных с тяжёлой интраабдоминальнои инфекцией
в зависимости от способов лечения.
а - больные основной группы (n = 29);
б - больные контрольной
группы (n = 30).
-- исходный уровень;
- показатели после лечения на 7-е
сутки.
Таблица 3. Динамика эндогенной интоксикации
(МСМ, усл. ед.)
и воспалительного синдрома (ЛИЯ, усл. ед.) у больных
с тяжелой интраабдоминальнои инфекцией
при различных способах лечения (М ± m)
|
Исследуемая группа
|
Показатели эндогенной интоксикации и
воспалительного синдрома у исследуемых больных
|
|
МСМ (усл. ед.)
|
ЛИЯ (усл. ед.)
|
|
До лечения
|
После лечения
|
До лечения
|
После лечения
|
|
Основная группа
(n = 29)
|
0,51 ± 0,09
|
0,26 ± 0,03*
|
6,02 ± 0,68
|
2,41 ± 0,55*
|
|
Группа сравнения
(n = 30)
|
0,5 ± 0,06
|
0,37 ± 0,07
|
5,98 ± 0,23
|
3,29 ± 0,4*
|
|
Контрольная группа
(n = 10)
|
0,24 ± 0,04
|
1,96 ± 0,14
|
Примечание:
* - различия достоверны по сравнению с нормой; **
- различия достоверны в сравниваемых группах при р < 0,05; ***
- различия достоверны в сравниваемых группах при р < 0,05; (до
лечения) при р < 0,05; # / ## /### - то же при р <
0,01.
В основной группе пациентов после проведенного лечения на фоне
снижения лейкоцитоза, отмечены рост содержания относительного и
абсолютного количества лимфоцитов (на 35,3% и 21,8% соответственно
по отношению к исходному уровню). При этом отмечено увеличение
иммунорегуляторного индекса (ИРИ) и лейкоцитарного интегрального
показателя (ЛИП) [на 14,8% и 7,8%, соответственно], что
свидетельствовало об активации иммунного ответа посредством
повышения клеточного звена иммунитета.
Таким образом, применение реамберина в комплексном лечении
больных с тяжёлой интраабдоминальнои инфекцией позволило к 7-м
суткам послеоперационного периода стабилизировать
гиповолемические нарушения, нормализовать показатели
сократительной функции миокарда и общего периферического
сопротивления при одновременной нормализации показателей КОС
организма, V пациентов при использовании этого препарата отмечено
достоверное снижение показателей эндогенной интоксикации и
воспалительного синдрома; тенденция к нормализации Т-клеточного
звена иммунитета за счет повышения его лимфоцитарной активности. Во
многом данный эффект реамберина обусловлен его дезинтоксикационным,
антигипоксическим, антиоксидантным, гепато-, нефро- и
кардиопротевторным действием. Он определяется способностью
препарата усиливать компенсаторную активацию аэробного
гликолиза, снижать степень угнетения окислительных процессов в
цикле Кребса в дыхательной цепи митохондрий клеток с увеличением
внутриклеточного фонда макроэнергетических соединений
аденозинтрифосфата (АТФ и креатинфосфата, стабилизацией клеток
иммунной системы человека [2, 3, 7, 8, 11].
Комплексное использование реамберина позволило улучшить течение
послеоперационного периода по отношению к группе сравнения. При
этом отмечено более быстрое (в среднем, на 2,52 дня) разрешение
воспалительного синдрома, явлений полиорганной дисфункции (на 2,78
дня) и снижение частоты гнойно-воспалительных послеоперационных
осложнений на 4,67%. При этом отмечено снижение общей летальности
в основной группе с 26,7 до 20,7%. Включение реамберина в
комплексную терапию больных с тяжёлой интраабдоминальной инфекцией
способствует повышению резистентности к гипоксии и снижению
выраженности клинических проявлений синдромов эндогенной
интоксикации и полиорганной недостаточности, позволяя улучшить
непосредственные результаты лечения - снизить частоту
послеоперационных осложнений и уменьшить общую летальность.
Таким образом, реамберин, как новое средство метаболического
действия, относящееся по клинической классификации к субстратным
антигипоксантам [9], в условиях тяжёлого интраабдоминального
инфекционного процесса позволяет достоверно уменьшить проявления
гипоксии тканей. Вероятным механизмом действия препарата в
условиях критического состояния является повышение устойчивости к
гипоксии за счет энергообеспечивающих интермедиатов цикла Кребса
путём положительного влияния на аэробные процессы в клетках,
уменьшения продукции свободных радикалов и восстановления
энергетического потенциала клеток, активации антиоксидантной
системы ферментативного звена, снижения процессов перекисного
окисления липидов и инициации мембраностабилизирующего эффекта [5,
7-9, 11, 12].
Список литературы
- Зильбер А.Л. Клиническая физиология в анестезиологии и
реаниматологии.- М.: Медицина, 1984-479 с.
- Ивницкий Ю.Ж.). Интенсивность клеточного дыхания и
радиорезистентность организма: Автореф. … д-ра мед. наук.- СПб,
1994.- 56 с.
- Ивницкий Ю.Ю., Головко А.Л., Сафронов Г.А. Янтарная кислота в
системе средств метаболической коррекции функционального состояния
и резистент ности организма.-СПб: Лань, 1998.- 82 с.
- Саенко В.Ф., Голопыхо Л.Л., Викторов А.Л. и др. Клиническая
фармакология аминогликозидов и их роль в профилактике и лечении
хирургической инфекции // Клинич. хирургия.- 1993.- № 3.- С.
56-59.
- Коваленко А.А., Романцов M.Г. Реамберин 1,5% для инфузии от
эксперимента в клинику. СПб., 1999.-112 с.
- Плоткин Л.Л., Конашев A.Г., Киршенштейн А.С. и др. Оценка
показателей кровообращения и кислородно-транспортной функции крови
в зависимости от уровня эндогенной интоксикации у больных с
абдоминальным сепсисом // Анестезиол. и реаниматол.- 2000.- № 2.-
С. 35-36.
- Бисенков Л.Л., Замятин М.Л., Гунят Р.Я. и др. Применение
реамберина для профилактики и лечения гастродуоденальных эрозий и
язв после операций на легких // Международный медицинский журнал.-
2002.- № 5.- С. 435-439.
- Исаков В.А., Сологуб Т.В., Коваленко А.Л. и др. Реамберин в
терапии критических состояний: Руководство для врачей.- Изд.
4-ое., доп. /.- СПб.: Полисан, 2002.- 160 с.
- Оболенский С.В. Реамберин - новое средство для инфузионной
терапии в практике медицины критических состояний: Методические
рекомендации /Санкт-Петербургская академия последипломного
образования: - СПб., 2002.- 24 с.
- Сиприя A.Г., Тальвик Р.М. Прогностическое значение некоторых
показателей центральной гемодинамики, кислородного баланса и
внутрилегочного шунтирования у больных с сепсисом в критическом
состоянии // Анестезиол. и реаниматол.- 1993. № б.-С. 40-43.
- Терапевтическое действие янтарной кислоты / Под ред. М.Н. Кондрашовой.-Пущино: Ин-т биофизики АН СССР, 1976.- 234 с.
- Янтарная кислота в медицине, пищевой промышленности, сельском
хозяйстве / Под ред. М.Н. Кондрашовой, Ю.Г. Калинского, Е.И.
Маевского,-СПб.-Пущино: ОНТИ РАМН, 1996.- 300 с.
Summary
The basic pharmacological effect of a preparation is caused
by ability to strengthen compensatory activity of the aerobic
glycolisis, to reduce a degree of the oppressions of oxidizing
processes in cycle of the Krebs in conditions of the hypoxia with
is increased contents of the ATF and creatinphosphatis.
Ream-berinum activates an oxide system of enzymes and brakes
processes of peroxide oxidations of the fats in is-chemising
bodies, rendering of the membranostabilizing action. The
preparation can be used as the proofreader characteristic for
patients with heavy intra-abdominal infection complicated an
abdominal sepsis or aseptic shock with the expressed phenomena of
the endogen intoxication, multiple organ insufficiency and
frustration of a power metabolism. Application of a preparation
allows lowering a level of the death rates and frequency of
postoperative complications in this heavy group of
patients.
| Версия для печати |
| Документ в формате PDF |