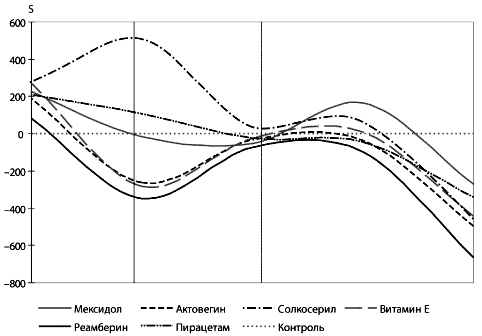
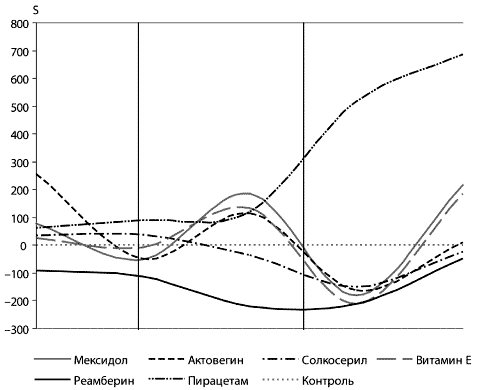
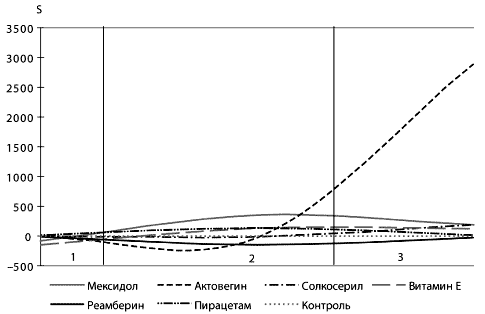
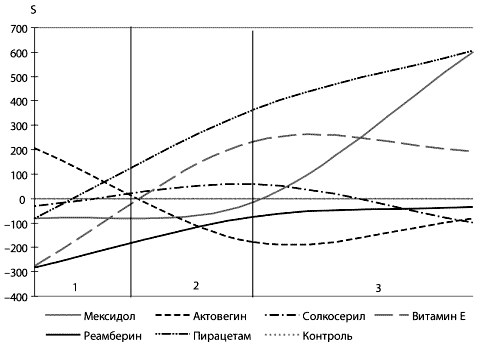
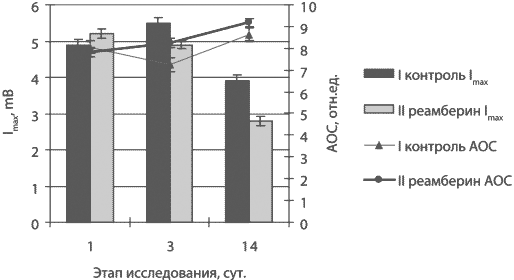
Антиоксиданты обладают мембраностабилизирующим эффектом.
Существуют достоверные различия в мембраностабилизирующем эффекте
антиоксидантов в зависимости от клинического синдрома и степени
тяжести. Исходя из проведенных исследований по
мембраноста-билизирующему действию антиоксидантов для клинических
синдромов и групп (АРАСНЕ II) больных установлено, что:
A.
Реамберин
действует эффективнее других
антиоксидантов при САС; при ССВО и СПОН действует эффективно
независимо от величины АРАСНЕ II, является препаратом выбора для
всех групп больных по синдрому ОЦН.
Б.
Мексидол
обладает сравнительно
умеренным эффектом для пациентов 1-й и 2-й групп при ОЦН,
эффективен у пациентов 1-й группы при СПОН, использование его при
САС не повышает антиоксидантный потенциал, а при ССВО отмечен
«преходящий» эффект.
B.
Актовегин –
второй по эффективности
препарат при САС, обладает выраженным антиоксидантным эффектом для
пациентов 1-й и 2-й групп при СПОН и для 2-й и 3-й групп больных с
ОЦН, но имеет временный эффект при ССВО.
Г.
Солкосерил
имеет меньший
антиоксидантный эффект по сравнению с реамберином (ССВО). Выявлено
положительное качество препарата — повышение эффекта на фоне роста
баллов АРАСНЕ II; подобно пирацетаму, действует у пациентов 1-й
группы и, в отличие от него, обладает мембраностабилизирующим
действием у пациентов с тяжелыми формами ОЦН (3-я группа),
использование же его при САС и СПОН не повышает антиоксидантный
потенциал.
Д.
Витамин Е
имеет выраженный эффект
стабилизации клеточной мембраны, но только у пациентов 1-й группы
при ОЦН, имеет временный эффект при ССВО, действие его при СПОН
ограничивается 1-й группой пациентов.
Е.
Пирацетам
обладает позитивным эффектом
лишь на ранних стадиях угнетения сознания при ОЦН, неэффективен
при САС, ухудшает антиоксидазные свойства мембран эритроцитов при
ССВО и СПОН.
Таким образом, можно рекомендовать реамберин к использованию в
отделении реанимации и интенсивной терапии в комплексном лечении
синдромов абдоминального сепсиса, системного воспалительного
ответа, полиорганной и церебральной недостаточности
Острая кровопотеря
при язвенных гастродуоденальных
кровотечениях
(ЯГДК) остается важнейшей проблемой
экстренной хирургии желудочно-кишечного тракта, летальность
составляет от 5 до 14%. Патологические эффекты острой кровопотери
связаны с двумя важнейшими факторами – снижением объема
циркулирующей крови (ОЦК) и уменьшением количества гемоглобина.
Следствием этого являются нарушения периферического кровотока,
развитие ишемии (гипоксии) органов и тканей. Прогрессирование
тканевой ишемии сопровождается накоплением недоокисленных
кислородом продуктов обмена. В митохондриях (Мх) метаболические
процессы переходят на анаэробный путь окисления, который вызывает
накопление лактата, что способствует развитию метаболического
ацидоза.
С.С.
Моргуновым2 (Ижевск) изучена клиническая эффективность реамберина
у больных с гастродуоденальным кровотечением.
В
обследование включены пациенты с ЯГДК в возрасте от 17 до 80 лет
(46,9 ± 18,1), поступившие в экстренном порядке с признаками
геморрагического шока и тяжелой степенью кровопотери (дефицит ОЦК
– 30-40% и ГО – 50-60%).
Больные разделены на две группы, тяжесть состояния которых не
различалась по шкалам APACHE II (от 21 до 25 баллов) и SAPS II
(52,1 ±2,5 балла) при поступлении. Основная группа состояла из
пациентов, которым наряду со стандартной интенсивной терапией
проводили
инфузии реамберина 1,5% по 400 мл 2 раза в
сутки
(1-я группа), и группы больных (2-я), лечение которых
проводили по традиционной схеме. Этапы исследования: при
поступлении – I этап, II – через 24 часа, III – через 48 часов, IV
– через 72 часа.
При включении в интенсивную терапию
реамберина
сокращалось время пребывания пациентов в ОРИТ, уменьшалась частота
осложнений, снижались летальные случаи (см. таблицу). Применение
реамберина у больных с тяжелой степенью кровопотери показало
клиническую эффективность препарата, что проявилось снижением в
1,6 раза летальных исходов, частоты развития осложнений,
сокращением периода нахождения в ОРИТ (соответственно в 1,5 и 1,3
раза).
Реамберин удовлетворительно переносится больными. Реакций и
осложнений при использовании реамберина во время и после инфузии
не отмечалось.
Нарушения метаболизма в организме при критических
состояниях (полиорганная недостаточность, сепсис)
нередко
сопровождаются изменениями кислотно-щелочного состояния, как и
наоборот, серьезные сдвиги кислотно-щелочного гомеостаза оказывают
влияние на состояние метаболических процессов организма.
С.
В. Синьковым, К.Д. Зыбиным (Краснодар) изучено влияние
реамберина на метаболические процессы при сепсисе.
Таблица. Клинические критерии эффективности
раствора реамберина
|
Показатель
эффективности
|
1-я группа
(больные, получавшие реамберин)
|
2-я группа
(больные, получавшие базовую терапию)
|
|
Длительность нахождения пациентов
в ОРИТ, сутки
|
4,6±0,4
|
5,7±0,4
|
|
Частота развития
осложнений
(ОРДС, НК, ОПН, ДВС, ПОН), %
|
45,2
|
71,9
|
|
Летальность, %
|
12,5
|
20,0
|
В исследование включено 28 пациентов с септической патологией.
Возраст пациентов колебался от 24 до 65 лет. Верификация тяжести
септического процесса осуществлялась по критериям R. C. Bone (1992)
с выделением таких состояний, как синдром системного
воспалительного ответа (ССВО), сепсис, тяжелый сепсис и
септический шок.
В зависимости от состояния кислотно-щелочного гомеостаза в
исследование вошли пациенты с субкомпенсированным метаболическим
ацидозом (рН не ниже 7,2).
Пациенты разделены на 2 группы: в 1-ю группу вошли лица,
получающие на фоне стандартной интенсивной терапии
реамберин
в дозе 10-20 мл/кг/сут в течение 5 дней,
во 2-ю группу –
пациенты, получающие стандартную интенсивную терапию.
Применение реамберина показало свою эффективность, позволив
добиться нормализации кислотно-щелочного состояния, азотного
баланса, снизить эндогенную интоксикацию, а как следствие,
уменьшить тяжесть состояния больных вследствие нормализации
метаболических процессов у критических пациентов.
Выраженные метаболические нарушения, возникающие при
сахарном диабете,
являются основой для развития осложнений
со стороны ЦНС. В основе патофизиологических изменений в развитии
диабетического кетоацидоза лежат нарушения обмена веществ, в
первую очередь углеводного, и энергетики клетки. Когда речь идет о
сахарном диабете, для избежания полипрагмазии целесообразно
выбирать препараты, сочетающие эффекты активации метаболизма,
улучшения гемодинамики и нормализации углеводного обмена. Таким
условиям отвечает реамберин – стимулятор утилизации кислорода и
глюкозы в условиях ишемии и гипоксии, увеличивающий транспорт и
накопление глюкозы в клетках, улучшающий аэробный синтез
макроэргических соединений и повышающий энергетические ресурсы
нейронов, препятствуя их гибели.
В.
А.
Сединкин, Е.Н. Клигуненко3> (Днепропетровск) провели оценку роли реамберина в
интенсивной терапии диабетического кетоацидоза.
Под наблюдением находилось 59 больных сахарным диабетом 1-го
типа (23 мужчины и 36 женщин) в возрасте от 17 до 55 лет (средний
возраст 37 лет). У всех больных течение сахарного диабета
осложнилось диабетическим кетоацидозом, сопровождающимся
расстройствами сознания (до комы или прекомы). В зависимости от
интенсивной терапии больные были разделены на две группы. 1-я
группа (30 человек) получала лечение по традиционной схеме.
Больным 2-й группы (29 человек) в интенсивную терапию был включен
реамберин.
Препарат вводили внутривенно капельно в дозе 400
мл 1,5% раствора 1 раз в день до 5 суток
на фоне
традиционной базисной интенсивной терапии. Традиционная интенсивная
терапия включала регидратацию, коррекцию водно-электролитных
нарушений, инсулинотерапию, терапию, направленную на улучшение
микроциркуляции, лечение инфекционно-воспалительных заболеваний,
симптоматическую терапию.
Использование реамберина способствовало улучшению показателей
обмена кислорода, центральной гемодинамики и функций ЦНС, что
свидетельствовало об улучшении газообменной функции легких,
позволяя уменьшить степень гипоксического повреждения головного
мозга и улучшить утилизацию кислорода клетками головного мозга.
Это подтверждалось сравнительной
оценкой когнитивных
функций.
В группе больных, получавших реамберин,
коэффициент устойчивости внимания (КУВ)
с 3-х суток
от момента наблюдения стабильно превышал значения его у больных,
получавших традиционную терапию. Определялся достоверный рост КУВ
к 5-м и 28-м суткам соответственно на 30,2 и 67,9% по сравнению с
3-ми сутками. При исследовании
вербальной памяти у больных 2-й группы отмечался рост количества правильных повторений,
проявляющийся в ускорении запоминания и увеличении количества
правильно запоминаемых слов к 28-м суткам. На фоне традиционной
терапии темп восстановления мыслительных процессов был ниже, чем у
больных, получавших реамберин. Под влиянием реамберина отмечался
рост количества правильных ответов на 5-е и 28-е сутки наблюдения
соответственно на 45,8 и 73,8%, что свидетельствовало о более
высокой сохранности мыслительных процессов после перенесенного
эпизода мозговой гипоксии.
Таким образом, реамберин обеспечивает улучшение доставки и
увеличение потребления кислорода клетками головного мозга.
Нейропротективное действие реамберина на головной мозг у больных
с диабетическим кетоацидозом, осложнившимся прекомой и комой,
проявляется в ускорении процессов восстановления когнитивных
функций как в раннем, так и в отдаленном от перенесенного эпизода
мозговой гипоксии периоде.
Сахарный диабет
(CД) относится к
распространенным заболеваниям. Им страдает около 3-4% населения.
Ожидаемая распространенность СД к 2010 году составит около 215 млн
человек. СД тип 1 составляет 15-20% от всех больных диабетом. В
настоящее время, несмотря на появляющиеся эпидемиологические
данные и результаты многоцентровых исследований,
свидетельствующие о наличии патогенетической взаимосвязи между
метаболическими расстройствами при СД и его осложнениями,
современные клинические руководства и международные рекомендации
не уделяют достаточного внимания новым методам лечения СД,
эффективно воздействующим на метаболические процессы.
Дискуссионным остается вопрос, касающийся применения лекарственных
средств, обладающих метаболическим действием и способствующих
улучшению нейронального метаболизма, стабилизации физиологических
механизмов ауторегуляции мозгового, кардиального и почечного
кровообращения, которые нарушены в условиях энергетического
дисбаланса при СД тип 1. На примере популяции пациентов с сахарным
диабетом (СД тип 1), находящихся в стадии декомпенсации,
И.В. Сарвилиной4
(Ростов-на-Дону)
разработана схема оценки
фармакодинамических эффектов и предложена новая методика оценки
фармакокинетических показателей инфузионной среды «Реамберин 1,5%
для инфузий». Применение реамберина привело к снижению
среднесуточного, максимального и минимального уровней глюкозы,
концентрации малонового диальдегида (МДА), уменьшению
продолжительности скорости образования диеновых конъюгат (ДК) с
увели чением СОД и содержания глутаминовой кислоты в крови.
Выявлено уменьшение выраженности протеинурии, концентрации
креатинина в сыворотке крови и снижение отношения
альбумин/креатинин мочи. В группе пациентов, получавших интенсивную
инсулинотерапию (ИИ) и реамберин, отмечалось выраженное уменьшение
ионов Na+, К+ и хлора в сыворотке крови при
увеличении соотношения Na+/K+,
Mg++и Ca++. Выявлено снижение утренней и
вечерней концентрации АКТГ при увеличении содержания кортизола и
утренних и вечерних показателей Т3 и Т4 и
уменьшение ТТГ. В группе больных, принимавших реамберин,
увеличивалось количество пациентов с удовлетворительным качеством
жизни (по шкале the Diabetes Quality of Life).
Обнаружен высокий терапевтический эффект реамберина 1,5%
раствора для инфузий, связанный с гормонально-метаболическим и
антиоксидантным действием активного вещества. Основной причиной
поражения органов-мишеней (сердце, головной мозг, почки, глазное
дно) при СД тип 1 является поражение сосудов. Основная роль в
развитии сосудистых осложнений СД принадлежит неферментативному
аутоокислительному гликозилированию и окислительному стрессу. При
терапии реамберином увеличивается чувствительность инсулиновых
рецепторов к инсулину и уменьшается гипергликемия, что устраняет
механизмы активации окислительного стресса. Увеличение
чувствительности к экзогенному инсулину связано с положительным
действием сукцината на оксигенацию внутриклеточной среды,
стабилизацию структуры и функции митохондрий, ионный обмен в
клетке, о чем косвенно свидетельствуют внеклеточные изменения
Na+/K+, Са++, хлора,
Mg++. Обнаружены сопряженные изменения функционирования
оси гипофиз—надпочечники и системы ПОЛ-АОС на фоне приема
реамберина. Наиболее вероятной мишенью представляются
глюкокортикоидные рецепторы II и III типа. Механизм их
ингибирования (концепция G. Vallette) обеспечивается вторым
неспецифическим локусом, расположенным вне пределов специфического
глюкокортикоидного локуса глюкокортикоидного рецептора II и
IIIтипа, что вызывает трансформацию специфического
глюкокортикоидного локуса, которая является причиной снижения
глюкокортикоид-связывающей способности рецептора II и III типа.
Возможными механизмами реализации кардио- и вазопротективного
эффекта реамберина (у пациентов с СД тип 1) являются: 1) устранение
неблагоприятных эффектов гипергликемии – угнетение активности
гликозилирования, пероксидации белков и радикала NO; 2) влияние
на биохимические процессы – бета-окисление жирных кислот,
окислительное фосфорилирование глюкозы в миокарде, синтез АТФ,
синтез коллагена в сердце; 3) опосредованное изменение уровня
функционирования нейроэндокринной регуляции (инсулин, кортизол,
Т3).
Уменьшение активности ПОЛ у пациентов с СД тип 1 в ходе приема
реамберина свидетельствует о снижении образования продуктов
неферментативного гликозилирования белков – оснований Шиффа
(обратимых), слабо-обратимых (продуктов Амадори) и необратимых
конечных продуктов гликозилирования. На уровне нефроцита
представляется вероятным возникновение, на фоне приема реамберина,
адаптационного резерва, связанного с активностью
глутаматдегидрогеназного комплекса (происходит снижение
активности глутаматдегидрогеназы, что вызвано увеличением
содержания NAD•Н2, в результате торможения активности
ферментов NAD•Н-дегидрогеназы и цитохромоксидазы в митохондриях
почек). Возможно накопление пиридиннуклеотида за счет генетически
опосредованного синтеза, являющегося аллостерическим регулятором
глутаматдегидрогеназы, что обращает ферментативную реакцию в
сторону образования глутаминовой кислоты, которая способна связать
аммиак. Другим важным следствием обращения этой реакции является
генерирование окисленного NAD, наличие которого обеспечивает
возможность катализа дегидрирования субстратов. На уровне нефроцита
происходит убывание глутамата в цикле Робертса, что способствует
предохранению сукцинатдегидрогеназы от ингибирующего действия
оксалоацетата и обеспечивает достаточно высокий уровень
энергопродукции для клеток органа. Увеличение окисления глутамата
приводит к шунтированию α-кетоглутарата с преобразованием
последнего в цикле Кребса. Наблюдающаяся активация гликолиза
является одним из механизмов, способствующих поддержанию уровня
АТФ, являющегося поставщиком субстратов окисления для цикла
Кребса.
Механизмы реализации
психокорригирующего эффекта
реамберина,
лежащего в основе улучшения качества жизни,
связаны с основными путями синтеза ГАМК с учетом эффекта Вэлша
(компартмента-лизация метаболизма глутамата, глутамина и ГАМК).
Представляется возможным влияние реамберина на активность
окислительного декарбоксилирования α-кетоглутарата с образованием
сукцинил–КоА, так как данная реакция обеспечивает поддержание
суммарной концентрации метаболитов цикла на стационарном уровне.
Образование α-кетоглутарата способствует его дальнейшему участию
как в цикле трикарбоновых кислот, так и в глутаматдегидрогеназной и
трансаминазной реакциях. Сукцинатдегидрогеназная реакция
обеспечивает поддержание энергетического баланса ткани, особенно
на пиридиннуклеотидном участке дыхательной цепи. Основными
энергозависимыми процессами, функция которых улучшается при приеме
реамберина, являются: проведение нервных импульсов; поддержание
пространственной ориентации и конформации структурных единиц
нейрона; образование синаптических структур, функционирование
синапсов; нейрологическая память; трансмембранный перенос
субстратов, нейромедиаторов; аксональный и ретроградный ток.
При тяжелых формах
послеродового эндометрита
важную роль в патогенезе заболевания играют реологические свойства
крови.
И.А. Салов, А.В. Романовская (Саратов)
провели
изучение реологических свойств крови при различных формах
послеродового эндометрита с оценкой эффективности препарата
«Реамберин 1,5% для инфузий» на гемореологические показатели. Под
наблюдением находилось 79 родильниц с послеродовым эндометритом, в
возрасте от 15 до 37 лет, в палате интенсивной терапии 1-й
городской клинической больницы г. Саратова.
В зависимости от выраженности клинических симптомов
интоксикации, гемодинамических нарушений больные разделены на 2
группы.
В 1-ю группу входили 52 женщины с выраженными клиническими
признаками интоксикации: гектическая температура (38,9 ± 0,7°С) с
повторными ознобами, тошнота, рвота, гемодинамические нарушения в
виде бледности кожных покровов, периоральный периорбитальный
цианоз, стойкая тахикардия (110 ±6,5 в 1 мин.), одышка (26-32 в 1
мин.). Во 2-й группе больных (27 чел.) симптомы интоксикации были
менее выражены: гипертермия (37,8±0,5°С), вялость, адинамия,
снижение аппетита, тошнота, умеренная тахикардия.
У родильниц выявлены показатели интоксикации, изменения
вязкостных свойств крови, нарушение тромбоцитарного гемостаза,
которые зависели от тяжести состояния, выраженности послеродового
эндометрита. При тяжелой интоксикации с гемодинамическими
нарушениями развивались изменения реологических свойств крови по
типу синдрома высокой вязкости крови: повышение вязкости крови при
всех скоростях сдвига, вязкости плазмы (р<0,01), увеличение
гематокритного числа, фибриногена (р<0,05), в связи с чем
уменьшается способность эритроцитов обеспечивать адекватную
капиллярную перфузию.
Инфузионно-трансфузионная терапия больным с тяжелым
послеродовым эндометритом должна быть индивидуальной, включать в
себя дезинтоксикационные препараты и препараты, нормализующие
реологические свойства крови. Больные 1-й группы (52 чел.)
нуждались в инфузионной терапии. В качестве дезинтоксикационного
раствора применяли
«Реамберин 1,5% для инфузий» в дозе 400 мл
внутривенно
капельно.
В группе сравнения
использовали только глюкозо-солевые растворы.
На фоне терапии реамберином отмечено снижение уровня
фибриногена в группе больных, получавших реамберин (p<0,05). К
5-му дню наблюдалось снижение вязкости плазмы и вязкости крови при
различных скоростях сдвига [при 20 1/с (p<0,001), при 100 1/с
(p<0,05), при 200 1/с (p<0,01)] и снижение индекса агрегации
эритроцитов (p<0,001) у пациентов основной группы в сравнении с
пациентами, получавшими глюкозо-солевые растворы.
Применение реамберина позволило добиться более быстрой
нормализации реологических характеристик крови, без
дополнительного назначения других антиагрегантных препаратов, с
целью реокоррекции, а так как известно, что он обладает
дезинтоксикационным действием, то можно избежать назначения
нескольких препаратов, уменьшив стоимость лечения.
Сравнительная оценка результатов лечения
больных острыми
вирусными гепатитами
(А, В и С),
проведенная
Г.А. Гипаевой, С.А. Пашаевой, Д.Р. Ахмедовым
(Дагестан),
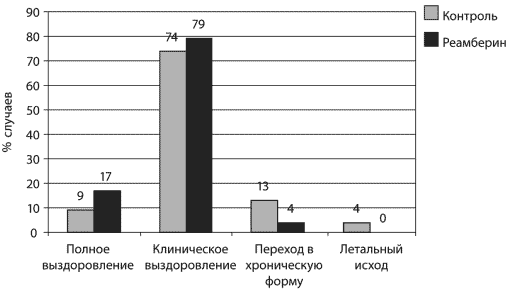
указывает на то, что реамберин нормализует
антиоксидантную систему, сокращает продолжительность клинических
симптомов, более быстро нормализует биохимические показатели, что
приводит к сокращению сроков пребывания больных в стационаре.
Никаких побочных реакций при использовании реамберина не
наблюдалось.
Улучшение результатов лечения больных
острым панкреатитом
(ОП)
остается одной из актуальных проблем неотложной
абдоминальной хирургии и интенсивной терапии. Современный подход к
решению этой сложной задачи характеризуется дифференцированным
применением как консервативных, так и оперативных методов в
зависимости от морфологической формы заболевания. Оперативные
вмешательства у этой категории больных в ранние сроки от начала
заболевания при асептическом течении панкреонекроза заканчиваются
летально в 90% случаев. Снижение уровня летальности у лиц старше 60
лет может быть достигнуто путем совершенствования консервативной
терапии, ключевыми направлениями которой, в силу возрастных
особенностей патогенеза заболевания, должны считаться купирование
эндогенной интоксикации (ЭИ), органной гипоксии,
иммунодепрессивного и синдрома окислительного стресса,
функциональных нарушений жизненно важных органов и систем.
Тяжесть состояния больных ОП и необходимость синхронного
воздействия на все механизмы прогрессирования заболевания требуют
одновременного применения большого количества медикаментов
различных фармакологических групп, что повышает вероятность их
нежелательных взаимодействий и возникновения побочных эффектов.
Исследованиями А.П. Власова с соавт. (2007)5
показано существенное
снижение риска развития панкреонекроза при применении реамберина.
Показано, что своевременность коррекции липидного метаболизма
реамберином – основа его лечебной эффективности.
Эти обстоятельства послужили поводом для применения
раствора реамберина больным острым панкреатитом (Блахов Н.Ю.,
Минск).
Оказывая антиоксидантное, антигипоксическое и
дезинтоксикационное действие, препарат способствует повышению
резистентности организма к гипоксии и уменьшению клинических
проявлений синдрома ПОН, что определяет его перспективность в
качестве компонента интенсивной терапии у больных острым
панкреатитом старше 60 лет. Обследовано и пролечено 96 больных ОП
пожилого и старческого возраста в 432 ГВКГ г. Минска. Согласно
классификации ОП, принятой на Международном симпозиуме в г.
Атланта (США), больных интерстициальным отечным панкреатитом было
65 (67,7%), некротическим панкреатитом – 31 (32,3%). Мужчин было 62
(64,6%), женщин – 34 (35,4%). Среди больных каждой из
морфологических форм заболевания были выделены по 2 группы. В
контрольные группы вошли 54 больных (37 – отечным панкреатитом, 17
– некротическим), получавших стандартное лечение: при отечном
панкреатите – базисный комплекс в сочетании с
лечебно-диагностической лапароскопией и экстракорпоральными
методами. 42 больных (28 – отечным панкреатитом, 14 –
некротическим), в лечении которых дополнительно применялся
реамберин, составили основные группы.
Препарат назначался с 1-х суток по 400-800 мл внутривенно
или внутриартериально в течение 3-8 дней, при этом дозировка,
кратность и сроки использования определялись динамикой
клинического состояния больного и результатов лабораторных и
инструментальных методов исследования.
Применение реамберина при ОП у лиц пожилого и старческого
возраста способствует нормализации функционального состояния
печени, увеличению антикоагулянтной и фибринолитической активности
и потенциала антиоксидантной системы. Реамберин является
эффективным средством оптимизации интенсивной терапии при остром
панкреатите у больных пожилого и старческого возраста.
При
отечном панкреатите реамберин назначают по 400 мл внутривенно 1
раз в сутки в течение 2-5 дней, при некротическом – по 400
мл внутривенно или внутриартериально 1-2 раза в сутки в
течение 3-8 дней.
Критериями продолжительности терапии реамберином служат
стабилизация функционального состояния печени, нормализация
антикоагулянтной и фибринолитической активности, устойчивая
тенденция к возрастанию антиоксидантного потенциала.
Роль реамберина в модуляции метаболического ответа и
острофазовой реакции печени у больных с тяжелым сепсисом и
септическим шоком изучалась А.В. Коломоец, Н.Н. Мосенцевым6(Днепропетровск).
К настоящему времени сформулирована новая, радикально меняющая
взгляд на патогенез сепсиса парадигма, которая рассматривает
нарушения гомеостаза как неконтролируемый каскад изменений в
системах коагуляции, воспаления и фибринолиза, происходящие
одновременно, как цикл автоматического наложения
взаимообусловленных процессов с последующими нарушениями
микроциркуляции и тканевой оксигенации, развитием метаболических
расстройств, вследствие митохондриальной дисфункции. Это состояние
определяется как микроциркуляторно-митохондриальный
дистресс-синдром.
Принимая во внимание важность воздействия на метаболический
ответ и острофазовую реакцию при сепсисе, авторами предпринята
попытка модуляции этих процессов с применением раствора
реамберина. В контексте исследования представляет интерес прямое
влияние янтарной кислоты на клеточный метаболизм и транспорт
свободного кислорода в ткани, нормализация аэробной фазы
тканевого дыхания, восстановление функции печени и синтеза ею
белков. В основу рабочей гипотезы положено предположение, что
экзогенное пополнение пула интермедиатов цикла трикарбоновых
кислот, в частности янтарной кислоты, оказывает каталитическое
действие на метаболизм субстратов в цикле Кребса, приводя к
нормализации аэробной фазы тканевого дыхания, способствуя
устранению митохондриальной дисфункции в тканях, особенно в печени,
с восстановлением синтеза положительных белков острой фазы
(альбумина, трансферина, протеинов С и S, и других). Работа
выполнена в клинике анестезиологии и интенсивной терапии
Днепропетровской государственной медицинской академии (директор
клиники – член-корр. АМН Украины, проф. Л.В. Новицкая-Усенко), на
базе специализированного отделения интенсивной терапии сепсиса
(ОИТС) Днепропетровской областной клинической больницы им. И.И.
Мечникова.
Существенные различия выявлены между группами сравнения в
частотах развития органных нарушений после завершения лечения (рис.
5).
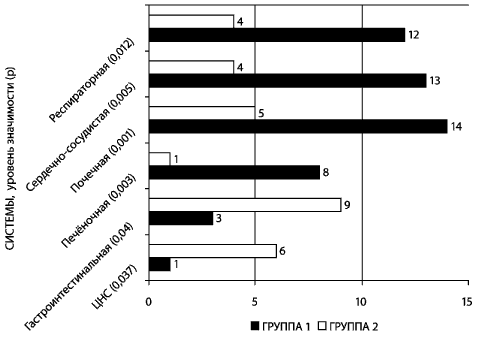
Рис. 5. Частота развития органных нарушений
Оценка результатов лечения по конечным пунктам выявила
достоверные различия, связанные с проведенным видом терапии (рис.
6). Длительность лечения в ОИТС и летальность после завершения
лечения отличались, но не были достоверными, тогда как выявленные
различия в частоте персистирующих органных нарушений до 28-го дня
болезни были определяющими для выживаемости пациентов до 28-го дня,
восстановления качества жизни до 35-го дня заболевания.
Степень метаболического стресса значительно выражена у больных
1-й группы, но под влиянием терапии реамберином метаболический
стресс определялся как умеренный (КИ<5 ед) уже на 2-е сутки
лечения. Лактатпируватный индекс более быстро нормализовался у
больных во 2-й группе и уже на 3-и сутки был меньше 10,0 ед.
Повышенная концентрация лактата сохранялась значительно дольше у
больных 1-й группы, ведь избыток лактата у больных сепсисом
объясняется замедлением его печеночного клиренса.
О нарушении митохондриального статуса свидетельствует
увеличение соотношения ацетата к гидроксибутирату более 0,4, что
наблюдается при повышении концентрации последнего выше 0,07
мкмоль/л, указывая на наличие митохондриальной дисфункции, а в
сочетании с микроциркуляторными нарушениями –
микроциркуляторно-митохондриального дистресс-синдрома (ММДС). Под
влиянием реамберина восстановление митохондриальной функции
наблюдалось более отчетливо и быстро. Одновременно с устранением
митохондриальной дисфункции у больных в группе реамберина
наблюдалось существенное увеличение концентрации мочевой кислоты в
сыворотке крови – конечного продукта деградации адениловых
нуклеотидов, что свидетельствует об увеличении общего пула
макроэргических соединений в результате их интенсивного синтеза в
процессе аэробного дыхания.
Применение реамберина больным
с тяжелым сепсисом и
септическим шоком
оказывает модулирующее влияние на
метаболизм, сопровождается катализацией аэробного дыхания с
пополнением общего пула макроэргических соединений, восстановлением
цитоплазматического и митохондриального редокси-статуса,
устранением митохондриальной дисфункции и ограничением
гиперметаболического ответа на воспаление.
Медикаментозную профилактику нарушений гомеостаза при
хроническом калькулезном холецистите путем применения препарата
«Реамберин 1,5% раствор» больным с сопутствующей
сердечнососудистой патологией в раннем послеоперационном периоде
проводили А.Г. Буткеева, С.И. Чистяков.
Объектом клинического исследования явились 22 больных
хроническим калькулезным холециститом с сопутствующей
сердечно-сосудистой патологией, в возрасте 65±8 лет. Сопутствующая
патология представлена ишемической болезнью сердца с
недостаточностью кровообращения I-IIA и артериальной гипертензией
различного генеза (3 человека); ИБС с недостаточностью
кровообращения IIБ и артериальной гипертензией различного генеза
(4 человека); гипертонической болезнью с нарушениями сердечного
ритма в виде мерцательной аритмии (2 человека), частой
желудочковой экстрасистолии (3 человека); гипертонической болезнью
– (10 человек).
Первая группа больных получала инфузии Sol. Ringeri (5-7 мл/кг
внутривенно).
Пациентам второй группы
вводился раствор реамберина в дозе
5-7мл/кг внутривенно капельно.
У больных, получавших реамберин, более чем в 1,5 раза
сокращалось время восстановления адекватного дыхания после
тотальной внутривенной анестезии. У данной группы пациентов
практически не отмечалось постнаркозных нарушений дыхания в виде
кратковременных периодов апноэ, брадипноэ и неэффективного
поверхностного дыхания, сопровождающихся выраженным снижением
сатурации кислорода.
Инфузии реамберина (в дозе 5 мл/кг)
в раннем
послеоперационном периоде после лапароскопической холецистэктомии
приводят к нормализации основных клинико-биохимических показателей
крови у больных с сопутствующей сердечно-сосудистой патологией.
Реамберин в раннем послеоперационном периоде, после
лапароскопической холецистэктомии (в дозе 5 мл/кг) приводит к
быстрой и стойкой стабилизации артериального давления, сердечного
выброса и сатурации кислорода у больных с сопутствующей
сердечно-сосудистой патологией. Введение реамберина значительно
сокращает время восстановления адекватного дыхания и сознания после
общей анестезии, что особенно важно при оказании хирургической
помощи большому числу пострадавших при возникновении чрезвычайных
ситуаций в мирное время.
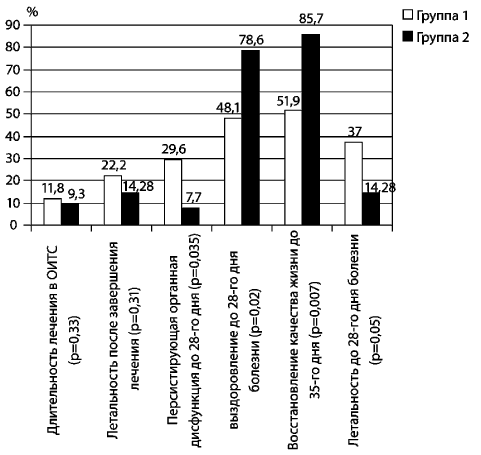
Рис. 6. Оценка результатов лечения
с применением
реамберина по конечным точкам
Ярким признаком, характеризующим современную ситуацию во
фтизиатрии, можно считать рост заболеваемости, появление остро
прогрессирующих форм туберкулеза (ОПФТ), учащение случаев
лекарственно-устойчивого (ЛУ) и множественно
лекарственно-устойчивого (МЛУ) туберкулеза у больных с
хроническими туберкулезными процессами и с впервые выявленными
туберкулезными процессами. Вышеперечисленные формы туберкулеза
протекают на фоне выраженной интоксикации, иммунодефицита,
синдрома дыхательных расстройств. При нормальном обеспечении
организма кислородом питательные вещества проходят метаболические
превращения, в ходе которых образуется энергия, необходимая для
работы функциональных систем организма, реакции замыкаются на
цикле Кребса или аэробном гликолизе.
При гипоксии,
сопровождающей туберкулезный процесс, скорость аэробного гликолиза
и окислительного фосфорилирования существенно снижается, вызывая
целый ряд метаболических нарушений в организме, что приводит к
расстройству обмена веществ в митохондриях.
Таким образом, борьба с гипоксией и интоксикацией занимает одно
из первых мест в лечении тяжелых форм туберкулеза. Вторым, не
менее важным моментом является коррекция осложнений
химиотерапии.
Для коррекции развивающихся побочных эффектов химиотерапии
реамберин использовался
О.
В. Трибунской7 у пациентов с
туберкулезом:
из них: 42 человека (35%) – впервые
выявленные пациенты (группа А) и 78 человек (65%) – пациенты с
хроническими формами туберкулеза (группа В). В группе А у 21
пациента (50%) удалось обойтись без коррекции схемы химиотерапии, у
10 пациентов (24%) был отменен один противотуберкулезный препарат,
у 9 пациентов (21%) – 2-3 противотуберкулезных препарата, у 2
пациентов (5%) потребовалось временное прекращение химиотерапии. В
группе В у 28 пациентов (36%) удалось обойтись без коррекции схемы
химиотерапии, у 9 пациентов (11,5%) был отменен один
противотуберкулезный препарат, у 32 пациентов (41%) – 2-3
противотуберкулезных препарата, у 9 пациентов (11,5%) потребовалось
временное прекращение химиотерапии.
Анализ применения реамберина для коррекции состояний,
обусловленных наличием у пациентов сопутствующей патологии,
проводился на всей группе пациентов (192 человека). Сопутствующая
патология представлена хроническим холецистопанкреатитом (58%),
сахарным диабетом 1-го типа (11%) и 2-го типа (7%), хроническим
алкоголизмом (9%), язвенной болезнью желудка (10%),
гипертонической болезнью (3%), хроническим бронхитом (5%) и
пиелонефритом (4%). Применение реамберина в 100% случаев приводило
к улучшению самочувствия больных, исчезновению или уменьшению
жалоб. В 82% случаев отмечалась положительная динамика
лабораторных показателей уже на фоне 1-2 инфузий препарата.
Современные особенности течения туберкулезного процесса диктуют
необходимость использования в схеме фармакотерапии новых средств
патогенетической терапии, одним из которых является раствор
реамберина. Применение его на ранних сроках химиотерапии
позволяет купировать проявления «бактериального криза» и сохранить
полный объем противотуберкулезной терапии. Применение реамберина
для коррекции побочных эффектов химиотерапии у впервые выявленных
пациентов в 50% случаев позволяет обойтись без отмены
противотуберкулезных препаратов, что значительно снижает риск
развития лекарственно-устойчивого туберкулеза. Применение
реамберина для коррекции побочных эффектов химиотерапии у пациентов
с хроническими формами туберкулеза позволяет сохранить полный или
частично уменьшенный объем противотуберкулезной терапии, что для
данной категории больных всегда является весьма проблематичным (в
силу наличия выраженных изменений со стороны многих органов и
систем). Применение реамберина для коррекции состояний,
обусловленных наличием сопутствующей патологии у больных с
различными формами туберкулеза, позволяет добиться улучшения
качества жизни пациентов и, в значительном проценте случаев,
улучшения показателей лабораторного исследования. Применение
реамберина позволяет строго соблюдать основные принципы
химиотерапии, сформулированные А. Е. Рабухиным: «раннее начало,
комбинированность, непрерывность, регулярность, контролируемость,
своевременная коррекция побочных эффектов».
О.В. Тихомировой, О.И. Нырковой, Л.
В. Говоровой8, а также
Е.В. Михайловой, Т.К. Чудаковой9 изучены особенности метаболических сдвигов и
разработаны клинико-лабораторные критерии диагностики
интоксикационного синдрома при бактериальной дизентерии у
детей.
Проведено комплексное клинико-лабораторное
обследование 142 детей в возрасте от 1-го года до 14 лет с тяжелой
и среднетяжелой формами шигеллеза.
Детям в комплексную терапию острого периода дизентерии включен
инфузионный раствор реамберина 1,5%. Препарат назначали с первых
дней стационарного лечения из расчета 10 мл/кг массы тела в сутки,
в течение 2-3 дней. Группу сравнения составили 44 ребенка,
получавшие глюкозо-солевые растворы.
Применение реамберина (рис. 7) сокращает длительность
интоксикации [вялость (2,8±0,3 против 4,1±0,4, p<0,05);
анорексия (2,5±0,4 против 4,3±0,5), купирует лихорадочный период
(1,8±0,3 против 2,2±0,4 дня), тахикардию (2,1±0,3 и 2,8±0,4 дня) и
гемоколит (1,7±0,3 против 2,3±0,2 дня)]. Наибольший клинический
эффект препарата наблюдался у больных с тяжелыми формами инфекции
и высокими показателями эндотоксемии (рис. 8). Так, в группе детей
(с уровнем ВНСММ более 20 УЕ) установлена отчетливая тенденция к
сокращению лихорадочного периода в стационаре до 2,4±0,3 дня
(против 3,1±0,4 дня в группе сравнения), периода вялости (2,5±0,4
против 3,6±0,5 дня), анорексии и тахикардии (2,7±0,4 и 2,0±0,3
дня против 4,0±0,6 и 2,8±0,4 дня соответственно).
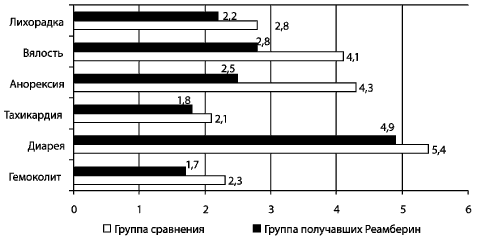
Рис. 7. Длительность клинических проявлений дизентерии
у детей
Параллельное изучение лабораторных маркеров эндотоксикоза
позволило установить, что при использовании реамберина
параметры
Изучена (Горячева Л. Г. с соавт.10) клиническая эффективность препарата
«Реамберин 1,5% для инфузий» у детей, больных желтушным вариантом
острого вирусного гепатита. Под наблюдением находились пациенты с
желтушным вариантом острого вирусного гепатита различной
этиологии.
Показана эффективность препарата «Реамберин 1,5%» в качестве
дезинтоксикационного средства у детей, больных вирусным гепатитом,
протекающим с нарушением пигментного обмена. При его применении
наблюдалось уменьшение длительности симптомов интоксикации, по
сравнению с контрольной группой, сокращался период пребывания детей
в стационаре на 3,5 койко-дня. Инфузионная среда «Раствор
реамберина 1,5%», в качестве дезинтоксикационного средства
рекомендована для лечения больных острыми вирусными гепатитами,
независимо от этиологии заболевания, с выраженными признаками
интоксикации.
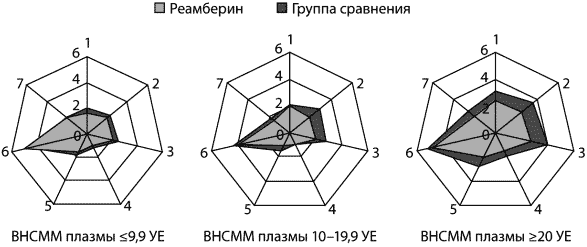
Рис. 8. Длительность клинических проявлений дизентерии
в зависимости от уровня ВНСММ плазмы
и варианта инфузионной терапии
Обозначения:
1. Лихорадка. 2. Вялость. 3. Анорексия. 4. Головная боль.
5. Тахикардия. 6. Диарея. 7. Гемоколит
Рис. 9. Динамика показателей ХЛ плазмы у больных
Общепризнанным универсальным неспецифическим патогенетическим
звеном в развитии атопического дерматита является усиление
перекисного окисления липидов (ПОЛ) мембран, в результате чего
нарушается их структурная целостность, повышается проницаемость
и изменяется функциональное состояние. Активация ПОЛ ведет к
нарушению центральных механизмов регуляторных систем, развитию
метаболического ацидоза, гипоксии, что является одной из причин,
вызывающих воспалительный процесс кожных покровов, на этом фоне
снижается антиоксидантная защита.
Применение известных антиоксидантов как прямого, так и не
прямого действия у больных атопическим дерматитом ограничено
вследствие нарушения всасывания в кишечнике, возникновения
аллергических реакций как на сами препараты, так и на их
метаболиты, плохой проницаемости большинства из них через
биологические мембраны.
Под наблюдением О.Д. Куликовой11 находилось 59 детей с атопическим дерматитом в
возрасте от 10 до 15 лет. Тяжесть течения заболевания оценивалась
по индексу SCORAD. Давность заболевания составляла от 9 до 14 лет.
Субъективно всех детей беспокоил интенсивный зуд, особенно в ночное
время (даже при легком течении заболевания).
Реамберин вводился внутривенно, капельно из расчета 10 мг/кг
массы. Курс лечения состоял из 5 инфузий. Общая курсовая доза
препарата составила 32-60 мг/кг массы.
После лечения реамберином клиническая ремиссия наблюдалась у
25,4% детей, значительное улучшение – у 49,2% и улучшение – у 23,7%
пациентов. Не выявлено положительной динамики у 1 больного с
тяжелым течением (1,7%).
По соотношению значений малонового диальдегида и показателей
общей антиокислительной активности рассчитывали индекс пероксидации
(ИП), а по соотношению продуктов ПОЛ и уровней церулоплазмина и
токоферола высчитывали интегральный показатель соотношения
ПОЛ/АОА, коэффициент «К».
До начала терапии реамберином у всех больных выявлено повышение
уровня токоферола по сравнению с контролем, причем максимально
высоким этот показатель был у детей с легкой и средней тяжестью
течения заболевания, превышая контрольные значения в 2 раза, тогда
как у больных с тяжелым течением этот показатель был увеличен в 1,7
раза. Общая антиокислительная активность сыворотки у больных с
легким течением заболевания была выше контрольных значений в 1,3
раза, а при средней степени тяжести и тяжелом течении – в 1,2 и 1,4
раза соответствeнно. Индекс пероксидации до начала лечения
превышал таковой в контрольной группе в 1,8, 2,4 и 2,1 раза.
Таким образом, при атопическом дерматите у детей усилены
процессы перекисного окисления липидов на фоне увеличения
показателей антиоксидантной системы.
В группе больных с тяжелым течением заболевания констатировали
клиническую ремиссию у 4 больных, значительное улучшение – у 19
больных, улучшение у 8 пациентов. Надо отметить, что практически у
всех пациентов после первой инфузии значительно уменьшился зуд,
побледнела эритема, а после четвертой инфузии уменьшилась
инфильтрация и лихенизация. К окончанию курса терапии
документировано улучшение цвета кожи, уменьшение сухости и
отсутствие шелушения.
Во второй группе больных, со средней тяжестью течения
заболевания, констатировали клиническую ремиссию у 5 детей,
значительное улучшение у 7 пациентов и улучшение у 7 детей. В этой
группе, как и в предыдущей, после первой инфузии реамберина
значительно уменьшился или полностью прекратился зуд, после
окончания лечения практически все очаги инфильтрации и лихенизации
разрешались.
Среди больных с легким течением клиническая ремиссия наступила у
6, значительное улучшение у 3 детей.
Следует отметить, что после первой и второй инфузии у всех
пациентов улучшалось общее состояние, повышалось настроение,
нормализовался сон и аппетит.
Изучены показатели перекисного окисления липидов (ПОЛ) и
антиоксидантной системы (АОС) сыворотки до и после лечения. После
проведения курса лечения реамберином наблюдали достоверное
снижение уровня токоферола у больных с легким течением в 1,7 раза,
у больных со средней степенью тяжести в 1,8 раза, а при тяжелом
течении снижение этого показателя было недостоверным.
Показатели общей антиокислительной активности после проведенной
терапии имели четкую тенденцию к повышению (в среднем в 1,5 раза).
Индекс пероксидации после лечения, напротив, уменьшился в 1,5 раза
при легком течении, в гpynne больных со средней степенью тяжести в
1,6 раза, при тяжелом течении в 1,2 раза.
Анализируя динамику лабораторных показателей и клиническую
эффективность, патогенетически обоснованным является
использование реамберина в терапии атопического дерматита. В
процессе проводимой терапии не отмечено побочных реакций и
осложнений, все больные хорошо переносили лечение. Реамберин
способствует смягчению течения заболевания, удлиняя при этом сроки
ремиссии, нормализуя антиоксидантную защиту организма.
С.О. Рогаткиным12
(с соавт.) проведено изучение клинической эффективности препарата
реамберин для профилактики и терапии постгипоксических поражений
ЦНС у новорожденных детей и установлены оптимальные сроки его
назначения. Под наблюдением находились 89 недоношенных
новорожденных, родившихся в тяжелом состоянии, нуждавшихся в
проведении интенсивной терапии после оказания первичной
реанимационной помощи. Дети первой группы получали терапию
реамберином, которая была начата в первые 12 часов жизни; а дети
2-й группы (22 ребенка) начали получать лечение препаратом от 24-48
часов жизни; остальные дети составили группу контроля. Резюмируя
результаты исследования, авторы приходят к выводу, что у
препарата четко проявляется церебропротекторный эффект. В группе
детей с ранним началом терапии отмечено достоверное сокращение
сроков пребывания на ИВЛ и более низкие уровни сывороточных
концентраций нейроспецифических антигенов. Применение инфузионных
растворов на основе сукцината натрия снижает частоту и тяжесть
гипоксически-ишемических поражений головного мозга у недоношенных
новорожденных.
Раннее назначение (через 2-12 часов после рождения) раствора
реамберина оказывает достоверно более выраженный
церебропротекторный эффект по сравнению с его отсроченным
назначением (24-48 часов) у недоношенных детей, перенесших
перинатальную гипоксию. Системное антигипоксическое и
антиоксидантное действие реамберина позволяет сократить
продолжительность ИВЛ и снизить частоту осложнений, связанных с ее
проведением. Применение реамберина снижает частоту возникновения
перивентрикулярных лейкомаляций у недоношенных новорожденных,
нуждающихся в проведении ИВЛ и интенсивной терапии.
В.В. Лазаревым, В.А. Михельсоном, А.У. Лекмановым 13,14
изучена эффективность
применения реамберина у детей с целью устранения постнаркозной
депрессии и активации (ускорения) периода восстановления
адекватного спонтанного дыхания после искусственной вентиляции
легких.
В исследование включались дети всех возрастных категорий до 14
лет. Они были распределены на две группы. В первую группу
(основную) вошли 32 ребенка, которым на этапе окончания анестезии
внутривенно вводился реамберин 1,5% раствор для активизации вывода
ребенка из наркоза за 10 минут до окончания оперативного
вмешательства (дважды с интервалом в 10 минут) в дозе 2 мл/кг веса
ребенка. Второй группе (37 детей) препарат не вводился. В обеих
группах в анестезиологическом пособии использовалась общая
анестезия препаратами атаралгезии (реланиум, фентанил), ГОМК, а
также ингаляция закиси азота в газовой смеси при искусственной
вентиляции легких.
После введения реамберина у детей 1-й группы отмечалось
сокращение времени, необходимого для восстановления адекватного
спонтанного дыхания, последующей успешной экстубации и
восстановления сознания. Клинически это проявлялось в увеличении
глубины и частоты дыхания, что свидетельствовало о повышении
минутной вентиляции легких и, соответственно, внешнего газообмена.
Активнее восстанавливался мышечный тонус, о чем можно было судить
по времени появления активных движений конечностей, сокращения
мимической мускулатуры, открывания глаз на фоне постоянной звуковой
стимуляции (громкий разговор анестезиолога с пациентом) у детей
старшего возраста. Данные по исследованию кислотно-основного
состояния крови и напряжения газов в крови свидетельствовали о
положительном влиянии реамберина. Так, на 10-й минуте после
повторного введения препарата в основной группе отмечалось стойкое
повышение напряжения кислорода в крови, а также стабильные в
пределах нормальных величины СО2, что свидетельствовало
об адекватности спонтанного дыхания.
Использование реамберина 1,5% раствора для инфузий эффективно у
детей в анестезиологическом обеспечении для устранения
постнаркозной депрессии, что, несомненно, имеет большую
актуальность в повседневной практической деятельности. Препарат
оказывает положительное действие в устранении побочного влияния
нейролептиков и наркотических анальгетиков.
Ранняя активация сознания, устранение последействия
наркотических анальгетиков и нейролептиков на фоне
программируемого регулирования энергетики тканей головного мозга,
восстановления баланса между прооксидантными и антиоксидантными
системами в условиях возможной послеоперационной гипоксии
является, несомненно, важным компонентом в профилактике
периоперационных поражений центральной нервной системы.
Использовать реамберин для устранения постнаркозной
депрессии у детей следует согласно схеме: двукратная медленная
инфузия препарата в течение 2 минут внутривенно в дозе 2 мл/кг с
интервалом в 10 минут после первого введения, которое выполняется
за 10 минут до окончания оперативного вмешательства.
Реамберин может быть использован при критических
состояниях у детей
в качестве эффективного
антигипоксического и дезинтоксика ционного средства, поскольку в
лечении таких пациентов помимо эффективной респираторной и
инфузионной поддержки все большее место занимает метаболическая
коррекция, направленная на воздействие непосредственно на клетки с
помощью субстратных антигипоксантов. Число детей с критическими
состояниями не уменьшается, сохраняется высокая летальность, а у
значительной части выживших детей перенесенное гипоксическое
состояние вызывает тяжелые неврологические нарушения.
Реамберин
был применен (Лазарев В.В., Михельсон В.А., Лекманов А.У.) при
угрозе развития (или уже развившемся) критического
состояния
у 30 детей (от 1 года до 14 лет), в связи с
тяжелой ожоговой травмой (более 30% поверхности тела), сочетанной
травмой и черепно-мозговой травмой (без признаков отека головного
мозга), при септических состояниях и энцефалопатиях, связанных с
токсикозами.
У детей выявлены различные виды нарушения сознания, от сопора до
развития коматозного состояния различной степени. Более, половине
больных при назначении реамберина проводилась искусственная
вентиляция легких.
Инфузию реамберина начинали в течение 1-З
суток с момента начала заболевания в суточной дозе 10 мл/кг
веса со скоростью 3-4 мл/мин, но не более 400 мл. Как правило,
суточную дозу разделяли на 2 приема в течение суток. Курс
применения препарата составлял 5 суток.
Использование реамберина оказывало положительное влияние на
течение заболевания (улучшение сознания у 80% детей с тяжелой
ожоговой и сочетанной травмой). Процессы активации сознания и
выхода из коматозного (или сопорозного) состояния были более
быстрыми, чем при ретроспективной оценке у подобных больных, ранее
находившихся в отделении и не получавших реамберин.
В группе детей с тяжелой черепно-мозговой травмой, не
сопровождающейся отеком головного мозга, положительный эффект
выявлен у половины больных. Благоприятное влияние препарата
заключалось в быстрой динамике активации сознания. Отсутствие
положительного эффекта у части больных связано с поражением ствола
и подкорковых структур головного мозга.
Введение реамберина сопровождалось умеренным диуретическим
эффектом, после инфузии препарата усиливался темп диуреза,
соответственно чему усиливался и дезинтоксикационный эффект.
Авторами не зафиксировано токсического воздействия препарата на
систему кровообращения и дыхания. Аллергические реакции, связанные
с инфузией препарата, не наблюдались.