
Рис. 1. Длительность клинических проявлений дизентерии у
детей
Источник:
журнал "Экспериментальная и клиническая фармакология",
2010, Том 73, №9 c. 28-33
1НИИ детских инфекций ФМБА, Санкт-Петербург;
2Кафедра инфекционных болезней,
Санкт-Петербургская государственная медицинская академия им.И.И. Мечникова
3Саратовский государственный медицинский университет им.В.И. Разумовского
О.В. Тихомирова1, М.Г. Романцов2, Е.В. Михайлова3, Л.В. Говорова1
Применение реамберина способствует быстрому купированию общеинфекционных симптомов, улучшает самочувствие, сокращает лихорадочный период заболевания. Динамика местного воспалительного процесса в кишечнике характеризуется сокращением длительности гемоколита у больных, получавших терапию реамберином, по сравнению с больными, получавшими глюкозо-солевые растворы. Реамберин способствует более быстрой нормализации показателей хемилюминесценции, снижает интенсивность оксидативных процессов у больных с высокой активацией свободнорадикального окисления (СРО) уже к 3-5 дню лечения. Клиническая эффективность реамберина определяется снижением показателей эндогенной интоксикации в ранние сроки заболевания у получавших препарат. Устранение дисбаланса между оксидантной и антиоксидантной системами, особенно при тяжелых формах шигеллеза и у больных с гиперактивацией СРО способствует уменьшению повреждающего воздействия активных форм кислорода и устранению метаболических сдвигов у детей к периоду ранней реконвалесценции.
Проблема бактериальных кишечных инфекций сохраняет актуальность за счет повсеместного распространения, высокого уровня заболеваемости, тяжелого течения, особенно в детском возрасте [2, 8, 9, 12, 17, 18, 20-22]. Тяжесть, течение и исход инфекционного процесса зависят от адаптивных возможностей макроорганизма, качественного состояния клеток крови, их функциональной активности, обусловленной метаболическими сдвигами в них [26, 27]. Активация процессов катаболизма, чрезмерное накопление продуктов промежуточного и конечного обмена при несостоятельности систем детоксикации приводит к развитию синдрома эндогенной интоксикации и изменению метаболизма клеток макроорганизма [1, 6, 10, 14, 15, 19].
При эндотоксикозе активация процессов свободно-радикального окисления (СРО), играя роль неспецифической защиты организма, способна повреждать клеточные мембраны органов и систем [3,4]. Вопросы взаимосвязи нарушений баланса СРО, системы антиоксидантной защиты и эндотоксикоза между собой, а также выраженности метаболических нарушений с этиологией и формой тяжести бактериальных инфекций, в частности, дизентерии, у детей остаются открытыми.
К патогенетической терапии дизентерии относится обязательная инфузионная терапия, направленная на улучшение реологии крови, ускорение элиминации токсинов из организма, регидратацию и поддержание водно-электролитного обмена. В связи с этим представляется актуальным применение препаратов на основе янтарной кислоты, обладающих антигипоксантным/антиоксидантным действием для купирования симптомов интоксикации. По классификации Т. Г. Кожока, реамберин относится к субстратам энергетического обмена [7]. В состав раствора для инфузий входят соль янтарной кислоты и макроэлементы (магния, калия, натрия хлориды). Инфузионная среда обладает антиоксидантным и антигипоксантным, энергопротективным свойствами, уменьшает продукцию свободных радикалов, утилизирует жирные кислоты и глюкозу в клетках, нормализует кислотно-щелочной баланс и газовый состав крови [3, 5, 25].
Ранее проведена оценка эффективности препарата реамберин (1,5 % инфузионный раствор) в терапии среднетяжелых и тяжелых форм дизентерии у 221 ребенка [13, 16, 23, 24]. В составе препарата меглумина натрия сукцинат – 15, натрия хлорид – 6 г, калия хлорид – 0,3 г, магния хлорид – 0,12 г, натрия гидроксид – 1,788 г, вода для инъекций – до 1 л. Препарат используют у детей с 1 года в качестве дезинтоксикационного и антигипоксического средства при экзо- и эндогенных интоксикациях различного генеза.
Для этого проведено клинико-лабораторное обследование детей в возрасте от 1-го года до 14 лет, больных бактериальной дизентерией. Среди госпитализированных больных преобладали пациенты старше 3-х лет (88 %). Этиология заболевания подтверждалась бактериологическими и серологическими методами.
Дизентерия Флекснера зарегистрирована у 76,8 % детей, дизентерия Зонне – у 23,2 % больных. В структуре шигеллеза Флекснера преобладали сероварианты 2а и За, доля которых составила 40,4 и 46,8 % соответственно. Дизентерия Флекснера, обусловленная другими серовариантами (2в, Зв, 4, 6), наблюдалась у 6,4 % детей.
Оценивая эффективность реамберина, используя метод случайных чисел, больных распределили на 2 группы: группу получавших реамберин составили 155 человек, группу сравнения - 66 детей. Доза препарата составляла 10 мл/кг в сутки, продолжительность лечения зависела от выраженности интоксикационного синдрома и не превышала 3 дней. В группе сравнения в эти же сроки применяли глюкозо-солевые растворы (раствор Рингера, раствор глюкозы 10 % с электролитами).
Контрольную группу составили 15 практически здоровых детей в возрасте от 1-го до 14 лет без существенных отличий по фоновой и сопутствующей патологии с наблюдаемыми детьми.
Статистическую обработку полученных данных проводили на ПК Pentium IIIc помощью пакета прикладных программ Microsoft Exel 2000, StatSoft Statistica v 6.0 с использованием параметрических (t-тест) и непараметрических (критерий U-Манна-Уитни) методов вариационной статистики.
Клиническое течение дизентерии у детей позволило выявить зависимость продолжительности основных проявлений заболевания от варианта инфузионной терапии (рис. 1). Так, у больных, получавших реамберин, его применение способствовало более быстрому купированию общеинфекционных симптомов. Длительность анорексии и вялости на фоне проводимой терапии составила 2,5 ± 0,4 и 2,8 ± 0,3 дней соответственно, против 4,3 ± 0,6 и 4,1 ± 0,4 дней у больных группы сравнения (р < 0,05). Установлено сокращение длительности тахикардии (1,8 ± 0,3 против 2,1 ± 0,4 дней) и лихорадочного периода (2,2 ± 0,3 против 2,8 ± 0,5 дней). Выявление примеси крови в испражнениях детей, получавших реамберин, составило 1,7 ± 0,3 против 2,3 ± 0,2 дней.

Рис. 1. Длительность клинических проявлений дизентерии у
детей
Реамберин, в терапии среднетяжелых форм заболевания, сокращал длительность интоксикационного синдрома в среднем на сутки по сравнению с больными, получающими общепринятую инфузионную терапию. При тяжелом течении дизентерии отмечается более стремительная обратная динамика общеинфекционных симптомов, характеризующаяся уменьшением их проявлений на 2 дня и более в отличие от группы сравнения.
Изучение показателей эндогенной интоксикации выявило зависимость тяжести заболевания от уровня маркеров эндотоксикоза. В острый период дизентерии (1-3-й болезни) у 23,5 % больных имело место незначительное нарастание концентрации веществ низкой и средней молекулярной массы (ВНСММ) плазмы (до 10 УЕ). У 62,8 % обследованных детей данные показатели находились в пределах 10-19,9 УЕ, а у 13,7 % детей отмечалось выраженное повышение ВНСММ плазмы свыше 19,9 УЕ. Установлена прямая зависимость тяжести основных клинических проявлений дизентерии и уровня ВНСММ в плазме крови больных. В группе детей с концентрацией ВНСММ плазмы, превышающей 19,9 УЕ, заболевание протекало с преобладанием в клинической картине выраженных проявлений интоксикации (100% против 31 и 33% в сравниваемых группах).
При сопоставлении течения дизентерии у детей с различной концентрацией ВНСММ плазмы показано, что реамберин сокращает продолжительность интоксикации у больных всех групп (рис. 2). Наиболее выраженный эффект препарата отмечен у детей с концентрацией ВНСММ более 19,9 УЕ. У этих больных лихорадочный период составил 2,4 ± 0,3 против 3,1 ± 0,4 дней у детей группы сравнения, вялость наблюдалась в течение 2,5 ± 0,4 против 3,6 ± 0,5 дней, анорексия, соответственно 2,7 ± 0,4 против 4,0 ± 0,6 дней (р < 0,05).
Длительность сохранения примеси крови в испражнениях детей составила 2,0 ± 0,3 дня, против 2,6 ± 0,4 дней, у пациентов группы сравнения. Аналогичная динамика интоксикационного синдрома наблюдалась у больных с уровнем ВНСММ плазмы 10-19,9 УЕ, получавших в составе патогенетической терапии реамберин. Период вялости и анорексии составил 1,9 ± 0,3 и 2,1 ± 0,2 дней соответственно, в отличие детей группы сравнения, у которых продолжительность симптомов была превышена в 1,5 раза (2,9 ± 0,4 и 2,8 ± 0,3 дней соответственно).
Таблица 1. Показатели интенсивности СРО и эндогенной
интоксикации
в плазме крови у детей, больных дизентерией (М ± m )
| Биохимические показатели |
Здоровые дети (n = 15) |
Группы детей, больных дизентерией |
||
|---|---|---|---|---|
| Сниженная активация СРО (n=14) | Средний уровень СРО (n=20) | Гиперактивация СРО (n=12) | ||
|
ХЛМАКС(имп·10-3) |
0,7 ± 0,2 |
0,4 ± 0,1 |
1,6 ± 0,1* |
7,5 ± 2,2** |
|
ХЛ1(имп·10-3) |
0,4 ± 0,2 |
0,2 ± 0,1 |
0,6 ± 0,1** |
3,4 ± 1,6* |
|
S(имп·10-3) |
106,3 ± 64,0 |
105,5 ± 22,7 |
238,5 ± 31,3* |
1386,3 ± 453,5** |
|
% торможения |
41,5 ± 3,4 |
21,9 ± 6,8 |
38,1 ± 5,5 |
40,7 ± 11,1 |
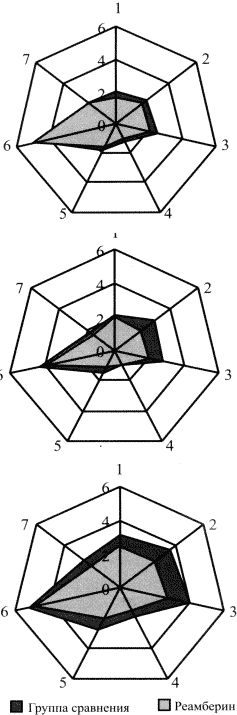
Рис. 2. Длительность клинических проявлений дизентерии, в зависимости от уровня веществ низкой и средней молекулярной массы (ВНСММ) плазмы и варианта инфузионной терапии.
Обозначения:
ВНСММ плазмы < 9,9 УЕВ;
НСММ плазмы 10 - 19,9 УЕВ; НСММ плазмы > 20 УЕ
1 - лихорадка, 2 - вялость, 3 - анорексия, 4 - головная боль,
5 - тахикардия, 6 - диарея, 7 - гемоколит.
Изучение оксидативных процессов плазмы крови позволило установить неоднородный характер активации СРО в острый период шигеллезной инфекции у детей. У большинства обследованных (69,5%) отмечено нарастание уровня СРО, который более чем в 2,5 раза превышал показатели здоровых детей (табл. 1). Из них у 26,1% детей имела место гиперактивация СРО с достоверно значимыми гипервысокими значениями хемилюминесценции плазмы (р < 0,01). В этиологической структуре отмечалось преобладание больных дизентерией Флекснера (70,0 и 83,3% соответственно). У 30,4% больных детей отмечалось достоверное снижение интенсивности оксидативных процессов, что свидетельствует о быстром истощении субстратов окисления.
Учитывая полученные данные о неоднородном характере процессов СРО в плазме крови, провели сравнительный анализ эффективности реамберина у детей с различной активностью оксидативных процессов.
У больных (табл. 2), со средним уровнем активации свободнорадикальных процессов реамберин способствовал наиболее быстрому регрессу интоксикационного синдрома. Период вялости и анорексии детей короче в 2-2,5 раза, в отличие от больных группы сравнения, достоверно быстрее купировалась тахикардия. При изучении динамики местного воспалительного процесса в кишечнике выявлено сокращение длительности гемоколита у детей, получавших реамберин, в сравнении с больными на общепринятой инфузионной терапии.
У детей с гиперактивацией свободнорадикальных процессов реамберин сокращал длительность температурной реакции, тахикардии, анорексии, меньше регистрировалась вялость, в отличие от больных группы сравнения. У детей с исходно низкими показателями СРО длительность интоксикационного синдрома и местных проявлений воспалительного процесса была сопоставима с больными группы сравнения, однако по ряду показателей выявлялась тенденция к сокращению периода интоксикации (табл. 2).
Таблица 2. Эффективность реамберина у больных
с различной интенсивностью свободнорадикального
окисления(СРО)
в плазме крови (М ± m)
| Клинические симптомы (дни) |
Группа сравнения (n=25) |
Терапия реамберином | |||
|---|---|---|---|---|---|
|
Сниженная активация СРО (n=27) |
Средний уровень активации CРО (n=23) |
Гиперактивация СРО (n=19) |
|||
|
Лихорадка |
2,8 ± 0,6 |
2,3 ± 0,6 |
1,6 ±0,4 |
2,1 ±0,6 |
|
|
Вялость |
4,1 ±0,4 |
2,8 ± 0,8 |
1,9 ±0,5" |
2,3 ± 0,7* |
|
|
Анорексия |
4,3 ± 0,7 |
3,2 ± 0,6 |
1,7 ±0,5" |
2,6 ± 0,7 |
|
|
Тахикардия |
2,1 ±0,2 |
1,4 ±0,4 |
1,0 ±0,4* |
1,7 ± 0,4 |
|
|
Диарея |
5,4 ± 0,8 |
4,6 ±1,1 |
4,7 ± 0,8 |
5,0± 1,2 |
|
|
Патологические примеси в стуле |
7,4 ±1,2 |
6,5 ± 1,6 |
5,8 ± 1,3 |
5,3 ± 1,0 |
|
|
Гемоколит |
2,3 ± 0,2 |
1,5 ±0,5 |
1,2 ±0,4* |
1,7 ±0,6 |
|
Примечание
* - достоверное отличие c группой сравнения (р <
0.05)
** - достоверное отличие c группой сравнения (р < 0.01)
Помимо положительного влияния на клинические проявления интоксикационного синдрома, использование реамберина приводило к более быстрой ликвидации воспалительных сдвигов лабораторных показателей периферической крови и копроцитограммы. Уже к 3-му дню терапии у больных, получавших инфузии реамберина, отмечалось снижение количества лейкоцитов относительно исходного состояния (7,9 ± 0,8·109/л против 10,8 ± 1,3 соответственно). Абсолютное и относительное снижение лейкоцитов происходило за счет уменьшения количества незрелых (палочко-ядерных) форм с 24,5 % в первые сутки госпитализации до 5,3% – в период ранней реконвалесценции. К 6-му дню лечения у 84% больных уровень лейкоцитов не отличался от такового здоровых детей (составив 5,6 ± 0,6·109/л против 5,1 ± 0,3·109/л). У детей группы сравнения показатели гемограммы сохраняли умеренно воспалительную реакцию до периода ранней реконвалесценции, характеризующуюся относительным нейтрофилезом (до 63%) и палочкоядерным сдвигом лейкоцитарной формулы (до 9,4%) при количестве лейкоцитов в 7,8 ± 0,9 ·109/л.
Определение длительности колитных изменений в испражнениях больных, по данным копроцитограммы, не выявило отличительных особенностей от варианта проводимой терапии. Отмечена лишь тенденция к сокращению микроскопической визуализации эритроцитов у детей, получавших реамберин (4,6 ± 0,9 против 5,4 ± 1,1 дней в группе сравнения).
При оценке показателей, характеризующих синдром эндогенной интоксикации [11, 14], выявлена более динамичная нормализация уровня ВНСММ плазмы в группе детей, получавших реамберин (табл. 3).
Таблица 3. Динамика маркеров эндогенной интоксикации,
в зависимости от варианта проводимой инфузионной терапии (М±m)
| Показатели эндогенной интоксикации |
Здоровые дети (n=15) |
Группа сравнения (n=53) |
Терапия реамберином (n=118) |
|---|---|---|---|
|
При поступлении |
|||
|
ВНСММ плазмы (УЕ) |
6,7 ± 0,8 |
13,2 ± 1,1 |
13,8 ± 0,9 |
|
ВНСММ эритроцитов (УЕ) |
22,1 ± 1,0 |
23,1 ± 0,9 |
24,0±1,0 |
|
Индекс распределения |
0,4 ± 0,03 |
0,6 ± 0,02 |
0,6 ± 0,02 |
|
3-й день стационарного лечения |
|||
|
ВНСММ плазмы (УЕ) |
6,7 ± 0,8 |
10,2 ± 0,7* |
8,1±0,5*** |
|
ВНСММ эритроцитов (УЕ) |
22,1 ± 1,0 |
22,4 ± 0,8 |
23,2 ± 0,9 |
|
Индекс распределения |
0,4 ± 0,03 |
0,5 ± 0,02* |
0,4 ± 0,03 |
|
6-й день стационарного лечения |
|||
|
ВНСММ плазмы (УЕ) |
6,7 ±.0,8 |
8,3 ± 0,6 |
7,3 ± 0,5 |
|
ВНСММ эритроцитов (УЕ) |
22,1 ±1,0 |
21,3 ±1,2 |
21,9 ± 0,9 |
|
Индекс распределения |
0,4 ± 0,03 |
0,4 ± 0,05 |
0,3 ± 0,02 |
Примечание
Отличия достоверны по сравнению:
* – с исходным уровнем (р < 0,05);
** – с группой сравнения (р < 0,05);
# – со здоровыми детьми (р < 0,01).
ВНСММ – вещества низкой и средней молекулярной
массы
У больных, получавших инфузии глюкозо-солевых растворов, нормализация маркеров эндотоксикоза происходила медленнее, и к 3-му дню стационарного лечения их уровень был достоверно выше аналогичных показателей у здоровых и получавших реамберин детей. Окончательная нормализация величины ВНСММ плазмы происходила к концу 1-й недели у детей, получавших реамберин, а у пациентов группы сравнения концентрация ВНСММ плазмы лишь приближалась к величинам здоровых детей.
Аналогичные изменения отмечались в динамике лейкоцитарного индекса интоксикации, выражавшиеся в его нормализации к 6-му дню терапии во всех группах больных (рис. 3). Однако его снижение к 3-му дню терапии было более очевидно у больных, получавших реамберин, составив соответственно, 0,8 ± 0,2 против 1,4 ± 0,3 у детей контрольной группы.
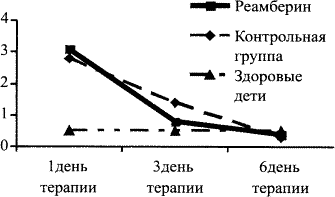
Рис. 3. Динамика лейкоцитарного индекса интоксикации
в зависимости от варианта проводимой терапии
У больных среднетяжелой формой дизентерии, в составе терапии которых использовали реамберин, нормализация значений ВНСММ плазмы наступала уже к 3-му дню стационарного лечения (6,7 ± 0,9 УЕ), тогда как у больных группы сравнения аналогичные показатели сохраняли высокие значения (10,4 ± 1,2 УЕ, р < 0,05). При тяжелой форме дизентерии к 3-му дню терапии концентрация ВНСММ плазмы сохранялась на высоком уровне, однако, при использовании реамберина была меньшей, в отличие от исходного состояния (11,8 ± 1,2 УЕ, против 18,1 ±2,1 УЕ до терапии, р < 0,05) и больных группы сравнения (11,8 ± 1,2 УЕ, против 15,3 ± 1,5, р < 0,05). Нормализация маркеров эндотоксикоза на фоне терапии реамберином при тяжелом течении заболевания происходила к концу первой недели терапии, тогда как у детей группы сравнения в эти сроки отмечена лишь тенденция к их снижению (8,1 ± 0,9 УЕ, против 10,8 ± 1,5 УЕ).
Динамика маркеров эндотоксикоза, в зависимости от сероварианта возбудителя, выявила наиболее быструю нормализацию ВНСММ плазмы и лейкоцитарного индекса интоксикации (ЛИИ) при среднетяжелых формах дизентерии Зонне, согласуясь с данными клинического обследования. Среднетяжелые формы шигеллеза Флекснера характеризовались постепенным снижением уровня ВНСММ плазмы и ЛИИ с тенденцией к нормализации показателей к концу первой недели терапии (8,8 ± 0,4 УЕ и 0,5 ± 0,03 соответственно). При использовании реамберина обратная динамика показателей эндогенной интоксикации отмечалась наиболее отчетливо, с нормализацией значений ВНСММ плазмы и ЛИИ к 7 дню заболевания (7,5 ± 0,5 УЕ и 0,4 ± 0,03 соответственно). Тяжелые формы дизентерии Флекснера характеризовались максимальным исходным уровнем ВНСММ плазмы и ЛИИ с постепенным снижением изучаемых показателей в динамике заболевания. Однако к концу первой недели полной нормализации маркеров эндотоксикоза не отмечалось. Реамберин приводил к выраженному снижению концентрации ВНСММ плазмы и величины ЛИИ при тяжелой форме дизентерии Флекснера, значения которых к 7-му дню лечения составляли 8,3 ± 0,8 УЕ и 0,6 ±0,06, соответственно, против 10,2 ±1,0 УЕ и 0,8 ± 0,1 у детей группы сравнения.
Антиоксидантное действие реамберина проявлялось снижением интенсивности оксидативных процессов у больных с высокой активацией СРО уже к 3-5-му дню стационарного лечения (рис. 4), устранение дисбаланса между оксидантной и антиоксидантной системами при тяжелых формах дизентерии.
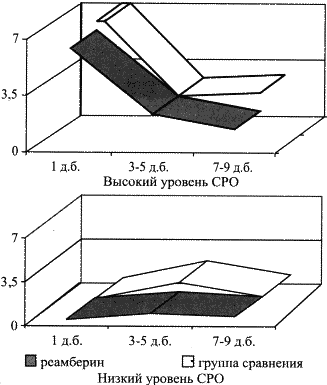
Рис. 4. Динамика показателей
хемилюминесценции плазмы у больных
Таким образом, объективными лабораторными маркерами интоксикационного синдрома являются показатели веществ низкой и средней молекулярной массы плазмы, отражающие степень эндотоксемии, обусловливающие тяжесть инфекционного процесса. Рациональная терапия больного предполагает воздействие на все составляющие инфекционного процесса: возбудителя и его токсины, реактивность организма и отдельные звенья патогенеза. Острый период дизентерии характеризуется определенными метаболическими сдвигами, выраженность которых определяет не только форму тяжести заболевания, но и вероятность развития осложненного течения заболевания.