|
АлАТ – аланинаминотрансфераза
СОД – супероксиддисмутаза
АОС – антиоксидантная система
ТДК – тиолдисульфидный коэффициент
АсАТ – аспартатаминотрансфераза
ХВГ – хронические вирусные гепатиты
ГГТП – γ-глутамилтранспептидаза
ХЗП – хронические заболевания печени
ГЦК – гепатоцеллюлярная карцинома
ЩФ – щелочная фосфатаза
ЛДГ – лактатдегидрогеназа
|
Заболевания печени остаются серьезной социально-экономической и
клинико-эпидемиологической проблемой здравоохранения всех стран
мира, занимая значительное место в структуре заболеваний органов
пищеварения. По данным ВОЗ, в мире насчитывается более 2 млрд людей
с признаками текущей или завершившейся инфекции вирусом гепатита
В, более 170 млн больных хроническим гепатитом С. Летальность,
обусловленная последствиями цирротической стадии хронических
заболеваний печени (ХЗП), такими как декомпенсированная
печеночная недостаточность, гепатоцеллюлярная карцинома (ГЦК),
по-прежнему остается высокой, унося ежегодно около 1 млн
человеческих жизней [1, 2].
В настоящее время при определении общей стратегии и тактики
лечения больных хроническими вирусными гепатитами (ХВГ) основное
внимание уделяют этиологическому направлению лечения для
достижения максимальной эффективности противовирусной терапии
[3-6]. Патогенетическое направление возможных лекарственных
воздействий при ХВГ остается без должного внимания. Хотя очевидно,
что при лечении инфицированных HCV и HBV должен оставаться
незыблемым основной принцип терапии инфекционных заболеваний –
комплексность и общая этиопатогенетическая направленность
лечебных воздействий.
Противовирусная терапия направлена на элиминацию гепатотропных
вирусов из организма больного, однако эрадикация вирусов не всегда
достижима. Приходится констатировать, что даже применение
современных противовирусных схем с использованием препаратов
рекомбинантных интерферонов с улучшенными фармакокинетическими
свойствами не позволяет вылечить всю инфицированную вирусами
популяцию больных с ХЗП. Тем не менее важно предотвратить
прогрессирование заболевания (стабилизировать или улучшить
гистологическую картину и функции печени) для профилактики
осложнений портальной гипертензии и предотвращения развития ГЦК
[7-9].
Трудности в проведении стандартной противовирусной терапии,
основанной на длительном применении препаратов интерферона-±,
аналогов нуклеотидов, обусловлены многочисленными и зависимыми от
дозы побочными реакциями в связи с нейро-, гепато- и
кардиотоксическим действием, по причине которых 5% больных
отказываются от лечения в начале курса противовирусной терапии, а
20% не доводят его до конца [10-13].
Если учитывать разнообразие патологических процессов и их
последствия на региональном уровне (в печеночной ткани) и на уровне
всего организма при ХВГ, а также обилие побочных эффектов
используемых противовирусных препаратов, то становятся очевидными
издержки увлечения противовирусными средствами и ошибочность
тактики выстраивания терапии лишь на основании этиологической
направленности [14].
Рациональное лечение больных с латентными и клинически
проявляющимися формами гемоконтактных вирусных гепатитов
предполагает необходимость воздействия на все составляющие
инфекционного процесса:
- возбудителя инфекции,
- общую реактивность организма,
- отдельные звенья патогенеза.
В последние годы выявлена взаимосвязь процессов
свободнорадикального окисления липидов клеточных мембран и
повреждения клеток печени [15, 16]. В патогенезе синдрома
цитолиза важная роль отводится свободнорадикальным процессам
(рис. 1, 2). Изменения в окислительно-восстановительном гомеостазе
тиолдисульфидной системы, оцениваемые ТДК, свидетельствуют о
нарушениях в тиоловом звене как белковой, так и низкомолекулярной
фракций сыворотки крови [17, 18].
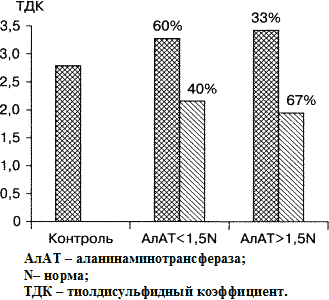
Рис.1. ТДК белковых соединений у больных ХВГ
в зависимости от наличия цитолитического синдрома.
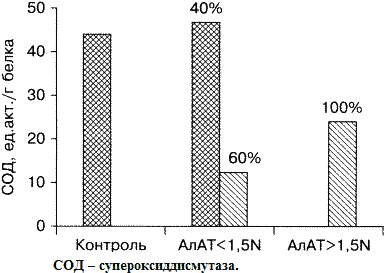
Рис.2. Показатели активности СОД у больных ХВГ
в зависимости от наличия цитолитического синдрома.
По данным экспериментальных и клинических исследований, рост
числа признаков мезенхимального воспаления в печени, а также
выраженность печеночно-клеточной недостаточности ассоциируются с
дисфункцией системы мононуклеарных фагоцитов. Основными
проявлениями этой дисфункции служат резкое повышение уровня
провоспалительных цитокинов, истощение ферментного и
субстратного звеньев антиоксидантной системы (АОС) сыворотки крови,
дисбаланс системы интерферона и другие признаки вторичной иммунной
недостаточности, которые определяют патогенез и факторы
неэффективности этиотропной терапии [19, 20).
Функционирование ряда АОС напрямую зависит от уровня
восстановленного глутатиона в клетке и общего фонда
восстановительных эквивалентов НАДН и НАДФН. По этой причине
наиболее эффективным путем коррекции гипоксических нарушений в
тканях является комплексная активация дыхательной цепи,
включающая активацию альтернативного сукцинатоксидазного
окисления путем повышения активности сукцинатдегидрогеназы;
улучшение проникновения экзогенного сукцината в митохондрии
клеток; стимуляцию зависимого от НАД окисления; подавление
образования свободных радикалов в клетке [21-23].
На различных экспериментальных моделях гипоксии установлено
действие янтарной кислоты (сукцината) как субстратного
антигипоксанта и протектора клеточных мембран.
Универсальными подходами патогенетической терапии при ХЗП
является применение средств восстановления энергетического
потенциала клеток в условиях тканевой гипоксии; средств защиты
клеточных мембран от факторов свободнорадикального окисления;
средств индуктивной и заместительной иммунокоррекции [24, 25]. Ниже
представлены препараты для патогенетической терапии ХВГ.