По мнению А.П. Зильбера (1995) под критическим состоянием
следует понимать крайнюю степень любой, в том числе и ятрогенной,
патологии, при которой требуется искусственное замещение или
поддержка жизненно-важных функций организма. Универсальной основой
любого критического состояния выступает полиорганная
несостоятельность, под которой понимают (Лейдман И.Н., 1999)
тяжелую неспецифическую стресс-реакцию организма, недостаточность
двух и более функциональных систем, универсальное поражение всех
органов и тканей организма агрессивными медиаторами критического
состояния с временным преобладанием симптомов той или иной органной
недостаточности: легочной, сердечной, церебральной, почечной и т. д.
При этом всегда можна выделить орган или систему, расстройства и
повреждения которых приводят к формированию первичного синдрома
множественной недостаточности (Beal A.L., Cerra F.B., 1994). В
ответ на него развивается системная патологическая реакция,
обуславливающая недостаточность функциональных систем и нарушения
деятельности органов, составляющих вторичный синдром множественной
органной несостоятельности (Шанин В.Ю., 2003).
Главной особенностью полиорганной несостоятельности является
настолько глубокое повреждение органа и/или системы, после которого
он/они не способны функционировать как в интересах поддержания
жизненно-важных функций всего организма, так и в интересах
сохранения своей структуры. Формированию полиорганной
несостоятельности предшествует развитие полиорганных дисфункции и
недостаточности (Сизов Д.Н. и соавт., 1998), клинико-лабораторная
характеристика стадийности течения которых представлена в
табл. 1.
Для идентификации клинико-лабораторной дисфункции органов и
систем можно также использовать табл. 2 или приложение 1.
Непосредственными причинами, определяющими выраженность
полиорганной дисфункции, являются различная способность органов
противостоять гипоксии и снижению кровотока, их исходное
функциональное состояние, характер фактора агрессии. Таким образом,
основными патогенетическими звеньями критических состояний,
невзирая на их полиэтиологичность, являются гипоксия, интоксикация,
иммуносупрессия.
Таблица 1. Клинико-лабораторная характеристика стадийности
органных
повреждения (по Д.Н. Сизову и соавт., 1998)
|
Орган
|
Стадия
|
Характеристика
|
|
ЦНС
|
Дисфункция
Недостаточность
Несостоятельность
|
Шкала Глазго – 9-13 баллов
Сомноленция, психоз
Шкала Глазго – 5-8 баллов
Сопор – кома І стадия
Шкала Глазго - <5 баллов
Кома ІІ - ІІІ стадии
|
|
Сердце и сосуды
|
Дисфункция
Недостаточность
Несостоятельность
|
АД относительно стабильно
АД нестабильно (гипотензия)
АД нестабильно
|
|
Легкие
|
Дисфункция
Недостаточность
Несостоятельность
|
Дыхательный дискомфорт
рО2/ FiO2>250 мм. рт. ст.
Дыхательная гипоксия
рО2/ FiO2= 100-250 мм. рт. ст.
рО2/ FiO2= 75 - 100 мм. рт. ст.
|
|
Почки
|
Дисфункция
Недостаточность
Несостоятельность
|
Мочевой синдром, азотемия отсутствует
FeNa - 0,5-1%, с(Н2О) 1 –40 мл/ч
Азотемия (креатинин >200 ммоль/л)
FeNa >1%, с(Н2О) <1 мл/ч
Стойкая олигоанурия (более суток)
Калий плазмы >7,0 ммоль/л
|
|
Печень
|
Дисфункция
Недостаточность
Несостоятельность
|
Цитолиз (АсАТ, АлАТ, СДГ, ГДГ)
Билирубинемия (до 60 ммоль/л)
Гипоальбуминемия (<15 г/л)
Снижение протромбина (до 60%)
Печеночная кома
Геморрагический синдром
|
|
Желудочно-кишечный тракт
|
Дисфункция
Недостаточность
Несостоятельность
|
Кишечный парез
Мальабсорбция
Паралитическая непроходимость
Острые язвы и эрозии желудочно-кишечного тракта
Энтероррагия
Кровотечение из желудочно-кишечного тракта
|
Таблица 2. Клинические и лабораторные признаки
для идентификации дисфункции органа
(R.A. Balk и соавт., 2000)
|
Система органов
|
Признаки
|
|
Клинические
|
Лабораторные
|
|
Респираторная
|
Тахипноэ
Ортопноэ
|
РаО2< 70 мм рт ст
SaO2<90%
РаО2/FiO2< 300
|
|
Почечная
|
Олигурия
Анурия
|
Увеличение уровня креатинина
|
|
Печеночная
|
Желтуха
|
Гипербилирубинемия
Рост АЛТ. АСТ
Рост щелочной фосфатазы
Гипоальбуминемия
|
|
Сердечно-сосудистая
|
Тахикардия
Гипотензия
Аритмия
|
Уменьшение фракции выброса
Уменьшение сердечного выброса
|
|
Гематологическая
|
Кровотечение
Тромбоз
|
Тромбоцитопения
Уменьшение протеина С
|
|
Желудочно-кишечная
|
Желудочно-кишечное кровотечение или перфорации, кишечная
непроходимость
|
Увеличение уровня липазы, амилазы
Уменьшение рН
|
|
Нервная
|
Нарушение сознания и ментальности
|
Биспектральный контроль
Электроэнцефалография
|
|
Эндокринная
|
Потеря веса
|
Гипертриглицеридемия, гипоальбуминемия
|
Причем, помимо того, что гипоксия и интоксикация сами по себе,
т. е. по отдельности, могут привести к развитию критических
состояний, они обладают эффектом взаимного потенцирования или
отягощения, что резко увеличивает степень их танатогенности.
Гипоксия сопровождает любую патологию. По современным
представлениям (Лукьянова Л.Д., 2001) гипоксия является
патофизиологическим процессом, развивающимся в условиях дефицита
кислорода или действия токсических веществ. В основе гипоксии лежит
инактивация митохондриальных ферментных и ионотранспортных
комплексов. Это ведет к нарушению аэробного синтеза энергии, к
торможению (или полной блокаде) энергозависимых метаболических
функций клеточных мембран, к структурным изменениям и гибели
клеток.
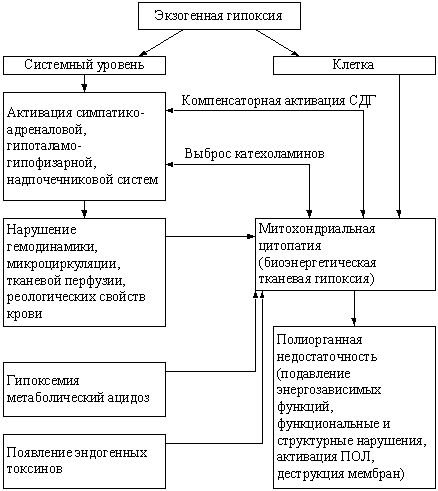
Рисунок 1. Биоэнергетическая гипоксия, как базовый механизм,
формируемый двумя путями (Л.Д. Лукьянова, 2001)
По мнению Лукьяновой Л.Д. (1999, 2001) патологические эффекты
гипоксии реализуются двумя путями (рис. 1): вследствие прямого
воздействия на биоэнергетический аппарат клетки с нарушением его
функции (биоэнергетическая гипоксия) и опосредованно – через
стрессорную активацию нейрогуморального звена, запускающего
реакции «патологического» метаболического каскада, которые
формируют условия, ухудшающие диссоциацию оксигемоглобина и
ограничивающие поступление кислорода в клетку. Возникает так
называемая «метаболическая гипоксия».
Гипоксия имеет стадийный характер течения (рис. 2). При снижении
кислорода в среде, окружающей клетку, изменяется активность
митохондриальных ферментов (биоэнергетическая гипоксия) на
субстратном участке в области І ферментного комплекса
(НАД-зависимый путь окисления). Это приводит к нарушению
сопряженного с ним процесса окислительного фосфорилирования (1-я –
компенсаторная – стадия биоэнергетической гипоксии).
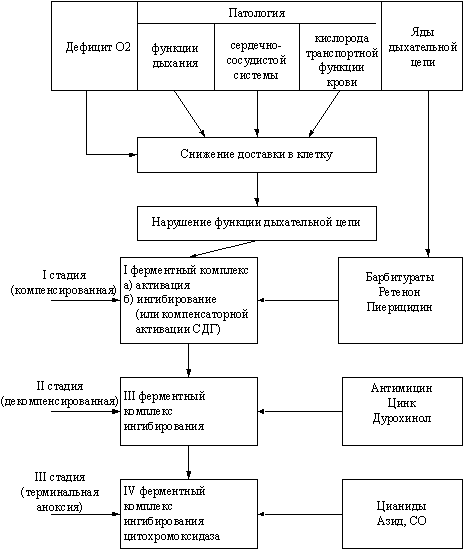
Рисунок 2. Схема последовательности нарушений активности
различных митохондриальных ферментных компонентов при гипоксии,
возникающей при разных патологиях
(Л.Д. Лукьянова, 2001.)
При продолжающемся гипоксическом воздействии нарушения
электрон-транспортной функции дыхательной цепи распространяются от
субстратного к цитохромному участку (область цитохромов в-с). Это
соответствует 2-й – обратимой – стадии биоэнергетической гипоксии и
сопровождается декомпенсацией энергетического обмена. Когда
нарушения электрон-транспортной функции дыхательной цепи
митохондрий приводят к инактивации цитохромоксидазы, формируется
3-я – терминальная или необратимая – стадия биоэнергетической
гипоксии. Стадийность процесса определяется тяжестью и
длительностью снижения доставки кислорода к клетке, а в комплексе
функционально-метаболических нарушений («метаболическая гипоксия»)
изменения энергетического обмена играют ведущую роль.
Для коррекции митохондриальных нарушений при гипоксии
современная медицина использует вещества, способные защитить клетку
от гипоксии, так называемые, цитопротекторы или антигипоксанты.
Антигипоксанты – это лекарственные вещества, повышающие
резистентность организма к гипоксии или предотвращающие ее, а также
ускоряющие нормализацию функции клетки в восстановительный период
(Коваленко А.Л., Романцев М.Г., 1999). В настоящее время
антигипоксанты выделены и признаны в качестве нового
самостоятельного класса фармакологических веществ, в основе
действия которых лежит коррекция возникающего на почве гипоксии
дефицита энергии в тканях, что дает возможность профилактики и
смягчения влияния гипоксии на любой орган. Они могут быть
прямого или непрямого действия (Гусев Е.И. и соавт.,
2003). Антигипоксанты прямого действия корректируют физиологические
процессы в клетке, находящейся в условиях гипоксии, на уровне
митохондрий: нормализуют электрон-транспортную функцию дыхательной
цепи, активируют ферменты. Это облегчает поступление кислорода в
клетку и восстанавливает аэробный энергетический обмен.
Антигипоксанты непрямого действия облегчают реакцию организма на
гипоксию в целом и ускоряют нормализацию функций клеток
опосредованно.
Повышение устойчивости к гипоксии обеспечивают такие
интрамедиаторы цикла Кребса, как фумаровая, лимонная и янтарная
кислоты. Последняя по клинической классификации относится к
субстратным антигипоксантам.
Янтарная кислота (бутадионовая кислота,
этан-1,2-дикарбоновая кислота) - является универсальным
промежуточным метаболитом, образующимся при взаимопревращениях
углеводов, белков и жиров в растительных и животных клетках
(Оболенский С.В., 2003). В физиологических условиях она
диссоциирована, поэтому название ее аниона – сукцинат, часто
применяют как синоним термина «янтарная кислота».
Свободная янтарная кислота в небольших количествах обнаружена в
буром угле, торфе, натуральных смолах и янтаре. В незначительных
количествах янтарная кислота содержится в незрелых ягода и соках
сахарной свеклы, сахарного тростника, репы, в ревене, алоэ,
боярышнике, землянике, каланхоэ, крапиве, чистотеле, полыни и
других растениях, а также в продуктах спиртового брожения.
Дополнительным источником ее в тканях является липолиз.
Содержание янтарной кислоты в животных тканях сопоставимо с
таковым для других ди- и трикарбоновых кислот. Эндогенный уровень
ее в плазме крови человека колеблется от 1 до 6 мкг/мл.
Обнаруживаемая в животных тканях, янтарная кислота является
продуктом пятой и субстратом шестой реакции в цикле Кребса (рис.
3.)
Рисунок 3. Цикл Кребса
Превращение янтарной кислоты в организме обеспечивает продукцию
энергии. Мощность системы энергопродукции, которую она
обеспечивает, в сотни раз превосходит все другие системы
энергообразования организма (Кондрашова М.Н, 1971, 1976).
В нервной ткани функционирует так называемый γ-аминобутиратный
шунт (ГАМК-шунт или цикл Робертса), в ходе которого янтарная
кислота образуется из γ-аминомасляной кислоты через промежуточную
стадию янтарного полуальдегида. У растений янтарная кислота
продуцируется в глиоксилатном цикле при расщеплении изолимонной
кислоты изоцитралазой, у некоторых микроорганизмов - в процессе
сукцинат-пропионатного брожения.
Биологическая активность экзогенного сукцината зависит от дозы,
режима введения препарата, его химической формы (кислота, соль,
сложный эфир) и функционального состояния организма.
При применении физиологических доз янтарной кислоты можно
выделить две группы эффектов:
- прямое действие янтарной кислоты на клеточный метаболизм;
- влияние янтарной кислоты на транспорт свободного кислорода в
ткани.
В экспериментах in vitro было показано, что применение сукцината
увеличивает потребление кислород тканями за счет окисления
добавленных субстратов до конечных продуктов: углекислоты, воды и
тепла. Одна молекула сукцината обеспечивает окисление многих
эндогенных субстатов. Т. е. окисление сукцината является необходимым
условием каталитического действия других карбоновых кислот для
усвоения тканью кислорода. Для пополнения пула всех органических
кислот цикла Кребса у человека оказалось достаточным вводить
экзогенный сукцинат (Кондрашова М.Н., 1976, 1979, 1996; Маевский
Е.И., 1989). Биологическое значение данного явления заключается в
быстром ресинтезе клетками АТФ и в повышении их антиоксидантной
резистентности. Преимущества сукцината перед другими субстратами
клеточного окисления наиболее выражены в условиях гипоксии, когда
возрастает продукция эндогенного сукцината и скорость его
окисления.
Например, при ишемических и гипоксических поражениях головного
мозга снижается уровень таких макроэргов, как АТФ и креатинфосфат.
Изменения дыхательной цепи митохондрий начинаются на субстратном
участке, где после кратковременного усиления резко снижается
активность НAДН-зависимого пути окисления. Последнее нарушает
перенос электронов на участке НAДН-коэнзим Q и окислительное
фосфорилирование, связанное с ним. И если на начальных этапах
гипоксии внутриклеточная концентрация макроэргов снижается
незначительно т. к. активизируются компенсаторные альтернативные
метаболические потоки (в частности, сукцинат оксидазный путь
окисления), то при прогрессировании гипоксии блокируется
терминальный-цитохромный участок дыхательной цепи митохондрий.
Параллельно происходят изменения в гликолитическом пути
образования АТФ. Первоначальная активация его и накопление молочной
кислоты выступают в роли процесса альтернативного окислительному
фосфорилированию. Однако гликолиз даже в условиях, когда он
поставляет в клетки до 80% всей образующейся энергии, удовлетворяет
потребности их в энергии всего на одну треть. А если ишемия не
устраняется, то наступает торможение гликолиза.
Необходимо отметить, что повреждение системы доставки АТФ часто
опережает нарушение его образования. Разобщение синтеза и
утилизации АТФ объясняет возникновение необратимых изменений
(повреждений) клеток мозга при довольно высоком уровне АТФ.
Факторами особой значимости при церебральных ишемии и вторичной
гипоксии выступают «оксидантный стресс» и рост свободных радикалов,
источником генерации которых служат либо митохондриальные ферменты,
либо НAДН-оксидаза наружной мембраны митохондрий, которая не
связана с дыхательной цепью. Повышенная продукция свободных
радикалов является одной из причин длительного спазма сосудов,
прогрессирования ишемических отека или набухания мозга.
Поэтому фармакологическая коррекция энергетических нарушений в
нейронах, обусловленных ишемией или гипоксией, должна включать либо
восстановление НAД - зависимого участка дыхательной цепи
митохондрий, либо активацию метаболических потоков, альтернативных
НAД - оксидазному, т. е. обеспечива-ющих поступление электронов на
терминальный-цитохромный-участок дыхатель-ной цепи и поддерживающих
тем самым способность митохондрий производить энергию.
Наиболее быстрым альтернативным путем выступает
сукцинатоксидазное окисление, активация которого возможна через
повышение активности сукцинатдегидрогеназы и улучшение
проникновения как экзогенного, так и эндогенного сукцината в
митохондрии. Введенная в организм янтарная кислота, выполняя
каталитическую функцию по отношению к циклу Кребса, снижает
содержание в крови таких интермедиаторов этого цикла, как лактат,
пируват, цитрат, которые накапливаются на ранних стадиях гипоксии.
Феномен быстрого окисления янтарной кислоты
сукцината-дегидрогеназой с быстрым ресинтезом АТФ, получил название
«монополизации дыхательной цепи».
Цикл Робертса, функционирующий в нервной ткани, в ходе которого
янтарная кислота образуется из гамма – аминомасляной кислоты, также
направлен на защиту нейронов от гипоксии. Т. е. антигипоксическое,
нейропротекторное действие янтарной кислоты обусловлено ее влиянием
на ресинтез АТФ в митохондриях и увеличением содержания в мозге
гамма - аминомасляной кислоты (Румянцева С.А. и соавт., 2002). Это
ослабляет деструкцию мембранных элементов нейронов, способствует
полному восстановлению функций и структуры мозга (Клигуненко Е.Н. и
соавт., 1986; Усенко Л.В. и соавт., 1996; Гусев Е.И., Скворцова
В.И., 2001).
Под влиянием янтарной кислоты в организме нормализуются обмен
гистамина и серотонина, улучшается микроциркуляция в органах и
тканях, ограничивается зона некроза в миокарде, усиливается
биоэлектрическая активность сердца, улучшается гемодинамика,
восстанавливается активность ключевого
окислительно-восстановительного фермента дыхательной цепи
митохондрий клеток-цитохромоксидазы (Кондрашова М.Н., 1996; Исаков
В.А., Коваленко А.Л., 2001). Таким образом, в основе
лечебно-профилактического действия янтарной кислоты и ее соединений
лежит модифицирующее влияние на процессы тканевого метаболизма
(клеточное дыхание, ионный транспорт, синтез белков). Причем,
амплитуда и направленность модификаций зависят от исходного
функционального состояния тканей, а конечный результат выражается в
оптимизации параметров их функционирования.
Реамберин (от слова «янтарь») – единственный полиионный
раствор для внутривенного введения, содержащий натрия сукцинат.
Состав реамберина представлен в табл. 3. Препарат относится к 5-му
классу практически нетоксичных лекарственных средств, не обладает
мутагенным или канцерогенным действием.
Таблица 3. Физико-химические свойства и состав реамберина
|
Химический состав
|
Ионный состав
|
|
Натрия хлорида – 6,00 г
Калия хлорида – 0,30 г
Магния хлорида – 0,12 г
N-(1-дуокси-Д-глюцитол-1-ил)-N-метиламмония натрия сукцината –
15,00 г
Вода для инъекций – до 1 л
Осмолярность – 322 мосм/л
|
натрия – 142, 4 ммоль
калия – 4,0 ммоль
магния – 1,2 ммоль
хлорида – 109,0 ммоль
сукцината N-метилглюкаммония – 44,7 ммоль
рН – слабощелочной раствор
|
Показаниями для применения препарата являются:
- Гипоксические состояния различной этиологии: критические
состояния в интенсивной терапии, ранний послеоперационный и
постнаркозный периоды, шоки (гиповолемический, геморрагический,
ожоговый, инфекционно-токсический, травматический, кардиогенный),
острая сердечная недостаточность (в том числе, при аритмиях),
различные виды острой и хронической дыхательной недостаточности,
острая ишемия головного мозга различного генеза.
- Интоксикации различного генеза: отравления ксенобиотиками и
эндогенная интоксикация (в том числе, при перитонитах, панкреатитах
и панкреонекрозах).
- Гепатиты различной этиологии: холестатические, токсические,
лекарственные (в том числе - вирусные).
Способ применения
Реамберин применяют у взрослых только внутривенно капельно в
суточной дозе до 2 литров. Скорость введения препарата определяется
тяжестью состояния больного, но не должна превышать 90 кап./мин (1
– 1,5 мл/мин). Средняя доза препарата составляет 400-800 мл/сутки.
При тяжелой кровопотере препарат вводится также медленно на фоне
быстрого введения коллоидов, кристаллоидов и других инфузионных
препаратов. При гепатитах доза препарата колеблется от 200 мл до
800 мл за сутки. Срок лечения – до 10 дней.
Фармакокинетика
Изучение фармакокинетики 1,5% раствора реамберина показало, что
при внутривенном введении препарат в дозе 5 мг/кг массы тела
максимальный уровень реамберина в крови наблюдается в течение
первой минуты после введения с последующим быстрым снижением до
уровня 9-10 мкг/мл и через 40 минут после введения концентрация
препарата в крови возвращается к значениям близким к фоновым (от 1
до 6 мкг\мл) и остается на таком уровне до конца наблюдения.
Клинические эффекты реамберина
В последние годы неоспоримым считается, что эндотоксикоз и
энцефалопатия являются наиболее яркими и информативными симптомами
множественной дисфункции органов при критических состояниях.
Снижение уровня эндогенной интоксикации и нормализация высшей
нервной деятельности у больных в критических состояниях, имеющих
как экстрацеребральный, так и интрацеребраль-ный генез, имеют
благоприятный прогностический характер.
Мы применяли реамберин у 195 больных, находившихся в отделении
реанимации и интенсивной терапии – клинических базах кафедры
анестезиологии, интенсивной терапии и медицины неотложных
состояний ФПО ДГМА.
Распределение больных по нозологическим формам представлено в
табл. 4. Все больные были обследованы в момент поступления в
отделение, через сутки после введения препарата, на 5, 7, 11 сутки
от начала лечения препаратом реамберин. Контролем служили больные,
не получавшие в лечении препарат реамберин.
Таблица 4. Распределение больных, получавших реамберин,
по нозологическим
формам
|
№ п/п
|
Заболевание
|
Количество больных
|
|
1.
|
Перитонит различной этиологии
|
40
|
|
2.
|
Шок, обусловленный кровопотерей
|
25
|
|
3.
|
Шок, обусловленный термическим ожогом
|
25
|
|
4.
|
Политравма с преимущественным поражением органов грудной
клетки
|
25
|
|
5.
|
Желчекаменная болезнь с холестатической желтухой
|
35
|
|
6.
|
Острый панкреатит
|
25
|
|
7.
|
Гипергликемическая кетоацидотическая или гиперосмолярная
кома
|
25
|
|
8.
|
Постреанимационная болезнь
|
5
|
|
Всего
|
205
|
Анализ эффектов действия реамберина показал выраженный
органопротективный эффект препарата у больных в критических
состояниях.
Так, под влиянием реамберина быстрее на 24-28 часов
восстанавливалась моторная функция кишечника, улучшались показатели
«белой» крови у больных с перитонитами (табл. 5), быстро уходили
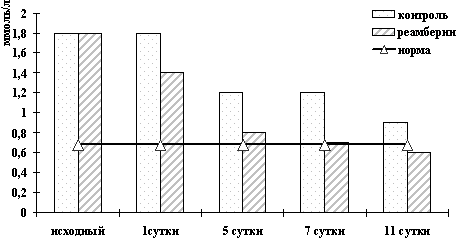
желтуха и ферментемия при холестазе (рис. 3, 4, 5), прерывался
воспалительный процесс при панкреатитах (табл. 6.), уменьшались
явления эндогенной интоксикации у всех перечисленных больных.
Таблица 6. Динамика уровня амилазы мочи
при различной ИТ острого
панкреатита
|
Сутки
|
Контроль
|
+Реамберин
|
|
Норма
|
4-63 ЕД
|
4-62 ЕД
|
|
Исходный фон
|
2480±124
|
2480±124
|
|
1-е
|
1640±100
|
750±95
|
|
5-е
|
250±64
|
124±30
|
|
7-е
|
108±12
|
62±8
|
|
11-е
|
64±8
|
32±6
|
Рисунок 3. Динамика изменений билирубина
при различной ИТ холестатических желтух
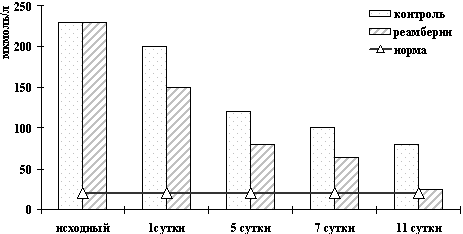
Рисунок 4. Динамика изменений АСТ
при различной ИТ холестатических желтух
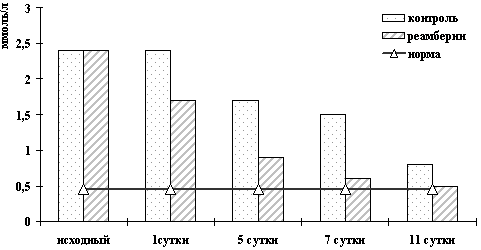
Рисунок 5. Динамика изменений АЛТ
при различной ИТ холестатических желтух
По данным Корнилова Н.Н. и соавт. (2002) применение реамберина
после ортопедических операций на крупных суставах обеспечивает
ускорение разрешения астено-вегетативного синдрома на 3-4 суток.
Боли в оперированной конечности и отек ее стихают к 4-5 суткам
после операции. Это позволяет проводить раннююю (со вторых суток)
мобилизацию больных, что улучшает конечные результаты лечения и
сокращает его продолжительность.
При ишемических поражениях головного мозга и энцефалопатиях
сложного генеза ранее применение реамберина позволяет сохранить
структурную целостность и адекватную функциональную активность
мозга (Румянцева С.А. и соавт., 2002).
При синдроме ПОН реамберин на 7%-5% уменьшает летальность
благодаря повышению резистентности организма к гипоксии.
При отравлениях нейротропными ядами под влиянием реамберина
уменьшается длительность коматозного состояния, снижается
количество вторичных легочных осложнений, что сокращает сроки
пребывания больных на интенсивной койке.
Таким образом, реамберин обладает целым рядом уже доказанных
положительных клинических эффектов, что позволяет нам рекомендовать
его широкое применение у критических больных. Вместе с тем, мы
надеемся, что Ваша работа с препаратом позволит выявить его новые
удивительные свойства.
Приложение 1
Приложение 2
Рекомендованная литература:
- Коваленко Л.А., Романцев М.Г. Реамберин 1,5 % для инфузий: от
эксперимента в клинику – Санкт-Петербург, 1999. – 112 с.
- Реамберин: реальность и перспективы/Сборник научных статей. –
Санкт-Петербург, 2002. – 168 с.
- Оболенский С.В. Реамберин – новое средство для инфузионной
терапии в практике медицины критических состояний/Метод.
рекомендации. – Санкт-Петербург, 2002. – 19 с.
- Лукьянова Л.Д. Гипоксия при патологиях. Молекулярные механизмы и
принципы коррекции// Перфторорганические соединения в биологии и
медицине. – Пущино, 2001. – с. 56-69.
- Кондрашова М.Н. Выясненные и наметившиеся вопросы на пути
исследования регуляции физиологического состояния янтарной
кислоты//Терапевтическое действие янтарной кислоты. - Пущино, 1976.
– с.8-30.
- Кондрашова М.Н. Накопление и использование янтарной кислоты в
митохондриях //Митохондрии. Молекулярные механизмы ферментативных
реакций. – Москва, 1972. – с.151-170.
- Усенко Л.В., Клигуненко Е.Н., Доронин А.Г. Динамика
функционального состояния коры головного мозга при лечении
экспериментальной черепно-мозговой травмы янтарно-кислым
натрием.//Актуальные проблемы теоре-тической и клинической медицины.
– Днепропетровск, 1996. – с. 64 - 67.
- Клигуненко Е.Н., Бондарь В.К., Доронин А.Г. Функциональное
состояние коры головного мозга и обмен биогенных аминов под
влиянием натрия сукцината при экспериментальной ЧМТ.//Материалы IV
научно-практич. конф. анестезиологов Казахстана. /Часть ІІІ. –
Кустанай, 1986. – с. 56-60.