Современные определения
и общие механизмы развития
полиорганной дисфункции-недостаточности
Синдром полиорганной дисфункции-недостаточности (СПОН), Multiple
Systems Organ Failure (MSOF), Multiple Organ Dysfunction Syndrome
(MODS) в настоящее время определяется, как универсальное поражение
всех органов и систем организма в результате тяжёлой
неспецифической стресс-реакции на множественные этиологические
факторы, когда нарушения физиологических функций отдельных органов
и систем не могут спонтанно восстанавливаться путём ауторегуляции
для поддержания постоянства внутренней среды в целом и сохранения
собственной структуры в частности и требуют частичной или полной
коррекции или протезирования утраченных функций [1].
Для СПОН характерна однотипность патологических изменений
независимо от характера патологического процесса и особенностей
этиологического фактора, приводящих к развитию критического
состояния.
Причины развития СПОН разнообразны и сложны, до настоящего
времени не сформулированы единые механизмы его развития, нет единых
методов его профилактики и лечения.
По данным Ferreira F.L. et al, 2002 [2,8], летальность,
обусловленная СПОН, остаётся высокой и зависит от количества
систем, вовлечённых в патологический процесс. Так, при
недостаточности двух систем летальность составляет 30 -40%, а
трёх-четырёх – 90-97%. У больных, находящихся в критических
состояниях, наиболее часто определяется дыхательная недостаточность
(65-80%), недостаточность кровообращения (60%), почек (60%),
печени (50%).
У больных, находящихся в отделениях интенсивной терапии (ОИТ)
СПОН развивается у 15-20% пациентов. Непосредственными факторами,
которые определяют выраженность полиорганной дисфункции, являются:
различные способности органов противостоять гипоксии и снижению
кровообращения; характер шокового агента; исходное состояние самого
органа.
В механизмах поражения органов и систем важное значение имеют
следующие факторы [3]:
- Глубокая продолжительная гипоксия, возникающая в период шока и
прогрессирующая после рециркуляции и реоксигенации.
- Длительное выраженное нарушение перфузии тканей несмотря на
стабилизацию центральной гемодинамики.
- Раннее развитие и длительность нарушений гемокоагуляции.
- Степень нарушений тканевого клеточного метаболизма.
- Генерализованная инфекция.
По этиологии СПОН разделяют на два основных вида:
- СПОН, возникающий в связи с нарастанием тяжести основной
патологии.
- Ятрогенный СПОН, возникающий в связи с профилактическими,
диагностическими, лечебными медицинскими действиями.
По клиническому течению различают два варианта СПОН:
- Быстрое развитие, когда клинические признаки возникают в первые
24 – 48 часов от начала действия этиологического фактора.
- Каскадное течение с постепенным и последовательным развитием
нарушений различных органов. В большинстве случаев
последовательность вовлечения систем в СПОН выглядит таким образом:
острое повреждение лёгких’энцефалопатия’синдром почечной
дисфункции’синдром печёночной дисфункции’стресс-язвы
желудочно-кишечного тракта.
В развитии СПОН выделяют три основных фазы:
- Индукционная фаза, результатом которой является синтез целого
ряда гуморальных факторов, запускающих реакцию системного
воспалительного ответа (ССВО).
- Каскадная фаза, сопровождающаяся развитием острого повреждения
лёгких, активацией каскадов калликреин-кининовой системы, цикла
арахидоновой кислоты, систем коагуляции и фибринолиза.
- Фаза вторичной аутоагрессии, предельно выраженной органной
дисфункции и метаболического стресса, когда органы больного
утрачивают способность к самостоятельной регуляции гомеостаза.
Сепсис является наиболее частой причиной развития СПОН,
как определяющего фактора критических состояний. СПОН следует
рассматривать, как наиболее тяжёлую степень ССВО, имеющего два
основных пути его развития. Первичный СПОН является прямым
результатом воздействия определённого повреждающего фактора любой
этиологии. Вторичный СПОН развивается после латентной фазы и
является результатом генерализованного системного ответа организма
на повреждающий фактор, чаще инфекционного генеза – септический
вариант СПОН.
Последовательность органных нарушений при сепсисе зависит от
ряда факторов [1-4].
- Характер и локализация септических очагов и микробиологические
факторы. Наиболее частым очагом инфекции являются лёгкие, затем
следует брюшная полость и мочевыводящие пути. У 20-30% больных не
удаётся установить локализацию первичного очага.
- Антимикробная терапия может вызвать парадоксальную индукцию
септического шока (реакция Яриша-Герцгеймера). К сожалению,
большинство антибактериальных препаратов обладают
органотоксичностью и способны углубить СПОН.
- Неконтролируемая транслокация условно-патогенных микробов
вследствие нарушения барьерной функции кишечника поддерживает
септический процесс даже при достаточно эффективной санации других
очагов инфекции.
- Развитие альтернативных очагов инфекции, например,
нозокомиальной пневмонии.
- Транслокация условно-патогенной флоры с поверхности слизистых
оболочек и даже с кожи.
- Вторичные повреждения отдельных органов вследствие феномена
ишемии-реперфузии.
- Исходное состояние отдельных органов.
- Тяжесть нарушения функции отдельных органов и систем: чем ниже
парциальное давление кислорода в артериальной крови при ОРДС или
чем выше уровень креатинина при почечной недостаточности, тем
вероятнее вовлечение других органов и систем в СПОН.
- Выраженность гипоперфузии органов и тканей, нарушений
микроциркуляции, гипоксии, аномально высокие концентрации
промежуточных и конечных продуктов метаболизма, биогенных аминов,
продуктов перекисного окисления липидов, которые усиливают
«медиаторную бурю».
Биохимические основы
полиорганной недостаточности
Органная недостаточность является следствием уникальной
комбинации клеточных, метаболических, сосудистых и воспалительных
нарушений у больных, находящихся в критических состояниях.
Активация воспаления
Инициальный ответ организма на причинный фактор индуцирует
провоспалительное состояние с продукцией воспалительных медиаторов:
фактора некроза опухолей (tumor necrosis factor – alpha – TNF-α),
интерлейкинов IL-1, IL-6, лейкотриенов, простагландинов,
интегринов, селектинов, оксида азота и других биологически активных
веществ[4]. Для защиты от деструктивного действия избыточных
концентраций провоспалительных медиаторов организм выделяет
противовоспалительные медиаторы, в частности IL-4, IL-10. Нарушение
баланса между про- и антивоспалительными медиаторами приводит к
клеточному повреждению, нарушениям тканевого метаболизма и органной
дисфункции.
Метаболический ответ на воспаление
Провоспалительные медиаторы повышают метаболические потребности
висцеральных клеток. Смесь цитокинов TNF-α, IL-1, IFN-γ резко
увеличивают потребность клеток в кислороде с повышением анаэробного
гликолиза. В результате митохондриальной дисфункции при сниженной
доставке кислорода возрастает потребление глюкозы, продукция
лактата. Ткани, которые чаще потребляют глюкозу, превращают её
быстрее в лактат, чем в конечные продукты. В результате лактат
транспортируется в печень, где превращается снова в глюкозу (цикл
Кори). Часть тканей организма потребляет жирные кислоты и кетоновые
тела как энергетический субстрат, недостаточная адаптация тканей к
липидам и кетоновым телам повышает протеолиз. Фактор, индуцирующий
протеолиз (proteolysis inducing factor – PIF) во взаимодействии с
цитокинами TNF-α, IL-1 в присутствии эссенциальных кофакторов –
кортикостероидов, оксида азота, свободных кислых радикалов,
ингибирующих анаболические факторы – инсулин, инсулиноподобный
фактор роста – IGF-1, провоцируют цитокин-индуцированный протеолиз
с повреждением мышечных белков и нарушением синтеза протеинов.
Биосинтез глюкозы из углеводных прекурсоров – аминокислот,
пирувата, лактата и глицерола, является универсальным механизмом у
животных, грибов и микробов.
Повреждение митохондрий с деполяризацией их мембран и нарушением
редокси-статуса в митохондриальном аппарате играют центральную роль
в продукции фактора, инициирующего апоптоз (apoptosis initiating
factor – AIF).
В условиях свободно-радикального и оксидативного стресса,
антигенной нагрузки и гипоксии усиление апоптоза лежит в основе
нарушений в иммунной системе.
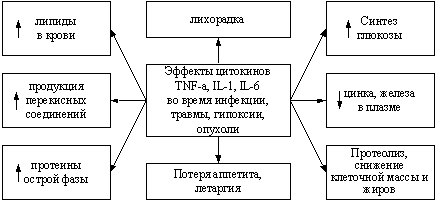
Рис. 1. Метаболический ответ на инфекцию, травму, опухоли,
хирургические вмешательства (Grimble R. F., 2004).
В результате развивается гиперметаболическое состояние,
ускоренная потеря белка скелетных мышц, возрастает толерантность к
глюкозе, повышается продукция белков острой фазы с появлением
лихорадки, лейкоцитоза, что определяется, как острофазовый ответ на
повреждение – интегральный ответ организма на критическое
состояние. Общие механизмы метаболического ответа на инфекцию,
травму, опухоли и хирургические вмешательства представлены Grimble
R.F., 2004[5].
Коагулопатия – ведущий путь к органной
дисфункции-недостаточности.
Провоспалительные цитокины IL-1a, IL-1b, TNF-α индуцируют
выделение из эндотелиальных клеток и моноцитов тканевого фактора
(TF), являющегося ключевым медиатором между иммунной и свёртывающей
системами и принципиальным активатором внешнего пути коагуляции. TF
взаимодействует с фактором VIIa, формируя VIIa-TF-комплекс,
активирующий факторы IX и X. Усиление коагуляции через
тромбин-опосредованные процессы сочетается с активацией факторов V,
VIII, XI в заключительной стадии и сопровождается образованием
значительного количества тромбина. Фибриновые нити формируют
сгусток с активацией тромбоцитов в местах эндотелиального
повреждения с последующим образованием стабильного тромба.
В большинстве экстремальных случаев разбаланс между воспалением,
коагуляцией и фибринолизом результируется в распространённую
коагулопатию и микрососу-дистый тромбоз [6].
Коагулопатия, известная как ДВС-синдром, является предвестником
полиорганной недостаточности и часто предвещает неблагоприятный
исход. Снижение эндогенного протеина С – интегрального модулятора
воспаления, коагуляции и фибринолиза указывает на развитие
неконтролируемых изменений в этих каскадах с переходом от
системного воспалительного ответа к тканевой гипоперфузии, органной
дисфункции и недостаточности.
Схема патогенеза полиорганной недостаточности представлена на
рисунке 2.
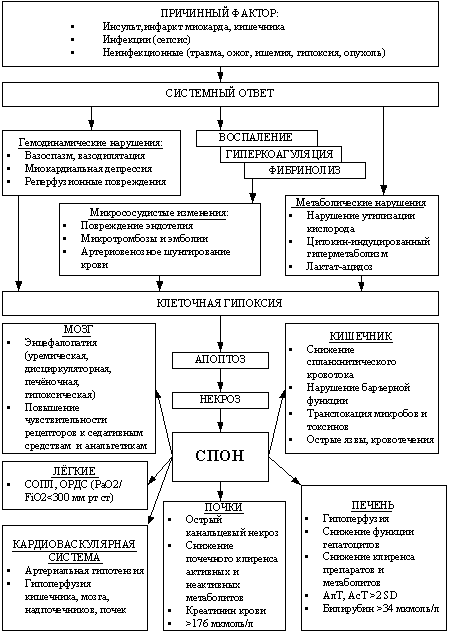
Рис. 2. Схема патогенеза полиорганной дисфункции-недостаточности
(Lerch C. et al., 1999 с дополнениями).
Клинические маркеры органной дисфункции и диагностические
системы.
Для оценки полиорганных нарушений в настоящее время используются
клинические и биохимические критерии, составляющие основу балльных
систем (Multiple Organ Dysfunction Syndrome – MODS, Sequential
Organ Failure Assessment – SOFA, Logistic Organ Dysfunction System
– LODS, Brussels Score – BS).
Признаки острой органной дисфункции для различных популяций
больных представлены в собирательной модифицированной модели Balk
R.A., Levi M. еt al., Marshall J.C. et al., Baue A.E., Smith O.P.
et al., 2002. [1]:
Респираторная дисфункция определяется, как нарушение
состояния оксигенации со снижением индекса PaO2/FiO2,
необходимостью в дополнительной инсуффляции кислорода, повышении
ПДКВ или искусственной вентиляции лёгких. Градации этих параметров
отражают степень дисфункции с недостаточностью лёгких, если
требуется FiO2 > 0,40 или ПДКВ > 5 см вод ст или ИВЛ.
Почечная дисфункция выражается клинически значимым
нарушением диуреза (d 400 мл/сут) или повышением концентрации
креатинина выше 176 мкмоль/л, когда необходимы гемодиализ или
другие виды терапии с восполнением дефицита жидкости, коррекцией
КЩС, электролитного гомеостаза.
Сердечно-сосудистая дисфункция может проявляться
артериальной гипотензией, аритмиями, необходимостью применения
инотропных и вазопрессорных средств.
Печёночная дисфункция может начинаться появлением
желтухи, гипербилирубинемии > 34,2 мкмоль/л, повышением уровня
печёночных энзимов в 2 и более раз, затем гипоальбуминемией и
удлинением протромбинового времени.
Гематологическая дисфункция может характеризоваться
тромбоцитопенией, лейкоцитозом или лейкопенией и маркерами
коагулопатии, включая протромбиновое время, активированное
частичное тромбиновое время, Д-димеры и другие признаки ДВС,
снижением гематокрита < 0,2 л/л.
Гастроинтестинальная дисфункция определяется признаками
динамической кишечной непроходимости, наличием эрозий и острых язв
слизистой оболочки пищевода, желудка, кишечника, бескаменного
холецистита, панкреатита, перфорации кишечника или
некротизирующего энтероколита.
Неврологическая дисфункция характеризуется нарушением
ментального статуса, который оценивается по шкале ком Глазго, а
также наличием признаков перифери-ческой полинейропатии.
Эндокринная дисфункция проявляется гипергликемией,
гипертриглицеридемией, гипоальбуминемией, снижением массы тела,
гиперкатаболизмом, адреналовой дисфункцией.
Иммунологическая дисфункция может сопровождаться
развитием нозокомиальных инфекций, лейкоцитозом, лихорадкой.
Для динамической оценки СПОН целесообразно использовать шкалу
MODS или SOFA [1] (приложение 1).