Сепсис продолжает оставаться одной из актуальных проблем
современной медицины. Это обусловлено неуклонной тенденцией к росту
числа случаев сепсиса и его осложнений, стабильно высокой
летальностью, несмотря на определённый прогресс в диагностике,
использование антибиотиков широкого спектра действия, применение
новых методов медикаментозного и хирургического лечения [3].
Ежегодно в США наблюдается более 750 тыс., а в развитых странах
более 1,5 млн случаев тяжёлого сепсиса, ассоциированного с острой
органной дисфункцией, тканевой гипоперфузией или шоком [3, 8].
Летальность при тяжёлом сепсисе остаётся высокой и составляет от 28
до 60% [8, 14].
К настоящему времени сформулировалась новая, радикально меняющая
взгляд на патогенез сепсиса, парадигма, которая рассматривает
нарушения гомеостаза, как неконтролируемый каскад изменений в
системах коагуляции, воспаления и фибринолиза, происходящие
одновременно, как цикл автоматического наложения
взаимообусловленных процессов с последующими нарушениями
микроциркуляции и тканевой оксигенации, развитием метаболических
расстройств, вследствие митохондриальной дисфункции. Это состояние
определяется в последние годы, как
микроциркуляторно-мито-хондриальный дистресс-синдром [10].
Вследствие уникальной комбинации клеточных, метаболических,
сосудистых и воспалительных нарушений в ответ на инфекцию
развивается органная дисфункция и полиорганная недостаточность
(ПОН) [12].
Провоспалительные медиаторы повышают метаболические потребности
висцеральных клеток. Смесь цитокинов во взаимодействии с фактором,
индуцирующим протеолиз в присутствии эссенциальных кофакторов –
кортикостероидов, оксида азота, свободных кислых радикалов
ингибируют анаболические факторы – инсулин, инсулиноподобный
фактор роста и провоцируют цитокин-индуцированный протеолиз. В
результате развивается гиперметаболическое состояние, ускоренная
потеря мышечных белков, возрастает толерантность к глюкозе,
повышается продукция белков острой фазы, что определяется, как
острофазовая реакция на повреждение - интегральный ответ организма
на критическое состояние [7, 9].
Снижение продукции эндогенного протеина С - интегрального
модулятора воспаления, коагуляции и фибринолиза указывает на
развитие неконтролируемых изменений в этих каскадах с переходом от
системного воспалительного ответа к тканевой гипоперфузии, органной
дисфункции и недостаточности, несмотря на восстановление
показателей системной гемодинамики [3, 7, 8].
Ключевые рекомендации, по лечению тяжёлого сепсиса и
септического шока, за выживаемость при сепсисе [8] предлагают для
модуляции метаболического ответа достижение сатурации смешанной
венозной крови выше 70% с применением ранней направленной
гемодинамической терапии, включающей поддержание уровня гематокрита
выше 0,3 л/л, назначение добутамина, а также тщательный контроль
уровня глюкозы в крови. Для модуляции острофазового воспалительного
ответа рекомендовано использование рекомбинантного человеческого
активированного протеина С.
Принимая во внимание важность воздействия на метаболический
ответ и острофазовую реакцию при сепсисе, нами предпринята попытка
модуляции этих процессов с применением препарата
полифункционального действия на основе янтарной кислоты –
реамберина.
Более чем тридцатилетний опыт лабораторного и клинического
исследования действия янтарной кислоты [1, 4, 5] указывает на
наличие у препарата широкого спектра физиологических эффектов.
В контексте данного исследования представляет интерес прямое
влияние янтарной кислоты на клеточный метаболизм и транспорт
свободного кислорода в ткани, нормализация аэробной фазы тканевого
дыхания, восстановление функции печени и синтеза ею белков.
В основу рабочей гипотезы положено предложение, что экзогенное
пополнение пула интермедиатов цикла трикарбоновых кислот, в
частности, янтарной кислоты, согласно эффекту Сент-Дьердьи [2]
оказывает каталитическое действие на метаболизм субстратов в
цикле Кребса, приводя к нормализации аэробной фазы тканевого
дыхания, что способствует устранению митохондриальной дисфункции в
тканях, особенно в печени, с восстановлением синтеза положительных
белков острой фазы (альбумина, трансферина, протеинов С и S, и
других).
Цель исследования – установить особенности влияния
препарата на основе янтарной кислоты – реамберина на метаболизм и
продукцию белков острой фазы у больных с тяжёлым сепсисом и
септическим шоком.
Материалы и методы исследования. Работа выполнена в
клинике анестезиологии и интенсивной терапии Днепропетровской
государственной медицинской академии на базе специализированного
отделения интенсивной терапии сепсиса (ОИТС) Днепропетровской
областной клинической больницы им. И.И. Мечникова,
рандомизированное сравнительное исследование проведено у 55
больных с тяжёлым сепсисом и септическим шоком.
Критериями для включения пациентов в исследование являлись:
- Наличие 2-х (или более) признаков синдрома системного
воспалительного ответа (ССВО);
- Верифицированный специальными методами исследования первичный
очаг инфекции и/или вторичные метастатические очаги, доступные для
хирургической их санации или консервативного излечения;
- Тяжесть состояния пациентов по шкале APACHE II от 10 до 20
баллов;
- Наличие дисфункции или недостаточности двух или более органов и
систем (более 2 баллов по шкале SOFA);
- Согласие на участие в исследовании пациента или его законного
представителя.
Продолжительность периода от манифестации патологического
процесса до начала исследования составила в среднем 2,26 дня,
предшествующая антибактериальная терапия проводилась у 26 больных
(49,1%). До поступления больных в ОИТС микробиологический диагноз
установлен лишь у 9 пациентов (16,4%).
В соответствии с протоколом учтены все инвазивные манипуляции и
процедуры, сопутствующие заболевания, выраженность болевого
синдрома, психоэмоциональный статус больных по шкале Riker.
После отбора в исследование, пациенты распределены на две группы
в зависимости от способа лечения на основе процедуры рандомизации.
Пациенты, включенные в 1-ю группу, получали базисную терапию на
основе рекомендаций Surviving Sepsis Campaign [8]:
A) инфузионная терапия, начатая немедленно после распознавания
заболевания с достижением конечных пунктов;
B) верификация инфекции, с проведением необходимых
диагностических исследований и забора проб материала для
бактериологического исследования;
C) стартовая эмпирическая антибактериальная терапия препаратами
с высокой активностью против вероятных патогенов и прониканием в
ткани предполагаемого очага инфекции;
D) контроль состояния септических очагов, их хирургическое
лечение с применением инвазивных и малоинвазивных
вмешательств;
E) инфузионная терапия с использованием натуральных или
искусственных коллоидных растворов и растворов кристаллоидов;
F) применение вазопрессоров у больных с септическим шоком;
G) инотропная терапия с предпочтительным назначением
добутамина;
Н) гидрокортизон в дозе 200-300 мг/сут. в течении 7 дней у
больных с септическим шоком;
J) назначение препаратов крови: эритроцитарной массы для
поддержания гематокрита выше 0,3 л/л; свежезамороженной плазмы для
коррекции нарушений свёртывающей системы при наличии кровотечений
или инвазивных процедур;
К) респираторная терапия при синдроме острого повреждения лёгких
с соблюдением протокола по отлучению больных от респиратора;
L) седация и анальгезия по протоколу;
М) контроль уровня глюкозы крови;
N) профилактика тромбозов глубоких вен.
Пациенты 2-й группы в дополнение к базисной терапии получали
реамберин в дозе 12-14 мл/кг/сутки на протяжении 5 дней, начиная с
этапа первоначальной инфузионной терапии, сокращая расчётную дозу
вводимых кристаллоидных растворов пропорционально количеству
назначенного реамберина.
Обследование больных согласно клиническому протоколу включало
регистрацию признаков ССВО по критериям согласительной
конференции по сепсису [3], интегральную оценку тяжести состояния
больных по шкале APACHE II на основе 12 биохимических показателей,
наличие признаков органной дисфункции-недостаточности – по шкале
SOFA.
Потребление кислорода определяли методом непрямой калориметрии
на газовом хроматографе Поиск-2 (Украина). Газовый состав
артериальной и смешанной венозной крови изучали с помощью
автоматического анализатора рН и газов крови Bayer M-238 (Англия).
Содержание кислорода в артериальной и смешанной венозной крови
(СаО2, CvO2), артерио-венозную разницу по
кислороду (a-vDO2), доставку кислорода (DO2) и
актуальный расход энергии (АРЭ) рассчитывали по общепринятым
формулам. Минутный объём кровообращения определяли по уравнению
Фика из потребления кислорода (VO2) и a-vDO2.
Степень метаболического стресса отражал катаболический индекс
(КИ):
КИ=N-(NД+3)
где N, г - суточная экскреция азота, которую рассчитывали по
оригинальной формуле [3]: N = мочевина мочи (моль/л) * суточный
диурез (л) * 0,035.
Для оценки тканевой перфузии использовали регионарные маркеры:
проксимально-дистальный температурный градиент (dT, °C) с помощью
температурного датчика монитора Ютас-300 (Украина), проба
наполнения капилляров (сек), гастрально-альвеолярный градиент
СО2 (мм. рт. ст.) методом воздушной гастральной
тонометрии газоанализатором Сигма-Л (Украина), определяли минутный
диурез, концентрацию креатинина в сыворотке крови и клиренс
креатинина.
Концентрации глюкозы, лактата, пирувата, мочевины, мочевой
кислоты, билирубина, трансаминаз, лактат-дегидрогеназы,
α-гидрок-сибутиратдегидрогеназы определяли в сыворотке крови с
помощью полуавтоматического биохимического анализатора RA: 50 Bayer
Diagnostics (США) с наборами реактивов Human (Германия).
Протромбиновый индекс, концентрацию фибриногена, активированное
частичное тромбопластиновое время (АЧТВ) и нормализованное
отношение (НО) для оценки активности системы протеина С определяли
коагулометром Amelung KC-4A (Германия) с реактивами АПО «Рекам»
(Россия).
Концентрацию С-реактивного белка (СРВ) определяли методом
агглютинации латексных частиц с реактивами Humatex CRP фирмы Ниmen
(Германия).
Исследование проводили при поступлении больных в ОИТС, на 1, 2,
3, 5-е сутки, клиническое наблюдение продолжали до 28-го и 36-го
дней заболевания.
В статистический анализ включались все пациенты, первоначально
отобранные для исследования (intention-to-treat analysis),
клиническое выздоровление или улучшение состояния больных после
выполнения протокола (рег-protocol analysis), результаты лечения на
28-й день болезни и восстановление качества жизни до 36-го дня
являлись конечными пунктами для оценки эффективности лечения.
Статистическую обработку полученных данных проводили с
использованием программы Excel 2000 для Windows. Достоверность
различий определяли с помощью t-критерия Стьюдента.
Результаты и их обсуждение. Основные демографические и
клинические характеристики пациентов обеих групп после рандомизации
и первичной оценки тяжести их состояния представлены в табл. 1 Отсутствие достоверных различий по всем представленным показателям
свидетельствует об адекватности рандомизации. При первичном
обследовании всех больных не выявлено также достоверных различий со
стороны глобальных и регионарных маркеров тканевой перфузии и
оксигенации (табл. 2). В условиях относительно нормодинамического
типа кровообращения, умеренной артериальной гипоксемии и сниженной
сатурации смешанной венозной крови, эффективной доставки кислорода
наблюдалось повышение утилизации кислорода и его потребления,
актуальный расход энергии соответствовал гиперметаболическому типу
обмена веществ. Регионарные критерии указывали на выраженные
нарушения тканевой перфузии с увеличением температурного градиента,
пробы наполнения капилляров, снижением минутного диуреза, клиренса
креатинина. Наиболее значимыми представлялись увеличение
гастрально-альвеолярного градиента СО2 и существенное
увеличение концентрации лактата в крови. Об активности ССВО
свидетельствовали высокие исходные концентрации СРВ, снижение
активности системы протеина С в сочетании с повышенными значениями
маркеров почечной дисфункции в структуре синдрома полиорганной
дисфункции (табл. 3).
На фоне проводимой терапии показатели общей и регионарной
перфузии и оксигенации в группах сравнения имели тенденцию к
стабилизации показателя SvO2, снижению общего
потребления кислорода и актуального расхода энергии до
нормометаболического состояния на 5-е сутки, восстановлению
адекватного диуреза и клиренса креатинина, снижению
гастрально-альвеолярного градиента СО2.
Существенные различия выявлены в динамике концентраций лактата и
пирувата в сыворотке крови: достоверное снижение лактата и
увеличение концентрации пирувата на сутки раньше наблюдалось в
группе больных, получавших реамберин. Но основные отличия
наблюдались между показателями, характеризующими особенности
метаболического ответа (табл. 4) и острофазовой реакции печени
(табл. 3).
Дозы инсулина у больных с сахарным диабетом для поддержания
уровня гликемии менее 11 ммоль/л, и у больных без диабета для
поддержания концентрации глюкозы в пределах от 4,6 до 8 ммоль/л
были значительно ниже у больных 2-й группы на всех этапах
исследования (р<0,01).
Степень метаболического стресса значительно выраженнее у больных
в 1-й группе, тогда как под влиянием терапии реамберином
метаболический стресс определялся, как умеренный (КИ<5 ед) уже
на 2-е сутки лечения.
Характеризуя цитоплазматическую редокси-пару, лактат-пируватный
индекс более быстро нормализовался у больных во 2-й группе, и уже
на 3-й сутки был меньше 10,0 ед. Повышенная концентрация лактата
сохранялась значительно дольше в 1-й группе, в целом избыток
лактата у больных с сепсисом объясняется замедлением его
печёночного клиренса [3].
Улучшение функционального состояния печени уже на 2-е сутки по
основным печёночным маркерам (табл. 3) достоверно отличалось в
исследуемой группе, поэтому и клиренс молочной кислоты у больных
во 2-й группе был выше, о чём свидетельствует более быстрая
нормализация концентрации лактата.
Значительный интерес представляет динамика
α-гидроксибутиратдегидрогеназы (α-HBDH) – фермента,
характеризующего состояние митохондриальной редокси-пары –
ацето-ацетата и гидроксибутирата [11, 12].
О нарушении митохондриального статуса, как установлено раньше
[12,14], свидетельствует увеличение соотношения ацетеацетата к
гидроксибутирату более 0,4, что наблюдается при повышении
концентрации последнего выше 0,07 мкмоль/л и активности α-HBDH выше
70 ЕД/л [11].
Увеличение активности α-HBDH в 1-е сутки наблюдалось у всех
больных, указывая на наличие митохондриальной дисфункции, а в
сочетании с микроциркуляторными нарушениями –
микроциркуляторно-митохондриального дистресс-синдрома (ММДС) [14],
под влиянием реамберина восстановление митохондриальной функции
наблюдалась более отчётливо и быстро (табл. 4).
Одновременно с устранением митохондриальной дисфункции у больных
в группе реамберина наблюдалось существенное увеличение
концентрации мочевой кислоты в сыворотке крови – конечного
продукта деградации адениловых нуклеотидов ATP+ADP+AMP [6], что
свидетельствует об увеличении общего пула макроэргических
соединений в результате их интенсивного синтеза в процессе
аэробного дыхания.
Другими словами, ускорение синтеза аденилнуклеотидов и их
участие в метаболизме с последующей деградацией до мочевой кислоты
возможно при ограничении доли анаэробного метаболизма [6, 12].
Ещё в 1935 г. Сент-Дьердьи показал [2], что дикарбоновые кислоты
оказывают каталитическое действие на процесс дыхания, так как
каждая из этих кислот, например, янтарная, сильно стимулирует
окисление многих молекул эндогенного субстрата. Выявленные
особенности метаболического ответа при сепсисе под влиянием
янтарной кислоты наблюдались одновременно с изменениями
острофазовой реакции печени (табл. 3) – возрастанием активности
системы протеина С и снижением синтеза белков острой фазы с
отрицательным знаком (СРБ, фибриногена).
Важно, что эти процессы протекали одновременно: модуляция
острофазового и метаболического ответа при сепсисе положительно
влияют друг на друга, устраняя ММДС, способствуя восстановлению
аэробного метаболизма, что имеет большое значение для
предупреждения полиорганной недостаточнрсти [10,14]. Так,
существенные различия выявлены между группами сравнения в частотах
развития органных нарушений после завершения лечения по протоколу
(рис. 1).
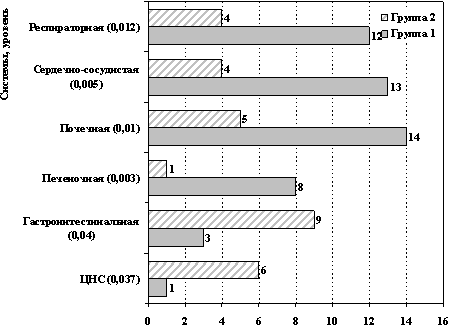
Рис. 1. Частота развития органных нарушений в группах
сравнения
Неожиданными оказались различия у больных с исходно неудачным
лечением через 48 часов интенсивной терапии (табл. 5). Количество
пациентов, требующих повторного хирургического вмешательства или
коррекции антибактериальной терапии в обеих группах было
практически одинаковым (51,9% и 53,6% соответственно), но у больных
1-й группы гипердинамический тип кровообращения, выраженный
гиперметаболизм и тяжёлый метаболический стресс сопровождались
высокой концентрацией лактата крови, активацией воспаления с
повышением СРБ, угнетением системы протеина С, что сопровождалось
достоверными различиями в тяжести пациентов по объективным шкалам
(табл. 5).
Оценка результатов лечения по конечным пунктам также выявила
достоверные различия, связанные с проведенным видом терапии (рис.
2). Длительность лечения в ОИТС и летальность после завершения
лечения по протоколу отличались, но не были достоверными, тогда как
выявленные различия в частоте персистирующих органных нарушений до
28-го дня болезни были определяющими для выживаемости пациентов до
28-го дня, восстановления качества жизни до 35-го дня заболевания
(рис. 2).
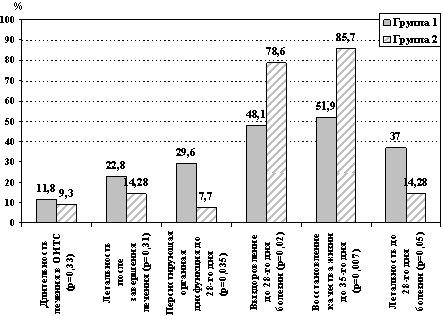
Рис. 2. Оценка результатов лечения с применением
реамберина
по конечным точкам
Выводы
- Применение препарата на основе янтарной кислоты – реамберина у
больных с тяжёлым сепсисом и септическим шоком оказывает
модулирующее влияние на метаболизм, что сопровождается катализацией
аэробного дыхания с пополнением общего пула макроэргических
соединений, восстановлением цитоплазматического и
митохондриального редокси-статуса, устранением митохондриальной
дисфункции и ограничением гиперметаболического ответа на
воспаление.
- Модуляция острофазового ответа на воспаление под влиянием
реамберина проявляется восстановлением функции печени, стимуляцией
синтеза протеинов острой фазы положительного действия - белков
системы протеина С, и ограничением продукции острофазовых белков с
отрицательным знаком - С-реактивного белка, фибриногена.
- Модуляция метаболического ответа и острофазовой реакции печени
на воспаление снижает риск развития органной дисфункции –
недостаточности, способствует повышению выживаемости и качества
жизни у больных с сепсисом и септическим шоком.
Список литературы
- Исаков В А., Сологуб Т.В., Коваленко AJI., Романцов М.Г.
Реамберин в терапии критических состояний: руководство для врачей,
издание третье, дополненное. СПб.- 2001.- 172 с.
- Ленинджер А. Биохимия. Молекулярные основы структуры и функции
клетки / Пер. с англ. Под ред. акад. А.А. Баева и д-ра хим. Наук
Я.М. Варшавского. М.: Мир.- 1976.- 957 с.
- Мальцева Л А. Сепсис: этиология, эпидемиология, патогенез,
диагностика, интенсивная терапия / Л.А. Мальцева, Л.В. Усенко,
Н.Ф. Мосенцев.- М.: Медпресс-информ, 2005.- 176 с.
- Оболенский СЈ. Реамберин – новое средство Для инфузионной
терапии в практике медицины критических состояний. Методические
рекомендации. СПб.- 2002.- 19 с.
- Усенко Л.В., Мосенцев Н.Ф., КоломоецА.В., Мосенцев НЛ. Реамберин
в комплексе интенсивной терапии полиорганной
дисфункции-недостаточности. ^Методические рекомендации.
Днепропетровск.-2004.-36с.
- Angelos M.G., Muzzay H.N., Waite M.D., inline R.T. Postischemic
inotropic support of the dys-mctional heart // Critical Care Med.-
2002.- Vol.30. P. 410-416.
- Castelli GJP., Pognani C, Meisner M., Stuani A., feUomi D.,
Sgarbi L. Procalcitonin and C-reactive producing systemic
inflammatory response syndrome, *peis and organ dysfunction //
Critical Care.- 2004.-[01.8.- R. 234 - R. 243.
- Dellinger R.P., Vincent J-L. The Surviving Sepsis
j&P&ign sepsis change bundles and clinical practice //
Critical Care.- 2005.- Vol. 9.- No. 11.- P. 653 - 654.
- Grimble R.F. Immunity: nutrients or genes as modulators? //
Nestle 3th Clinical Nutrition Course 20th to 26th gune, 2004.-
Glion-Swizzerland.- S. 15.
- Incle С. The microcirculation is the motor of sepsis // Critical
Care.- 2005.- Vol.- 9.- S. 13 - 19.
- Levy В., Sadoune L-O., Gelot A-M., Bollaert P.E., Nabet P.,
Larcan A. Evolution of lactate / pyruvate and arterial ketone body
ratious in the early course of catecholamine - treated septic shock
// Crit Care Med.-2000.- Vol. 28.- No. 1.- P. 114 - 119.
- Mizock В A. Redox pairs, tissue hypoxia, organ dysfunction,
and mortality // Crit Care Mad.- 2002.-vol. 28.- No. 1.- P. 270 -
271.
- Valenza F., Aletti G., Fossali Т., Chevallard G. Lactate as a
marker of energy failure in critically ill patients: hypothesis //
Critical Care.- 2005.- Vol. 9.-No. 9.-P. 588-593.
- Vincent J-L., De Backer D. Microvascular dysfunction as a cause
of organ dysfunction in severe sepsis // Critical Care.- 2005.-
vol. 9.- suppl. 4.- S. 9 - 11.