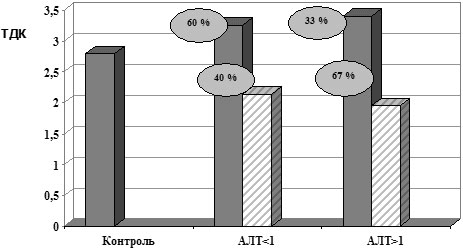
Рис. 1. ТДК белковых соединений у больных ХВГ С
в зависимости от наличия цитолитического синдрома
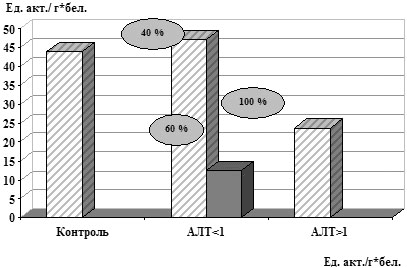
Рис. 2. Показатели СОД у больных ХВГ С
в зависимости от наличия цитолитического синдрома
Источник: Методические рекомендации. СПб. 2003
Комитет по здравоохранению администрации санкт-петербурга
ГОУВПО Санкт-Петербургская государственная медицинская академия им.И.И.Мечникова
(методические рекомендации)
Рецензенты:
Начальник кафедры гастроэнтерологии Военно-медицинской академии, д.м.н., профессор В.Б. Гриневич.
Зав. кафедрой внутренних болезней Санкт-Петербургского института усовершенствования врачей-экспертов, д.м.н., профессор Г.Д. Шостка
В методических рекомендациях изложены основные механизмы лечебного действия нового препарата на основе янтарной кислоты – реамберина, обладающего антиоксидантными свойствами, при хронических заболеваниях печени. Дано клинико-теоретическое обоснование использования этого препарата в гепатологии.
Методические рекомендации предназначены для практикующих врачей терапевтов, гастроэнтерологов, гепатологов.
Методические рекомендации подготовлены на основе отчетных данных на кафедре внутренних болезней №2 Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова д.м.н. профессором В.Г. Радченко, В.В. Стельмах.
АЗКЦ – антителозависимая клеточная цитотоксичность
АлАТ – аланинаминотрансфераза
АОС – антиоксидантная система
АсАТ – аспартатаминотрансфераза
АТФ – аденозинтрифосфат
ГГТП – гаммаглютамилтранспептидаза
ГМФШ – гексозомонофосфатный шунт
КАТ – каталаза
НАДФН – никотинамидадениндинуклеотидфосфат
НСТ-тест – тест функциональной активности моноцитов
ПТИ – протромбиновый индекс
СОД – супероксиддисмутаза
СМФ – система мононуклеарных фагоцитов
ТДК – тиол-дисульфидный коэффициент
ХВГ В – хронический вирусный гепатит В
ХВГ С – хронический вирусный гепатит С
ЩФ – щелочная фосфатаза
ЯК – янтарная кислота
CD – кластеры дифференцировки
CD3 – маркер абсолютного большинства зрелых Т-лимфоцитов
CD4 – маркер Т-хелперов
CD8 – маркер цитотоксических Т-лимфоцитов
CD72 – В-лимфоцит
CD4/CD8 – иммунорегуляторный индекс
HBV-DNA – дезоксирибонуклеиновая кислота вируса гепатита В
HCV-RNA – рибонуклеиновая кислота вируса гепатита С
HCVAb – антитела к вирусу гепатита С
HbeAg – антиген вирулентности вируса гепатита В
HbeAb – антитела к HBeAg
HbsAg – поверхностный антиген вируса гепатита В
HbsAb – антитела к HbsAg
HbcorAb– антитела к ядерному антигену
IFN-α/β – интерферон I типа
IFN-γ – интерферон II типа
NK – естественный киллер
s-IFN – сывороточный интерферон
TNF-α – туморнекротизирующий фактор α
Заболевания печени остаются серьезной социально-экономической и клинико-эпидемиологической проблемой здравоохранения всех стран мира. Хронические вирусные гепатиты (ХВГ) и циррозы печени занимают значительное место в структуре заболеваний органов пищеварения. По данным ВОЗ в мире насчитывается более 2 млрд. людей, имеющих признаки текущей или завершившейся инфекции вирусом гепатита В, более 170 млн. больных хроническим гепатитом С. В Европе наиболее высокая заболеваемость хроническими гепатитами встречается в Молдове, Венгрии, Италии, Германии и Франции, где уровни смертности от данных заболеваний колеблются от 32,7 (Франция) до 127,4 (Молдова) на 100000 населения. По нашим данным, в Ленинграде – Санкт-Петербурге многолетняя динамика регистрируемой заболеваемости имеет тенденцию к росту с 1,0 в 1962 г., до рекордной цифры 29,3 в 1995 г. на 100000 населения. Рост заболеваемости в 1990-е годы обусловлен в основном за счет вирусного гепатита В и вирусного гепатита С [8].
Общепризнанно, что лечение больных хроническими вирусными гепатитами В и С представляет довольно сложную задачу для практического врача, требует от него профессиональных навыков ведения таких больных, дифференцированного подхода в зависимости от клинической формы заболевания, а также от состояния иммунной системы пациента. В терапии ХВГ В и С используют противовирусные препараты, иммуномодуляторы, интерфероны и их индукторы, антиоксиданты в различных сочетаниях. Приходиться констатировать, что даже комплексная терапия больных ХВГ В, С в большинстве случаев, к сожалению, не приводит к желаемым результатам.
В последние годы важная роль в механизмах поражения печени различной этиологии придается синдрому цитолиза, в основе которого, как полагают, лежит интенсификация процессов перекисного окисления липидов биомембран гепатоцитов и нарушения антиокислительной защиты [8].
По результатам многих экспериментальных и клинических исследований, увеличение признаков мезенхимального воспаления в печени, а также выраженность гепатоцеллюлярной недостаточности ассоциируется с активацией процессов перекисного окисления липидов и дисбалансом некоторых неферментных систем антиоксидантной защиты сыворотки крови при хронических вирусных гепатитах. Активность протекания свободно-радикальных реакций и тяжесть эндогенной интоксикации взаимосвязаны, и в значительной степени определяют адаптационно-компенсаторные возможности организма.
При ХВГ наблюдается длительная активация системы мононуклеарных фагоцитов, сопровождающаяся гиперпродукцией активных форм кислорода, что следует рассматривать в качестве факторов риска развития антиоксидантной недостаточности, которая во многом определяет характер и тяжесть течения заболевания. В момент максимальной активации энергетического обмена макрофаги печени генерируют активные формы кислорода, которые обладают мощным антимикробным и цитотоксическим действием и запускают процессы свободнорадикального биологического окисления. В ряде случаев при ХВГ активация макрофагов имеет защитный характер и нуждается в восполнении резервов антиоксидантной защиты.
Срыв антиоксидантной защиты характеризуется развитием свободнорадикальных повреждений разных компонентов клетки и тканей, составляющих синдром пероксидации и включающий следующие изменения: повреждение мембран, инактивацию или трансформацию ферментов, подавление деления клеток, накопление в клетке инертных продуктов полимеризации. Периодически повторяющийся синдром пероксидации составляет фактор патогенеза ряда заболеваний, в том числе и при хронических вирусных гепатитах.
Многоступенчатость процессов регуляции свободнорадикального и перекисного окисления реализуется при помощи системы антирадикальной и антиперекисной защиты, которая включает два основных звена: ферментативное и неферментативное. Важное место в системе ферментативной защиты занимает супероксиддисмутаза (СОД), представляющая собой Cu, Zn или Mn-содержащий металлофермент. СОД катализирует реакцию дисмутации супероксидрадикала с образованием перекиси водорода. Дальнейшее расщепление перекиси водорода осуществляет каталаза (КАТ) – гемсодержащий фермент, активно участвующий в нерадикальном разложении перекиси водорода до воды либо по каталазному, либо по пероксидазному механизму. Наряду с СОД и КАТ активными компонентами антиоксидантной системы (АОС) являются некоторые металлоферменты печени, глутатионпероксидаза и др. [3].
Неферментативное звено антирадикальной и антиперекисной защиты, представлено низкомолекулярными антиоксидантами, среди которых описаны система глутатиона, аскорбатная система, другие водорастворимые и липидорастворимые витамины, растительные фенолы, серосодержащие соединения и др.
Участие низкомолекулярного глутатиона в восстановительной регенера ции двух других высокоактивных низкомолекулярных антиоксидантов: токоферола и аскорбиновой кислоты обеспечивает в определенных условиях поддержание буферной емкости АОС на относительно стабильном уровне. Глутатионпероксидаза макрофагов функционирует только при условии постоянной регенерации восстановленного глутатиона в клетке. Поэтому в макрофагах обнаруживается высокая активность НАДФН-зависимой глутатион-редуктазы. В то же время восстановленный глутатион является маркером дефицита НАДФН в клетке и стимулирует гексозомонофосфатный шунт (ГМФШ) [7].
Главный итог окисления глюкозы в ГМФШ сводится к генерации восстановленных эквивалентов в форме НАДФН [16]. Наиболее эффективным путем коррекции гипоксических нарушений в организме является комплексная активация дыхательной цепи: активация альтернативного сукцинатоксидазного окисления через повышение активности сукцинатдегидрогеназы и улучшение проникновения экзогенного сукцината в митохондрии клеток, стимуляция НАД-зависимого окисления и подавление радикальных процессов в клетке. Таким обра зом, функционирование ряда антиоксидантных систем зависит от уровня восстановленного глутатиона в клетке и общего фонда восстановительных эквивалентов НАДН и НАДФН.
Многолетние исследования, выполненные в период с 1970 по 1989 гг. под руководством Соколовского В.В. научными коллективами кафедры биохимии и биохимического отдела ЦНИЛ Ленинградского санитарно-гигиенического медицинского института свидетельствуют об участии тиол-дисульфидной системы в механизмах неспецифической резистентности и адаптации организма человека и животных к экстремальным воздействиям внешней среды. Соколовский В.В. предложил определение содержания сульфгидрильных и дисульфидных групп в крови методом обратного амперометрического титрования [11].
Использованию антиоксидантов в комплексной терапии ХВГ посвящены многочисленные сообщения [1,2]. Природные и синтетические антиоксиданты предупреждают активацию свободнорадикальных реакций, играют существенную роль в активации эффекторных клеток, опосредующих иммунные реакции, поэтому они могут обладать иммуномодулирующими свойствами.
В фармакологической и клинико-биохимической практике янтарная кислота (ЯК), ее соли и эфиры рассматривают как универсальный внутриклеточный метаболит. ЯК, содержащаяся в органах и тканях, является продуктом пятой реакции и субстратом шестой реакции цикла трикарбоновых кислот. Окисление янтарной кислоты в шестой реакции цикла Кребса осуществляется с помощью сукцинатдегидрогеназы, характерной особенностью которой является локализация на внутренней поверхности мембран митохондрий и независимость ее активности от концентрации окисленной и восстановленной форм НАД/НАДН, что позволяет сохранить энергосинтезирующую функцию митохондрий в условиях гипоксии и ишемии при нарушении НАД-зависимого дыхания клеток [14].
Выполняя каталитическую функцию по отношению к циклу Кребса, янтарная кислота снижает концентрацию в крови других интермедиаторов цикла – лактата, пирувата, цитрата, накапливающихся в клетке на ранних стадиях гипоксии. Феномен быстрого окисления ЯК сукцинатдегидрогеназой, сопровождающийся АТФ-зависимым восстановлением пула пиримидиновых динуклеотидов, получил название “монополизация дыхательной цепи”, биологическое значение которого заключается в быстром ресинтезе АТФ. Кроме того, сукцинат положительно влияет на ионный обмен в клетке, на оксигенацию внутренней среды, стабилизирует структуру и функциональную активность митохондрий, является индуктором синтеза некоторых белков. Противоишемический эффект ЯК связан не только с активацией сукцинатдегидрогеназного окисления, но и с восстановлением активности ключевого окислительно-восстановительного фермента дыхательной цепи митохондрий клеток – цитохромоксидазы [14].
ЯК по клинической классификации относится к субстратным антигипоксантам. Основной фармакологический эффект препарата обусловлен способностью усиливать компенсаторную активность аэробного гликолиза, снижать степень yгнетения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата.
Среди зарегистрированных лекарственных форм янтарной кислоты, содержащих ее в качестве основного компонента, на настоящий момент известен Реамберин. Реамберин проявляет дозозависимый антигипоксический эффект на модели гистотоксической гипоксии, вызванной введением фторида натрия. В эксперименте получены данные, свидетельствующие о защитном действии реамберина на микросомальную ферментативную систему печени при отравлении ксенобиотиками. Реамберин 1,5% для инфузий проявил высокий клинический эффект в качестве дезинтоксикационного средства у больных с тяжелыми формами эндогенной интоксикации. Отмечена высокая эффективность Реамберина в комплексной терапии больных синдромом полиорганной недостаточности. Отмечен высокий клинический эффект Реамберина в качестве дезинтоксикационного средства у больных, страдающих ХВГ В и С [9,10,12,13].
Клиническая значимость указанных систем, их связь с морфо-функциональным состоянием печени, все больше находит отражение в усовершенствовании патогенетических методов лечения, воздействующих на молекулярные основы патологии гепатоцитов. В соответствии с этим патологические состояния, характеризующиеся длительной активацией системы мононуклеарных фагоцитов (СМФ) и гиперпродукцией активных форм кислорода, следует рассматривать в качестве факторов риска развития антиоксидантной недоста точности, которая во многом определяет характер и интенсивность различных патологических процессов, в том числе и при хронических вирусных гепатитах [5].
Терапия хронических вирусных гепатитов в настоящее время разраба тывается в двух направлениях: 1 – усовершенствование патогенетических методов, направленных на профилактику затяжных и хронических форм заболевания, 2 – поиск противовирусных методов лечения. В схеме лечения больных хроническим вирусным гепатитом базисная дезинтоксикационная инфузионная терапия является первым этапом лечения и предшествует проведению этиологической противовирусной терапии. В настоящее время ведется поиск активных препаратов, обладающих антиоксидантным, цитопротективным действием.
Отечественный препарат реамберин, разработанный ООО НТФФ “Полисан” (Санкт-Петербург) представляет собой раствор для инфузий на основе 2% раствора соли янтарной кислоты с М-метилглюкамином и сбалансированного набора микроэлементов – калия, натрия и магния. Активным веществом препарата является янтарная кислота, обладающая прямым модифицирующим действием на клеточный метаболизм, благодаря чему происходит активация аэробного гликолиза, снижается степень угнетения окислительных процессов в цикле Кребса, в дыхательной цепи митохондрий клеток с увеличением внутриклеточного фонда макроэргических соединений. Это обусловливает прямое энергизирующее действие препарата. Известно об антигипоксантных и цитопротекторных сывойствах янтарной кислоты. Препарат обладает антиоксидантным, антигипоксантным, дезинтоксикационным, гепато-, нефро- и кардиопротекторными свойствами. Взаимодействуя с окислительно-восстановительными ферментами в дыхательной цепи митохондрий клеток, реамберин поддерживает эффективность аэробных процессов, нормализует процессы энергообразования в клетках, повышает их антивирусную устойчивость.
Целью исследования явилось изучение клинической эффективности Реамберина в качестве дезинтоксикационного, антигипоксантного средства в комплексной терапии больных, страдающих хроническими вирусными гепа титами.
1,5% раствор реамберина использовался в схеме лечения 120 больных ХВГ, среди которых ХВГ В верифицирован у 46 чел. (38,33%); ХВГ С – у 74 чел. (61,67%). Реамберин вводился внутривенно, капельно, по 400,0 мл. ежедневно или через день в сочетании с парентеральным применением витаминов группы В, гепатопротекторов, от 8 до 10 флаконов на курс. Группу сравнения составили 20 больных, сопоставимых по нозологической принадлежности, полу и возрасту, выраженности активности и стадии фиброзирования в печени, в схему лечения которых не входил реамберин. Контрольную группу составили 30 практически здоровых лиц, возрастом 28,2 ± 3,4 года.
Инфузионная терапия реамберином предшествовала проведению этиотропной противовирусной терапии с использованием интерферонов, индукторов интерферона.
Всем больным проводились общепринятые в гепатологических отделениях общеклинические исследования, включающие клинический анализ крови с определением уровня гемоглобина, количества эритроцитов, лейкоцитов, подсчетом лейкоцитарной формулы и количества тромбоцитов. В комплекс биохимического исследования входили: определение содержания билирубина и его фракций, активности аминотрансфераз (АлАТ, АсАТ), уровня общего белка и протеинограммы сыворотки крови, тимоловой пробы, протромбинового индекса (ПТИ), гаммаглютамилтранспептидазы (ГГТП), щелочной фосфатазы (ЩФ), коагулограммы.
Диагноз верифицировался вирусологически: проводилось исследование HCV-RNA, HBV-DNA методом полимеразной цепной реакции в сыворотке крови и в исследуемых гепатобиоптатах, серологических маркеров вирусов гепатита В, С методом иммуноферментного анализа: HBsAg, анти-HbsAb, HbeAg, HBcorAb, анти-HCV.
Из параметров клеточного и гуморального иммунитета, а так же функционального состояния клеток иммунной системы определялось общее количество Т-лимфоцитов (CD3), В-лимфоцитов (CD72), cубпопуляции Т-лимфоцитов: CD4, CD8, коэффициент дифференцировки (CD4/ CD8), а так же натуральные киллеры – NK (CD16/CD56), цитокиновые паттерны для Th-1 типа (IL-1β, TNF-α), уровень антителозависимой клеточной цитотоксичности (АЗКЦ).
Изучение показателей интерферонового статуса включало определение сывороточного интерферона (s-IFN), индуцированной продукции интерферонов-α/β (IFN-α/β) и интерферона-γ (IFN-γ) в интерфероновой реакции лейкоцитов по модифицированной методике В.Д. Соловьева и Т.А. Бектамирова. Исследования ферментного и субстратного звеньев антиоксидантной системы сыворотки крови проводились в ЦНИЛ СПбГМА им. И.И. Мечникова. Активность супероксиддисмутазы, каталазы плазмы определяли по методу В.В. Туркина (1994). Уровень сульфгидрильных групп определялся методом амперометрического титрования нитратом серебра в модификации В.В. Соколовского (1979).
Инструментальное исследование предусматривало ультразвуковое исследование печени, желчного пузыря и желчевыводящих путей, поджелудочной железы, селезенки; фиброгастродуоденоскопию с определением степени варикозного расширения вен пищевода; радиоизотопное исследование печени.
При исследовании клинической эффективности реамберина проводилось сопоставление показателей АОС сыворотки крови больных хроническими вирусными гепатитами с основными клинико-морфологическими критериями заболевания (этиологией, функциональным состоянием печени, выраженности процессов фиброзирования), определялось их диагностическое значение.
До лечения у исследуемых больных ХВГ В и С наблюдались изменения, характерные для окислительного стресса. Гиперпродукция активных форм кислорода, генерируемых активированными макрофагами, наряду с усиленной генерацией провоспалительных цитокинов, приводила к различной степени выраженности недостаточности ферментативного и субстратного звеньев АОС у исследуемых пациентов ХВГ в зависимости от стадии заболевания. Изменения в окислительно-восстановительном гомеостазе тиол-дисульфидной системе, оцениваемые с помощью тиол-дисульфидного коэффициента (ТДК), свидетельствовали о повреждении механизма тиолового звена как белковой, так и низкомолекулярной фракции сыворотки крови.
При ХВГ В наблюдались более низкие значения ТДК белковой фракции по сравнению с таковыми при ХВГ С, а более выраженная недостаточность ферментативного звена АОС установлена при ХВГ С. Фракционное определение ТДК в цельной крови и небелковой ее фракции позволяет дифференцировать нарушения в низкомолекулярной и белковой фракциях тиол-дисульфидной системы при ХВГ В и С.
При выявлении взаимосвязи между наличием цитолитического синдрома и частотой нарушений в АОС по исследуемым параметрам тиол-дисульфидной системы и СОД, установлено, что у пациентов с наличием цитолитического синдрома пониженные показатели ТДК регистрировались в 67% случаев, в то время как у лиц с нормальным уровнем АлАТ – лишь в 40%, (p<0,05) (рис. 1). При исследовании зависимости показателей СОД от наличия цитолитического синдрома снижение активности данного фермента регистрировалось в 100% случаев при АлАТ>1, в то время как у пациентов с нормальным уровнем АлАТ – в 60% случаев (рис. 2).

Рис. 1. ТДК белковых соединений у больных ХВГ С
в зависимости от наличия цитолитического синдрома

Рис. 2. Показатели СОД у больных ХВГ С
в зависимости от наличия цитолитического синдрома
Изменения в окислительно-восстановительном гомеостазе тиол-дисульфидной системы с преобладанием окисленных форм связано, вероятно, с истощением ферментов пентозофосфатного цикла и уменьшением активности НАДФН и НАДН-оксидаз.
Исходя из общих принципов патогенетического лечения ХВГ, оправдано применение антиоксидантов и антигипоксантов с целью нейтрализации активных форм кислорода. Выраженный метаболический эффект реамберина в отношении липоперикисного процесса делает возможным использование кислорода преимущественно по оксидазному пути, т. е. по пути ферментативного окисления субстратов в цикле трикарбоновых кислот с последующим транспортом протонов и электронов по дыхательной цепи и их реализацией на терминальном участке окислительного фосфорилирования – на цитохромоксидазе.
Реамберин применялся в качестве дезинтоксикационного, антигипоксантного средства в инфузионной терапии больных с хроническими вирусными гепатитами.
Показаниями для проведения курса терапии реамберином явились:
Результаты проведенных нами исследований по изучению клинической эффективности реамберина в инфузионной терапии больных с ХВГ В и С позволили заключить, что применение препарата в комплексной патогенетической терапии данной категории больных способствует улучшению основных клинико-лабораторных показателей, увеличивает эффективность базисной терапии вследствие восполнения антиоксидантной недостаточности сыворотки крови.
Как показали проведенные исследования, использование реамберина в инфузионной терапии больных с ХВГ приводило к более быстрому уменьшению проявлений астено-вегетативного, диспепсического синдромов по сравнению с больными, в схему лечения которых не входил препарат.
После курса инфузионной терапии реамберином у 62% больных ХВГ В и С с умеренной степенью активности и у 46% больных с выраженной активностью наблюдалось повышение абсолютного количества лимфоцитов, (p<0,05) тромбоцитов, (p<0,05).
Применение реамберина способствовало повышению неспецифической резистентности организма у большинства исследуемых больных ХВГ, оцениваемой с помощью НСТ-теста, (p<0,05), определения антителозависимой клеточной цитотоксичности, (p<0,05).
Применение реамберина оптимизировало реакцию АОС: у большинства исследуемых больных наблюдалось повышение тиол-дисульфидного соотношения белковых фракций крови, показателей СОД после курса терапии, что свидетельствовало об активном включении данных механизмов в ограничение стадии инициирования свободно-радикального окисления (рис.3– 4).
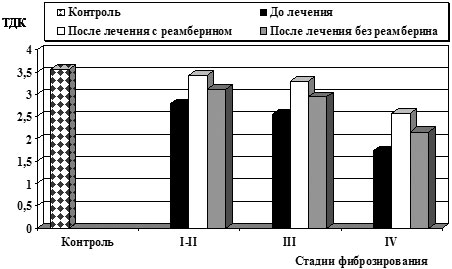
Рис.3. Влияние реамберина на тиол-дисульфидное соотношение белковых фракций крови у больных ХВГ В
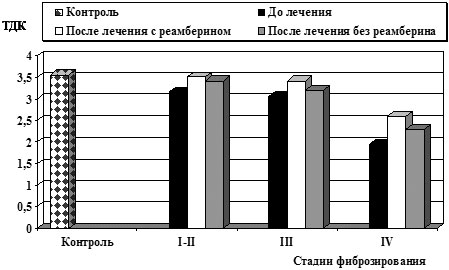
Рис.4. Влияние реамберина на тиол-дисульфидное соотношение белковых фракций крови у больных ХВГ С
Наряду с повышением антиокислительного потенциала сыворотки крови на фоне лечения реамберином наблюдалась положительная динамика биохимических показателей, заключавшаяся в уменьшении выраженности синдрома цитолиза. Снижение активности АлАТ у больных ХВГ В и С при III и IV стадии заболевания было более существенным, в схему лечения которых входил реамберин, (p<0,05).
Полученные результаты лабораторных обследований свидетельствуют о диссонансе системы IFN при всех формах ХВГ: во всех случаях отмечалось повышение сывороточного IFN и снижение индуцированной in vitro продукции IFN-a/b и IFN-g по сравнению с нормой. При этом более значительно продукция интерферона подавлена у больных с тяжелым течением хронического гепатита.
У 47% больных ХВГ после проведения курса терапии реамберином достигался положительный иммуномодулирующий эффект, заключавшийся снижении сывороточного s-IFN с (27,3 ± 1,02 до 18,1 ± 0,83 МЕ/мл, p<0.05), сопровождающееся тенденцией к повышению продукции IFN-α/β. Эти изменения наблюдались у больных ХВГ с умеренной и выраженной степенью активности. У 34% исследуемых больных наблюдалось повышение абсолютных значений Т-лимфоцитов, их субпопуляций, (p<0,05).
Следует отметить положительное влияние препарата на цитокинпродуцирующую функцию макрофагов, что особенно важно на цирротической стадии заболевания, когда циркулирующие моноциты, а так же резидентные макрофаги печени становятся основными генераторами провоспалительных цитокинов, поддерживая хроническое воспаление в печени и обусловливая системные реакции организма (рис. 5).
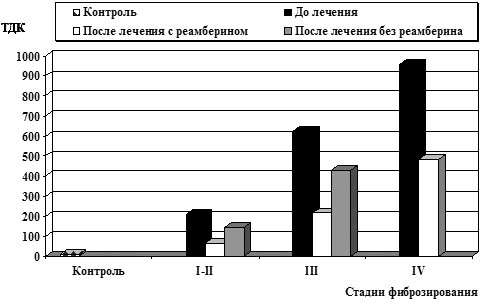
Рис. 5. Динамика сывороточных уровней IL-1І у больных ХВГ В и
С
на фоне инфузионной терапии реамберином.
Так, у больных ХВГ В и С при I-II cтадии фиброзирования терапия реамберином способствовала более существенному снижению сывороточных уровней IL-1β с (210,14 ± 25,32) пг/мл до (63,26 ± 18,94) пг/мл, (p<0,05), по сравнению таковыми показателями больных, в схему лечения которых не входил препарат. У больных ХВГ В и С на цирротической стадии на фоне лечения реамберином достигалось снижение средних значений данного цитокина с (956,24 ± 28,24) пг/мл до (482,14 ± 25,64) пг/мл, (p<0,05), чем возможно объяснить уменьшение проявлений основных системных реакций организма.
Изменения реологических свойств крови, возникающие на фоне лечения реамберином имеют неоднозначный характер: у больных ХВГ с умеренной и выраженной степенью активности, и у больных ХВГ на стадии цирроза печени наблюдается тенденция к гипокоагуляции, выражающаяся в снижении протромбинового индекса в среднем на 13,9% удлинением протромбинового времени в среднем на 9,3%, повышением фибринолитической активности сыворотки крови. Наблюдаемая гипокоагуляция устраняется изменением схемы лечения реамберином: препарат рекомендуется назначать в той же дозе, через день.
Таким образом, проведенные исследования показывают преимущество применения лекарственных средств с антигипоксантными свойствами по сравнению с традиционной инфузионной терапией для лечения больных с ХВГ В и С. Применение реамберина способствовало уменьшению гиперцитокинемии, восстановлению редокс-потенциала в тиол-дисульфидной системе, уменьшению проявлений основных биохимических синдромов у исследуемых больных.
Таким образом, анализ результатов клинических данных применения реамберина в терапии хронических гепатитов позволяет констатировать:
Реамберин 1,5% раствор 400 мл. рекомендуется вводить 1-2 раза в сутки по 400 мл. внутривенно, капельно, ежедневно, или через день в сочетании с традиционной базисной инфузионной терапией, от 5 до 10 флаконов на курс.
Инфузии 1,5 % раствора реамберина хорошо переносятся больными различными формами вирусных гепатитов В, С.
Не наблюдалось никаких серьезных побочных эффектов. В отдельных случаях при внутривенных введениях препарата возможно развитие преходящей гиперемии кожных покровов лица, верхней половины туловища, устраняемой замедлением скорости внутривенной инфузии препарата.
Отрицательное фармацевтическое, фармакодинамическое и фармакокинетическое взаимодействие с другими лекарственными препаратами и их побочное влияние на организм не установлены.
Реамберин хорошо сочетается с применяемыми инфузионными лекарственными средствами в гепатологии.
Основным противопоказанием к применению реамберина является индивидуальная непереносимость. С учетом антикоагуляционного эффекта препарат следует с осторожностью назначать при коагулопатиях, связанных с повышенным риском кровотечения.
Таким образом, анализ результатов собственных исследований свидетельствует о том, что использование реамберина в комплексной терапии больных ХВГ В и С:
Проведенные исследования и их динамика при лечении показывают преимущество применения лекарственных средств с антиоксидантными свойствами по сравнению с традиционной инфузионной терапией для лечения больных с хроническими заболеваниями печени. Реамберин эффективен в лечении больных с хроническими вирусными гепатитами, хорошо сочетается с применяемыми инфузионными лекарственными средствами в гепатологии.
Реамберин рекомендуется включать как обязательное патогенетическое средство в комплексную терапию больных с различными формами ХВГ.