Рис. 1. По оси абсцисс – НЛК усл. ед., по оси ординат – сутки.
Динамика НЛК у больных исследуемых групп
(описание основной 2-й группы см. ниже)
Источник: ХИРУРГИЯ. Журнал им. Н.И. Пирогова 2013; 6; 59-64
Ивано-Франковский национальный медицинский университет, Украина
В.Д. СКРИПКО, Е.И. ДЕЛЬЦОВА, М.Г. ГОНЧАР, Р.В. САБАДОШ
В работе проанализированы результаты обследования и лечения 154 больных синдромом диабетической стопы с критической ишемией. Изучены морфологические и гистохимические изменения мышечной ткани (окислительно-восстановительные ферменты: сукцинатдегидрогеназа и кислая фосфатаза, на разных уровнях нижней конечности. Исследованы некоторые патогенетические механизмы интоксикационного. синдрома и гипоксии тканей нижних конечностей. На основе выявленных изменений разработан алгоритм операционной тактики. Доказано, что использование разработанного алгоритма в конечном итоге дает достоверно лучшие результаты, чем общепринятая методика лечения.
На сегодняшний день в мире сахарным диабетом (СД) болеет около 100 млн человек. У 4-10% таких больных развивается синдром диабетической стопы (СДС), который в 65% наблюдений приводит к развитию критической ишемии нижней конечности [1, 2]. В связи с этим 40-70% всех ампутаций нижних конечностей приходятся именно на таких больных [2, 3]. Остается нерешенным важный вопрос выбора уровня ампутации конечности у больных СДС, особенно при его гангренозно-ишемической форме. Кроме того, нерешены вопросы улучшения оксигенации тканей нижней конечности с целью обеспечения адекватного заживления ран после проведения ампутаций и ускорения реабилитации больных [2, 4, 5].
Цель исследования – улучшить результаты лечения больных с гангренозноишемической формой СДС, разработав тактику хирургического лечения на основе изучения клинико-морфогистохимических характеристик ишемизированных мышц конечности и влияния ишемии на общее состояние больного.
На обследовании и лечении в хирургическом отделении Ивано-Франковской центральной городской клинической больницы на протяжении 2007-2012 гг. находилось 154 больных, СДС с поражением различных артериальных сегментов. Для однородности групп в исследование отобраны больные лишь 2-го типа сахарным диабетом и те пациенты, которым провести реконструктивные оперативные вмешательства на артериях нижних конечностей было невозможно (в связи с особенностями распространения окклюзионно-стенотического процесса) Степень хронической артериальной недостаточности ХАН нижних конечностей определяли согласно до полненной классификации R. Fontaine (1954) и А.В. Покровского (1979). Наличие субкритической, или критическиой ишемии нижней конечности – на основе «Документа Европейской договоренности по критической ишемии нижних конечностей» (1989).
При обследовании использованы общепринятые клинические, лабораторные и инструментальные методы. Для определения эндогенной интоксикации рассчитывали лейкоцитарный индекс интоксикации Я.Я. Кальф-Калифа (ЛИИКК), лейкоцитарного индекса интоксикации В.К. Островского (ЛИИО) и нейтрофильнолимфоцитарный коэффициент (НЛК). Проводили пункционную биопсию мышц нижней конечности, исследовали их жизнеспособность светооптическим методом и гистохимические изменения с определением активности кислой фосфатазы (КФ) и сукцинатдегидрогеназы (СДГ) с помощью наборов фирмы BIO-OPTIKA (Италия). Полуколичественным методом по пятибалльной шкале проводили градацию насыщенности тканей этими ферментами. Отсутствие гранул фермента в тканях расценивали как 0 баллов, незначительную окраску цитоплазмы с отдельными мелкими гранулами – как 1 балл, большое количество мелких гранул с единичными крупными гранулами – как 2 балла, преобладание крупных гранул – как 3 балла, наличиче только крупных гранул с их хаотичным размещением – как 4 балла и, наконец, наличие только крупных гранул на все поле зрения – как 5 баллов.
Для оценки эффективности предложенного лечения изучали ранскутанное напряжение кислорода (TcpO2) используя аппарат ТСМ-2 Radiometer (Дания), укомплектованный нагревательным кислородным электродом типа Clark, а также показатели иммунореактивности: ЛИИКК, ЛИИО и НЛК. Проводили морфологическое исследование биоптатов мышечной ткани конечности и гистохимическое исследование, используя специальные гистохимические методы для выявления СДГ и КФ с помощью наборов фирмы BIOOPTIKA (Италия) для мышечных биопсий.
На первом этапе исследования у 50 больных СДС с ХАН IVА степени изучены морфологические изменения мышечной ткани на различных уровнях нижней конечности: на стопе (в плюсновых промежутках), на голени (икроножная мышца) и на бедре (мышцы средней трети бедра). В зависимости от того, на каких уровнях нижней конечности изменения в мышцах были обратимыми, на каких – необратимыми, все больные разделены на четыре группы: 1-я (n=38) – ткани нижней конечности жизнеспособны на всех уровнях (этим больным рекомендуется осуществлять только санирующие операции на стопе), 2-я (n=5) – жизнеспособными оказались ткани бедра и голени, а ткани стопы были нежизнеспособными (этим пациентам первично следует проводить ампутацию нижней конечности на уровне голени), 3-я (n=4) – ткани сохраняли способность к регенерации в области бедра, а в области голени и стопы были нежизнеспособны (таким больным рекомендуем первично выполнять ампутацию конечности на уровне нижней трети бедра, 4-я (n=3) – ткани нежизнеспособны на всех уровнях (таким пациентам следует первично проводить ампутацию на уровне верхней трети бедра).
Таким образом, морфологическое исследование срезов мышечных волокон дает возможность четко определить объем необходимой операции. При ишемии тканей нижней конечности существенно изменяется содержание ферментов окислительно-восстановительных процессов, таких как СДГ и КФ, поэтому считали целесообразным изучить насыщенность этими ферментами мышечной ткани.
В результате исследования выявлено следующее: 1) при морфологически жизнеспособных мышцах бедра, голени и стопы СДГ может иметь активность от 0 до 5 баллов, тогда как при их морфологической нежизнеспособности – только 0 или 1 балл, 2) активность КФ при морфологически жизнеспособных мышцах не достигала 5 баллов активности, тогда как в морфологически не жизнеспособных мышцах ни разу не была на уровне от 0 до 3 баллов.
Отсюда выводы:
Исходя из полученных результатов, мы разработали алгоритм операционной тактики при гангренозно-ишемической форме СДС с ХАН IVА степени и отсутствием условий для реконструктивных оперативных вмешательств на магистральных артериях. Согласно этому алгоритму всем таким пациентам проводим гистохимическое исследование (определение активности СДГ и КФ) мышц бедра, голени и стопы. Если на всех уровнях нижней конечности активность СДГ была от 2 до 5 баллов или активность КФ – от 0 до 3 баллов, то показано выполнение только санирующей операции на стопе. При активности КФ 5 баллов показана первичная ампутация конечности на уровне верхней трети бедра. При активности КФ 5 баллов на стопе и ее активности от 0 до 3 баллов на бедре и голени – показана первичная ампутация нижней конечности на уровне голени. Если активность КФ 4 балла и/или СДГ имеет активность 0 или 1 балл, то необходимо морфологическое исследование мышц с этого уровня нижней конечности.
На втором этапе исследования нами апробирована эффективность применения этого алгоритма при СДС. Для этого больные были разделены на две группы. Основную группу составили 30 человек, обследование и лечение которых проводились согласно разработанному нами диагностическому лечебному алгоритму. В контрольную группу вошло 32 пациента, при лечении которых не проводили гистохимических и морфологических исследований. Первоначально в контрольной группе всем больным выполнены исключительно санирующие операции на стопе. В основной группе с учетом результатов гистохимического исследования санирующие операции выполнены лишь 76,7% больных, остальным пациентам произведены ампутации: 10% – на уровне голени, 6,7% – на уровне нижней трети бедра и 6,7% – на уровне верхней трети бедра. Таким образом, первоначально в основной группе выполнено достоверно большее количество больших и высоких ампутаций, чем в контрольной.
Вследствие прогрессирования некротического процесса у пациентов в контрольной группе выполнены 53,1% больных повторные операции, тогда как в основной группе – 13,3%. При этом на время выписки из стационара большие ампутации выполнены 43,8% больных контрольной группы и только 23,3% больных основной группы, из них высокие ампутации в 28,1% наблюдений контрольной группы и в 13,3% наблюдений основной группы №1. Средняя длительность пребывания в стационаре больных контрольной группы составила 33,0 дня, основной группы – 22,4 дня. Послеоперационная летальность в контрольной группе равнялась 9,4%, в основной – 0. Таким образом, доказано, что использование разработанного нами алгоритма в конечном итоге дает достоверно лучшие результаты, чем общепринятая методика лечения.
Несмотря на это, некоторой у части лиц, курированных по нашему диагностическому и лечебному алгоритму, все же приходилось делать повторные операции. С целью поиска причин такой ситуации, на третьем этапе исследования решено изучить некоторые патогенетические механизмы интоксикационного синдрома и гипоксии тканей нижних конечностей. Сформировано три группы пациентов. Первая группа – 82 пациентов с гангренозно-ишемической формой СДС, критической ишемией конечности и ХАН IVА степени. Этих пациентов сравнивали с пациентами с диабетической макроангиопатией с ХАН IIIБ степени – (n=46) вторая группа, и с ХАН IIIА степени – (n=26) третья группа. Для изучения выраженности интоксикационного синдрома определяли интоксикационные индексы, для исследования степени гипоксии тканей – ТсрО2.
При анализе результатов интоксикационных тестов выявлены достоверно высшие значения всех трех рассматриваемых индексов интоксикации на время поступления больных в стационар при ХАН не только IVА (5,9±1,0), но и IIIА (4,0±0,8) и IIIБ, (4,2±0,9) степени. Доказано, что интоксикационный синдром у больных с (ДАНК) возникает задолго до развития у них некротических и инфекционных поражений стопы и обусловлен, очевидно, ишемическими изменениями в тканях конечности. Это свидетельствует о том, что для ликвидации у таких лиц интоксикационного синдрома одним из перспективных направлений могло бы быть использование антигипоксантов.
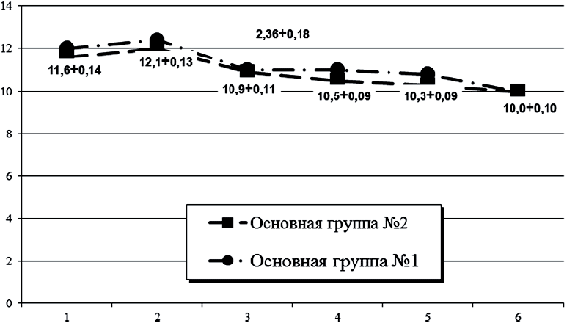
В динамике наиболее показательными были изменения нейтрофильно-лимфоцитарного коэфициента. На 3-и сутки лечения при ХАН IIIА степени значение этого показателя достоверно не изменялось (11,5±0,11), тогда как при ХАН IIIБ (11,9±0,15) и IVА (13,2±0,10) степени оно достоверно возрастало (р<0,05). Объяснить такой результат можно лишь тем, что у пациентов с ХАН IIIБ, и IVА степени при поступлении иммунная система уже была несколько истощена. Начатое лечение способствует ликвидации факторов, обусловливающих интоксикационный синдром, и уменьшает истощение иммунной системы. В ответ на это иммунная реакция организма временно усиливается, что приводит не к снижению интоксикационных индексов, а к их нарастанию или оставлению на предыдущих уровнях. Кстати, именно постепенной истощаемостью иммунной системы можно объяснить и тот факт, что исходные значения интоксикационных индексов у пациентов с различными степенями ХАН мало зависели от ее тяжести, и только НЛК был достоверно выше при IVА степени (12,2±0,10) чем при с IIIА (11,6±0,14) и IIIБ (11,1±0,13) степени. До 7-го дня лечения НЛК во всех группах достоверно снижался по сравнению с 3-м днем, а при ХАН IIIА (10,0±0,10) и IIIБ (10,6±0,14) степени – по сравнению с 1-м днем, (11,6±0,14) и (11,1±0,13). Такой результат, на наш взгляд, является закономерным свидетельством эффективности лечения больных, которое способствует к постепенному снижению НЛК (см. рисунок). Именно в связи с этим низкое значение НЛК наблюдается у пациентов с наименьшей степенью ХАН (10,0±0,10), а выше – у больных с ХАН IVА (12,1±0,11) степени (р<0,05), ведь легче поддаются лечению пациенты с наименее выраженными проявлениями заболевания.

Рис. 1. По оси абсцисс – НЛК усл. ед., по оси ординат – сутки.
Динамика НЛК у больных исследуемых групп
(описание основной 2-й группы см. ниже)
Несмотря на достоверное снижение НЛК на 6-е сутки лечения во всех исследуемых группах, нормализации этого показателя не наступило ни в одной из групп. Поскольку в настоящее время гнойнонекротический очаг на стопе у больных с ХАН IVА степени уже давно был санирован, а у пациентов с ХАН ША и IIIБ степени его вообще не было, весомым компонентом развития интоксикационного синдрома у больных с ДАНК (в частности, с СДС и ХАН IVА степени) являются ишемическо-гипоксические изменения в тканях конечности. При изучении транскутанного напряжения кислорода обнаружено, что степень базального ТсрО2 достоверно уменьшалась с ростом степени ХАН (см. таблицу).
|
Показатели мониторинга реактивной гиперемии в тканях стопы
|
Степень ХАН |
Норма |
||
|---|---|---|---|---|
|
ІІІ А (n=26) |
ІІІБ (n=46) |
ІVА (n=82) |
||
|
ТсрО2 баз, мм рт.ст. |
31,5±2,6 |
20,0±1,8 |
7,0±1,5 |
58,7±0,9 |
|
ТсрО2 мин мм рт.ст. |
5,0±0,8 |
5,0±1,1 |
2,5±1,0 |
5,0±0,7 |
|
T, мин |
4,3±0,5 |
4,7±0,6 |
5,3±0,5 |
1,5±0,5 |
|
ТсрО2макс мм рт.ст. |
36,0±1,4 |
24,5±0,9 |
0,2±0,9 |
75,3±0,7 |
Примечание: Динамика показателя
транскутанного напряжения кислорода ( ТсрО2)
у больных с ДАНК при ХАН ІІІА, ІІІБ, ІVА степени. Н-норма.
Это вполне закономерно, поскольку базальное ТсрО2 является одним из важнейших показателей, которые как раз и определяют у пациентов с гангренозно-ишемической формой СДС степень ХАН. При проведении пробы на реактивную гиперемию, ТсрО2 до снятия жгута, то есть минимальная, ТсрО2 у пациентов с ХАН ША и IIIБ степеней достоверно от нормы не отличалось. В настоящее время при ХАН IVА степени ТсрО2 было достоверно ниже нормы. Это свидетельствует о том, что любая компрессия голени или стопы у при СДС и ХАН IVА степени (например, тугое наложение асептической повязки, наличие гнойнонекротического очага) может усугубить к углублению некротические изменения и привести к неудовлетворительному результату лечения. Период восстановления уровня базального ТсрО2 во всех группах лиц был достоверно длиннее, чем в норме, это закономерно в связи с нарушением магистрального кровотока (окклюзии магистральных артерий у всех без исключения пациентов) и наличием значительных структурноморфологических изменений в стенках сосудов микроциркуляторного русла (что снижает их реактивность). При этом достоверных различий длительности восстановления уровня базального между ТсрО2 при различных степенях ХАН обнаружено не было, хотя и наблюдалась тенденция к его большему значению при ХАН IVА степени.
После снятия турникета с конечности показатель максимального в норме ТсрО2 выше ТсрО2 базальной почти на треть. Одновременно, при ХАН ША и IIIБ степени он лишь едва превышает базальное ТсрО2, а при ХАН IVА степени вообще достоверно от него не отличается. Все это свидетельствует о том, что у пациентов с ХАН IVА степени функциональные резервы микрососудистого русла практически отсутствуют. Назначение таким пациентам сосудорасширяющих средств не приведет к улучшению оксигенации стопы, поскольку максимально возможное ТсрО2 у них после расширения микроциркуляторного русла достоверно не превышает исходных данных (базального ТсрО2). Отсюда вывод: единственным достоверно возможным консервативным методом повышения оксигенации тканей стопы у таких пациентов является назначение антигипоксантов. В связи с этим на четвертом этапе исследования нами изучена целесообразность назначения антигипоксантов больным СДС с критической ишемией. С этой целью избран препарат реамберин («Полисан», Россия).
Преимущество реамберина перед другими препаратами со сходным механизмом действия заключается еще и в значительном нейропротекторном, антиоксидантном и реологическом воздействии. В состав препарата входят метиламоний натрий сукцинат (янтарная кислота) – 15 г, натрия хлорид – 6 г, калия хлорид – 0,3 г, магния хлорид – 0,12 г. Препарат разрешен к применению ЦФК МОЗ Украины.
Введение препарата начинали как компонента предоперационной подготовки начинали со времени госпитализации и продолжали в послеоперационном периоде. Длительность его введения составляла от 7 до 9 сут. Сформировано две группы пациентов. 1-й группой стала названная ранее основная 1-я группа, в которой использовали разработанный нами алгоритм лечебной тактики, но не использовали антигипоксантов. Вторую группу (основная 2-я группа) составили 20 пациентов, которых также вели согласно алгоритму, но дополнительно они получали реамберин.
Получены следующие результаты. На 7-е сутки лечения уровень базального напряжения кислорода в тканях стопы был выше исходного в обеих группах. Но если в основной 1-й группе он оставался на грани критической ишемии (28,7 мм рт.ст.), то в основной группе №2 он выходил за ее пределы и был достоверно выше, чем предыдущей группе (36,5 мм рт.ст.). Все это свидетельствует о выраженном положительном эффекте использования антигипоксантного средства. Что касается уровня максимального напряжения кислорода, после пробы на реактивную гиперемию, то достоверного его увеличения по отношению к базальному уровню не выявлено ни в одной из групп больных. Это закономерно, поскольку антигипоксантное вещество не может повлиять на ригидность сосудистой стенки, а значит, и на максимальное напряжение кислорода в тканях. Следовательно антигипоксант реамберин улучшает оксигенацию тканей за счет базального напряжения кислорода. Анализируя показатели эффективности лечения больных, отметим, что спектр первично выполненных оперативных вмешательств в основных 1-й и 2-й группах достоверно не различался. В период стационарного лечения повторные оперативные вмешательства выполнены 13,3% пациентов основной 1-й группы и только 5,0% лиц основной 2-й группы, хотя разница этих показателей недостоверна. В основной 2-й группе наблюдалась также тенденция к более редкому выполнению высоких ампутаций на уровне голени. И главное больных, которым вводили реамберин, оказался достоверно меньшим оказался средний срок пребывания больных в стационаре – 18,0 сут. Против 23,8 сут. Получены убедительные данные об эффективности применения у больных СДС препаратов с антигипоксантным свойством.
Таким образом, морфологическими критериями нежизнеспособности мышц нижней конечности при гангренозно-ишемической форме синдрома диабетической стопы являются глубокие деструктивные и некротические изменения большинства поперечнополосатых мышечных волокон с формированием их гангренозного повреждения, потеря поперечной и продольной исчерченности мышечных волокон и развитие некрозов не только в миосимпластах, но и в соединительной ткани пери и эндомизия.
При синдроме диабетической стопы гистохимическим критерием нежизнеспособности мышц нижней конечности на любом уровне является активность кислой фосфатазы 5 баллов, критериями их жизнеспособности – активность сукцинатдегидрогеназы от 2 до 5 баллов или активность кислой фосфатазы от 0 до 3 баллов.
С учетом результатов первичной ампутации выше уровня морфологически и гистохимически не жизнеспособных тканей и выполнения только санирующих операций на стопе при жизнеспособности тканей на всех исследуемых уровнях разработан алгоритм выбора оперативной тактики у больных с гангренозноишемической формой синдрома диабетической стопы с хронической артериальной недо статочностью IVА степени при отсутствии условий для реконструктивных оперативным вмешательств на артериях нижних конечностей, основанный на выполнении.
Использование этого алгоритма у больных синдромом диабетической стопы позволило снизить частоту высоких (с 28,1 до 13,3%) и выше голеностопного сустава до 23,3%) ампутаций, повторных операций (с 53,1 до 13, 3%) и средний срок пребывания в стационаре (с 33 до 22,4 сут).
При гангренозно-ишемической форме синдрома диабетической стопы развитие интоксикационного синдрома обусловлено не только гнойно-некротическими осложнениями, но и ишемическогипоксическими изменениями в тканях конечности.
Использование антигипоксантов, в частности раствора реамберина, у больных синдромом диабетической стопы с критической ишемией, позволяет ускорить ликвидацию интоксикационного синдрома, способствует восстановлению активности ферментов окислительно-восстановительных процессов и приводит к уменьшению среднего срока пребывания в стационаре (с 22,4 до 18,0 дня).
Перспективы исследований заключаются в дальнейшем изучении влияния антигипоксантов на ишемизированную мышечную ткань у больных синдромом диабетической стопы с критической ишемией.