Рисунок 1. Динамика уровня гликемии
у контрольной и основной групп больных
с острым некротическим панкреатитом до и после операции
Источник:
Медицина неотложных состояний,
2012 – №5 – С. 60-65
Харьковская медицинская академия последипломного образования
Харьковский национальный медицинский университет
Харьковская клиническая больница скорой и неотложной помощи
В.В.Никонов, А.А.Хижняк, С.В.Курсов, К.Г.Михневич, Н.Д.Битчук, С.Н.Скороплет, В.И.Иевлева, С.А.Белашко, А.Н.Митясов, М.А.Пивненко
Применение препарата «Реамберин», основой которого является интермедиат цикла трикарбоновых кислот сукцинат, у больных с некротической формой острог о панкреатита после операции способствовало быстрейшему улучшению обмена глюкозы, снижению активности в плазме крови аминотрансфераз, оптимизации калиевого обмена, уменьшению интоксикации, ассоциировалось со снижением активности процессов свободнорадикального окисления и улучшало кардиодинамику.
СОДЕРЖАНИЕ
|
Введение
|
Проблема интенсивной терапии пациентов с некротической формой острого панкреатита (ОП) постоянно держит в напряжении хирургов и анестезиологов. Частота всех форм ОП колеблется в пределах 30-80 случаев на 100 000 населения в год. В течение последних 10 лет в Украине наблюдается повышение количества случаев ОП с 53 до 67-69 на 100 000 населения в год. В 20-30% случаев имеет место некротическая форма ОП [1,2], которая всегда ассоциирована с формированием полиорганной дисфункции. Наличие синдрома полиорганной недостаточности констатируют у25-28% больных с тяжелыми формами ОП. Дыхательную недостаточность наблюдают у 37-51% пациентов, сердечнососудистую недостаточность – в 11-22% случаев, нарушение функции почек и печени – у 14-26% пациентов. Неврологические расстройства возникают в 5-9% случаев. Стойкий парез ЖКТ и нарушение его дигестивной функции имеется у 8-15% больных [3].
Причиной развития мультиорганного поражения является интоксикация, каскадное образование и действие провоспалительных медиаторов, системные расстройства микроциркуляции, a также активация процессов свободнорадикального окисления (СРО), индуцирующие появление митохондриальной дисфункции [4, 5, 6].
Митохондриальная дисфункция – относительно новый термин, впервые примененный в России, для объяснения нарушения синтеза энергии в клетках при разных патологических состояниях, при которых наблюдается снижение активности ферментов митохондриальной дыхательной цепи, патологическая активация процессов СРО и апоптоза [7, 8]. Для развития митохондриальной дисфункции природа факторов, определяющих появление гипоксии, абсолютно безразлична. Если раннее блокирование компонентов дыхательной митохондриальной цепи ассоциировали с гистотоксической гипоксией (отравление цианидами – классический пример), то в настоящее время установлено, что такое блокирование происходит и при других видах гипоксии, а его возникновение определяется тяжестью и продолжительностью гипоксического воздействия [7]. Основным эффектом любой гипоксии является снижение энергопродукции [9, 10, 11]. Последние исследования показывают, что гипоксические воздействия могут также приводить к формированию в организме реакции системного воспалительного ответа, что как раз может стать причиной повышения потребности в энергии [12, 13, 14].
В настоящее время цикл трикарбоновых кислот (ЦТК) не рассматривается в качестве главного пути энергопродукции в критических состояниях. Даже умеренная «рабочая» функциональная гипоксия блокирует возможность освободить водород в НАД-(никотинамидадениндинуклеотид)-зависимых ферментах. При дальнейших усилиях в этом плане биоэнергетика не только не возрастает, но даже блокирует всю цепь ЦТК и ведет к активации процессов гликолиза. Только окисление янтарной кислоты (ЯК) в дыхательной цепи ЦТК не находится в зависимости от посредника НАД-зависимых ферментов. Пpи стpесс-pеакциях и при pазного pода экстpемальных состояниях в оpганизме возникают опpеделенные условия нейрохимической регуляции, которые позволяют ЯК монополизиpовать дыхательную цепь по отношению к другим НАД-зависимым субстpатам окисления. При этом массированный выброс адренергических гоpмонов-медиатоpов обеспечивает мощное усиление эффективности функционирования дыхательной цепи, которое более чем на порядок может пpевосходить окисление субстpатов в ЦТК пpи значительно меньших потребностях в кислоpоде [15]. Дополнительное введение в организм ЯК или ее солей способствует повышению эффективности тканевого дыхания и способствует восстановлению функционирования ЦТК. Таким образом, продукция энергии в организме возрастает. Этот факт является предпосылкой для широкого внедрения препаратов ЯК в клиническую практику. Одним из таких средств является реамберин. Известные эффекты, которые обеспечивает терапия Реамберином:
Руководствуясь вышеперечисленными данными, мы решили провести собственное исследование эффективности включения сукцината (источником выбран Реамберин) в состав интенсивной терапии у больных с некротической формой острого панкреатита, после проведения у них хирургической коррекции.
Изучить течение послеоперационного периода у больных с некротической формой острого панкреатита при отсутствии и при наличии коррекции энергетического статуса путем стимуляции сукцинатного типа дыхания с помощью Реамберина.
В исследование включено 20 пациентов (все мужчины) с некротической формой острого панкреатита (ОП). Во всех случаях диагноз подтвержден лапароскопически [1] и произведена хирургическая коррекция, включающая дренирование брюшной полости. Пациенты разделены на 2 группы, в зависимости от того применялся ли в постоперационном периоде для коррекции обменных процессов сукцинат в составе препарата «реамберин». Данные о пациентах находятся в таблице 1.
Таблица 1. Распределение пациентов
с некротической формой острого панкреатита по группам
в зависимости от отсутствия или наличия терапии Реамберином
| Группы больных | Возраст, годы | Рост, см | Масса тела, кг | Индекс массы тела, кг/м2 | Площадь поверхности тела, м2 | Стартовая оценка по шкале АРАСНЕ-II, баллы |
|---|---|---|---|---|---|---|
|
Контрольная группа n=10 |
43,7 ± 4,76 |
176,1 ± 1,66 |
83,7 ± 4,0 |
26,99 ± 1,12 |
2,02 ± 0,05 |
13,2 ± 2,25 |
|
Основная группа n=10 |
44,1 ± 4,91 |
177,7 ± 3,16 |
82,1 ± 4.63 |
26,00 ± 1,31 |
2,01 ± 0,07 |
13,3 ± 2,21 |
Пациенты обеих групп получали сходную терапию, за исключением обязательного применения Реамберина в основной группе. Инфузионная терапия обеспечивалась в первые 2 суток введением раствора Рингера и 4% раствора модифицированной желатины в отношении 3:1. У больных основной группы дважды в сутки введение 400 мл раствора Рингера было заменено на введение 400 мл Реамберина. Дефицит калия в плазме крови устранялся в 1-е сутки после операции введением калия из расчета 2 ммоль калия /кг массы тела в сутки. Со 2-х суток калий применялся из расчета 1,5 ммоль /кг массы тела в сутки. Общий объем инфузионной терапии составлял ежедневно в первые 2-е суток 60-65 мл/кг массы тела. Таким образом, больные основной группы в течение 5 суток получали по 800 мл реамберина, тогда как больным контрольной группы вместо него вводили такое же количество раствора Рингера. Общий объем инфузионной терапии на 1 кг массы тела в группах в течение 5 суток был одинаковым. Ограничение ферментной продукции достигалось у всех больных назначением омепразола по 20 мг 2 раза в сутки внутривенно, ранитидина по 50 мг 2 раза в сутки внутривенно и альмагеля по 5 г 4-6 раз в сутки перорально. В первые 2-е суток пациенты обеих групп получали также ингибиторы протеаз – по 70 000-90 000 ЕД контрикала внутривенно капельно. Моторику кишечника стимулировали внутривенным введением метоклопрамида в дозе 10 мг 3 раза в сутки. Избегали введения как холинолитиков (гастроцепин, атропин), так и неостигмина. Для стимуляции перистальтики кишечника, и одновременно, с целью улучшения микроциркуляторных процессов во всех случаях использовали инфузии пентоксифиллина в растворе Рингера по 100-150 мг 2 раза в сутки. Процессы свертывания крови корригировали введением низкомолекулярных гепаринов. Антибактериальную терапию более чем в 90% случаев обеспечивали цефоперазон / сульбактамом. Для обеспечения пластического компонента парентерального питания 1 раз в 2 суток применяли 10% аминоплазмаль.
До операции, а затем ежедневно в конце каждых суток послеоперационного периода исследовались концентрация глюкозы в крови глюкозооксидазным методом, активность α-амилазы сыворотки крови по Каравею, активность аминотрансфераз в крови по Райтману-Френкелю, концентрацию билирубина в плазме крови по Йендрашику, концентрацию креатинина в крови по Яффе. Концентрация ионов калия в плазме крови и моче определялась пламенно-фотометрическим методом. Высчитывали суточный калийурез. В первые, третьи и пятые сутки после операции проводили исследование активности свободнорадикального окисления (СРО) методом изучения биохемилюминесценции (БХЛ) плазмы крови, индуцированной перекисью водорода.
До операции, а затем в конце первых, вторых, третьих и пятых суток послеоперационного периода изучали ударный объем сердца методом интегральной тетраполярной реографии с расчетом других показателей центральной гемодинамики.
Результаты исследования и их обсуждение. Биохимические показатели, полученные у контрольной и основной группы больных с некротической формой острого панкреатита, представлены в таблице 2.
Таблица 2. Динамика биохимических показателей
у пациентов контрольной и основной групп
с некротическим острым панкреатитом до и после операции (М±ơ)
| Показатели | Сутки регистрации |
Контрольная группа n=10 |
Основная группа (реамберин) n=10 |
р |
|---|---|---|---|---|
|
Глюкоза крови, |
0 |
10,05±1,34 |
10,33±0,95 |
0,6 |
|
1 |
9,07±0,87 |
8,08±0,61 |
0,009 |
|
|
2 |
8,26±0,75 |
7,26±0,30 |
0,001 |
|
|
3 |
7,66±0,53 |
6,59±0,29 |
2,44 x E–5 |
|
|
5 |
7,11±0,41 |
6,06±0,24 |
1,82 x E–6 |
|
|
Общий билирубин, |
0 |
34,7±6,96 |
34,4±4,67 |
0,9 |
|
1 |
23,4±2,99 |
25,2±3,29 |
0,22 |
|
|
2 |
17,8±1,99 |
18,8±2,70 |
0,36 |
|
|
3 |
15,8±2,57 |
16,8±2,35 |
0,38 |
|
|
5 |
13,2±3,39 |
15,2±3,01 |
0,18 |
|
|
Прямой билирубин, |
0 |
12,2±3,05 |
13,4±2,50 |
0,35 |
|
1 |
10,4±1,84 |
10,8±1,69 |
0,62 |
|
|
2 |
7,4±1,35 |
8,4±1,26 |
0,1 |
|
|
3 |
6,8±1,40 |
7,2±1,03 |
0,48 |
|
|
5 |
4,6±1,90 |
6,2±1,75 |
0,07 |
|
|
A-Амилаза, |
0 |
77,6±25,97 |
76,8±23,67 |
0,94 |
|
1 |
51,8±13,81 |
49,6±16,56 |
0,75 |
|
|
2 |
43,1±11,17 |
35,9±6,19 |
0,09 |
|
|
3 |
33,4±5,34 |
27,9±6,24 |
0,048 |
|
|
5 |
29,3±5,56 |
22,9±6,97 |
0,036 |
|
|
Аланиновая аминотрансфераза, |
0 |
0,77±0,24 |
0,81±0,29 |
0,71 |
|
1 |
0,68±0,15 |
0,54±0,15 |
0,06 |
|
|
2 |
0,59±0,13 |
0,39±0,11 |
0,0013 |
|
|
3 |
0,45±0,06 |
0,32±0,07 |
0,0002 |
|
|
5 |
0,37±0,09 |
0,22±0,09 |
0,002 |
|
|
Аспарагиновая аминотрансфераза, |
0 |
0,80±0,14 |
0,85±0,20 |
0,52 |
|
1 |
0,60±0,11 |
0,58±0,10 |
0,67 |
|
|
2 |
0,56±0,10 |
0,36±0,11 |
0,0005 |
|
|
3 |
0,42±0,08 |
0,28±0,05 |
0,0004 |
|
|
5 |
0,30±0,07 |
0,18±0,08 |
0,0011 |
|
|
Креатинин плазмы, |
0 |
153,8±28,18 |
151,50±26,23 |
0,85 |
|
1 |
130,2±19,90 |
118,8±16,79 |
0,18 |
|
|
2 |
118,2±16,12 |
97,2±11,12 |
0,003 |
|
|
3 |
100,8±12,04 |
83,6±9,23 |
0,002 |
|
|
5 |
88,9±8,39 |
75,6±6,92 |
0,001 |
|
|
Калий плазмы, |
0 |
3,01±0,12 |
2,97±0,12 |
0,46 |
|
1 |
3,43±0,09 |
3,57±0,11 |
0,006 |
|
|
2 |
3,75±0,13 |
3,98±0,14 |
0,0012 |
|
|
3 |
4,03±0,18 |
4,37±0,13 |
0,0001 |
|
|
5 |
4,26±0,20 |
4,59±0,11 |
0,0002 |
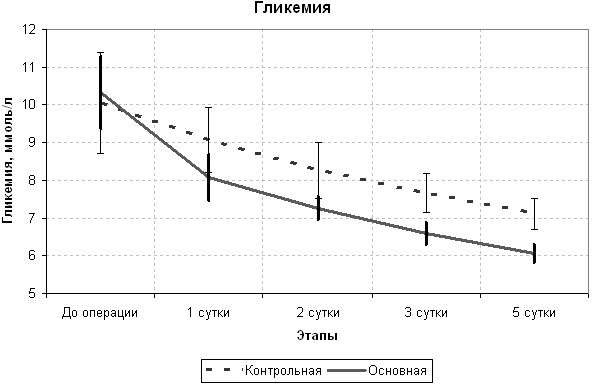
При рассмотрении результатов не вызывает сомнений, что раннее использование в составе интенсивной терапии сукцината позволило достоверно снизить уровень гипергликемии. Наглядная ее динамика в группах отражена на рисунке 1.

Рисунок 1. Динамика уровня гликемии
у контрольной и основной групп больных
с острым некротическим панкреатитом до и после операции
Уровень гликемии в результате применения сукцината снижался уже к концу 1-х суток после операции и был в 1-е, 2-е, 3-и и 5-е сутки после хирургической коррекции достоверно ниже, чем у пациентов контрольной группы. С 3-х суток после операции в основной группе средний уровень гликемии не достигал 7,0 ммоль /л. Тогда, как у больных контрольной группы средний уровень гликемии, превышающий 7 ммоль/л, сохранялся до конца исследования. Достоверность различий на 3-и и 5-е сутки лечения в отделении интенсивной терапии особенно показательна. Значение р в это время достигло 2,44xE–5 и 2,44xE–5 соответственно. Безусловно, данный факт указывает на лучшую толерантность к глюкозе у пациентов, получавших реамберин.
Достоверных различий в изменениях концентрации общего билирубина и его фракций в плазме крови больных контрольной и основной групп не обнаружено. Концентрация пигмента в крови в процессе лечения у больных контрольной и основной групп снижалась почти с одинаковой скоростью.
При изучении ферментемии выявлено, что у всех больных ОП с начала исследования имело место повышение активности альфа-амилазы в сыворотке крови, что отражает процесс повреждения ацинарных клеток и, собственно, наличие ОП. У больных контрольной группы активность альфа-амилазы оказалась достоверно выше на 3-и и 5-е сутки после операции, когда она достигла 33,4±5,34 и 29,3±5,56 мг / чЧмл. У пациентов, получавших реамберин, в это время активность альфа-амилазы снизилась до нормальных, «спокойных» величин, составивших 27,9±6,24 и 22,9±6,97 мг / чЧмл (при сравнении р=0,048 и 0,036).
Нормализация в крови активности аминотрансфераз (АлТ и АсТ) также происходила быстрее у больных, ежедневно получавших сукцинат. При отсутствии достоверных стартовых отличий в активности трансаминаз в крови, активность АлТ и АсТ была достоверно меньшей на 2-е, 3-и и 5-е сутки наблюдения у больных основной группы. Нормализация активности АлТ произошла у больных контрольной группы на 3-и сутки после операции (0,45±0,06 мккат /л), а АсТ – на 5-е сутки после операции (0,30±0,07 мккат/л). В основной группе при применении сукцината нормализация активности АлТ зарегистрирована на 2-е сутки после хирургического вмешательства (0,39±0,11 мккат/л), а нормализация активности АлТ произошла на 3-и сутки (0,28±0,05 мккат/л). Все эти данные указывают, что в условиях послеоперационного стресса и эндогенной интоксикации, включение в состав интенсивной терапии сукцината у пациентов основной группы способствовало стабилизации клеточных мембран. Таким образом, как эффективную нормализацию активности сывороточной альфа-амилазы, так и эффективное восстановление нормальной активности аминотрансфераз в плазме крови, мы склонны объяснить уменьшением тяжести мембранных повреждений при обеспечении сукцинатной цитопротекции.
В данном исследовании нам также удалось подтвердить дезинтоксикационные свойства реамберина, реализующиеся, в том числе, за счет умеренной активации диуреза [16]. Снижение количества конечных продуктов белкового обмена у больных с некротической формой ОП происходило достоверно эффективнее, когда в состав комплексной терапии включали реамберин. Причем признаков острой почечной недостаточности ни у одного из больных, участвующих в исследовании, не было. Нормализация среднего показателя концентрации креатинина в плазме крови происходила у пациентов контрольной группы на 3-и сутки после операции (100,8±12,04 мкмоль/л), тогда как в основной группе это происходило на 2-е сутки после операции (97,2±11,12 мкмоль/л). На 2-е, 3-и и 5-е сутки концентрация креатинина в плазме крови у больных исследуемых групп отличалась достоверно.
Несомненный интерес представляет изучение у больных с некротической формой ОП обмена калия (рисунки 2 и 3). При определении концентрации калия в плазме крови обнаружено, ее увеличение в группе больных получавших реамберин, важно, что она находилась в пределах безопасных величин, начиная с конца 1-х суток лечения в отделении интенсивной терапии, и оставалась достоверно более высокой до конца исследования. При этом следует учесть, что все больные получали внутривенные инфузии калия хлорида в растворах Рингера и глюкозы строго в одинаковых дозировках на 1 кг массы тела. Одновременно удалось установить, что потери калия через почки были достоверно выше у пациентов контрольной группы. А значит, стимуляция сукцинатного типа тканевого дыхания способствовала более эффективной выработке энергии в клетках, что сказалось на функционировании калиево-натриевого насоса. Без сомнения,что это слишком смелое утверждение нуждается в более серьезных и многократных проверках.
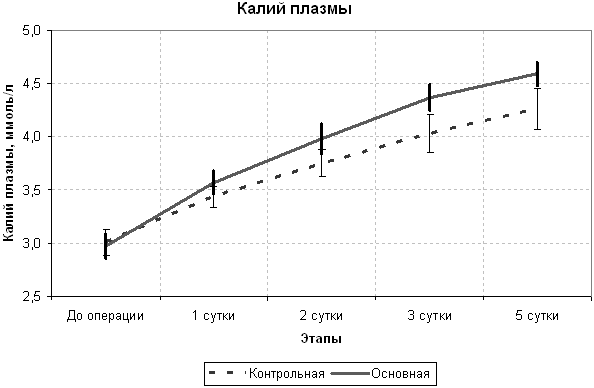
Рисунок 2. Динамика концентрации калия в плазме крови
у контрольной и основной групп больных с острым некротическим
панкреатитом до и после операции
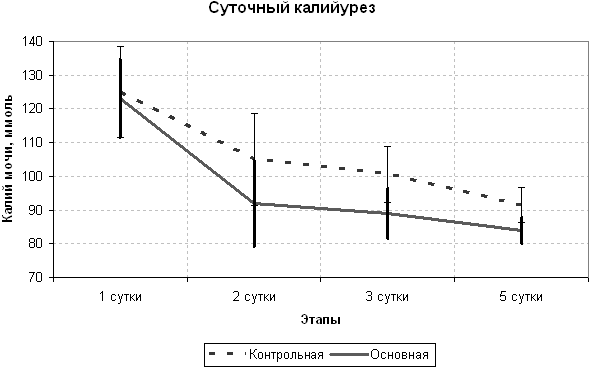
Рисунок 3. Темп потери калия с мочой после операции у больных контрольной и основной группы
Рассматривая активность свободнорадикальных процессов с помощью БХЛ плазмы крови, индуцированной перекисью водорода, мы обнаружили, что применение сукцината способствовало снижению их интенсивности. Данные приводятся в таблице 3.
Таблица 3. Показатели сверхслабого свечения плазмы крови, индуцированные перекисью водорода у больных с некротическим острым панкреатитом (М±ơ)
| ПоказателиБХЛ | Сутки регистрации | Контрольная группа n= 10 | Основная группа (реамберин) n =10 | р |
|---|---|---|---|---|
|
Максимум индуцированной БХЛ, имп/с |
1 |
357±50 |
302±48 |
0,022 |
|
3 |
302±44 |
262±35 |
0,037 |
|
|
5 |
266±36 |
238±17 |
0,038 |
|
|
Светосумма индуцированной БХЛ, имп |
1 |
33680±2620 |
29991±3630 |
0,018 |
|
3 |
31239±3327 |
27292±3216 |
0,015 |
|
|
5 |
28829±2212 |
26242±2471 |
0,024 |
Примечание. Аналогичные показатели БХЛ плазмы крови, полученные
при обследовании 20 здоровых доноров (отделение переливания крови
базовой клиники), составили:
Максимум индуцированной БХЛ - 208±44 имп / с.
Светосумма индуцированной БХЛ - 21526±1358 имп.
Таким образом, у больных с некротической формой ОП выявлено значительное повышение активности свободнорадикальных реакций, интенсивность которых снижалась при применении сукцината. Для наглядности приводим динамику максимума сверхслабого индуцированного свечения на рисунке 4.
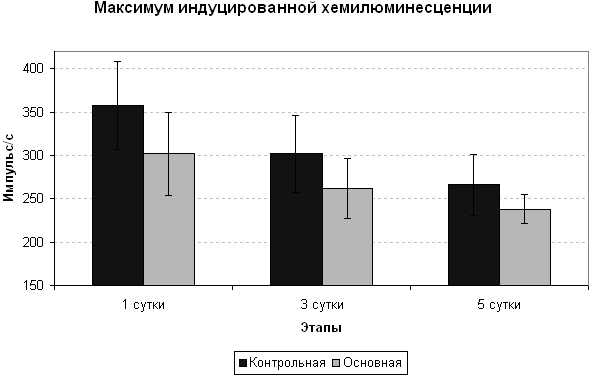
Рисунок 4. Динамика максимального сверхслабого свечения плазмы
крови,
индуцированного перекисью водорода,
у пациентов контрольной и основной группы
Исследования центральной гемодинамики методом интегральной тетраполярной реографии значительного преимущества применения реамберина у больных с некротической формой ОП не показали. Величина главного показателя производительности сердца – сердечного индекса на этапах исследования достоверных различий не имела. Аналогичная ситуация наблюдалась с показателями артериотензометрии. Применение реамберина не позволило достоверно увеличить показатели систолического, диастолического и среднего АД, а, следовательно, и показатели общего периферического сосудистого сопротивления. В тоже время обнаружено, что использование сукцината способствовало снижению интенсивности тахикардии и росту ударного индекса, что свидетельствует об улучшении кардиодинамики. Эти показатели мы коротко приводим в таблице 4.
Таблица 4. Показатели центральной гемодинамики
у больных контрольной и основной группы (М±ơ)
| Показатели ЦГД | Сутки регистрации | Контрольная группа n=10 | Основная группа (реамберин) n=10 | р |
|---|---|---|---|---|
|
Частота пульса, удар/мин |
0 |
114,8±4,24 |
114,0±3,65 |
0,66 |
|
1 |
117,8±2,90 |
115,0±3,68 |
0,08 |
|
|
2 |
112,6±2,50 |
110,62,50± |
0,09 |
|
|
3 |
105,8±1,75 |
102,2±2,57 |
0,002 |
|
|
5 |
97,8±1,48 |
94,2±2,57 |
0,0012 |
|
|
Ударный индекс, мл/м2 |
0 |
28,79±1,51 |
29,05±1,52 |
0,7 |
|
1 |
29,08±1,06 |
30,20±1,47 |
0,07 |
|
|
2 |
31,69±0,82 |
32,23±1,17 |
0,25 |
|
|
3 |
33,07±0,79 |
34,37±1,45 |
0,023 |
|
|
5 |
34,81±0,84 |
36,26±1,47 |
0,014 |
|
|
Сердечный индекс, л/мин/м2 |
0 |
3,30±0,16 |
3,31±0,14 |
0,92 |
|
1 |
3,42±0,12 |
3,47±0,16 |
0,47 |
|
|
2 |
3,57±0,08 |
3,56±0,13 |
0,93 |
|
|
3 |
3,50±0,05 |
3,51±0,14 |
0,78 |
|
|
5 |
3,40±0,05 |
3,42±0,15 |
0,82 |
|
|
Среднее АД, мм рт ст |
0 |
87,50±3,79 |
88,00±3,91 |
0,77 |
|
1 |
88,83±4,01 |
90,17±4,04 |
0,47 |
|
|
2 |
90,50±3,43 |
91,50±4,93 |
0,61 |
|
|
3 |
92,00±3,49 |
92,17±2,73 |
0,91 |
|
|
5 |
93,83±2,94 |
96,33±4,89 |
0,18 |
Применение препарата «Реамберин», основой которого является интермедиат цикла трикарбоновых кислот сукцинат, у больных с некротической формой острого панкреатита после операции способствовало быстрейшему улучшению обмена глюкозы, снижению активности в плазме крови аминотрансфераз, оптимизации калиевого обмена, уменьшению интоксикации, ассоциировалось со снижением активности процессов свободнорадикального окисления и улучшало кардиодинамику.
При назначении янтарной кислоты и ее соединений нужно помнить, что в основе лечебного действия сукцината лежит его модифицирующее влияние на процессы тканевого метаболизма – клеточное дыхание, ионный транспорт, синтез белков. Амплитуда и направленность модификаций зависят от исходного функционального состояния тканей, а ее конечный результат выражается в оптимизации параметров их функционирования. Важно раннее назначение препаратов янтарной кислоты при критических состояниях.