Проблема вирусных поражений печени, получивших широкое
распространение во второй половине нашего столетия в индустриально
развитых странах, позволяет трансформировать ее из чисто
Медицинской в социально-экономическую проблему. Этому способствует
не только высокая частота возникновения острых случаев заболевания,
но и ее неблагоприятные исходы в виде хронического гепатита,
цирроза печени и гепатоцеллюлярной карциномы.
Более 1/3 населения мира поданным ВОЗ, инфицированы вирусным
гепатитом, связанным с вирусом гепатита В, ежегодно умирают около
2 млн. человек.
Около 500 млн. человек в мире страдают хронической
HCV-инфекцией.
В настоящее время хорошо изучено строение вируса С, появилась
возможность идентифицировать его генотипы и субгенотипы, широко
стала использоваться полимеразная цепная реакция (ПЦР) для
непосредственного обнаружения вирусной РНК в сыворотке крови
больного.
Изучая распространенность вирусного гепатита С среди различных
слоев населения, установлено, что значительному риску
инфицирования ВГС подвергаются пациенты, страдающие гемофилией и
получающие препараты крови, которые собираются у большого пула
доноров, а, следовательно, не могут быть подвергнуты должному
вирусологическому контролю. Более того, абсолютное большинство
исследователей выявляют полную коррелятивную зависимость между
количеством полученных трансфузий и частотой инфицирования
пациентов.
К группе высокого риска инфицирования справедливо относят
больных отделений хронического гемодиализа. Отмечено, что у
больных, находящихся на гемодиализе более 3-х лет,
инфицированность ВГС достигает 100%. Вместе с тем, не найдена
зависимость между частотой инфицирований ВГС и продолжительностью
лечения. Авторы высказывают предположение, что случай ВГС в
отделениях гемодиализа могут рассматриваться как внутри
госпитальная инфекция.
В 1995 году выявлен из переливаемой крови вирус, обозначенный
как вирус G, вызывающий парентеральный гепатит, ранее описанный как
посттрансфузионный гепатит X. Генетический анализ показал, что
это флавивирус, содержащий РНК. Вирус имеет нуклеиновые
последовательности, характерные для НСV (на 25%), однако HGV — это
самостоятельный генетический клон из группы флавивирусов. J. Simons
et al. (1995), K. Masuko et al. (1996) показали, что вирус HGV
имеет 3 клона — А, В и С. Первые 2 клона выявлены в различных
регионах, GBV-C ассоциируется с хроническим гепатитом. HGV широко
распространен в мире. Передача происходит парентерально. В Западной
Европе уровень HG виремии колеблется в пределах 18-33% у лиц с
насыщенным парентеральным анамнезом, при этом показано, что HGV
может вызвать конфекцию у больных с хроническим гепатитом В (10%)
или С (21%).
Изучение эволюции флавивирусов (Leary T.P. et al., 1996)
позволило отнести их в общую кластерную группу HCV генотипов. В
таблице 23 представлена этиологическая структура вирусных
гепатитов за 1995-1997гг. по Санкт-Петербургу.
Таблица 23. Этиологическая структура вирусных гепатитов
(Виноградова Е.Н., 1998)
|
Этиология
|
% выявления
|
|
Острые вирусные гепатиты
|
|
Гепатит В
|
25
|
|
Гепатит С
|
5,4
|
|
Микст-гепатиты (А, В, С)
|
12,4
|
|
Хронические вирусные гепатиты
|
|
Гепатит В
|
20
|
|
Гепатит С
|
21
|
|
Гепатит ВЧ-С
|
23
|
Среди острых ВГ сохраняет свою актуальность вирусный гепатит В,
составляя 25%, на долю ВГС приходится лишь 5,4%, но особое внимание
привлекают микст формы вирусных гепатитов, частота их выявления
составляет 12,4%. Следует заметить, что ОГВ на фоне ХГС
регистрируются в 28%, а ОГС на фоне ХГВ – выявляется в 80%
случаев.
Вирус гепатита В (HBV) представляет ДНК содержащий гепадновирус
малых размеров с циркулярной двунитевой ДНК. К особенностям этого
вируса относят механизм репликации, наличие в вирионе фермента,
обладающего свойствами обратной транскриптазы. R. Miller и W.
Robinson (1986) указывают на общность ретровирусов и HBV, их единое
происхождение и наличие общих активирующих генов. Оболочка вириона
имеет поверхностный антиген HBsAg, ядерный антиген HBcAg, е-антиген
(HBeAg), вирусную ДНК и ДНК-полимеразу. Существенно, что НВV
способен вызывать персистирующую многолетнюю инфекцию с высокой
концентрацией, вирусов (Aragonf M. et. al, 1987).
Геном HBV имеет 4 открытых рамки считывания: ген С кодирует
полипептид нуклеокапсида со специфичностью HBcAg, ген S — с пре-Sl,
пpe-S2 и S регионами, которые кодируют поверхностные полипептиды.
Ген Р составляет 3/4 генома и перекрывает участок С-гена, весь ген
Б и участок Х-гена, кодируя полипептид, содержащий ДНК-полимеразу.
Существует корреляция между наличием HBeAg в сыворотке крови и
высокой концентрацией вирионов HBV и инфекционностью сыворотки
(Hollinder P. et al., 1990).
При заражении HBV идет одновременно и/или последовательно два
процесса: репликация HBV и интеграция. С репликацией связаны острая
и хроническая формы болезни, с интеграцией – "хроническое
носительство" HBsAg, eгo высокая концентрация в сыворотке крови,
свидетельствуя о возможности продукции HBsAg при отсутствии
репликации HBV (Robinson J., 1995). HBV инфекция, как правило,
протекает в виде безжелтушных или субклинических форм болезни и
выявляется на этапе ХГ у лиц, не имевших в анамнезе острого
гепатита (Hoofnage J. et al., 1980), реже имеет место острый
циклически протекающий гепатит. При этом к маркерам репликации HBV
относят HBeAg, ДНК вируса и ДНК-полимеразу (Hoofnage J., 1980). У
части больных с хроническим гепатитом В не определяется HBeAg или
же HBsAg при наличии активно текущего гепатита, подтверждаемого
вирусной репликацией по ДНК HBV в крови (Соринсон С.Н., 1996;
Hoofnage J. et al., 1987). В этих случаях остро стоит вопрос о
возможности наличия у этих больных либо дефектного, либо особого
штамма вируса гепатита.
HBV инфекции свойственны системные множественные поражения не
столько аутоиммунного, сколько специфического вирусного генеза, и в
таких ситуациях особо необходима комплексная диагностика и
комбинированная адекватная терапия больных.
Вирус гепатита С (HCV) содержит однонитевую РНК и по структуре
своего генома относится к флавивирусам (Brillfnti S. et al., 1991).
Геном BГC имеет две нетранслируемые области (5 NTR и 3 NTR) и ряд
регионов, кодирующих вирус специфическую протезу, несколько
структурных протеинов, включающих нуклеотиды ядра (core) и 2
оболочечных гликопротеида (El, E2/NS1). Последние выявляются в
эндоплазматическом ретикулуме. Возможно, когда идет процессе
протеолитической дезинтеграции во время репликации вируса,
гликопротеиды Е1 и Е2 липидной оболочки ВГС накапливаются в
аппарате Гольджи. Остальные неструктурные протеины также участвуют
в репликации вируса (Cristiano К. et al., 1991), при этом
включаются две вирусные протеазы (NS2 и NS3), а также хеликаза
(NS3) и РНК-полимераза (NS5).
На основании различий нуклеозидных последовательностей в области
NS5P Simmonds (1993) в своей классификации выделяет 76 различных
штаммов вируса, которые составляют б больших групп с 40
подгруппами. Okamoto Y. et al. (1992) также выделяет 6 основных
генотипов, но на основании различий нуклеотидных
последовательностей в области ядра вируса. Клиническая значимость
этих штаммов пока недостаточно изучена, но для отдельных регионов
мира характерна циркуляция различных генотипов вируса (таблица
24).
Таблица 24. Географическое распостранение генотипов вируса
гепатита С
|
Регион
|
Генотип вируса С по классификации
Simmonds и Okomoto
|
|
Европа, США
|
la, 1b
|
I, II
|
|
Япония, Европа
|
2a, 2b
|
III, IV
|
|
Россия, Санкт-Петербург
|
|
I, II
|
|
Египет, Йемен
|
4
|
|
|
Южная Африка
|
5
|
|
|
Гонконг
|
6
|
|
|
Бангладеш и Таиланд
|
3a, 3b
|
V, VI
|
В исследованиях, проведенных в России, антитела к этому вирусу
обнаружены в 3,4 и 1,1% случаев (Мукомолов С.Л., 1994). Среди групп
высокого риска – больных гемофилией и инъекционных наркоманов –
антитела к HCV выявились в 60-70% (Mendenhall С. et al, 1991).
Поданным М. Alter, 1992 (СDC) ожидается ежегодно появление
150000 новых случаев гепатита С. Из них 37500 составят манифестные
формы, приблизительно у 93000 инфицированных заболевание может
прогрессировать до хронического гепатита, а у 30700 - сформируется
цирроз печени.
Парентеральный путь передачи при вирусном гепатите С, по данным
исследователей, в 90% случаев связан с переливанием крови (Seeff
L.B. et al., 1992). Примерно 7% лиц, получавших переливание крови,
приобретают HСV. После внедрения скрининга на антитела к HVC
частота посттрансфузионного гепатита С снизилась до 0,03%.
Общность данных эпидемиологической характеристики, актуальность
практически всех путей передачи определяют значительную частоту
сочетанного развития HCV- и HBV-инфекции. Сочетанная инфекция чаще
регистрируется у лиц, употребляющих наркотики внутривенно.
Значительная распространенность вирусных гепатитов В и С, высокая
степень хронизации процесса, особенно обусловленного вирусом
гепатита С, большой риск развития гепатоклеточной карциномы
обуславливает проведение противовирусной терапии в максимально
ранние сроки.
Среди иммунных механизмов в патогенезе вирусных гепатитов важное
значение имеет дефицит продукции альфа-интерферона, что приводит к
снижению противовирусной защиты и активации вирусной репликации. В
соответствии с общими принципами лечения инфекционных болезней
программа комплексной терапии вирусных гепатитов включает два
основных направления.
Первое, включает в себя назначение специфических противовирусных
препаратов, среди которых широко используются препараты
интерферонов. Вместе с тем показано, что применение этих препаратов
дает временный терапевтический эффект даже при длительном их
применении, а у 50-70% больных отмечается отсутствие эффекта на
введение препаратов интерферона.
При этом многолетние исследования эффективности применения
экзогенного ИФН выявили некоторые недостатки и ограничения,
лимитирующие в ряде случаев использование этих препаратов в
клинике (таблица 25).
Таблица 25. Побочные эффекты интерферонотерапии*
(по Okanue Т., 1996; Fattovich G... 1996)
- Гриппоподобный синдром
- Сахарный диабет
- Заболевания щитовидной железы
- Синдром депрессии
- Аутоиммунный синдром: ревматоидный артрит, волчаночный синдром,
тромбоцитопеническая пурпура
- Угнетение костномозгового кроветворения
- Гемолитическая анемия, лейкопения, тромбоцитопения
- Ишемический колит, мелена
- Сепсис
- Отслоение сетчатки
- Ухудшение слуха
- Импотенция
|
*(Встречаемость синдромов до 1,5%, большинство носят обратимый
характер)
При длительно протекающих заболеваниях, когда ИФН вводится в
организм многократно и в больших концентрациях, образуются
АНТИИНТЕРФЕРОНОВЫЕ АНТИТЕЛА, нейтрализующие экзогенный интерферон,
кроме того, на сегодняшний день лечение препаратами ИФН остается
достаточно дорогим и не всем доступным средством (Ершов Ф.И.,
1996, 1998).
В единичных публикациях последних лет приводятся данные об
использовании противовирусных препаратов, направленных на
подавление репликации вирусов синтетических аналогов нуклеотидов
при гепатите В (ретровир) и С (рибавирин). Перспективным также
представляется использование препаратов ингибиторов протеаз.
Второе направление соответствует патогенетической терапии, которая
является корригирующей, и в процессе ее проведения необходим
динамический контроль над больными.
РЕАМБЕРИН для инфузий обладает дезинтоксикационным,
антигипоксическим,антиоксидантным и гепатопротекторным действием. Препарат улучшает дезинтоксикационную
функцию печени, способствуя процессам репаративной регенерации
гепатоцитов.
РЕАМБЕРИН активирует антиоксидантную систему
ферментативного звена, снижая при этом процессы перекисного
окисления липидов, обладая мембраностабилизирующим
действием.
Спектр применения препарата в клинической практике довольно
широк. Наряду с использованием его в гепатологической практике в
комплексной терапии различных клинических форм вирусных гепатитов,
возможно также применение его с дезинтоксикационной целью и с целью
коррекции гипоксических состояний различного генеза.
РЕАМБЕРИН улучшает микроциркуляцию и реологические свойства
крови: за счет повышения осмотического давления крови, наблюдается
отток жидкости и токсинов из тканей в кровь; при этом наблюдается
усиление обмена веществ, стимуляция диуреза, выведение токсинов из
организма. Препарат оказывает мембраностабилизирующее действие на
клетки печени.
Целью настоящего исследования явилась оценка
клинико-лабораторной эффективности использования препарата
РЕАМБЕРИН в комплексной терапии больных различными клиническими
формами вирусных гепатитов с гемоконтактным механизмом передачи
(ОГС, ХГС, ОГВ, ХГВ и микст-гепатитов).
В контролируемых условиях гепатологического отделения
(клиническое отделение кафедры инфекционных болезней
Санкт-Петербургской медицинской академии им. И.И. Мечникова)
проводилось лечение больных с различными формами вирусных
гепатитов.
Из них: больных острым вирусным гепатитом С было 38 человек,
хроническим вирусным гепатитом С — 32 человека, острой формой микст
гепатита В+С — 27 человек, вирусным гепатитом В+С — 23 человека, а
также больных, переносящих острую форму вирусного гепатита В — 25
человек. Из числа обследованных больных были мужчины в возрасте от
16 до 40 лет, а женщины в возрасте 30-37 лет; 17 человек
употребляли наркотики в инъекционной форме и имели стаж наркомании
от 6 месяцев до 3-х и более лет.
Все пациенты, регулярно и длительно употребляющие наркотики,
имели симптомы психической и физической зависимости, а так как
практически все вводили технический героин, то поражение печени
было вызвано не только вирусами, но и токсическим агентом.
Хронического алкоголизма не было выявлено ни у одного из
обследованных. Пятеро больных имели различные сопутствующие
заболевания: хронический холецистит и дискинезию ЖВП, также
наблюдались больные с заболеваниями сердечно-сосудистой и
дыхательной систем.
Обследование работали на промышленных предприятиях или являлись
учащимися техникумов и ВУЗов, а 10 - не имели постоянной работы,
однако в качестве официальных безработных зарегистрированы не
были.
Для проведения настоящего исследования больные разделены на 2
группы : опытная (145 человек) и контрольная (19 человек).
Пациентам опытной группы методом случайной выборки назначался
РЕАМБЕРИН в суточной дозе 200-400 мл. раствора в течение 7-10 дней
в зависимости от формы и тяжести заболевания. Больные контрольной
группы получали базисную терапию по общепринятой схеме. Пациенты
обеих групп были идентичны по полу, возрасту и наличию
сопутствующих заболеваний. Больные поступали в стационар в среднем
на 5-6-й день от начала заболевания.
Лечение больных опытной группы начиналось на 2-4-й день от
момента поступления в стационар после получения результатов
вирусологического обследования и уточнения этиологического вида
гепатита и его клинической формы.
Все больные кроме терапии и диеты N5 получали препарата
РЕАМБЕРИН внутривенно в суточной дозе 200-400 мл раствора в течение
7-10 дней.
Больные, поступающие в гепатологическое отделение, обследовались
по общепринятой методике. Диагноз вирусного гепатита ставился на
основе клинических, эпидемиологических данных и подтверждался
определением маркеров НВ- и НС-вирусной инфекции. Для индикации
HCV-РНК использовался метод полимеразной цепной реакции. У всех
больных производилось определение билирубина в сыворотке крови
методом Иендрашика, АлАТ и АсАТ, коллоидных проб печени, отдельных
фракций белка, холестерина, щелочной фосфатазы. В ходе работы: до
лечения, на фоне терапии, а также после проведения курса Реамберина
и базисной терапии производилось определение уровня SH-SS и
коэффициента SH/SS для выяснения уровня антиоксидантной защиты и
влияния на нее изучаемого препарата. Уровень сульфгидрильных групп
определялся методом амперометрического титрования нитратом серебра
в модификации В. В. Соколовского (1979). Для определения уровня
SH-групп у здоровых лиц обследовано 40 доноров крови, у которых
этот показатель составил 500,0±44,8 мкмоль/л. Таблица 26.
Клинические проявления периода разгара заболевания
соответствовали варианту течения гепатита. Так, преджелтушный
период у абсолютного большинства больных ОГС протекал по
бессимптомному типу, а период разгара характеризовался умеренно
выраженной интоксикацией, оцененной в 1-2 балла. Пациенты ХГС, как
правило, не указывали на перенесение вирусного гепатита, и диагноз
хронического вирусного гепатита был установлен впервые. Лица с
микст инфекцией в 45% случаев отмечали наличие вирусного гепатита в
анамнезе, а 5 человек перенесли, по-видимому, клинически
бессимптомную форму острого вирусного гепатита В и С.
При изучении данных биохимического исследования установлено, что
ОВГС у 75% больных протекал с желтухой, уровень билирубина
колебался от 231 мкмоль/ л до 160 мкмоль/л. Два пациента переносили
безжелтушную форму заболевания. Уровень АлАТ значительно превышал
показатель здоровых лиц и находился в пределах 3992 ЕД/л - 1189
ЕД/л. Ни у одного пациента не было изменений коллоидных проб
печени (таблица 27).
Таблица 28. Максимальные значения биохимических
показателей
у больных хроническим гепатитом
|
Диагноз
|
Били-
рубин
|
Суле-
мовый
титр
|
Тимо-
ловая
проба
|
АлАТ
|
АсАТ
|
ПЦР "+"
|
|
ХВГС
|
50,0
|
2,36
|
4,95
|
220,0
|
106,5
|
+
|
В течение всего периода наблюдения в опытной группе больных
учитывалась динамика объективных признаков заболевания, проводились
общие клинические анализы крови, мочи, анализы крови на
ВИЧ-инфекцию, RW.
В качестве критериев оценки функциональной способности печени
использовались показатели содержания в крови общего билирубина и
его фракций, активность АлАТ, АсАТ, протеинограмма сыворотки
крови. Кроме того, электрохимическим методом определялась
активность тиоловых антиоксидантов, характеризующих уровень
неспецифической резистентности организма. Исследования показали,
что у 85% обследованных больных, принимавших РЕАМБЕРИН,
наблюдалось достоверное увеличение количества SH-групп в сыворотке
крови в среднем на 40%, а у 10% обследованных больных наблюдалось
снижение количества SH-групп на 8-10%. Современные представления о
роли тиоловых антиоксидантов в системе неспецифической защиты
организма позволяют говорить о прогностическом значений состояния
тиолсульфидного обмена.
Таким образом, определение SH-групп может быть использовано
для изучения эффективности препаратов, направленных на повышение
неспецифической защиты организма. Более того, опыт показывает, что
реакция системы антиоксидантной защиты может быть как
кратковременной, так и отдаленной.
Примером этому могут служить результаты, полученные при
исследования тиол-дисульфидного обмена у больных вирусным
гепатитом, получавших внутривенно РЕАМБЕРИН. Таблица 29.
Как видно из таблицы значения показателей тиол-дисульфидного
равновесия количества SH- групп и "К SH/SS" в процессе терапии
препаратом Реамберин достоверно повышаются, что полностью
согласуется с положительной динамикой состояния больного.
В процессе проведения клинических исследований осуществлялось
повседневное наблюдение за больными с определением характера
изменений клинических показателей и учетом переносимости больным
препаратов. Следует отметить, что у части больных отмечались
индивидуальные реакции на введение Реамберина в виде тошноты,
тахикардии, гиперемии лица и головокружения. Однако при уменьшении
концентрации раствора путем разбавления препарата 0,9% раствором
NaCl и при уменьшении скорости внутривенного введения указанные
явления исчезали полностью.
На фоне лечения Реамберином отмечалось улучшение общего
самочувствия больных, снижались интоксикационные проявления и у
80% больных к 5-6 дню от начала лечения улучшалось
настроение, повышалось качество жизни и исчезали диспептические
расстройства.
У больных вирусным гепатитом С, получавших Реамберин
внутривенно к 8-10 дню от начала приема практически исчезала
желтуха (значения общего билирубина составили 52,2+1,2 мкм/л по
сравнению с исходными значениями 231,0+1,4 мкм/л), а также
наблюдалась положительная динамика в нормализации размеров печени
(у 87,6% против 60%). Нарушение пигментного обмена
восстанавливалось быстрее при введении Реамберина (р<0,01) в
сравнении с группой больных, находящихся на симптоматической
терапия. При изучении влияния Реамберина на биохимические
показатели в процессе терапии у больных вирусным гепатитом С
обращает внимание достаточно выраженная положительная динамика
параметров АлАТ, билирубина, а также SH-, SS-групп.
Следует
отметить, что у больных с микст вирусной инфекцией нормализация
уровня АлАТ наступала несколько медленнее, клинические показатели
сохранились на исходном уровне несколько дольше по сравнению с
острой формой вирусного гепатита.
Таким образом, при НСV-инфекции в группе леченных Реамберином
быстрее происходила нормализация клинических показателей и была
более отчетливая положительная динамика биохимических показателей
по сравнению с больными, переносившими микст-инфекцию. Таблица 30.
Таблица 31. Таблица 32.
Таблица 33.
В таблице 34 представлены показатели щелочной фосфатазы в
динамике наблюдений; щелочная фосфатаза – основной внутриклеточный
фермент печени, характеризующий гепатопротекторные свойства
препарата.
Показатели изменения креатинина в динамике лечения Реамберином
свидетельствуют о достаточно четком дезинтоксикационном эффекте
препарата.
Показатели неспецифического иммунного ответа у больных, получавших РЕАМБЕРИН представлены в таблице 35
Под влиянием Реамберина у больных, переносящих вирусный гепатит,
отмечалась положительная динамика, проявляющаяся в нарастании
сниженных показателей и нормализация высоких показателей (ФИ – в
опытной группе составил 7,1 против 21,0, а в контрольной группе
показатель составил 17,3 и 14,3). НСТ-тест у больных, получавших
Реамберин, в динамике наблюдения составил 17,0 и 9,2%, а в контроле
- 14,0 и 16,2%.
Таблица 36. Показатели эндогенной интоксикации
|
Показатели
|
Исходный фон
|
Группа больных
|
|
Основная
по окончании лечения
|
Контрольная
по окончании лечения
|
|
Индекс интоксикации плазмы
|
84,6
|
21,4
-62.2
|
29,7
-549
|
|
Катаболический пул (у.е.)
|
19,7
|
12,4
-7.3
|
16,3
-3.4
|
|
Олигопептиды
|
1749
|
860
-889
|
1534
-215
|
Как видно из представленных в таблицах 30-36 данных отмечена
положительная динамика в изменениях изучаемых показателей больных,
получавших Реамберин.
В результате проведенного исследования установлена
эффективность препарата в качестве дезинтоксикационного,
антиоксидативного средства; отсутствие побочных эффектов и
аллергических реакций делают применение препарата при вирусных
поражениях печени перспективным.
Таким образом, у подавляющего числа больных (более 80%) на
5-6 день от начала лечения препаратом Реамберин отмечалось
улучшение самочувствия, повышение общего тонуса, исчезновение
диспептических явлений, улучшение настроения. У 12% обследованных
больных введение Реамберина не оказало существенного влияния на
динамику клинических показателей; у больных опытной группы
достоверно чаще, чем в контрольной, наблюдались положительная
динамика уменьшения размеров печени и купирование желтухи. К
моменту выписки больного из стационара нормализация размеров печени
наступала у 45% обследованных. Все пациенты, получавшие базисную
терапию, выписаны с явлениями гепатомегалии: среди биохимических
показателей отмечена наиболее существенная положительная динамика
под влиянием лечения Реамберином в отношении уровня общего
билирубина, АлАТ и SH-групп в сыворотке крови, показатели которых
снижались более выражено по сравнению с контролем.
На основании результатов изучения препарата Реамберин можно
придти к заключению, что этот препарат целесообразно рекомендовать
для применения с лечебной целью при:
- острых вирусных гепатитах В и С, протекающих на фоне
токсического поражения печени;
- хронических вирусных гепатитах В и С;
- сочетанных формах НВ и НС-вирусной инфекции;
- на фоне сопутствующей патологии почек и сердечно-сосудистой
системы.
Рекомендуемая суточная доза препарата Реамберин – 200-400
мл в течение 2-10дней в зависимости от формы
заболевания.
Реамберин может быть использован в качестве
дезинтоксикационного средства перед назначением специфической
противовирусной терапии больным с различными клиническими формами
вирусных гепатитов, включая микст формы.
- Реамберин проявляет гепатопротекторные свойства, что
подтверждено динамикой внутриклеточного фермента печени –
щелочной фосфатазы
- Антиоксидантная активность препарата доказана изменением
показателей антиоксидантной системы (общими, небелковыми,
белковыми).
- Дезинтоксикационные свойства препарата подтверждены
показателями эндогенной интоксикации.
Понятие интоксикации при хроническом вирусном гепатите - сугубо
клиническое. Оно соответствует клиническим проявлениям организма
на накопление и циркуляцию токсинов. В отличие, например, от
желтухи, интенсивность которой в значительной мере соответствует
уровню гипербилирубинемии, степень выраженности токсикоза при
безжелтушных формах можно оценить только клинически. В инфекционной
клинике учет синдрома интоксикации традиционно служит важнейшим
критерием характеристики состояния больных и оценки тяжести
болезни.
Наличие и степень выраженности синдрома интоксикации
обосновывают детальным анализом жалоб больных (слабость,
потливость, повышенная утомляемость, отсутствие аппетита,
подташнивание, рвота, головные боли, головокружение, "мушки" перед
глазами, нарушение сна). Информативны угнетенное состояние,
вялость, адинамия, лабильность настроения. Такая практика
способствовала более объективному разграничению тяжелых и
среднетяжелых и легких форм гепатита. Интоксикация достигает
наибольшей степени выраженности при фульминантной форме вирусных
гепатитов. При тяжелом течении одновременно с синдромом
интоксикации наблюдаются мелкие единичные кровоизлияния в кожу и
конъюнктиву, кровоточивость десен, необильные носовые, маточные
кровотечения, макрогематурия. Их выявление всегда требует расспроса
больных и детального осмотра кожи и слизистых оболочек,
исследования мочи. Редко отмечаются признаки диапедезного
кишечного кровотечения. В диагностике синдрома интоксикации важны
также результаты эндотелиальных функциональных проб (симптомы
"щипка", "жгута"). При легкой форме гепатита любые клинические
признаки синдрома интоксикации, как правило, отсутствуют.
Определенные факторы (злоупотребление алкоголем, наркоманией;
беременность, сопутствующие заболевания) потенциально могут
способствовать более тяжелому течению синдрома интоксикации при
вирусных гепатитах.
В настоящее, время для эффективной терапии синдрома интоксикации
при вирусных гепатитах ведется поиск препаратов, обладающих помимо
дезинтоксицирующего также антигипоксическим, антиоксидантным и
гепатопротективным действием. Дезинтоксицирующая терапия при
хронических вирусных гепатитах является важным этапом лечения,
направленным на подготовку к интенсивной противовирусной терапии,
а при циррозе, к интенсивной гепатопротекторной терапии.
Материалы и методы
Под наблюдением находилось 44 больных, страдающих хроническим
заболеванием печени с синдромом интоксикации; средний возраст
составил 49±9 лет. Группы больных: 1-я группа: n=11 – больные
хроническим вирусным гепатитом (ХВГ) с минимальной степенью
активности; 2-я группа: n=11 – больные ХВГ с умеренно выраженной
активностью; 3-я группа: n=11 – больные ХВГ на стадии формирования
цирроза печени; 4-я группа: n=11 – больные первичным билиарным
циррозом печени.
В контрольные группы были подобраны пациенты с близкими
клинико-лабораторными показателями.
Диагноз верифицировался вирусологически: определялись HBsAg,
анти-HBeAb, HBeAg, анти-НВсоrАВ, анти-НСVАв проводилась
гепатобиопсия. Перед назначением препарата и в динамике
оценивались: общее состояние пациента и ряд клинически значимых
лабораторных показателей – ионный состав и биохимические показатели
крови, клинический анализ крови, иммунограмма (оценивалось
количество лимфоцитов и их субпопуляции методом моноклональных
антител), показатели интерферонового статуса (сывороточный
интерферон (ИНФ), индуцированная продукция ИНФ-±/І, ИНФ-і),
определялась функциональная активность моноцитов в (НСТ-тесте),
коагулограмма, определялся индекс эндогенной интоксикации.
Схема введения препарата: реамберин 1,5% 400 мл использовался в
инфузионной терапии больных хроническими вирусными гепатитами
(ХВГ) В и С на разных стадиях заболевания, включая цирротичеcкую
стадию ХВГ, а также у больных жировым гепатозом, первичным
билиарным циррозом печени. Препарат вводился один раз в сутки по
400 мл внутривенно капельно ежедневно, 10 флаконов на курс.
Базисная терапия (БТ) в группах сравнения включала: 400 мл. 0,9%
раствора натрия хлорида в сутки, гепатопротекторы, витамины группы
В в течение 10 дней.
РЕЗУЛЬТАТЫ ПРИМЕНЕНИЯ РЕАМБЕРИНА
Применение Реамберина в инфузионной терапии интоксикации больных
хроническими заболеваниями печени приводило к более быстрому
уменьшению проявлений астеновегетативного синдрома. Уже после
первого дня инфузионной терапии у подавляющего большинства
пациентов улучшалось самочувствие, прекращалась тошнота,
головокружение и головные боли, появлялся аппетит. Дальнейшая
инфузионная терапия Реамберином улучшила субъективные показатели
самочувствия пациентов – больные чувствовали бодрость и прилив
сил, нормализовался сон.
При проведении дезинтоксикационной терапии раствором натрия
хлорида в группе сравнения субъективные признаки отсутствия явной
интоксикации больные отмечали значительно позже – только на 3-4
день лечения.
В дальнейшем детальному обсуждению будут подвергаться
лабораторные показатели со значимой динамикой в процессе
инфузионной дезинтоксикационной терапии при хронических
заболеваниях печени.
Применение препарата благоприятно отразилось на показателях
периферической крови: наблюдалось повышение абсолютного количества
лимфоцитов (НСТ-тест) (рис. 6).
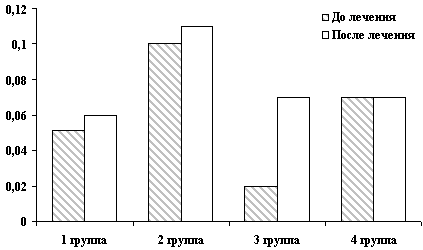
Рис. 5. Значения абсолютного количества лимфоцитов
в динамике в исследуемых групп больных
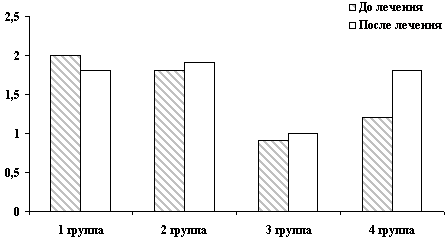
Рис. 6. Изменение функциональной активности моноцитов
в исследуемых группах больных.
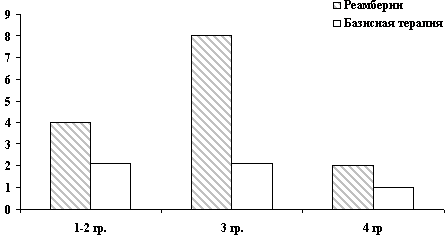
Рис. 7. Активность АлАТ
при инфузионной терапии
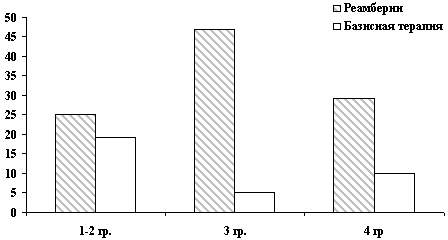
Рис. 8. Активность АсАТ
при инфузионной терапии
Уменьшение активности аминотрансфераз в группе больных ХВГ с
умеренной и выраженной активностью было более существенным у
больных, в схему лечения которых входил Реамберин. В группе
больных ХВГ на стадии цирроза печени и больных первичным билиарным
циррозом печени также наблюдалась положительная динамика АлАТ, АсАТ
по сравнению с группой больных, получавших базисную терапию (Таблица 37). Изменения реологических свойств крови на фоне терапии
Реамберином имеют неоднозначный характер: у больных ХВГ с
минимальной активностью и больных билиарным циррозом печени не
наблюдалось изменений, у больных с ХВГ с умеренной и выраженной
активностью, фиброзированием и у больных ХВГ на стадии цирроза
печени наблюдалась тенденция к гипокоагуляции, выражающаяся
снижением протромбинового индекса с 84,3 до 72,6% (р<0,05),
удлинением протромбинового времени с 15,6 с до 17,2 с (р<0,05);
увеличением времени образования сгустка крови с 5 мин 41 с до 6
мин 9 с (р<0,05), повышением фибринолитической активности.
Наблюдаемая гипокоагуляция устранялась изменением схемы лечения
Реамберином: препарат назначался через день в той же дозе.
Использование Реамберина через день в терапии больных ХВГ с
умеренной активностью приводило к повышению показателей
протромбинового индекса, уменьшению протромбинового времени,
времени образования сгустка крови.
Приведенные данные свидетельствуют о дисбалансе системы ИФН при
всех формах ХЗП (таблица 38): отмечается повышение сывороточного ИФН и снижение
индуцированной in vitro продукции ИФН-α/β и ИФН-γl; по сравнению с
нормой, свидетельствуя о высоком уровне интоксикации. Наиболее
существенный дисбаланс системы ИФН наблюдался у больных ХВГ на
стадии цирроза печени. На фоне проводимой терапии Реамберином в 47%
случаев наблюдалось достоверное снижение сывороточного ИФН с
(27,3±1,02 до 18,1±0,83) МЕ/мл, р<0,05, сопровождающееся
тенденцией к повышению продукции ИФН- α/β, что свидетельствует о
снижении уровня интоксикации организма. У 34% больных (ХВГ
минимальной, выраженной степенью активности, больных
первичнымбилиарным циррозом печени) на фоне терапии повышались
показатели CD3+, CD4+, CD8+ЛФ, хотя исходно эти показатели
находились на нижней границе нормы (рис. 9).
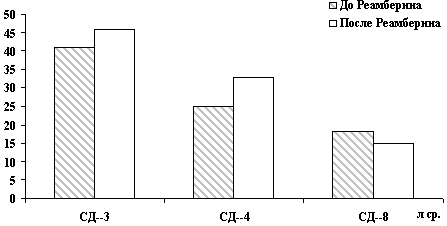
Рис. 9. Изменение иммунологических показателей у больных ХВГ
минимальной и умеренной активности после терапии Реамберином
В группе больных с хроническим вирусным гепатитом (таблицы 39,
40) минимальной и умеренной активности при интоксикации до
инфузионной терапии Реамберином наблюдался высокий уровень молекул
средней массы и олигопептидов в плазме крови. После инфузий
Реамберина нормализация индекса интоксикации плазмы наблюдалась к
10 дню терапии. В группе с базисной терапией динамика снижения
уровня индекса интоксикации организма была меньше. Этот эффект на
фоне лечения Реамберином, очевидно, связан как с усилением
выведения токсинов засчет увеличения ОЦК и стимуляции
диуреза, так и за счет активации метаболизирующей активности печени
под действием янтарной кислоты. Характерно, что в группах с
интоксикацией на фоне цирроза печени динамика снижения молекул
средней массы, олигопептидов и самого индекса эндогенной
интоксикации имела сопоставимый уровень, что, очевидно, связано с
уменьшением метаболизирующей функции печени за счет разрастания
фиброзной ткани при циррозе и получения детоксицирующего эффекта в
большей степени за счет стимуляции диуреза.
Таблица 39. Показатели эндогенной интоксикации в группах ХВГ
|
Показатели интоксикации
|
Группы больных
|
|
Группа с Реамберином, (n=22)
|
Группа с базисной терапией, (n=22)
|
|
А
|
Б
|
А
|
Б
|
|
Молекулы средней массы, у.е.
|
31,8±4,3
|
24,9±1,9*
|
34,5±8,3
|
32,7±1,2
|
|
Олегопептиды, мг/л
|
1510±87
|
345±10*
|
1640±160
|
1080±110
|
|
Индекс эндогенной интоксикации по Малаховой
|
51,2±0,3
|
20,1±0,1
|
58,6±0,4
|
38,2±0,7
|
Обозначения:
А - до исследования;
Б - 10-е сутки.
Таблица 40. Показатели эндогенной интоксикации в группе
с предциррозной формой ХВГ и циррозом печени
|
Показатели
интоксикации
|
Группы больных
|
|
Группа с Реамберином
(n=22)
|
Группа с базисной терапией, (n=22)
|
|
А
|
Б
|
А
|
Б
|
|
Молекулы средней массы, у.е.
|
45,8±5,1
|
39,6±1,9*
|
54,5±9,1
|
4б,7±1,2
|
|
Олегопептиды, мг/л
|
1671±96
|
v1545±12*
|
1640±123
|
1610±110
|
|
Индекс эндогенной интоксикации по Малаховой
|
66,9±0,3
|
40,8±0,1
|
68,6±0,4
|
45,2±0,7
|
Обозначения:
А - до исследования;
Б - 10-е сутки.
Примечание: * – достоверно Р<0,05
Таким образом, Реамберин, обладая дезинтоксикационным действием
при хронических заболеваниях печени, способствует снижению
цитолиза и эндогенной интоксикации.