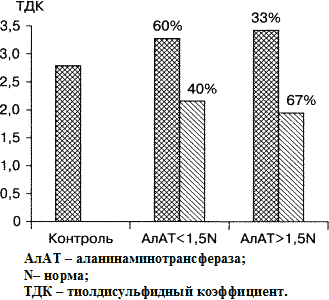
Рис.1. ТДК белковых соединений у больных ХВГ
в зависимости от наличия цитолитического синдрома.
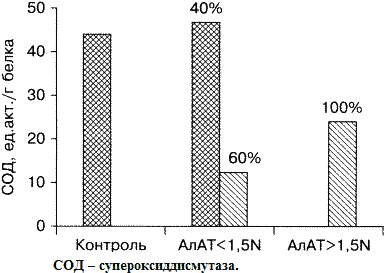
Рис.2. Показатели активности СОД у больных ХВГ
в зависимости от наличия цитолитического синдрома.
Источник:
журнал «Терапевтический архив», 2011, №2, С.1-4
1Кафедра внутренних болезней
с курсом терапии и нефрологии ФПК ГОУ ВПО СПбГМА им. И.И. Мечникова,
Гепатобилиарный центр СЗФО Санкт-Петербург;
2Институт высоких медицинских технологий медицинского факультета СПбГУ,
Санкт-Петербург
В.В. Стельмах1, В.Г. Радченко1, В.К. Козлов2
Сведения об авторах:
Радченко Валерий Григорьевич – д-р мед. наук, проф., зав. каф. внутренних болезней с курсом терапии и нефрологии ФПК ГОУ ВПО СПбГМА
им. И.И. Мечникова, дир. Гепатобилиарного центра СЗФО, Санкт-Петербург
Козлов Виктор Константинович – д-р мед. наук, проф., каф. внутренних болезней с курсом терапии и нефрологии ФПК ГОУ ВПО СПбГМА
им. И.И. Мечникова, Ин-т высоких медицинских технологий медицинского факультета СПбГУ, каф. клинической лабораторной диагностики ГОУ ДПО СПбМАПО, каф. микробиологии, иммунологии и инфекционных болезней университета им. Ярослава Мудрого г. В. Новгород
Стельмах Виктория Валерьевна – канд. мед. наук, каф. внутренних болезней с курсом терапии и нефрологии ФПК ГОУ ВПО СПбГМА им. И.И. Мечникова, Гепатобилиарный центр СЗФО, Санкт-Петербург
При хронических вирусных гепатитах (ХВГ) наблюдается длительная активация системы мононуклеарных фагоцитов, сопровождающаяся гиперпродукцией активных форм кислорода, что следует рассматривать в качестве факторов риска развития антиоксидантной недостаточности, которая во многом определяет характер и тяжесть течения заболевания. В настоящее время в гепатологии все больше находят применение лекарственные препараты, оказывающие антиоксидантное, цитопротективное действие.
Обзор содержит результаты многочисленных отечественных клинических исследований по оценке эффективности метаболических корректоров на основе янтарной кислоты (реамберин, ремаксол) как средств патогенетической терапии при ХВГ. Использование препаратов метаболических корректоров в комплексной терапии у больных ХВГ способствует улучшению основных клинико-лабораторных показателей; увеличивает эффективность базисной терапии; корректирует недостаточность системы антиоксидантной защиты. Результаты исследований подтверждают преимущество применения лекарственных средств с антигипоксантными свойствами по сравнению с традиционной инфузионной терапией для лечения больных с ХВГ.
СОДЕРЖАНИЕ
|
1. Введение
|
|
АлАТ – аланинаминотрансфераза |
Заболевания печени остаются серьезной социально-экономической и клинико-эпидемиологической проблемой здравоохранения всех стран мира, занимая значительное место в структуре заболеваний органов пищеварения. По данным ВОЗ, в мире насчитывается более 2 млрд людей с признаками текущей или завершившейся инфекции вирусом гепатита В, более 170 млн больных хроническим гепатитом С. Летальность, обусловленная последствиями цирротической стадии хронических заболеваний печени (ХЗП), такими как декомпенсированная печеночная недостаточность, гепатоцеллюлярная карцинома (ГЦК), по-прежнему остается высокой, унося ежегодно около 1 млн человеческих жизней [1, 2].
В настоящее время при определении общей стратегии и тактики лечения больных хроническими вирусными гепатитами (ХВГ) основное внимание уделяют этиологическому направлению лечения для достижения максимальной эффективности противовирусной терапии [3-6]. Патогенетическое направление возможных лекарственных воздействий при ХВГ остается без должного внимания. Хотя очевидно, что при лечении инфицированных HCV и HBV должен оставаться незыблемым основной принцип терапии инфекционных заболеваний – комплексность и общая этиопатогенетическая направленность лечебных воздействий.
Противовирусная терапия направлена на элиминацию гепатотропных вирусов из организма больного, однако эрадикация вирусов не всегда достижима. Приходится констатировать, что даже применение современных противовирусных схем с использованием препаратов рекомбинантных интерферонов с улучшенными фармакокинетическими свойствами не позволяет вылечить всю инфицированную вирусами популяцию больных с ХЗП. Тем не менее важно предотвратить прогрессирование заболевания (стабилизировать или улучшить гистологическую картину и функции печени) для профилактики осложнений портальной гипертензии и предотвращения развития ГЦК [7-9].
Трудности в проведении стандартной противовирусной терапии, основанной на длительном применении препаратов интерферона-±, аналогов нуклеотидов, обусловлены многочисленными и зависимыми от дозы побочными реакциями в связи с нейро-, гепато- и кардиотоксическим действием, по причине которых 5% больных отказываются от лечения в начале курса противовирусной терапии, а 20% не доводят его до конца [10-13].
Если учитывать разнообразие патологических процессов и их последствия на региональном уровне (в печеночной ткани) и на уровне всего организма при ХВГ, а также обилие побочных эффектов используемых противовирусных препаратов, то становятся очевидными издержки увлечения противовирусными средствами и ошибочность тактики выстраивания терапии лишь на основании этиологической направленности [14].
Рациональное лечение больных с латентными и клинически проявляющимися формами гемоконтактных вирусных гепатитов предполагает необходимость воздействия на все составляющие инфекционного процесса:
В последние годы выявлена взаимосвязь процессов свободнорадикального окисления липидов клеточных мембран и повреждения клеток печени [15, 16]. В патогенезе синдрома цитолиза важная роль отводится свободнорадикальным процессам (рис. 1, 2). Изменения в окислительно-восстановительном гомеостазе тиолдисульфидной системы, оцениваемые ТДК, свидетельствуют о нарушениях в тиоловом звене как белковой, так и низкомолекулярной фракций сыворотки крови [17, 18].

Рис.1. ТДК белковых соединений у больных ХВГ
в зависимости от наличия цитолитического синдрома.

Рис.2. Показатели активности СОД у больных ХВГ
в зависимости от наличия цитолитического синдрома.
По данным экспериментальных и клинических исследований, рост числа признаков мезенхимального воспаления в печени, а также выраженность печеночно-клеточной недостаточности ассоциируются с дисфункцией системы мононуклеарных фагоцитов. Основными проявлениями этой дисфункции служат резкое повышение уровня провоспалительных цитокинов, истощение ферментного и субстратного звеньев антиоксидантной системы (АОС) сыворотки крови, дисбаланс системы интерферона и другие признаки вторичной иммунной недостаточности, которые определяют патогенез и факторы неэффективности этиотропной терапии [19, 20).
Функционирование ряда АОС напрямую зависит от уровня восстановленного глутатиона в клетке и общего фонда восстановительных эквивалентов НАДН и НАДФН. По этой причине наиболее эффективным путем коррекции гипоксических нарушений в тканях является комплексная активация дыхательной цепи, включающая активацию альтернативного сукцинатоксидазного окисления путем повышения активности сукцинатдегидрогеназы; улучшение проникновения экзогенного сукцината в митохондрии клеток; стимуляцию зависимого от НАД окисления; подавление образования свободных радикалов в клетке [21-23].
На различных экспериментальных моделях гипоксии установлено действие янтарной кислоты (сукцината) как субстратного антигипоксанта и протектора клеточных мембран.
Универсальными подходами патогенетической терапии при ХЗП является применение средств восстановления энергетического потенциала клеток в условиях тканевой гипоксии; средств защиты клеточных мембран от факторов свободнорадикального окисления; средств индуктивной и заместительной иммунокоррекции [24, 25]. Ниже представлены препараты для патогенетической терапии ХВГ.
Антиоксиданты: витамины А, Е, С
Антигипоксанты: реамберин, ремаксол, глутоксим
Антифибротические препараты: колхицин
Иммуноактивные препараты: тиопоэтины, рекомбинантные белки, индукторы интерфероногенеза
Препараты желчных кислот: УДХК, ХДХК.
Глюкокортикостероиды: преднизолон
Цитостатики: азатиоприн, циклофосфан
Гепатопротекторы: эссенциале, гептрал, ремаксол, гепамерц, карсил и др.
Методы экстракорпоральной коррекции: плазмаферез, эритроцитаферез, криоплазмосорбция.
Коррекция нарушений в функционировании АОС организма с помощью препаратов антиоксидантного типа действия – одно из перспективных направлений нормализации метаболизма клеток. Она способствует восстановлению функциональной активности различных клеток, включая гепатоциты и клетки системы мононуклеарных фагоцитов печени [26, 27].
Данные многочисленных отечественных исследователей обосновывают необходимость дополнения этиопатогенетической терапии у больных ХВГ средствами метаболической коррекции. По совокупности фармакологических эффектов препаратами выбора для эффективной коррекции патогенетически значимых нарушений метаболизма клеток являются метаболические средства с антигипоксическим и антиоксидантным механизмами действия – препараты на основе янтарной кислоты [28].
Среди зарегистрированных лекарственных средств, применяемых в гепатологии, которые имеют в составе янтарную кислоту в качестве основного компонента, имеются разработанные ООО "НТФФ "Полисан" (Санкт-Петербург) хорошо известный клиницистам препарат реамберин, вошедший в перечень необходимых и жизненно важных лекарственных средств (№ 1938-р от 11.11.2010 г.), и новый комбинированный метаболический корректор ремаксол, представляющий собой композицию: янтарной кислоты – 5,28 г, рибоксина (инозина) – 2,0 г, метионина – 0,75 г, никотинамида – 0,25 г.
Активным веществом препаратов является янтарная кислота, оказывающая прямое модифицирующее воздействие на клеточный метаболизм. Благодаря этому активируется аэробный гликолиз, а в условиях гипоксии увеличивается интенсивность окислительных процессов в цикле Кребса, возрастает внутриклеточный фонд макроэргических соединений (АТФ и креатин-фосфата), обеспечивается переход глюкозы в гликоген, стабилизируется липидный обмен, повышается активность ферментов первой линии свободнорадикальной защиты (СОД и каталаза), стабилизируется уровень восстановленной части тиолдисульфидной АОС, что способствует снижению активности аминотрансфераз.
В экспериментах на моделях гипоксии получены данные, свидетельствующие о противогипоксической активности реамберина, в частности о его защитном эффекте по отношению к системе микросомальных ферментов печени при отравлении высокотоксичными ксенобиотиками. Отмечен значимый клинический эффект реамберина как дезинтоксикационного средства у больных ХВГ и пациентов с синдромом полиорганной недостаточности [29]. Результаты проведенных исследований продемонстрировали высокую эффективность препарата реамберин как дополнительного средства в составе комплексной терапии при ХВГ [18, 24, 25].
Следует отметить положительное влияние препарата на цитокинпродуцирующую функцию макрофагов, что особенно важно на цирротической стадии заболевания, когда циркулирующие моноциты, а также резидентные макрофаги печени становятся основными генераторами провоспалительных цитокинов, поддерживая хроническое воспаление в печени и обусловливая системные реакции организма (рис. 3) [27]. Реамберин оптимизирует реакцию АОС: у большинства исследуемых больных наблюдалось повышение тиолдисульфидного коэффициента (ТДК) белковых фракций крови, показателей СОД после курса терапии, что свидетельствовало об активном включении данных механизмов в ограничение стадии инициирования свободнорадикального окисления (рис. 4) [27].
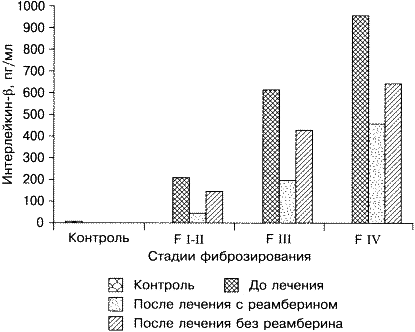
Рис. 3. Динамика уровней интерлейкина-lβ в сыворотке крови
у больных ХВГ на фоне инфузионной терапии реамберином
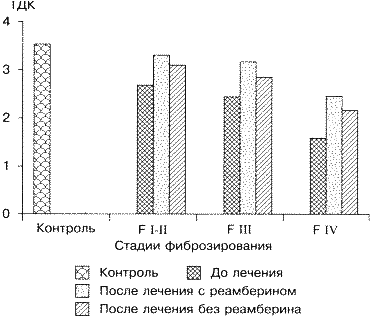
Рис. 4. Влияние реамберина на ТДК белковых фракций крови
у больных ХВГ
Дополнение схем противовирусной терапии курсовым назначением инфузионной терапии реамберином увеличивает общую эффективность лечения и уменьшает побочные эффекты интерферонотерапии [30]. В условиях подобной комплексной терапии восстанавливается чувствительность к противовирусным препаратам группы интерферонов, достигается иммуно-корригирующий эффект (рис. 5).

Рис. 5. Иммунокорригирующий эффект реамберина
у больных ХВГ (по абсолютному числу лимфоцитов)
Ремаксол как гепатопротектор, прошедший полный этап доклинического изучения и клинического исследования, рекомендованный к применению в практическом здравоохранении при нарушении функциональной активности печени, проявил себя как препарат антитоксического, антихолестатического и мембраностабилизирующего действия [31, 32].
Ремаксол представляет собой уникальную метаболическую композицию благодаря входящему в его состав наряду с янтарной кислотой метионина (0,75 г). S-аденозил-L-метионин участвует в биохимических реакциях 3 типов:
Препарат не только активизирует окислительно-восстановительные процессы в гепатоцитах, снижая цитолиз (активность АлАТ, аспартатаминотрансферазы – АсАТ и лактатдегидрогеназы – ЛДГ), но и способствует уменьшению проявлений холестаза (γ-глутамилтранспептидазы – ГГТП, щелочной фосфатазы – ЩФ) (рис. 6).
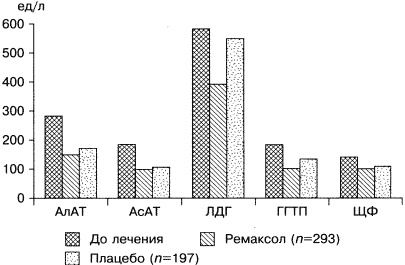
Рис. 6. Динамика биохимических показателей
у больных ХВГ на фоне инфузионной терапии ремаксолом
Абсолютными показаниями к назначению ремаксола должны явиться все варианты внутрипеченочного холестаза при паренхиматозных поражениях печени (гепатоцеллюлярный, каналикулярный, дуктулярный), а также внепеченочный холестаз с желтухой и без нее (рис. 7).
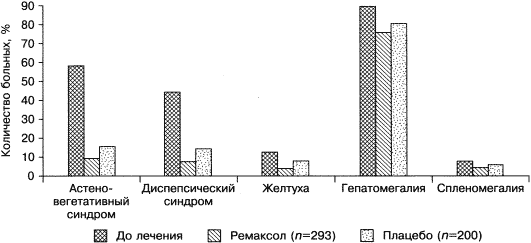
Рис. 7. Динамика клинических симптомов
у больных ХВГ на фоне инвузионной терапии ремаксолом
Полученные результаты позволяют отнести препараты янтарной кислоты к патогенетически обоснованным средствам лечения больных ХВГ. При оптимизации противовирусной терапии с целью повышения общей эффективности лечения необходимо ориентироваться не только на влияние компонентов лечения на процессы персистенции вируса (наличие вируса в крови, интенсивность его репликации в печеночной ткани и в периферической крови), но и на возможности изменения метаболических процессов с помощью адекватных средств коррекции.
Цитопротекторная терапия метаболическими лекарственными средствами на основе янтарной кислоты (реамберин, ремаксол) должна рассматриваться как обязательный компонент комплексного лечения больных ХВГ. Показания к назначению реамберина и ремаксола больным ХВГ обобщены ниже.