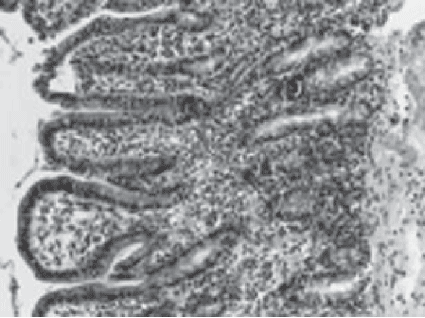
Рис. 1. Повреждения слизистой оболочки III—IV степени.
Окрашивание гематоксилином и эозином. Увеличение ок. 10. об 40.
Источник: ХИРУРГИЯ. Журнал им. Н.И. Пирогова 2013; 4: 74-77
ДВНЗ «Ивано-Франковский национальный медицинский университет»
В.Д. СКРИПКО, Е.И. ДЕЛЬЦОВА,
С.Б. ГЕРАЩЕНКО, М.Г. ГОНЧАР
Изучение этиологии, патогенеза, диагностики и лечения тонкокишечной непроходимости в современной хирургии является актуальным. Несмотря на достижения последних лет, смертность от этого заболевания составляет 15-52% [2]. При острой кишечной непроходимости возникают полиорганные поражения, которые связаны, прежде всего, с нарушением барьерной функции стенки кишки [3, 9]. Большинство данных о строении стенки кишки при кишечной непроходимости представлены экспериментальными исследованиями [6-8]. Данные об объективизации структурных нарушений, которые возникают в стенке тонкой кишки при острой кишечной непроходимости, и их коррекции у человека малочисленны, что и определило необходимость выполнения данной работы.
Цель – изучение состояния структур тканей стенки тонкой кишки при острой механической непроходимости у человека и ее коррекция в эксперименте раствором реамберина.
С целью патогенетического обоснования использования препаратов с антигипоксантным и антиоксидантным действием при острой кишечной непроходимости нами выполнена экспериментальная часть работы на 40 свиньях вьетнамской породы массой 10-25 кг на базе Тернопольского государственного университета им. И.Я. Горбачевского на протяжении 2011-2012 гг. Все вмешательства, содержание и эвтаназию животных, проводили в соответствии с основными положениями Европейской конвенции защите позвоночных животных, используемых для экспериментов или в иных научных целях, от 18.03.86, Директивы ЕС от 24.11.86 и приказа МОЗ Украины №960 от 23.09.09.
Моделирование острой тонкокишечной непроходимости выполняли по методике А.С. Шалимова (1989), а хирургическое восстановление проходимости тонкой кишки осуществляли через 12, 24, 48 и 72 ч путем резекции участка кишки с наложением межкишечного анастомоза бок в бок. Для возможности забора материала в динамике эксперимента при изучении патоморфологических изменений стенки кишки при непроходимости без и в сочетании с разработанным методом применения антиоксидантной и антигипоксантной терапии в лапаротомную рану вшивали «молнию» для прогнозированной лапаротомии. В соответствующий срок опыта инцизионным методом забирали кусочки стенки кишки – до 50 см приводящего и 30 см отводящего отделов соответственно, через каждые 10 см с последующим наложением касетного шва.
Животные были разделены на три группы. 1-ю группу составили подопытные животные, у которых изучали гистологические показатели стенки кишки при непроходимости; 2-ю – животные с механической острой тонкокишечной непроходимостью, у которых в отдельных подруппах через 12, 24, 36, 48 и 72 ч (на 5–7-е и 12–14-е сутки) определяли динамику морфологических изменений при возобновлении проходимости тонкой кишки, и использованием общепринятых схем лечения; 3-ю – животные, которым после проведеного восстановления проходимости тонкой кишки через 12, 24, 36, 48 и 72 ч дополнительно к общепринятым препаратам в схемах лечения назначали внутривенное введение раствора реамберина по 50 мл/кг в сутки.
Материал для исследования (тонкая кишка 13 пациентов) был забран во время операции по поводу резекции тонкой кишки. По нозологическим единицам: по поводу острой кишечной непроходимости по странгуляционному типу – 7 случаев (ущемленная бедренная грыжа – 3 случая, паховая грыжа – 2, вентральная грыжа – 2), по поводу тромбоза ветвей верхней мезентериальной артерии и вены – 4 случая. В 2 случаях резекция выполнена по поводу спаечной кишечной непроходимости. В качестве контроля использовали фрагменты тонкой кишки, которые забирали на автопсии у 7 больных через 3-9 ч после смерти от заболеваний, не связанных с патологией органов желудочно-кишечного тракта.
Микроскопические срезы стенки кишки подвергали гистологическому (окраска срезов тонкой кишки гематоксилином и эозином), нейрогистологическому (для изучения нервных структур – импрегнация азотнокислым серебром по Бильшовскому–Гросс) согласно соответствующим прописям морфологического исследования. Гистохимическое исследование активности сукцинатдегидрогеназы и кислой фосфатазы проводили по Берстону [4].
Тонкая кишка после резекции по поводу острой странгуляционной непроходимости была увеличена в диаметре, раздута, c тусклой серозной оболочкой, почти черного цвета, отводящая петля спазмирована. Во всех случаях клинически отмечались выраженные перитонеальные явления, которые характеризовали наличие острого разлитого перитонита разной степени тяжести. В ущемленной петле кишки на почве массивного геморрагического инфаркта отмечали некроз стенки кишки. Даже при незначительной продолжительности заболевания (6-9 ч) при окрашивании гематоксилином и эозином в стенке кишки наблюдали отек, лимфостаз, геморрагический инфаркт тканей с диффузным гнойным воспалением слизистой оболочки и очагами скопления бактерий. В расширенных сосудах подслизистой основы – стаз крови и мелкие кровоизлияния.
В ближайших от некротической зоны участках (5–10 см) приводящей петли тонкой кишки кровеносные сосуды переполнены кровью. Стенка кишки в состоянии отека. В слизистой оболочке наблюдаются значительные изменения. Эпителий кишечных ворсинок отделен от уплотненной стромы ворсинок на всем протяжении отечной жидкостью. Границы между столбчатыми абсорбтивными энтероцитами практически не различаются, их ядра часто смещены в апикальном направлении. Верхушки многих ворсинок «голые», их эпителий слущен, что соответствует III–IV степени тяжести морфологических повреждений эпителиальной выстилки ворсинок тонкой кишки по C. Chiu и соавт. [11]. В энтероцитах крипт наблюдаются некробиотические изменения. Активность ферментов сукцинатдегидрогеназы и кислой фосфатазы определить не удалось. При импрегнации азотнокислым серебром по Бильшовскому–Гросс нервные клетки в ганглиях мышечно-кишечного сплетения не выявляются. Определяются только их контуры и небольшое количество дегенерирующих нервных волокон.
В участках, взятых на границе резекции тонкой кишки в пределах жизнеспособных тканей (40 см), наблюдается отек всех оболочек стенки кишки. Микрогемососуды в состоянии стаза, повсеместно явления лейкодиапедеза. Рыхлая соединительная ткань стромы кишечных ворсинок уплотнена, инфильтрирована полиморфноклеточными элементами. В ворсинках повсюду явления подэпителиального отека. Столбчатые эпителиоциты отекшие, их высота уменьшена, цитоплазма мутная, ядра смещены в апикальном направлении. Количество бокаловидных клеток увеличивается. В этих же участках нервные элементы мышечно-кишечного нервного сплетения аргентофильные, ядра нейронов визуализируются не всегда. Отростки нейронов утолщаются, на их телах появляются дополнительные короткие шиповатые выросты.
Функциональные свойства энтероцитов нарушаются. Резко уменьшается активность сукцинат-дегидрогеназы, которая в контроле локализируется в виде темно-синих гранул в апикальном и базальном полюсе энтероцитов. На расстоянии 40 см от странгуляционной борозды количество гранул, которые свидетельствуют об активности фермента, незначительное, определяется только бледная мелкая зернистость. Локализация и выраженность окрашивания энтероцитов при определении кислой фосфатазы изменена с увеличением количества осажденного продукта реакции, по сравнению с контролем.
При изучении стенки кишки, которая подвергалась резекции по поводу тромбоза ветвей верхней брыжеечной артерии и вены, нами выявлены тяжелые ишемические и воспалительные изменения ее приводящей петли на расстоянии 50 см от границ некроза. На расстоянии 10 см оральнее от некротически измененного участка кишки наблюдается отек всех оболочек стенки органа. В слизистой оболочке он проявляется значительным расширением субэпителиальных пространств. Кишечные ворсинки имеют неодинаковую длину, оголенные верхушки и в некоторых из них энтероциты слущены от верхушки до основания ворсинок. Энтероциты отекшие, их цитоплазма мутная, ядра разных размеров дислоцированы в направлении апикального полюса, выявляется кариопикноз отдельных ядер. Границы энтероцитов не различаются. Степень повреждения слизистой оболочки в основном III–IV, местами участки характеризуются V степенью повреждения, где наблюдается дезинтеграция собственной пластинки слизистой оболочки с кровоизлияниями и язвообразованием. Крипты укорочены и очагово разрушены. В строме ворсинок полиморфноклеточная инфильтрация.
Нервные элементы мышечнокишечного нервного сплетения слабо импрегнированы, имеют размытые контуры, их ядра определяются редко. Только отдельные нейроны имеют огрубевшие, деформированные отростки (рис.1).

Рис. 1. Повреждения слизистой оболочки III—IV степени.
Окрашивание гематоксилином и эозином. Увеличение ок. 10. об 40.
На расстоянии 40 см приводящей петли в криптах клетки сохранены, и можно надеяться на регенерацию эпителиального слоя кишки. Активность сукцинатдегидрогеназы в энтероцитах резко снижена. При постановке реакции на кислую фосфатазу энтероциты окрашиваются неравномерно. Нейроны мышечно-кишечного нервного сплетения гиперхромные. Чаще выявляются длинноаксонные нейроциты I типа Догеля, в которых короткие отростки утолщаются и содержат наплывы цитоплазмы типа колб. Строма нервных ганглиев просветляется. Только на расстоянии 50-55 см выше зоны некроза гистологическое строение кишки стабилизируется при сохранении незначительного отека и воспалительной лимфоцитарной инфильтрации (I–II степень повреждения). По сравнению с предыдущим участком, активность ферментов выше, но не достигает уровня нормы. В отводящей петле наиболее выраженные патогистологические нарушения отмечаются на расстоянии 30 см аборальнее зоны некроза. На расстоянии 40 см в слизистой оболочке наблюдается умеренный отек и лимфоплазмоцитарная инфильтрация (I–II степени повреждения).
При спаечной кишечной непроходимости объем резекции был разным – от 20 см до всей подвздошной кишки. Участок кишки, который подвергался резекции, как правило, был деформирован, сужен в диаметре, с утолщенной стенкой. Спайки состояли из плотной соединительной ткани, сращенной с серозной оболочкой стенки кишки. Мышечная оболочка умеренно гипертрофирована. В слизистой оболочке обнаружены значительные изменения – отек стромы ворсинок, набухание энтероцитов, уменьшение активности сукцинатдегидрогеназы, что свидетельствовало о I–II степени повреждения. Нейроны гиперемированы, с утолщенными грубыми отростками.
Таким образом, морфофункциональные исследования стенки тонкой кишки в пределах ее резекции при тонкокишечной непроходимости показали разнообразие изменений в сосудах, нервных образованиях и слизистой оболочке, которые отличаются при странгуляции и обтурации.
В условиях острой непроходимости по странгуляционному типу при нарушении кровообращения превалируют ишемические изменения, которые осложняются воспалительными явлениями. При обтурационной кишечной непроходимости патогистологические признаки имели менее выраженный характер, который свидетельствует о том, что ишемия значительно утяжеляет странгуляцию [13]. Изменения в энтероцитах могут служить показателем повреждения слизистой оболочки кишки в сочетании с повреждением ее нервных структур [10]. В динамике восстановления структуры и функции слизистой оболочки после ликвидации тонкокишечной непроходимости эти моменты могут обусловливать недостаточность кишечных анастомозов из-за необъективной оценки состояния жизнеспособности стенки кишки [5, 12].
Результаты экспериментального исследования показали, что нарушения кишечного пассажа продолжительностью 24-48 ч при механической кишечной непроходимости характеризируются значительными повреждениями в стенке кишки с развитием дистрофических и некробиотических изменений эпителия ворсинок слизистой оболочки (рис. 2). Через 72 ч наблюдалось углубление дистрофических и воспалительных процессов, которые приобретали необратимый характер с появлением нитчатых фибринозных наслоений на серозной оболочке.
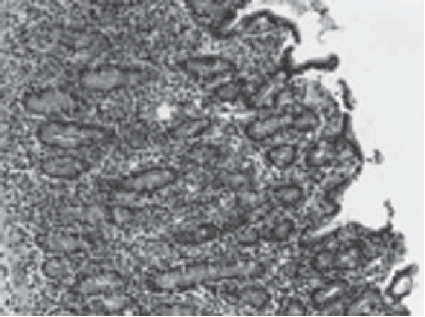
Рис. 2. Дистрофические и некробиотические изменения
ворсинок слизистой оболочки. Увеличение ок. 10. об 40.
После возобновления проходимости тонкой кишки при использовании общепринятой схемы лечения структурные изменения кишечной стенки проявлялись регенерацией эпителия частично структурированных ворсинок. Обнаруживались диапедезные кровоизлияния в подслизистом и мышечном слоях, очаговый некроз, десквамация слизистой оболочки с распространением на ее глубокие слои.
После применения нами комплексного хирургического и консервативного лечения с использованием внутривенного введения раствора реамберина на 5–7-е сутки в супрастенотической части тонкой кишки обнаружено структурно сохраненные ворсинки, а в криптах наблюдалось возрастание количества клеток с фигурами митоза, незначительный отек подслизистого слоя. На 12–14-е сутки обнаружено морфофункциональное восстановление слизистой оболочки ворсинок кишки на фоне незначительных проявлений отека подслизистой основы (рис. 3).
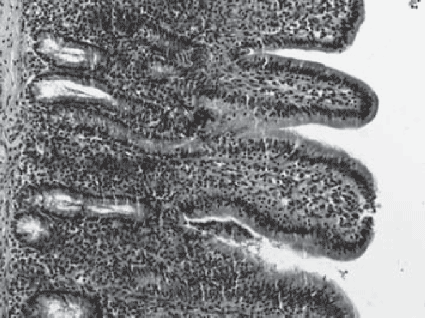
Рис. 3. Восстановление слизистой оболочки кишки.
Увеличение ок. 10. об 40
Таким образом, в условиях применения медикаментозной коррекции ишемии тонкой кишки реамберином наблюдалась активация регенераторных процессов в слизистой оболочке супрастенотической части тонкой кишки, что обеспечивает функциональное восстановление резорбтивных и сосудистых процессов в кишечной стенке.