В основе неврологических расстройств у больных с критическими
состояниями различного генеза лежат ишемические и гипоксические
поражения головного мозга. На первое место ишемия выдвигается как
при острых или хронических цереброваскулярных заболеваниях
(инсульт, ДЭ, хроническая ишемия мозга), так практически при всех
состояниях, ведущих к патологии церебрального кровоснабжения
(гипоксия, травма, шок, нарушения системной гемодинамики, срывы
ауторегуляции церебрального кровотока на фоне медиаторных
цитокиновых повреждений). Патоморфологический каскад нейрональных
расстройств прямо коррелирует со степенью снижения уровня мозгового
кровотока : так, при снижении церебральной перфузии до 65 мл на 100
грамм мозговой ткани в минуту развивается первичная реакция в виде
угнетения белкового синтеза, до 35 мл - имеет место активация
анаэробного гликолиза, при снижении этого показателя до 20 мл
формируется энергетическая недостаточность, дестабилизация мембран
нейронов, выброс глутамата и аспартата, а развивающийся
лактат-ацидоз способствует ферментативной глиальной гиперактивности
с последующим формированием апоптоза и некроза.
Сложная динамика развития постгипоксических церебральных
расстройств, вовлеченность в этот процесс широкого спектра
функционально-метаболических систем объясняет сложность решения
вопросов, связанных с антиоксидантной защитой организма.
При ишемических и гипоксических поражениях мозга происходят
комплексные функционально-метаболические нарушения, в которых
ведущую роль играет снижение уровня макроэргов - аденозинтрифосфата
и креатинфосфата в организме. Изменения функций дыхательной цепи
митохондрий начинается на субстратном участке, где происходит
сначала усиление, а затем резкое снижение функциональной активности
NADH-зависимого пути окисления, приводящее к нарушению переноса
электронов на участке NADH - коэнзим Q и сопряженного с ним
процесса окислительного фосфорилирования. Несмотря на нарушение
активности NAD- зависимого окисления, на ранней стадии
внутриклеточная концентрация макроэргов снижается незначительно,
поскольку активируются альтернативные компенсаторные метаболические
потоки, главным образом, сукцинатоксидазный путь окисления. При
прогрессировании гипоксии блокируется терминальный цитохромный
участок дыхательной цепи митохондрий. Таким образом, изменение
метаболических потоков является одним из наиболее ранних признаков
ишемии и гипоксии мозга. Изменения в содержании макроэргов
кореллируются со значительными нарушениями параметров
жизнедеятельности клеток, например, неспособности окислять
энергетические субстраты даже при наличии их в среде.
В ходе ишемических расстройств отмечаются изменения и в
гликолитическом пути образования АТФ. Усиление гликолиза является
альтернативным окислительному фосфорилированию компенсаторным
процессом. В начале происходит активация гликолиза и накопление
молочной кислоты. Однако, даже когда гликолиз поставляет до 80%
всей образующейся энергии, он удовлетворяет потребности обмена
клеток лишь на одну треть, а если причины ишемии не устраняются, то
наступает торможение гликолиза. Повреждение системы транспорта АТФ
часто опережает нарушение его образования, вызывая разобщение
синтеза и утилизации АТФ, объясняя возможность возникновения
необратимых повреждений клеток мозга на фоне довольно высокого
уровня АТФ. Наряду с угнетением синтеза АТФ при ишемии нарушается
транспорт и утилизации этого макроэрга, что является ранним и
тяжелым симптомом ишемии, поскольку значительная часть АТФ,
синтезированного в митохондриях, утилизируется энергозависимыми
системами, расположенными вне митохондрий. Энергодефицит является
причиной подавления синтетических восстановительных процессов.
Фактором, имеющим особое значение при ишемии и вторичной
церебральной гипоксии, является "оксидантный стресс и большое число
свободных радикалов. Источником генерации радикальных частиц служат
либо митохондриальные ферменты, либо NADH-оксидаза наружной
митохондриальной мембраны, не связанная с дыхательной цепью.
Головной мозг особенно чувствителен к гиперпродукции свободных
радикалов, т. к. все факторы их инактивации находятся в крови, и в
условиях ишемии не достигают нейрональных структур, в которых на
фоне колоссального энергопотребления, обнаруживается наиболее
высокое во всем организме содержание фосфолипидов - главного
субстрата перекисного окисления, активирующегося при ишемии, а
также олеиновой кислоты и железа, низкое содержание витамина А,
каталазы и церулоплазмина, являющихся естественными
антиоксидантами.
В силу этих причин именно окислительный стресс, ведущий к
гиперпродукции свободных радикалов и деструкции мембран, в
результате активации фосфолипазного гидролиза, играет в генезе
ишемии мозга особенно значимую роль. Так, основным фактором,
повреждающим митохондриальные, плазматические и микросомальные
мембраны является высокоактивный гидроксильный радикал ОН.
Повышенная продукция свободных радикалов, инициируемая при ишемии
мозга арахидоновой кислотой, является одной из причин длительного
спазма сосудов и срыва церебральной ауторегуляции, а также
прогрессирования постишемического отека и набухания за счет
дезинтеграции нейрональнойсинаптической активности и повреждения
мембранных насосов.
Под воздействием оксидантного стресса резко возрастает
проницаемость мембранных структур митохондрий, саркоплазматического
ретикулума и лизосом за счет изменения свойств фосфолипидов
мембран. Если в норме оксидантная система служит целям
дезинтоксикации экзогенных и эндогенных токсинов, то в условиях
прогрессирования ишемии неадекваность деятельности антиоксидантной
системы ведет к нарастанию выраженности эндотоксикоза со вторичным
повреждением мембран и прогрессированием постишемического
отека-набухания мозга. При ишемии вследствие энергодефицита
снижается активность ферментов антиоксидантной защиты:
супероксиддисмутазы (СОД), осуществляющей восстановление кислорода
до перекиси водорода, каталазы, обеспечивающей восстановление
перекиси водорода до воды и глутатионпероксидазы (ГТП), отвечающей
за нерадикальное разложение перекиси водорода и органических
перекисей. Фармакологическая коррекция энергетических нейрональных
нарушений, вызванных ишемией и гипоксией, должна включать либо
восстановление NAD-зависимого участка, либо активацию
альтернативных NAD-оксидазному пути метаболических потоков,
обеспечивающих поступление электронов на терминальный цитохромный
участок и поддерживающий способность к образованию энергии.
Существуют ли реальные - естественные или фармакологические,
механизмы и средства предотвращения или уменьшения повреждающего
влияния "оксидантного стресса"? Есть ли пути, обеспечивающие защиту
мембран нейронов и глиальных элементов от повреждающего действия
избытка свободных радикалов и цитокинов путем предотвращения
действия прооксидантных факторов, гидролаз, органических и
неорганических перекисей для сохранения целостности как отдельных
мембран, так подержания объема и структур клеток в целом?
Наиболее быстрым альтернативным путем коррекции гипоксии
является сукцинатоксидазное окисление. Активация
сукцинатоксидазного окисления достигается через повышение
активности сукцинатдегидрогеназы и улучшения проникновения
экзогенного и эндогенного сукцината в митохондрии. Таким образом,
наиболее эффективным путем коррекции гипоксических нарушений в
организме является комплексная активация дыхательной цепи :
активация альтернативного сукцинатоксидазного окисления, стимуляция
NAD-зависимого окисления и подавление радикальных процессов в
клетке.
В условиях гипоксии при резком снижении активности NAD-зависимых
ферментов цикла Кребса, остро встает вопрос о необходимости
активации альтернативных NAD метаболических потоков, и прежде
всего, окисляющего янтарную кислоту сукцинатдегидрогеназного (СДГ)
шунта, с целью активации антиоксидантных защитных систем.
Существующая в организме в норме физиологическая антиоксидантная
система представляет собой совокупную иерархию защитных механизмов
клеток, тканей, органов и систем, направленных на сохранение и
поддержание в пределах нормы реакций организма, в том числе, в
условиях ишемии и стресса. Она включает систему внутриклеточных
антиокислительных ферментов, противодействующих окислительному
стрессу и обезвреживающих активные формы кислорода. Однако, в
условиях ишемии перекисное окисление липидов в фосфолипидных
структурах биологических мембран плохо устраняется системой
супероксиддисмутаза - каталаза. Детоксикация в этих структурах
осуществляется главным образом ферментами системы глутатиона,
прежде всего глутатионредуктазой, глутатионпероксидазой и
глутатионтрансферазой. Наряду с антиоксидантными ферментами к числу
высокомолекулярных антиоксидантов следует отнести также
сывороточный альбумин, гаптоглобин, трансферрин, ферритин,
связывающие высокоактивные ионы, но слабо проникающие через
мембраны.
Контроль свободнорадикального окисления в головном мозге
осуществляется также некоторыми нейропептидами. Так, введение АКТГ
вызывает длительное снижение продуктов перекисного окисления
липидов (ПОЛ) в мозгу и крови и активирует
супероксидперехватывающие системы головного мозга. Основные
механизмы действия антиоксидантов основаны на стимуляции
естественных ферментных систем.
Известные к настоящему времени естественные и синтезированные
антиоксиданты подразделяются на жирорастворимые и водорастворимые.
Жирорастворимые антиоксиданты локализуются там, где расположены
мишени атаки свободных радикалов и пероксидов, наиболее уязвимые
для процессов перекисного окисления биологические структуры. К
числу таких структур относятся прежде всего биологические мембраны
и липопротеины крови, а основными мишенями в них являются
ненасыщенные жирные кислоты. Среди жирорастворимых антиоксидантов
наиболее известен альфа-токоферол, который взаимодействуя с
гидроксильным радикалом ОН, оказывает подавляющее влияние на
синглетный кислород. Среди водорастворимых антиоксидантов наиболее
известным является глутатион, играющий ключевую роль в защите
клеток от реакционно-способных интермедиатов кислорода. Второй по
значимости среди водорастворимых антиоксидантных систем является
система аскорбиновой кислоты.
Наиболее адекватным синергистом и практически повсеместным
спутником аскорбиновой кислоты является система физиологически
активных фенольных соединений. Количество известных фенольных
соединений превышает 20000. В значительных количествах они
встречаются во всех живых растительных организмах, составляя 1-2%
биомассы и более и выполняя разнообразные биологические
функции.
Наибольшим разнообразием химических свойств и биологической
активности отличаются фенольные соединения с двумя и более
гидроксильными группами в бензольном ядре в орто, пара-или рядовом
положении. Эти классы фенольных соединений в физиологических
условиях образуют буферную окислительно- восстановительную
систему.
Антиоксидантные свойства фенолов связаны с наличием в их
структуре слабых фенольных гидроксильных групп, которые легко
отдают свой атом водорода при взаимодействии со свободными
радикалами. В этом случае фенолы выступают в роли ловушек свободных
радикалов, превращаясь сами в малоактивные феноксильные радикалы.
Широко известные препараты со свойствами антиоксидантов в настоящее
время применяются в клинической, в том числе в неврологической и
нейрореанимационной практике. К препаратам с таким действием
относится аскорбиновая кислота, церрулоплазмин, витамин Е, каротин,
убихинон, эмоксипин, олифен. Все указанные препараты применяются
достаточно давно, но они обладают недостаточно выраженной
антиоксидантной фармакокинетикой.
В фармакологической и клинико-биохимической практике известно
действие янтарной кислоты, ее солей и эфиров, представляющих собой
универсальный внутриклеточный метаболит. Янтарная кислота,
содержащаяся в органах и тканях, является продуктом пятой реакции и
субстратом шестой цикла трикарбоновых кислот. Окисление янтарной
кислоты в шестой реакции цикла Кребса осуществляется с помощью
сукцинатдегидрогеназы, характерной особенностью которой является
локализация на внутренней поверхности мембран митохондрий и
независимость ее активности от концентрации окисленной и
восстановленной формы НАД\НАДН, что позволяет сохранить
энергосинтезирующую функцию митохондрий в условиях гипоксии и
ишемии даже при нарушении НАД-зависимого дыхания клеток.
Выполняя каталитическую функцию по отношению к циклу Кребса,
янтарная кислота снижает в крови концентрацию других интермедиатов
данного цикла - лактата, пирувата и цитрата, накапливающихся в
клетке наранних стадиях гипоксии. Феномен быстрого окисления
янтарной кислоты сукцинатдегидрогеназой, сопровождающийся
АТФ-зависимым восстановлением пула пиримидиновых динуклеитидов
получил название "монополизация дыхательной цепи", биологическое
значение которого заключается в быстром ресинтезе АТФ. В нервной
ткани функционирует так называемый гамма-аминобутиратный шунт (цикл
Робертса), в ходе которого янтарная кислота образуется из
гамма-аминомасляной кислоты через промежуточную стадию янтарного
альдегида. В условиях стресса и гипоксии образование янтарной
кислоты возможно также в реакции окислительного дезаминирования
альфа-кетоглутаровой кислоты в печени.
Антигипоксическое действие янтарной кислоты обусловлено ее
влиянием на транспорт медиаторных аминокислот, а также увеличением
содержания в мозге гамма-аминомасляной кислоты за счет шунта
Робертса. Янтарная кислота в организме в целом нормализует
содержание гистамина и серотонина и повышает микроциркуляцию в
органах и тканях, прежде всего в тканях мозга, не оказывая влияния
на артериальное давление и показатели работы сердца.
Противоишемический эффект янтарной кислоты связан не только с
активацией сукцинатдегидрогеназного окисления, но и с
восстановлением активности ключевого
окислительно-восстановительного фермента дыхательной
митохондриальной цепи - цитохромоксидазы.
Использование препаратов - антиоксидантов - производных янтарной
кислоты с целью уменьшения выраженности ишемических повреждений в
лекарственной терапии острых сосудистых и диффузных постишемических
поражений головного мозга до настоящего времени является
недостаточно изученным, особенно в связи с появлением на
фармакологическом рынке большого числа новых антиоксидантов.
Высокая активность янтарной кислоты нашла применение в растворе
"Реамберин 1,5% для инфузий", в состав которого входят: активное
вещество - смешанная натрий N -метилглюкаминовая соль янтарной
кислоты, составляющая 1,5% раствор янтарной кислоты и микроэлементы
в оптимальных концентрациях (магния хлорида 0,012%, калия хлорида
0,03% и NaCl 0,6% в инфузионной форме - 400 мл раствора во флаконе.
Препарат содержит 142,4 ммоль натрия, 4,0 ммоль калия, 1,2 ммоль
магния, 109,0 ммоль хлорида, 44,7 ммоль сукцината. Реамберин в виде
1,5% раствора является сбалансированным препаратом с осмолярностью,
приближающейся к нормальной осмолярности плазмы крови человека, т.
е. изотоническим слабощелочным в пределах нормальных значений рН
крови, раствором. Препарат обладает выраженным антигипоксческим и
антиоксидантным действием, оказывая положительное влияние на
аэробные биохимические процессы в клетке в период ишемии и
гипоксии, уменьшает продукцию свободных радикалов и восстанавливая
энергетический потенциал клетки, инактивирует гиперферментативные
процессы цикла Кребса и способствует утилизации жирных кислот и
глюкозы клетками, нормализует кислотно-щелочной баланс и газовый
состав крови.
В связи с этим препарат проявляет антиоксидантные и
антирадикальные свойства, обладая широким спектром воздействия на
различные механизмы регуляции метаболической активности клеток.
Препарат не имеет аналогов в России и за рубежом.
Реамберин является антиоксидантом - ингибитором свободных
радикалов, мембранопротектором, уменьшает активацию перикисного
окисления липидов в условиях ишемии и гипоксии, повышает активность
физиологической антиоксидантной системы в целом, активирует
энергосинтезирующие функции митохондрий и улучшает энергетический
обмен. Препарат обладает выраженным мембраностабилизирующим
действием, оказывает модулирующее влияние на мембраносвязанные
ферменты, ионные каналы - транспортеры нейромедиаторов, рецепторные
комплексы, в том числе бензодиазепиновые, ГАМК и ацетилхолиновые,
улучшает синаптическую передачу и, следовательно, взаимосвязь
структур мозга, улучшает и стабилизирует мозговой метаболизм и
кровоснабжение головного мозга, корригирует расстройства в
регуляторной и микроциркуляторной системах, улучшает реологические
свойства крови.
Таким образом, Реамберин, именно, в условиях ишемического
поражения мозга обладает антигипоксическим и антиоксидантным
действием. Препарат активизирует внутриклеточный синтез белка и
нуклеиновых кислот, ферментативные процессы цикла Кребса,
способствует утилизации глюкозы, синтезу и внутриклеточному
накоплению АТФ, сниженный синтез которой в условиях ишемии и
гипоксии является пусковым механизмом патоморфологических изменений
в клетках мозга. Основной фармакологический эффект препарата
обусловлен способностью усиливать компенсаторную активацию
аэробного гликолиза, снижать степень угнетения окислительных
процессов в цикле Кребса в условиях гипоксии с увеличением
содержания АТФ и креатинфосфата со стабилизацией клеточных
мембран.
Критические состояния любого генеза достаточно часто ведут к
формированию синдрома полиорганной недостаточности, развивающегося
как проявление многокомпонентного воздействия агрессивных
медиаторов и цитокинов, в том числе свободнорадикальной природы, на
функциональную активность и структурную целостность всех
жизнеобеспечивающих систем организма (легкие, желудочно-кишечный
тракт, почки, нервная система и т. д.).
Возможности корекции полиорганной недостаточности прежде всего
связаны с осуществлением эффективной программированной
инфузионно-корригирующей терапии. Это положение является актуальным
для больных с критическими состяниями и последующим развитием СПОН
практически любой этиологии, поскольку борьба с агрессивными
медиаторами критического состояния основана на поддержании
эффективной органной перфузии, что становится возможным только при
положительном водно-электролитном балансе. Использование
электролитно-сбалансированного изотоничного раствора "Реамбрин 1,5%
для инфузий" позволяет одномоментно с антиоксидантным воздействием
на церебральные структуры, проводить и грамотную инфузионную
коррекцию с целью стабилизации состояния больных и во избежания
полипрагмазии.
В последние годы неоспоримым считается, что эндотоксикоз (ЭТ) и
энцефолопатия являются наиболее яркими и информативными симптомами
проявления СПОН. Снижение уровня эндогенной интоксикации и
нормализация высшей нервной деятельности у больных с критическими
состояниями как экстрацеребрального так и интрацеребрального
генеза, носят благоприятный прогностический характер.
Выраженность постишемических и постгипоксических церебральных
расстройств может определять тяжесть клинических проявлений и
исходы тяжелых критических состояний внецеребрального генеза
(панкреонекроз, перитонит, кровопотеря) и усугублять у больных
данной группы тяжесть течения синдрома полиорганной
недостаточности.
При интрацеребральных - ишемических сосудистых процессах, прежде
всего при нарушениях мозгового кровообращения, синдром полиорганной
недостаточности развивается вторично, в результате утраты мозгом
регуляторно-трофических влияний. Он во многом обусловлен нарушенным
органным метаболизмом, провоцирующим обратную симпатическую и
парасимпатическую гиперафферентацию.
Оценка степени эндотоксикоза до сих пор представляет
определенные трудности, несмотря на множество предложенных методов.
Наиболее серьезные нарушения при ЭТ наблюдаются в показателях
белкового обмена, что связано с угнетением синтеза белков и
усилением их катаболизма. Важным звеном является альбумин - белок,
выполняющий пластические и транспортные функции. Снижение
содержания этого белка служит важнейшим прогностическим признаком
степени интоксикации и выживаемости.
При тяжелом ЭТ в организме создаются условия для образования
форм альбумина с измененными физико-химическими характеристиками,
"перегруженного" лигандами, что препятствует обмену между тканями и
сосудистым руслом, и транспорту токсинов к органам
детоксикации-биотрансформации. Поэтому особый интерес вызывают
методы, позволяющие судить не только о количестве, но и структуре и
функциональной активности альбумина. Это стало возможным благодаря
разработкам НИИ ФХМ РФ (Г.Е. Добрецов, Ю.А. Грызунов, Ю.И. Миллер) и
НПО "Монокристалреактив" (Б.М. Красовицкий, г.Харьков). Был создан и
внедрен в клиническую практику флуориметр АКЛ-01 и наборы реактивов
"ЗОНД-Альбумин", позволяющие контролировать общую концентрацию
альбумина (ОКА) в крови, эффективную концентрацию альбумина (ЭКА),
его связывающую способность (РСА - резерв связывания альбумина) и
рассчитывать производный показатель "индекс токсичности" (Т =
ОКА/ЭКА - 1).
Использование этих показателей, наряду с общеизвестными
клиническими тестами (клинический анализ крови, биллирубин, уровень
трансаминаз и фосфатаз в крови, уровень молекул средней массы,
уровень электролитов в плазме крови и моче, протеинограмму)
позволяет оценить уровень ЭТ, а также по их изменениям оценить
эффективность лечения.
Другим важным критерием уровня эндотоксемии является степень
выраженности энцефолопатии. Важнейшим тестом при оценки
выраженности энцефалопатии всегда являлась объективизация уровня
состояния сознания и депресии электрогенеза головного моза.
В последние годы появились приборы, объективно оценивающие
функциональную активность головного мозга в динамике, в том числе в
режиме реального времени. Энцефалографический монитор фирмы Drager,
Германия позволяет проводить длительное динамическое наблюдение
всех стандарных парамтров энцефало-граммы по двум полушариям. При
этом на экран монитора выводится нативная энцефалограмма по двум
отведениям и одновременно производится компрес-сированный
спектральный анализ энцефалограммы с выведением на экран монитора
трендов спектра ЭЭГ по обоим полушариям в двух стандартных режимах
(частоты и амплитуды составляющих спекрта ЭЭГ). Специально
разработанное фирменное програмное обеспечение, позволяет длительно
хранить и проводить анализ спектров ЭЭГ в режиме реального
времени.
Динамика ЭЭГ, при визуальной оценке нативной ЭЭГ и, особенно,
при количественном подсчете спектральных составляющих по амплитуде
и частотам, явялется одним из наиболее аргументированных и
достоверных методов оценки функциональной активности головного
мозга.
Энцефалограмма, как конечная результирующая электрогенеза мозга,
отражает как некоторые очаговые изменения, так и выраженность
поражения мозга в целом. Как показано многочисленными
исследованиями (Safar, 1976; Revers,1990; Sidi, 1990; Dick, 1992)
параметры ЭЭГ и их динамика коррелирует с уровнем мозгового
кровотока и определяется как его состоянием, так и газовым
составом, притекающей к мозгу крови.
Таким образом, анализ ЭЭГ может служить объективным критерием
состояния кислородного баланса и уровнем метаболитов мозга при
различных патологических воздействиях.
Целью данной работы стало изучение клинической эффективности
использования препарата "РЕАМБЕРИН 1,5% для инфузий" у больных
реанимационного профиля с развитием синдрома полиорганной
недостаточности как экстрацеребрального так и интрацеребрального
генеза.
В группу исследования были включены больные с экстрацеребральным
генезом энцефалопатии, как неврологического проявления синдрома
полиорганной недостаточности, возникших у больных на фоне разлитого
перитонита. Группу больных с интрацеребральным поражением составили
пациенты с острыми нарушениями мозгового кровообращения
ишемического и геморрагического характера, у которых также развился
СПОН.
Комплексное клинико-лабораторное и интруметнальное обследование
проводилось у больных с фоновым экстра и интрацеребральным
поражением соответственно в 2 группах: контрольной - без
применения препарата и основной - с применением препарата.
В обеих группах больным проводилась коплексная, принятая в
отделении реанимции ГКБ 15 г. Москвы, инфузионно-коррегирующая
терапия, направленная на лечение СПОН, развившегося в результате
экстракраниального (перитонит) и интракраниального (острого
нарушения мозгового кровообращения) поражения.
Обследование больных осуществляли в динамике в следующих в
следующих временных интервалах:
- До начала лечения, в момент поступления больного в отделение
реанимации.
- На следующий день после введения препарата.
- На 3, 5 и 8 сутки от начала лечения препаратом " РЕАМБЕРИН 1,5%
для инфузий".
Эффективность лечения препаратом определялась по следующим
показателям:
- клиническое состояние больного до и после лечения по
параметрам неврологического и соматического статуса;
- динамика стандартных клинико-лаборатоных показателей в процессе лечения;
- динамика уровня ЭТ в процессе лечения; динамика спектра ЭЭГ в
процессе лечения.
Сравнение полученных данных с аналогичными
показателями у больных опытной и контрольной группы проводилось
одномоментно.
Препарат "Реамберин" вводился внутривенно капельно в количестве
400 мл инфузионного раствора в сутки согласно инструкции по
клиническому изучению в течении 7 дней, начиная со 2-го дня от
поступления больного в отделение реанимации.
В исследование были включены две группы больных, разделенных по
нозологическим факторам возникновения церебрального поражения:
- Больные с ПОН, обусловленной разлитым перитонитом 29 человек
основной группы и 26 человек контрольной.
- Больные с ПОН, обусловленной органным поражением ЦНС (острым
нарушением мозгового кровоообращения по ишемическому и
геморагическому типу) 33 человека основной группы и 25 человек
контрольной.
Средний возраст больных состовлял 52±3,1 года в первой
группе и 63±4,3 года во второй группе.
Применяя синдромный подход к оценке тяжести состояниях больных,
наиболее широко используемый в настоящее время в реаниматологии и
интенсивной терапии, мы объединили в ходе данного исследования
группы больных с различными этиологическими факторами возникновения
критического состояния, оценивая у больных обоих групп сходную
вараженность синдромов поражения тех или иных органных структур
(поражение легких, печени, почек, и, главное - синдром
энцефалопатии с расстройствами сознания и очаговой и рассеянной
неврологической симптоматикой).
Клиническая оценка была основана на осмотре больного при
поступлении больного в отделение реанимации, оценке уровня сознания
по шкале Глазго, оценке общего состояния пациента по шкале
SAPS.
В таблице 1 представлены основные причины разлитого перитонита у
больных 1 группы.
Таблица 1. Причины разлитого перитонита
|
Характер основного заболевания
|
Количество больных контрольной группы
|
Количество больных опытной группы
|
|
Гангренозный аппендицит
|
10
|
10
|
|
Прободная язва
|
10
|
10
|
|
Тупая травма живота
|
6
|
9
|
|
Всего
|
26
|
29
|
Всем больным проводились однотипные оперативные вмешательства,
направленные на санацию и дренирование брюшной полости.
В таблице 2 представлены причины органных нарушений ЦНС у
больных 2-ой группы.
Таблица 2. Нозологические формы и локализация поражений ЦНС
|
Характер и локализация инсульта
|
Основная группа
|
Контрольная группа
|
|
Ишемический полушарный
|
18
|
12
|
|
Ишемический стволовой
|
5
|
6
|
|
Геморрагический полушарный
|
7
|
6
|
|
Геморрагический стволовой
|
3
|
1
|
Биохимические исследования включали в себя определение уровня
калия и натрия в плазме, уровней билирубина, мочевины, креатинина,
общего белка и альбумина, щелочной фосфатазы, трансаминаз,
гаммаглютаматтрансфераз, сахара крови на биохимическом анализаторе
Express 550, уровня МСМ по способу М.Я Малаховой (Малахова М.Я. и
др., 1983, 1987, 1995 гг.), калия и натрия в эритроцитах методом
пламенной фотометрии, осмолярность плазмы и мочи на осмометре
производства ГДР; КОС на анализаторе Corning, уровни ОКА, ЭКА, РСА
И Т определяли на отечественном приборе "ЗОНД", по методике
предложенной НИИ ФХМ РАМН (Г.Е. Добрецов); ЭЭГ контроль осуществляли прикроватным электроэнцефалог-рафом фирмы Drager, Германия.
Оценивая тяжесть состояния больных по шкале SAPS было выявлено,
что в обоих групах имела место сходная степень тяжесть состояния.
Фоново уровень синдромной недостаточности составлял в среднем 14,2.
Как видно из приведенной таблицы, все больные основных и
контрольных групп, относились к тяжелым. Согласно правилам
пользования системой SAPS к тяжелым относятся пациенты, набравшие
более 12 баллов.
Клинические исследования показали, что на фоне применения
"Реамберина" отмечено снижение уровня тяжести состояния пациентов
по шкале SAPS как в группе больных с СПОН на фоне
экстрацеребральной патологии, так и при интрацеребральных
поражениях нервной системы.
В процессе лечения все больные, получавшие "Реамберин" в ходе
терапии, были склонны к более выраженному купированию тяжелых
синдромных расстройств, что выражалось в быстром уменьшении числа
баллов по шкале SAPS.
Тяжесть состояния пациентов по шкале SAPS в группе больных с
СПОН на фоне перитонита в динамике на фоне применения Реамберина
представлена в таблице 3.
Таблица 3. Тяжесть состония больных СПОН по шкале SAPS
|
Группы больных
|
Фон
|
1
сутки
|
3
сутки
|
5
сутки
|
8
сутки
|
|
Больные СПОН экстрацеребрального генеза (основная)
|
13,8
|
10,4
|
9,3
|
6,8
|
5,5
|
|
Больные СПОН экстрацеребрального генеза (контрольная)
|
14,2
|
12,2
|
11,2
|
9,0
|
6,5
|
|
Больные с органическим поражением ЦНС
(основная)
|
14,8
|
12,4
|
10,3
|
7,8
|
6,7
|
|
Больные с органическим поражением ЦНС
(контрольная)
|
14,9
|
14,1
|
13,4
|
11,0
|
8,9
|
Это было отмечено в группах больных как с экстра так и с
интрацеребральными поражениями. Полученные результаты убедительно
свидетельствуют о положительном действии комплексной инфузионной
терапии Реамберином даже при достаточно тяжелом течении
критического состояния вне зависимости от исходного этиологического
фактора его возникновения.
Анализ основных лабораторных тестов показал, что у больных обеих
групп, на фоне введения препарата отмечается четкая тенденция к
более быстрому купированию метаболического ацидоза, нормализации
клеточного и плазменного калия, уменьшению уровней креатинина,
билирубина, щелочной фосфатазы и АСТ, МСМ уже на следующий день
после введения препарата. Однако статистически эти показатели, по
сравнению с контрольной группой были недостоверны.
Анализ уровня токсемии по "альбуминовому тесту" выявил
достоверные различия в основной и контрольной группах. В таблице 4 и таблице 5
представлены изменения "альбуминовых тестов" на фоне введения
"Реамберина" у больных обоих групп.
У здоровых доноров ЭКА=ОКА, РСА =100%, Т= 0. Однако, даже в
нормальных условиях это наблюдается крайне редко. Исследования
О.А. Андреева с соавт., 1998 г. показали, что норма ЭКА = 29-54,
ОКА=31-57, РСА= 71-98, Т=0,02-0,40.
Таким образом, из приведенных данных видно, что у всех больных в
момент поступления в отделение реанимации имел место высокий
уровень эндотоксемии. Применение в комплексной терапии препарата
"Реамберин" позволяет быстрее, чем в контрольной группе, снизить
уровень эндотоксикоза.
В таблице 5 представлены данные о динамике эндотоксикоза по
данным "альбуминового" теста у больных с интрацеребральными
поражениями ЦНС (с нарушениями мозгового кровобращения).
Как видно из данной таблицы в этой группе больных отмечается
нарастание явлений эндотоксикоза в ходе развития заболевания, что
согласуется с клиническими данными. У больных с органическими
поражениями ЦНС острым периодом считается период до 3-х недель от
начала заболевания, когда возможно прогрессирование симтоматики.
Вместе с тем из таблицы видно, что у больных основной группы,
получавших Реамберин, отмечено более медленное нарастание
эндотоксикоза. Разницы в степени нарастания эндотоксемии у больных
в зависимости от характера острого нарушения мозгового
кровообращения не отмечалось.
Выраженность эндотоксемии зависела от исходной тяжести и
локализации церебрального инсульта и была наиболее выраженной у
больных с геморрагическими и ишемическими стволовыми
инсультами.
Анализ летальности показал, что у больных с разлитым перитонитом
не было значимых различий у больных контрольной и основной групп. У
больных с заболеваниями ЦНС летальность в среднем составлет 67,3% в
контрольной группе и 56,5 % в основной, т.е. на фоне комплексной
терапии Реамберином имело место снижение летальности на 10,8%.
Всем больным всех указанных групп на фоне применения Реамберина
проводился длительный комплексный нейромониторинг, включавший
оценку динамики неврологического статуса, состояния сознания по
шкале комы Глазго и оригинальной шкале авторов и длительный
энцефалографический мониторинг.
Всем больным энцефалографический церебральный мониторинг
проводили в динамике в следующие сроки; при поступлении в отделение
реанимации, в первые сутки, на 3 сутки, на 7 сутки, у части больных
исследования проведены на 10, 15, 20 и 45 сутки.
Характерными особенностями спектра ЭЭГ и нативной
электроэнцефалограммы у больных с энцефалопатией на фоне СПОН при
экстрацеребральном поражении при фоновом исследовании было грубое
снижение амплитуды спектра (до 40 - 60% мощности) от стандартных
параметров амплитуды у здоровых испытуемых. Характерным было также
значительное нарастание частот в медленно - волновом диапазоне с
преимущественной выраженностью дельта-волн, которые составляли от
50 до 80% общей мощности спектра. В стандартных условиях у здоровых
испытуемых выраженность дельта-активности составляет не более 15%
суммарной мощности спектра.
На фоне депрессии суммарной мощности спектра со сдвигом частот в
медленно - волновую его составляющую, у больных с рассройствами
сознания до комы 3 (3 больных) характерны были участки еще более
грубой депрессии нативной ЭЭГ и ее спектра с последующим появлением
нарастающих по амплитуде медленных волн. Частоты альфа-диапазона
были представлены в среднем в объеме до 17 % мощности, частоты
бетта - диапазона до 5% мощности. В двух случаях у больных с комой
4 отмечено появление только единичных медленных волн на фоне
участков биоэлектрического молчания.
У 19% больных с разлитым перитонитом и развитием СПОН выявлялась
электроэнцефалографическая картина церебрального гиперметаболизма с
активацицией преимущественно медленноволновой части спектра ЭЭГ
билатерально.
У больных с церебральными инсультами характерно было снижение
суммарной мощности спектра ЭЭГ у 66 % больных, а также наличие
межполушарной асимметрии со снижением суммарной мощности спектра в
зоне соответствующем пораженному полушарию. У 34% больных
характерно было наличие по фоновом исследовании явлений
церебрального гиперметаболизма с активацией суммарной мощности
спектра. Именно у больных с данной электроэнцефалографической
картиной, выявленной при фоновом исследовании, в последующем
течение острого нарушения мозгового кровообращения было наиболее
тяжелым и неблагоприятным. Та же тенденция неблагоприятного течения
заболевания на фоне фонового гиперметаболизма имела место и в
группе больных с СПОН на фоне разлитого перитонита.
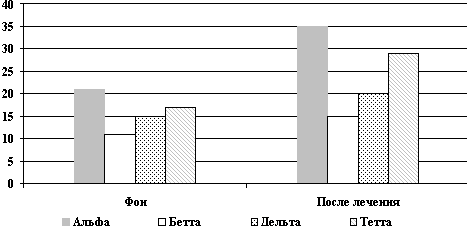
Рис. 1. Динамика спектра ЭЭГ.
- Активация альфа-диапазона спектра ЭЭГ до 24% от исходной
- Нарастание активности медленно волновой части спектра до 16% от
исходной при более тяжелом течении
На рисунке 1 представлены диаграммы динамики суммарной мощности
спектра ЭЭГ и частотных составляющих ЭЭГ у больных обоих групп
фоново и после курса лечения Реамберином. Прослеживается активация
частот альфа-диапазона спектра ЭЭГ у больных обоих групп, а также
нарастание суммарной мощности спектра ЭЭГ после курса лечения
Реамберином до 16% фоновой мощности при наиболее тяжелом течении
заболевания.
Полученные данные мониторинга ЭЭГ у больных с энцефалопатиями
различного генеза соответствуют данным литературы о характере
депрессии церебрального метаболизма у больных на фоне токсического,
циркуляторного и гипоксического поражения.
Получены новые данные о прямой коррелятивной связи фоновых
явлений церебрального гиперметаболизма, отражающего уровень
медиаторной цитокиновой церебральной агрессии в ходе СПОН экстра и
интрацеребрального генеза, с особенно тяжелым и неблагоприятным
течением основного заболевания.
Особенности состояния спектра ЭЭГ с постепенной депрессией его
по амплитуде и увеличением представленности медленно волновой части
спектра или с явлениями церебрального гиперметаболизма, практически
не зависели от генеза поражения мозга, поскольку конечным пусковым
механизмом повреждения всегда была гипоксия, но в большинстве
случаев коррелировали с глубиной расстройств сознания.
Так, наиболее грубые нарушения амплитуды и частоты имели место у
больных с расстройствами сознания до комы 2-3, у больных с фоновым
уровнем сознания до глубокого сопора или сопора выраженность
депрессии амплидуды была меньшей, хотя медленно-волновой сдвиг
прослеживался практически во всех случаях.
В ходе клинического исследования прослежены следующие
особенности состояния электроэнцефалографической активности по
данным нативной ЭЭГ и при мониторировании ее спектра.
У 16 больных на фоне применения Реамберина (непосредственно в
ходе внутривенного капельного введения препарата и после окончания
введения препарата было отмечено нарастание амплитуды
электроэнцефалограммы до 24% суммарной мощности от фоновой, за счет
преимущественной активации частот дельта и тетта-диапазона. У 8
больных было отмечено нарастание суммарной мощности спектра ЭЭГ на
20% за счет активации частот альфа-диапазона. У данной группы
больных нарастание мощности спектра ЭЭГ сопровождалось активацией
состояния сознания до более выского уровня (практически во всех
случаях от глубокого сопора до сопора или сонливости) на фоне
применения Реамберина или через 2-3 часа после окончания инфузии. У
больных с фоновым уровнем сознания кома 3-4 и наиболее грубой
степенью депрессии энергетического метаболизма по данным
спектрограмм ЭЭГ(снижение вольтажа ниже 70 - 80 % от стандартного),
наличие практически только медленоволновой части спектра, наличие
участков биоэлектрического молчания ) динамики спектрограмм на фоне
применения Реамберина не было, активации состояния сознания не
происходило, вс больные погибли в ближайший период. У 18 больных
положительная динамика по данным КСА ЭЭГ и уровню состояния
сознания была отмечена в отсроченный период - через 5 - 10 суток
после окончания первого курса применения препарата. У остальных
больных четкой коррелятивной устойчивой связи динамики нативной ЭЭГ
и спектра ЭЭГ с применением Реамберина отмечено не было.
Отрицательной динамики по данным КСА ЭЭГ, связанной с применением
Реамберина у больных ни в одном случае отмечено не было.
Отрицательной динамики на уровень расстройств сознания препарат не
оказал ни в одном случае.
На рисунке 2 и 3 представлены спектрограммы ЭЭГ больного с СПОН
на фоне разлитого перитонита в ходе применения терапии Реамберином.
Выявляется низкий уровень фонового метаболизма с преимущественной
представленностью частот медленноволновой части спектра (рис. 2) и
значительным нарастанием суммарной мощности спектра, в том числе за
счет частот альфа-диапазона после применния Реамберина (рис. 3).
Активация суммарной мощности спектра сопровождалась активацией
состояния сознания и последующим благоприятным течением
заболевания.
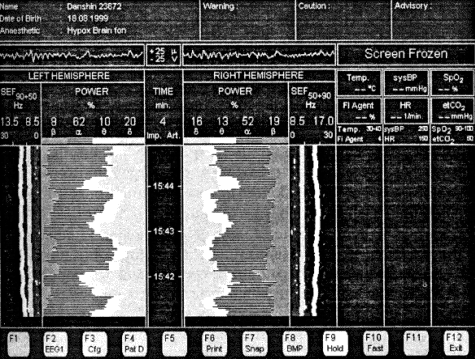
Рис. 2.

Рис. 3.
Активация состояния сознания на фоне применения Реамберина и у
больных с энцефалопатиями на фоне СПОН и в случаях
интрацеребральных процессов (острые нарушения мозгового
кровообращения) имела место у 18 больных, что, учитывая фоновую
глубину расстройств сознания у больных данной группы может
считаться хорошим показателем. У 4 больных с наиболее тяжелыми
поражениями мозга было отмечено значительное увеличение сроков
переживания (до 60 суток) по сравненю с больными аналогичной
тяжести не получавшими терапию Реамберином.
Положительная динамика по данным спектрограмм при проведении
мониторинга ЭЭГ у больных с тяжелыми энцефалопатиями, активация
состояния сознания у части больных, увеличение сроков жизни у
больных с тяжелейшими поражениями головного мозга, снижение
летальности у больных указанных групп позволяют рекомендовать
использование препарата Реамберин в клинической реанимационой и
нейрореанимационной практике в качестве инфузионного
нейрометаболического корректора. Препарат может быть использован в
качестве энергокорректора у больных с первичными и вторичными
ишемическими поражениями мозга, в том числе на фоне развития
синдрома полиорганной недостаточности, при этом отмечено уменьшение
выраженности эндотоксикоза и постишемических поражений как по
клинико-лабораторным, так и по энцефалографическим показателям.
Комплексное использование антиоксидантов, том числе Реамберина -
электролитно сбалансированного раствора янтарной кислоты в ранние
сроки развития ишемических поражений мозга является одним из
наиболее оптимальных методов патогенетической терапии.
Значение такой терапии возрастает по мере углубления тяжести
состояния больного. Своевременное использование антиоксидантов, т.
е. препаратов, нормализующих энергетику тканей и восстанавливающих
баланс между прооксидантными и антиоксидантными системами, является
оптимальной стратегией для восстановления жизнеспособности
ишемизированных тканей, прежде всего церебральных корковых
нейроглиальных комплексов, наименее резистентных к
патобиохимических гостгипоксческим повреждениям, но наиболее важных
для сохранения интегративной деятельности мозга, и
мезодиенцефально-стволовых структур, целостность которых
обеспечивает регуляторно-трофические церебральные влияния на всю
соматическую сферу.
Эта терапия является особенно актуальной для сохранения
структурной целостности и адекватной функциональной активности
мозга при поражениях головного мозга любого генеза, возникающих в
ходе критического состояния, в том числе при возникновении и
развитии синдрома полиорганной недостаточности, обеспечивая и прямо
направленное саногенетическое антиоксидантное действие и адекватную
инфузионную коррекцию электролитно-сбалансированным раствором.