|
|
| |
|
|
|
|
Реамберин: реальность и перспективы
|
|
Румянцева С.А.
РГМУ, ГКБ N 15
Комплексная антиоксидантная терапия реамберином
у больных с
критическими состояниями
неврологического генеза
Ишемические и гипоксические поражения головного мозга лежат в
основе неврологических расстройств у больных с критическими
состояниями различного генеза. На первое место ишемия выдвигается
при острых или хронических цереброваскулярных заболеваниях, но
имеет место практически при всех состояниях, ведущих к патологии
церебрального кровоснабжения или церебрального перфузионного
давления (гипоксия, травма, шок, нарушения системной гемодинамики).
Так, при снижении уровня мозгового кровотока до 65 мл на 100 мл в
мин. развивается первичная реакция в виде угнетения белкового
синтеза, до 35 мл в мин. имеет место активация анаэробного
гликолиза, при снижении этого показателя до 20 мл на 100 г в минуту
формируется энергетическая недостаточность, дестабилизация мембран
нейронов и выброс нейротрансмиттера (глутамата), а развивающийся
лактат-ацидоз способствует глиальной активации с последующим
формированием некроза и апоптоза клеток в локальных или диффузных
очагах ишемии. Сложная динамика развития постгипоксических
церебральных расстройств, вовлеченность в этот процесс широкого
спектра функционально-метаболических систем объясняет сложность
решения вопросов, связанных с антиоксидантной защитой
организма.
При ишемических и гипоксических поражениях мозга происходят
комплексные функционально-метаболические нарушения, в которых
ведущую роль играет снижение уровня макроэргов - аденозинтрифосфата
и креатинфосфата в организме. Изменения функций дыхательной цепи
митохондрий начинается на субстратном участке, где происходит
сначала усиление, а затем резкое снижение функциональной активности
NADH-зависимого пути окисления, приводящее к нарушению переноса
электронов на участке NADH - коэнзим Q и сопряженного с ним
процесса окислительного фосфорилирования. Несмотря на нарушение
активности NAD - зависимого окисления, на ранней стадии
внутриклеточная концентрация макроэргов снижается незначительно,
поскольку активируются альтернативные компенсаторные метаболические
потоки, главным образом, сукцинатоксидазный путь окисления. В более
жестких условиях гипоксии блокируется терминальный цитохромный
участок дыхательной цепи митохондрий. Таким образом, изменение
метаболических потоков является одним из наиболее ранних признаков
ишемии и гипоксии мозга. Изменения в содержании макроэргических
соединений корреллируют со значительными нарушениями параметров
жизнедеятельности клеток, например, неспособности окислять
энергетические субстраты даже при наличии их в среде.
В процессе ишемии отмечаются изменения и в гликолитическом пути
образования АТФ. Усиление гликолиза является альтернативным
окислительному фосфорили-рованию компенсаторным процессом. В начале
происходит активация гликолиза и накопление молочной кислоты.
Однако, даже когда гликолиз поставляет до 80% всей образующейся
энергии, он удовлетворяет потребности обмена клеток лишь на одну
треть, если причины ишемии не устраняются, то наступает торможение
гликолиза. Повреждение системы транспорта АТФ часто опережает
нарушение его образования, вызывая разобщение синтеза и утилизации
АТФ, объясняя возможность возникновения необратимых повреждений
клеток мозга на фоне довольно высокого уровня АТФ.
Наряду с угнетением синтеза АТФ при ишемии нарушается транспорт
и утилизации этого макроэрга, что является ранним и тяжелым
симптомом ишемии, поскольку значительная часть АТФ,
синтезированного в митохондриях, утилизируется энергозависимыми
системами, расположенными вне митохондрий. Энергодефицит является
причиной подавления синтетических восстановительных процессов.
Фактором, имеющим особое значение при ишемии и вторичной
церебральной гипоксии, являются продукты свободнорадикальных
реакций. Увеличение степени восстановления переносчиков дыхательной
цепи и наличие высоких концентраций кислорода в окружающей среде
создают особо благоприятные условия для их образования. Источником
генерации радикальных частиц служат либо митохондриальные ферменты,
либо NADH-оксидаза наружной митохондриальной мембраны, не связанная
с дыхательной цепью. Под воздействием оксидантного стресса резко
возрастает проницаемость мембранных структур митохондрий,
саркоплазматического ретикулума и лизосом путем изменения свойств
липидов. Кроме того, в норме, оксидантная система служит целям
дезинтоксикации экзогенных и эндогенных токсинов, а в условиях
ишемии активация антиоксидантной системы ведет к нарастанию
выраженности эндотоксикоза со вторичным повреждением мембран и
постишемического отека мозга. В процессе ишемии вследствие
энергодефицита снижается активность ферментов антиоксидантной
защиты: супероксиддисмутазы (СОД) (восстановление кислорода до
перекиси водорода), каталазы (восстановление перекиси водорода до
воды) и глутатионпероксидазы (нерадикальное разложение перекиси
водорода и органических перекисей). Фармакологическая коррекция
энергетических нейрональных нарушений, вызванных ишемией и
гипоксией, должна включать либо восстановление NAD-зависимого
участка, либо активацию альтернативных NAD-оксидазному пути
метаболических потоков, обеспечивающих поступление электронов на
терминальный цитохромный участок и поддерживающий способность к
образованию энергии.
Наиболее быстрым альтернативным путем коррекции гипоксии
является сукцинатоксидазное окисление. Активация
сукцинатоксидазного окисления достигается через повышение
активности сукцинатдегидрогеназы и улучшения проникновения
экзогенного сукцината в митохондрии клетки. Таким образом, наиболее
эффективным путем коррекции гипоксических нарушений в организме
является комплексная активация дыхательной цепи: активация
альтернативного сукцинатоксидазного окисления, стимуляция
NAD-зависимого окисления и подавление радикальных процессов в
клетке. В условиях гипоксии при резком снижении активности
NAD-зависимых ферментов цикла Кребса, остро встает необходимость
активации альтернативных NAD метаболических потоков, и прежде всего
окисляющего янтарную кислоту сукцинатдегидрогеназного (СДГ)
шунта.
Головной мозг весьма чувствителен к гиперпродукции свободных
радикалов, к т. н. "окислительному стрессу", т. к. все факторы ему
препятствующие находятся в крови и в условиях ишемии не достигают
нейрональных структур, в которых на фоне колоссального
энергопотребления, обнаруживается наиболее высокое во всем
организме содержание фосфолипидов - главного субстрата перекисного
окисления активирующегося при ишемии, олеиновой кислоты, железа,
низкое содержание витамина А, отсутствие каталазы и церулоплазмина,
о роли которых будет сказано ниже. В силу этих причин, именно
окислительный стресс, ведущий к гиперпродукции свободных радикалов
и деструкции мембран, в результате активации фосфолипазного
гидролиза, играет в патогенетических влияниях ишемии мозга особенно
значимую роль. Так, основным фактором, повреждающим
митохондриальные, плазматические и микросомальные мембраны является
высокоактивный гидроксильный радикал ОН. Повышенная продукция
свободных радикалов, инициируемая арахидоновой кислотой при ишемии
мозга, является одной из причин длительного спазма сосудов и срыва
церебральной ауторегуляции, а также прогрессирования
постишемического отека и набухания за счет дезинтеграции нейронов,
и повреждения мембранных насосов.
Существуют ли реальные - естественные или фармакологические,
механизмы и средства предотвращения или уменьшения повреждающего
влияния оксидантного стресса? Есть ли пути, обеспечивающие защиту
мембран нейронов и глиальных элементов от повреждающего действия
избытка свободных радикалов и цитотоксинов путем предотвращения
действия прооксидантных факторов, гидролаз, органических и
неорганических перекисей для сохранения целостности как отдельных
мембран, так подержания объема и структур клеток в целом?
Во-первых, необходимо сказать, что сохранение
окислительно-антиоксидантного равновесия является важнейшим
механизмом гомеостаза живых систем любой степени сложности. Это
равновесие реализуется как в жидкостных средах организма (кровь,
лимфа, межклеточная и внутриклеточная жидкость), так и в
структурных элементах клетки-прежде всего в мембранных структурах
(плазматических, эндоплазматических, митохондриальных, ядерных
мембранах). Поддержание энергетического гомеостаза происходит при
участии ряда саморегулирующих систем, поддерживающих баланс между
энергозатратными и энергопродуцирующими процессами. Реализованный в
клетках, в том числе и в нейронах, принцип сопряжения окисления и
фосфорилирования с использованием мембран, на которых создается
электрический потенциал, представляет собой преобразователь
химической энергии в электрическую и осмотическую. В полном обьеме
и с полной энергетической отдачей этот механизм может работать
только в условиях адекватного кислородного баланса организма, т. е.
при отсутствии гипоксии и ишемии.
Кислород для любой клетки, особенно для нейрона и популяций
нейронов, является ведущим энергоакцептором в дыхательной
митохондриальной цепи. Связываясь с атомом железа цитохромоксидазы,
молекула кислорода подвергается четырехэлектронному восстановлению
и превращается в воду. Но в условиях нарушения энергообразующих
процессов дисбаланс энергетического метаболизма может негативно
сказаться на клетке и даже привести ее к гибели. Главной причиной
негативных последствий этих нарушений является образование при
неполном восстановлении кислорода высокореакционных, а потому
токсичных, свободных радикалов или продуктов, их генерирующих.
Относительная доступность и легкость образования свободных
радикалов в условиях неполного восстановления кислорода связана с
уникальными свойствами его молекул. В химических соединениях атомы
кислорода двухвалентны. Простейшей иллюстрацией этого является всем
извесная формула молекулы воды. Однако в молекуле кислорода оба
атома соединены только одинарной связью, а остающиеся на каждом
атоме кислорода по одному электрону остаются свободными.
Наличие в молекуле неспаренного электрона позволяет отнести ее к
особому классу химических веществ - свободным радикалам. Именно
наличие неспаренных электронов определяет возможность для кислорода
эффективно связываться с цитохромоксидазой и реализовывать функцию
конечного акцептора электронов, запускающего работу всей
дыхательной цепи. При этом необходимо отметить, что основной
устойчивой формой кислорода является так называемый "триплетный"
кислород, в молекуле которого оба неспаренных электрона
параллельны, но их спины (валентности) направлены в одну сторону.
При разнонаправленном расположении спинов в молекуле кислорода он
носит название синглетного и по своим химическим свойствам является
нестабильным и токсичным для биологических субстанций.
Свободные радикалы представляют собой пеструю группу
разнообразных по природе веществ, характеризующихся одним общим
признаком - наличием на одном из атомов неспаренного электрона. Как
правило такое состояние вещества является неустойчивым и свободные
радикалы стремятся превратиться в стабильные продукты путем
спаривания свободного электрона. Это достигается отрывом атома,
чаще всего это атом водорода, от другого соединения и
присоединением его к радикалу, либо за счет реакции рекомбинации,
связанной с соединением двух радикалов в одну молекулу. Современные
теории свободнорадикальнх цепных процессов учитывают влияние их на
структурное состояние и функции прежде всего биологических мембран.
В состав клеточных мембран входит большое количество фосфолипидов.
При появлении в мембране свободного радикала вероятность его
взаимодействия с жирной кислотой нарастает по мере увеличения числа
кратных связей. Поскольку ненасыщенные жирные кислоты обеспечивают
мембранам большую подвижность, то их изменения в результате
процессов перекисного окисления липидов приводит как к увеличению
вязкости мембран, так и к частичной утрате барьерных функций. В
настоящее время не вызывает сомнения факт изменения функциональных
свойств ряда ферментов, углеводов и белков, в том числе белков ДНК
и РНК, под действием свободных радикалов, на фоне чего клеткой
утрачиваются регуляторные функции, могут появляться аномальные
белки, стимулироваться, помимо прямого подреждающего действия,
вторичные деструктивные процессы. Однако, в процессе
функционирования биологических обьектов вырабатываются вещества из
групп радикалов, обладающие антиоксидантным действием, которые
называют стабильными радикалами. Стабильные радикалы, появляющиеся
в биологических обьектах, правильнее было бы называть условно
стабильными. Такие радикалы не способны отрывать атомы водорода от
большинства молекул, входящих в состав клетки. Но они могут
совершать эту операцию с особыми молекулами, имеющими слабо
связанные атомы водорода.
Этот класс химических соединений получил название
антиоксидантов, поскольку механизм их действия основан на
торможении свободнорадикальных процессов в тканях. Время жизни
таких радикалов достаточно велико. В отличии от нестабильных
свободных радикалов, оказывающих повреждающее действие на клетки,
стабильные свободные радикалы тормозят развитие дектруктивных
процессов. Существующая в организме физиологическая антиоксидантная
система представляет собой совокупную иерархию защитных механизмов
клеток, тканей, органов и систем, направленных на сохранение и
поддержание в пределах нормы реакций организма, в том числе, в
условиях ишемии и стресса. Она включает внутриклеточные
антиокислительные ферментные системы, противодействующие
окислительному стрессу и обезвреживающие активные формы кислорода.
К антиокислительным внутриклеточным ферментам относятся: прежде
всего супероксиддисмутаза, осуществляющая инактивацию
супероксидного радикала и каталаза, разлагающая пероксид
водорода.
Однако перекисное окисление липидов в фосфолипидных структурах
биологических мембран плохо устраняется системой
супероксиддисмутаза - каталаза. Детоксикация в этих структурах
осуществляется главным образом ферментами системы глутатиона,
прежде всего глутатионредуктазой, глутатионпероксидазой и
глутатионтрансферазой. Наряду с антиоксидантными ферментами к числу
высокомолекулярных антиоксидантов следует отнести также
сывороточный альбумин, гаптоглобин, трансферрин, ферритин,
связывающие высокоактивные ионы, но слабо проникающие через
мембраны. Контроль свободнорадикального окисления в головном мозге
осуществляется также некоторыми нейропептидами. Так, введение АКТГ
вызывает длительное снижение продуктов перекисного окисления
липидов (ПОЛ) в мозгу и крови и активирует
супероксидперехватывающие системы головного мозга. Основные
механизмы действия антиоксидантов основаны на стимуляции
естественных ферментных систем.
Среди водорастворимых антиоксидантов наиболее известным является
глутатион, играющий ключевую роль в защите клеток от
реакционно-способных интермедиатов кислорода. Второй по значимости
среди водорастворимых антиоксидантных систем является система
аскорбиновой кислоты, играющей важную роль в антиоксидантной защите
структур мозга в нормальных условиях, но резко снижающая свою
антиоксидантную активность в условиях ишемии и гипоксии.
Наиболее адекватным синергистом и практически повсеместным
спутником аскорбиновой кислоты является система физиологически
активных фенольных соединений. Количество известных фенольных
соединений превышает 20000. В значительных количествах они
встречаются во всех живых растительных организмах, составляя 1-2%
биомассы и более и выполняя разнообразные биологические
функции.
Наибольшим разнообразием химических свойств и биологической
активности отличаются фенольные соединения с двумя и более
гидроксильными группами в бензольном ядре в орто, пара-или рядовом
положении. Эти классы фенольных соединений в физиологических
условиях образуют буферную окислительно- восстановительную
систему.
Антиоксидантные свойства фенолов связаны с наличием в их
структуре слабых фенольных гидроксильных групп, которые легко
отдают свой атом водорода при взаимодействии со свободными
радикалами. В этом случае фенолы выступают в роли ловушек свободных
радикалов, превращаясь сами в малоактивные феноксильные
радикалы.
Широко известные в настоящее время препараты со свойствами
антиоксидантов в настоящее время применяются в клинической, в том
числе в неврологической и нейрореанимационной практике. К
препаратам с таким действием относится аскорбиновая кислота,
церрулоплазмин, витамин Е, каротин, убихинон. Все указанные
препараты применяются достаточно давно, но обладают недостаточно
выраженной антиоксидантной фармакокинетикой.
В фармакологической и клинико-биохимической практике известно
универсальное действие янтарной кислоты, ее солей и эфиров,
представляющих собой универсальный внутриклеточный метаболит.
Янтарная кислота, содержащаяся в органах и тканях, является
продуктом пятой реакции и субстратом шестой цикла трикарбоновых
кислот. Окисление янтарной кислоты в шестой реакции цикла Кребса
осуществляется с помощью сукцинатдегидрогеназы, характерной
особенностью которой является локализация на внутренней поверхности
мембран митохондрий и независимость ее активности от концентрации
окисленной и восстановленной формы НАД\НАДН, что позволяет
сохранить энергосинтезирующую функцию митохондрий в условиях
гипоксии и ишемии при нарушении НАД-зависимого дыхания клеток.
Выполняя каталитическую функцию по отношению к циклу Кребса
янтарная кислота снижает в крови концентрацию других интермедиатов
данного цикла - лактата, пирувата и цитрата, накапливающихся в
клетке наранних стадиях гипоксии. Феномен быстрого окисления
янтарной кислоты сукцинатдегидрогеназой, сопровождающийся
АТФ-зависимым восстановлением пула пиримидиновых динуклеитидов
получил название "монополизация дыхательной цепи", биологическое
значение которого заключается в быстром ресинтезе АТФ. В нервной
ткани функционирует так называемый гамма-аминобутиратный шунт (цикл
Робертса), в ходе которого янтарная кислота образуется из
гамма-аминомасляной кислоты через промежуточную стадию янтарного
альдегида. В условиях стресса и гипоксии образование янтарной
кислоты возможно также в реакции окислительного дезаминирования
альфа-кетаглутаровой кислоты в печени.
Антигипоксическое действие янтарной кислоты обусловлено ее
влиянием на транспорт медиаторных аминокислот, а также за счет
увеличения содержания в мозге гамма-аминомасляной кислоты за счет
шунта Робертса. Янтарная кислота в организме в целом нормализует
содержание гистамина и серотонина и повышает микроциркуляцию в
органах и тканях, прежде всего в тканях мозга, не оказывая влияния
н артериальное давление и показатели работы сердца.
Противоишемический эффект янтарной кислоты связан не только с
активацией сукцинатдегидрогеназного окисления, но и с
восстановлением активности ключевого
окислительно-восстановительного фермента дыхательной
митохондриальной цепи - цитохромоксидазы.
Использование препаратов - антиоксидантов - производных янтарной
кислоты с целью уменьшения выраженности ишемических повреждений в
лекарственной терапии острых сосудистых постишемических поражений
головного мозга до настоящего времени является недостаточно
изученным, особенно в связи с появлением на фармакологическом рынке
большого числа новых антиоксидантов, успешно апробированных в
эксперименте, но пока не нашедших достаточно широкого применения в
клинической практике.
При применении физиологических доз янтарной кислоты можно
выделить две группы эффектов: а) прямое действие янтарной кислоты
на клеточный метаболизм; б) влияние янтарной кислоты на транспорт
свободного кислорода в ткани. Пополнение пула кислот цикла Кребса,
нарушающееся при гипоксии, эндотоксикозах, ишемических
расстройствах, является необходимым механизмом поддержания
энергогомеостаза (Ленинджер А., 1966). Для пополнения пула всех
органических кислот цикла Кребса оказалось достаточным экзогенное
введение лишь одного сукцината (Кондрашова М.Н., 1976; 1979; 1996;
Маевский Е.И., 1989; Жуков А.А., 1988; Раевский К.С., Георгиев
В.П., 1986). Сукцинат является стимулятором синтеза
восстановительных эквивалентов в клетке за счет феномена быстрого
окисления его в цитоплазме, сопровождающегося быстрым ресинтезом
АТФ, на чем и основано повышение антиоксидантной резистентности
янтарной кислотой и ее производными. Кроме того, сукцинат
положительно влияет на оксигенацию внутренней среды, стабилизирует
структуру и функциональную активность митохондрий, является
индуктором синтеза некоторых белков, влияет на ионный обмен в
клетке (Кондрашева М.Н., 1976). Преимущества сукцината в скорости
окисления перед другими субстратами клеточного дыхания наиболее
выражено в условиях гипоксии, когда НАД-зависимый транспорт
электронов в дыхательной цепи тормозится, а активность
сукцинатдегидрогеназы и продукции эндогенного сукцината возрастает
(Кондрашова Н.М., 1976, 1979, 1996; Гуляева Н.В., 1986).
Исследования последних лет показали наличие у янтарной кислоты
биологической активности с уникальным сочетанием проявлений: по
отношению к здоровому организму сукцинаты выступают в роли
адаптагенов и актопротекторов, а при наличии патологических
проявлений проявляют нетипично высокий для адаптагенов
терапевтический эффект. Перспективно лечебное применение сукцинатов
при заболеваниях сердечно-сосудистой, дыхательной, эндокринной
систем, при желудочно-секреторной недостаточности и поражениях
печени различной этиологии, онкологических, психических
заболеваниях, в качестве стимуляторов посттравматической
регенерации; янтарная кислота используется в медицине для
профилактики состояния пониженной иммунологической реактивности и
для повышения адаптогенной устойчивости к стрессовым влияниям
(Зозуля Ю.А., Барабой В.А., Сутковой Д.А., 2000; Исаков В.А.,
2001; Романцов М.Г., 2000). При этом амплитуда и направленность
модификаций под действием янтарной кислоты зависят от
функционального исходного состояния тканей, а ее конечный результат
выражается в оптимизации параметров их функционирования. Такие
свойства позволяют отнести сукцинаты и, прежде всего фенольные
производные янтарной кислоты, к лечебно-профилактическим препаратам
нового поколения - к так называемым "умным лекарствам" (Кондрашева
М.Н., 1976, 1979, 1996; Сергеев П.В., 1991; Скулачев В.П., 1989;
Раевский К.С., 1986; Иваницкий Ю.Ю., 1996; Кулинский В.И., 1990;
Лужников Е.А., 1994; Зозуля Ю.А., 2000). Учитывая уникальную
разносторонность проявлений биологической активности янтарной
кислоты, сфера ее применения в медицинской практике является пока
еще чрезмерно узкой. Поэтому направление но созданию препаратов на
основе янтарной кислоты и расширение сферы применения уже известных
препаратов, является весьма перспективным.
Янтарная кислота, содержащаяся в органах и тканях, является
продуктом пятой и субстратом шестой реакции цикла трикарбоновых
кислот (Ленинджер А., 1966). Окисление янтарной кислоты в шестой
реакции цикла Кребса осуществляется с помощью специфического
фермента - сукцинатдегидрогеназы, характерной особенностью которой
является локализация на внутренней мембране митохондрий и
независимость её активности от концентраций окисленной и
восстановленной форм НАД/НАДФ, что позволяет сохранить
энергосинтезируюшую функцию митохондрий в условиях гипоксии при
нарушении НАД-зависимого дыхания клеток; выполняя каталитическую
функцию по отношению к циклу Кребса (Браун А.Д., 1977; Браунштейн
А.Е., 1987), янтарная кислота снижает концентрацию в крови других
интермедиатов цикла - лактата, пирувата и цитрата (Бариляк И.Р.,
1980; Ленинджер А., 1966; Березов Т.Г., 1983; Маевский Е.И.,
Гришина Е.В., 1989; Раевский К.С., 1986).
Янтарная кислота в организме нормализует содержание гистамина и
серотонина в крови и повышает микро циркуляцию в органах и тканях,
не оказывая, влияния на артериальное давление и показатели работы
сердца. Экзогенное поступление в организм янтарной кислоты, как
показано экспериментальным путем, нормализует активность
сукцинатдегндрогеназы, ограничивает зону некроза в миокарде, при
этом усиливается биоэлектрическая активность сердца, улучшается
геодинамика и увеличивается толерантность сердца к физическим
нагрузкам (Исаков В.А., Коваленко А.Л., 2001; Батоцыренов Б.В.,
1998; Жуков А.А., 1988; Ивницкий Ю.Ю., 1998; Кондрашова М.Н., 1979).
Противоишемический эффект янтарной кислоты связан не только с
активацией сукцинатдегидрогеназного окисления, но и с
восстановлением активности ключевого окислительно -
восстановительного фермента дыхательной цепи митохондрий клеток
-цитохромоксидазы (Кондрашева М.Н., 1976, 1979, 1996; Гуляева Н.В.,
1986; Самарченко Л.А., 1989; Меерсон Ф.З., 1984)
В условиях экспериментального шока, вызванного 10-минутной
остановкой сердца, янтарная кислота снижала уровень свободно
радикальных процессов в мозге и сыворотке крови, ослабляла
деструкцию мембранных элементов нейронов и способствовала полному
восстановлению функций и структуры мозга (Кондрашова М.Н., 1979;
Ивницкий Ю.Ю., 1998; Гусев Е.И., Скворцова В.И., 2001). В
постреанимационном периоде янтарная кислота способствовала
нормализации функций центральной нервной системы, снижала
чувствительность животных к стрессу, накопление
свободно-радикальных продуктов и восстанавливала морфологические
изменения в крови и головном мозге (Биленко М.В., 1989; Гуляева Н.В., 1986; Ивницкий Ю.Ю., 1996).
Янтарная кислота, проявляя антиоксидантные свойства (Кондрашева
М.Н., 1996), ингибирует, индуцируемые ионами железа в условиях
ишемии и гипоксии, процессы перекисного окисления липидов (Гусев
Е.И., Скворцова В.И., 2001). В присутствии янтарной кислоты
отмечается повышение усвояемости железа за счет образования хорошо
растворимых в воде комплексов, которые быстро всасываются в тонком
кишечнике, не разрушаясь и не образовывая не усваиваемых гидратов
трехвалентной окиси железа (Ерюхин И.А., 1995; Кулинский В.И.,
1990; Гуляева Н.В., 1986; Клименко В.Н., 1993).
Таким образом, янтарная кислота, являясь фармакологически высоко
активным соединением, может быть использована для получения
лекарственных препаратов с улучшенными фармакологическими
свойствами истинных антиоксидантов, тем более, что
зарегистрированных лекарственных форм, содержащих ее в качестве
основного компонента, немного (Машковский 2000).
Использование современных нейропротекторов на основе фенольных
производных янтарной кислоты в различных модификациях, обладающих
многокомпонентным антигипоксическим, антиоксидантным, и вазо и
реопротекторным и дезинтоксикационным действием становится
целесообразным в условиях развития тканевых постгипоксических и
эндотоксических церебральных расстройств, как это имеет место у
больных синдромом полиорганной недостаточности, который может
рассматриваться как универсальная модель комплексного (сосудистого
макро и микроциркуляторного ишемическо-гипоксического поражения
головного мозга в результате массивного цитокинового каскада с
вторичным вовлечение в патологический процесс корковых,
лимбико-ретикулярных, мезодиенцефальных и стволовых церебральных
структур и развитием различных неврологических синдромов, таких как
синдромы энцефалопатии, острого нарушения мозгового кровообращения,
энцефалополинейропатии, миелоишемии, надсегментарной вегетативной
дисфункции. В клинической неврологической, реанимации
нейрореанимационной практике в последние годы описаны (Зильбер
А.П., 1998; Румянцева С.А., 2001) как синдромы поражения структур
центральной и периферической нервной системы при СПОН, так и
различные степени тяжести сочетанных неврологических расстройств,
оцениваемые по количественным шкалам неврологического дефицита.
Высокая активность янтарной кислоты нашла применение в
дезинтоксикационном растворе "Реамберин 1,5% для инфузий", в состав
которого входят: активное вещество - смешанная натрий
N-метилглюкаминовая соль янтарной кислоты, составляющая 1,5%
раствор янтарной кислоты и микроэлементы в оптимальных
концентрациях (магния хлорида 0,012%, калия хлорида 0,03% и NaCl
0,6% в инфузионной форме 400 мл раствора во флаконе)
В комплексе терапии больных синдромом полиорганной
недостаточности 1,5% раствор реамберина использовали в суточной
дозе 400 - 800 мл раствора со скоростью 20-30 капель в минуту в
течение 5-7 суток. Данная доза была клинически эффективной. В
таблице 48 представлены данные динамики неврологического статуса и
состояния сознания у больных СПОН на фоне применения реамберина.
Препарат реамберин включали в комплекс интенсивной терапии больных
СПОН со 2-3 суток диагностики данного синдрома вне зависимости от
уровня депрессии сознания, в том числе на фоне проведения
нейровегетатавной блокады. При анализе данных динамики
неврологического статуса было отмечено положительное влияние
комплексной интенсивной терапии с включением реамберина на такие
показатели неврологического статуса как состояние сознания,
расстройства мышечного тонуса, частоту возникновения и клинические
проявления вторичного стволового синдрома, а также на частоту и
характер развития вегетативно-трофических расстройств. Наиболее
значимой была динамика состояния сознания у больных с синдромом
энцефалопатии и энцефалополинейропатии при фоновой депрессии
сознания до уровня комы 1, комы 1-2. При более глубоких
расстройствах сознания динамика клинической симптоматики была
незначительной. Наиболее эффективным было применение реамберина у
больных СПОН, развившемся на фоне критических состояний, связанных
с гипоксическими факторами (клиническая смерть, наркозные
осложнения, циркуляторные гиповолемические расстройства со
вторичной гипоксией). У двух больных при введении препарата в дозе
800 мл в сутки непосредственно после клинической смерти (в период
первых 5 минут после успешных реанимационных мероприятий) была
отмечена значительная положительная динамика в виде активации
состояния сознания от комы 4 до сопора, быстрое восстановление
самостоятельного дыхания, быстрая стабилизация параметров
системного гомеостаза, уменьшение выраженности расстройств
мышечного тонуса и значительное уменьшение выраженности
вегетативно-трофических нарушений, имевших место у больных со
сходной фоновой тяжестью состояния после клинической смерти.
На рисунке 1 представлены спектрограммы ЭЭГ больного А., 40 лет
сразу после успешных реанимационных мероприятий после клинической
смерти (у больного имел место СПОН в результате массивного
желудочно-кишечного кровотечения из язвы желудка, был оперирован,
язва ушита, на фоне циркуляторной анемии у больного через 2 суток
после операции развилась клиническая картина полиорганной
дисфункции с острой дыхательной недостаточностью и клинической
смертью). На рисунке 2 представлены спекрограммы того же больного
через 40 минут после введения 800 мл реамберина. Прослеживается
значительное нарастание суммарной мощности спектра ЭЭГ
преимущественно за счет частот альфа и дельта- диапазонов. На
рисунке 3 спектрограмма больного А. через 3 суток на фоне
продолжения терапии реамберином, при хорошей клинической динамике
состояния больного: депрессия сознания до уровня сонливости,
незначительное диффузное снижение тонуса, отсутствие патологических
стопных знаков и признаков вторичного стволового синдрома,
самостоятельное дыхание, суммарная оценка по шкале полиорганной
дисфункции - 4 балла, суммарная оценка по шкале неврологического
статуса 35 баллов. Прослеживается дальнейшее нарастание мощности
спектра ЭЭГ за счет нарастания частот альфа и бета-диапазона.
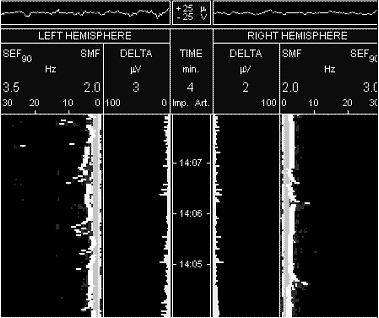
Рис. 1.
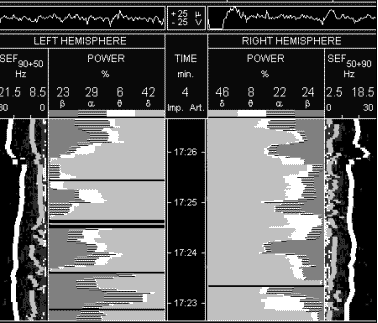
Рис. 2.
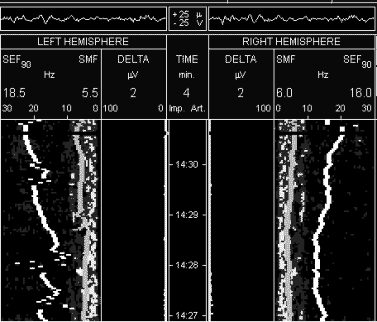
Рис. 3.
Количественная оценка тяжести неврологических расстройств при СПОН на фоне применения реамберина у больных
при различных степенях тяжести неврологических расстройств представлена в таблице 1.
Помимо положительного влияния на отдельные параметры
неврологического статуса у больных на фоне применения реамберина
было отмечено снижение летальности на 7 % при 1 степени тяжести
неврологических расстройств, на 6% - при 2 степени тяжести, на 3 %
при 3 степени тяжести, и на 2 % при 4 степени тяжести
неврологических расстройств. Постепенное снижение влияния массивных
доз антиоксидантной терапии реамберином на уровень летальности
больных СПОН при увеличении степени тяжести неврологических
расстройств может быть, как и при использовании других видов
нейропротективной терапии, связано с крайне тяжелыми степенями
поражения церебральных структур.
В таблице 2 представлена количественная оценка тяжести неврологических
расстройств при СПОН на фоне стандартной терапии у больных при
различных степенях тяжести неврологических расстройств.
При включении реамберина в комплексную терапию положительное
влияние препарата, отмечавшееся по данным динамики неврологического
статуса и снижения летальности подтверждалось при проведении
электроэнцефа-лографического мониторинга нативных
электроэнцефалограмм и спектрального анализа ЭЭГ.
В таблице 3 представлены данные динамики суммарной мощности и
частотного распределения спектрально-энергетических характеристик
ЭЭГ у больных на фоне применения реамберина. При этом у 30% больных
СПОН при применении реамберина отмечалось нарастание суммарной
мощности спектров ЭЭГ в среднем на 20-25% от фоновой мощности
спектров непосредственно после инфузии препарата при его
использовании у больных с различными уровнями фоновой суммарной
мощности спектров ЭЭГ в том числе со средним и высоким; на 2-3
сутки от начала применения у больных СПОН при его использовании у
больных с исходно низким и средним уровнем суммарной мощности
спектра ЭЭГ эта тенденция сохранялась. При повторных введениях
препарата суммарная мощность спектра ЭЭГ увеличивалась в среднем на
25-30% от фоновой и сохранялась весь период применения препарата (в
среднем 5-10 суток) и после окончания его инфузий, что совпадало с
улучшением клинической симптоматики, прежде всего с активацией
состояния сознания у больных СПОН, а также с уменьшением
выраженности вегетативных расстройств и системных расстройств
гомеостаза. На фоне фонового церебрального гиперметаболизма и очень
высоких фоновых уровней спектральной мощности ЭЭГ (выше 80 мвк2)
положительная динамика состояния спектральной активности ЭЭГ,
проявлявшаяся в снижении выраженности представленности
медленно-волнового диапазона спектра ЭЭГ и нарастании мощности
частот альфа-диапазона отмечалась у 10% больных. У данной группы
больных нарастание мощности спектра ЭЭГ сопровождалось активацией
состояния сознания до более высокого уровня (практически во всех
случаях от глубокого сопора до сопора или сонливости) на фоне
применения реамберина или через 2-3 часа после окончания инфузии. У
остальных пациентов динамики состояния функциональной активности
мозга на фоне применения реамберина не отмечалось.
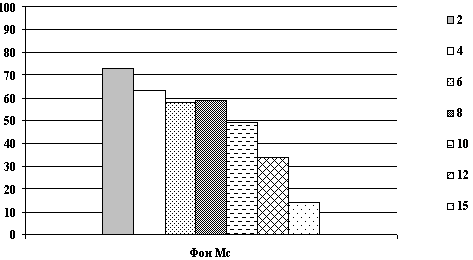
На рисунках представлены графики динамики суммарной мощности ЭЭГ
и частотно-энергетического распределения в дельта и
альфа-диапазонах до и после применения реамберина при различной
степени тяжести СПОН.
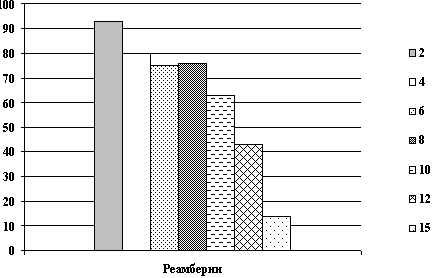
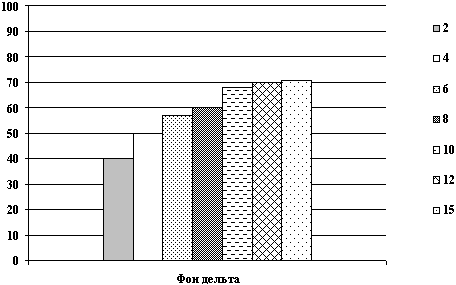
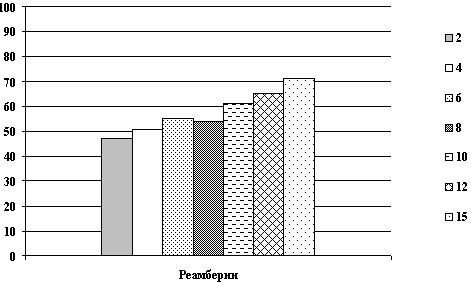
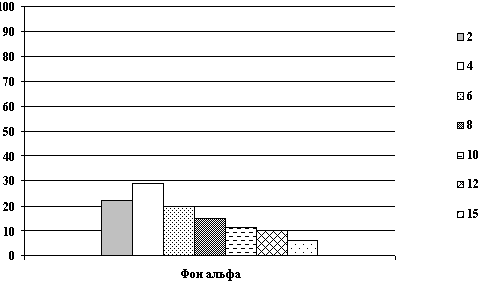
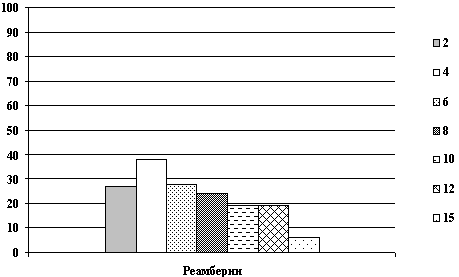
Все энцефалографические исследования проводились в динамике до,
после введения препарата (через 30 минут после окончания инфузии),
на 2, 5, 7 и 10 сутки после применения препарата. В ходе
клинического применения препарата реамберин было выявлено
несомненное положительное его влияние на течение неврологических
расстройств у больных СПОН. Оно проявлялось прежде всего в
активации состояния сознания у 65% больных с синдромом
энцефалопатии, у 2-х больных с нарушением мозгового кровообращения
и у 28% больных с явлениями энцефаломиелополинейропатии. У 8%
больных положительная динамика по данным КСА ЭЭГ и уровню состояния
сознания была отмечена в отсроченный период - через 5 - 10 суток
после окончания первого курса применения препарата. Активация
состояния сознания у больных с энцефалопатией является несомненным
положительным прогностическим признаком и свидетельствует о
стимуляции нейротрофических процессов в ретикулярной формации
ствола головного мозга и в корковых структурах.
Отсутствие динамики состояния сознания в группе больных с крайне
выраженным уровнем угнетения сознания имело место у больных с 4
степенью тяжести неврологических расстройств на фоне грубых
морфологических изменений в мозге, подтвержденных впоследствии при
патологоанатомических исследованиях, и свидетельствовало о
невозможности вообще какого-либо нейропротективного
фармакологического воздействия на структуры мозга вследствие
запредельного угнетения рецепторной синаптической активности.
Активизация состояния сознания у больных на фоне лечения
реамберином корреллировала с активацией функциональной активности
головного мозга по данным мониторинга ЭЭГ. Отмеченное нарастание
представленности частот быстро волновой части спектра ЭЭГ по
сравнению с медленно волновой, что несомненно является
благоприятным электрофизиологическим признаком и свидетельствует о
нормализации рецепторной активности коры и подкорково-стволовых
образований.
Включение реамберина в комплексную терапию постгипоксических
расстройств у больных, перенесших критическое состояние, несомненно
способствует повышению резистентности к гипоксии и снижению
выраженности клинических проявлений синдрома полиорганной
недостаточности, и, в частности, энцефалопатии.
Комплексное использование антиоксидантов, в том числе
реамберина, в ранние сроки развития ишемических, гипоксических и
токсических поражений мозга является одним из наиболее оптимальных
методов патогенетической терапии, значение такой терапии возрастает
по мере углубления тяжести состояния больного.
Преимущества реамберина перед антиоксидантами и
нейропротекторами других групп заключается как в высокой
антиоксидантной активности данного препарата, так и в одномоментном
проведении сбалансированной инфузионной терапии, учитывая готовую
инфузионную форму данного препарата. Помимо этого данный препарат,
как показывают данные электроэнцефалографического мониторинга,
может быть использован в ранние сроки критических состояний, в том
числе, одномоментно с проведением нейровегетативной блокады,
поскольку стабилизирует функциональное состояние головного мозга
при фоново низких, средних и даже при фоново высоких уровнях
церебрального метаболизма, что свидетельствует о благоприятном
влиянии антиоксиданта реамберина на структурно-морфологическое и,
следовательно, функциональное состояние ритикуло-стволовых и
корковых церебральных структур.
Своевременное использование антиоксидантов, т. е. препаратов,
нормализующих энергетику тканей и восстанавливающих баланс между
прооксиднтными и антиоксидантными системами, является оптимальной
стратегией для восстановления жизнеспособности ишемизированных
тканей, что является особенно актуальным для сохранения структурной
целостности и адекватной функциональной активности мозга при
сосудистых поражениях.
Литература
- Алабовский В.В., Хамбуров В.В., Винокуров А. Ослабление
реперфузионного повреждения с помощью системы Na/Ca - обмена.
Нейрохимия, 1996, т. 13, N4, с. 320-327.
- Александрова А.Е., Болдина И.Г., Болдышева А.В. и др.
Эффективность совместного применения антигипоксантов и
антиоксидантов при туберкулезе. Проблемы туберкулеза, 1988, N6, с.
62-65.
- Андросов K.A., Варфоломеев H.А., Воробьев Р.Л. и др.
Эффективность антигипоксантов и антиоксидантов при воздействии
низкочастотного акустического шума. Антигипоксанты и
актопротекторы. Итоги и перспективы. -СПб., 1994, с. 11.
- Антипенко А.Е., Красовская И.Е., Диже Г.П. и др. Взаимное
влияние фосфорилирования, окисления и протеолиза на транспорт
кальция в саркоплазматическом ретикулуме сердца и сосудов; //Докл.
АН, 1992, т. 326, N5, с. 920-923.
- Антоненкова Е.В. Сравнительная фармакологическая характеристика
антигипоксантов олифена и амтизола как средств патогенетической
терапии туберкулеза. Автореф. дис. канд. мед. наук. -СПб 1996, 20
с.
- Биленко М.В. Ишемические и реперфузионные поражения органов
(Молекулярные механизмы, пути предупреждения и лечения).-М.:
Медицина, 1989.- 386 с.
- Воронина Т.А. с соавт. Механизм действия и обоснование
применения препарата мексидол в неврологии. Материалы
научно-практической конференции по неврологии. М., 2000. - 14
с.
- Гуляева Н.В. Перспективы создания лекарственных препаратов на
основе карнозина. Биохимия. 1992. т. 57, N9. стр. 1398 -1403.
- Гусев Е.И. с соавт. Механизмы повреждения ткани мозга на фоне
острой фокальной ишемии мозга. Журнал невропатологии и психиатрии
им. С.С. Корсакова.-1999.-т. 99, N2. с. 65 -70.
- Дюмаев К.М. с соавт. Антиоксиданты в профилактике и терапии
патологии ЦНС.-М.: Издание института биомед. химии РАМН, 1995. 272
с.
- Береговая Е.Д. Фармаклогия и токсикология.-1990. т. 53.5, с.
34-37.
- Березов Т.Т. Биологическая химия. М. Медицина, 1983.-с.
597.
- Бариляк И.Р. Действие сукцината натрия на развитие крыс. М.,
1980. Рукопись депонирована в ВИНИТИ.
- Башкатова В.Г., Раевская К. С. Оксид азота в механизмах
повреждения мозга, обусловленных нейротоксическим действием
глутамата// Биохимия, 1998, т. 63, вып. 7, с. 1020-1028.
- Белоусова В.В., Дудченко А. М., Лукьянова Л. Д. Роль гликолиза
в подержании энергетических функций гепатоцитов. //Бюлл. эксп.
биол. и мед., 1995, т. 119, N1, с. 28-32.
- Биленко М.В. Ишемическое и реперфузионное повреждение органов:
молекулярные механизмы, пути предупреждения и лечения. -М.:
Медицина, 1989. –367 с.
- Болдина И.Г., Миловский В. Г. Перспективы использования
антигипоксантов при коррекции нарушения энергооброзования при
эндогенной интоксикации. // Антигипоксанты и антиоксиданты. Итоги и
перспективы.- СПб., 1994, с. 19.
- Бровкович В.М. Влияние тотальной ишемии на Са-транспортирующую
активность саркоплазматического ретикулума миокарда крыс//Укр.
биохим. журн., 1990, т. 62, N4, с. 72-76.
- Брюно Б., Сандау К., фон Кнетен А. Апоптотическая гибель
клеток и окись азота: механизмы активации и антагонистические
сигнальные пути. Биохимия, 1998, т. 63, вып. 7, с. 966-975.
- Бурлакова Е.Б., Храпова Н.Г. Перекисное окисление липидов
мембан и природные антиоксиданты. Успехи химии, 1985, т. 54, N9, с.
1540-1558.
- Бурлакова Е.Б. Биоантиоксиданы: новые идеи и повторение
пройденного //Биоантиоксидант. Междунар. симп. в рамках между нар.
выставки "Медицина и охрана здоровья" (Тюмень, 16-19 сентября 1997
г.): Изд-во Тюменьского гос. Университета, 1997, с. 3-4.
- Ванин А.Ф. Окись азота в биологии: история, состояние и
перспективы исследования//Биохимия, 1998, т. 63, вып. 7, с.
867-869.
- Владимиров Ю.А. Арчаков А.К. Перикисное окисление липидов в
биологических мембранах. -М.;Наука, 1972, 252с.
- Волин М.С., Дэ видео н К. А., Камински П. М.и др. Механизм
передачи сигнала оксидант - оксид азота в сосудистой
ткани//Биохимия, 1998, т. 63, вып. 7, с. 958-965.
- Волков Н.И., Хоронюк С.Л. Применение антиоксиданов
полифенольного ряда для коррекции тканевой гипоксиии при мышечной
деятельности .Антигипоксанты и актопротекторы. Итоги и
перспективы,- СПб., 1994, с. 180.
- Гайнуллин Р.3., Медвинский А.Б., Кожура А.Ф. и др.
Электрофизиологическое исследование антиаритмического действия
антиоксиданта ионола . Бюлл. эксп. биол. и мед.1991. т, 112, N8, с.
167-169.
- Гацура В.В., Смирнов Л.Д. Кардиотропные свойства некоторых
синтетических антиоксидантов // Хим.-фарм. жури., 1992, т. 26,
N11-12, с. 10-15.
- Глубокий Ю.И., Курский М.Д., Задорина О.В. и др.Транспорт
кальция в эндоплазматическом ретикулуме печени крыс при активации
перекисного окисления липидов //Биохимия, 1995, т. 55, вып. 1. с.
12-21.
- Гуляев а Н.В., Ерин А.Н. Роль свободонорадикальных процессов в
развитии нейродегенеративных заболеваний// Нейрохимия, 1995, т. 12,
вып. 2, с. 3-10.
- Гусаков И.В., Голубев А.Г., Опарина Т.И. и др. Исследование
эффекта антигипоксантов на различных моделях эпилепсии //
Антигипоксанты и актопротекторы. Итоги и перспективы. -СПб., 1994,
с. 34.
- Душкин М.И. Биологическая роль окисленных производных
холестерина в клетках млекопитающих //Успехи сов. биол., 1991, т.
111, вып. 6, с. 845-857.
- Ерин А.Н., Гуляева Н.В., Никушкин Е.В. Свободонорадикальные
механизмы в церебральных патологиях// Бюлл. совр. биол. и мед.,
1994, т. 118, N10, с. 343-348.
- Зенков Н.К., Меньшикова Е.Б. Окислительная модификация
липопротеинов низкой плотности.Успехи совр. биол., 1996, т. 116,
вып. 6, с. 729-738.
- Исаков В.А., Туркин В.В., Киселев О.И. и др. Использование
антиоксидантов в терапии гриппа.- СПб.: НИИ гриппа. 1996,49 с.
- Киселев О.И., Шаронов Б.П.. Смородинцева О.М. Развитие
гриппозной инфекции и токсичность молекулярного кислорода. Клиника,
патогенез и лечении гриппа и других ОРЗ. -Л., 1989, с. 63-75.
- Крылов Ю.Ф. Любимов А.Б., Мулер А.Г. Перспективы использования
эйкозапентаеновой и докозагексаеновой кислот как лекарственных
средств// Хим.-фарм. жури., 1991, т. 25, N9, с. 4-10.
- Кузтина Е.Н., Глушенко Н.Н. Влияние железа, цинка, меди на
процесс перекисного окисления липидов печени in vivo //Биохимия,
1996, т. 61, вып. 6, с. 993-997.
- Кулинский В.И., Колесниченко Л.С. Биологическая роль
глутатиона//Успехи совр. биол., 1990, т. 110, вып. 1, с. 20-32.
- Лукьянова Л.Д. Биоэнергетическая гипоксия: понятие, механизмы
и способы коррекции. Бюлл. эксп. биол. и мед., 1997, т. 124, N9, с.
244-254.
- Машковский М.Д. Лекарственные средства. В двух томах, т. 2.
Изд. 13-е, новое.-Харьков: Торсинг, 1997, с. 88-89.
- Меньшикова Е.Б., Зенков Н.К. Антиоксиданты и ингибиторы
радикальных окислительных процессов. Успехи совр. биол., 1991, т.
113, вып. 4, с. 442-455.
- Меньшикова Е.В., 3енков Н.К. Окислительный стресс при
воспалении. Успехи совр. биол., 1997, т. 117, вып. 2, с.
155-171.
- Меньшикова Е.В., Зенков Н.К., Сафина А.Ф. Механизмы развития
окислительного стресса при ишемическом и реперфузионном повреждении
миокарда /Успехи совр. биол, 1997, т. 117, вып. 3, с. 362-373.
- Мусил Я. Основы биохимии патологических процессов. - М.:
Медицина, 1985, 432 с.
- Пауков В.С., Проценко Д.Д. Рекомбинационные преобразования
митохондрий в поврежденных кардиомиоцитах. Бюлл. эксп. биол. имед,
1998, т. 125, N3, с. 244-250.
- Полинг Л. Витамин С и здоровье. - М.: Наука, 1975,80 с.
- Рубин А.Б., Шинкарев В.П. Транспорт электронов в биологических
системах. -М.: Наука, 1984. с. 6-21.
- Сазонтова Т.Г., Белкина Л.М., Сянцунь Фу и др.
Са-транспортирующая система и повреждение мембран
саркоплазматического ретикулума левого желудочка сердца крысы при
ишемии и реперфузии//Бюлл. эксп. биол. и мед., 1994, т. 121, N2, с.
1335.
- Северина И.С. Растворимая гуанилатциклаза в молекулярном
механизме физиологических эффектов оксидов азота. Биохимия, 1998,
т. 63, вып. 7, с. 939-947.
- Селищева А.А., Козлов Ю.П. Метаболизм фосфолипидов и
биологические мембраны. -Иркутск: Изд-во Иркутского университета,
1988, 88 с.
- Скоричев В., Конь И.Я. Биологическая роль жирорастворимых
витаминов. Итоги науки и техники. Сер. физиологи) человека и
животных. /АН. ВИНИТИ. -М.: 1989,т. 37,225 с.
- Скулачев В.П. Нефосфорилирующее дыхание как механизм
предотвращения образования активных форм кислорода. Молекуляр.
биол., 1995, т. 29, вып. 6, с. 1199-1209.
- Скулачев В.П. Соотношение окисления и фосфолированн в
дыхательной цепи. - М.: Изд-во АН СССР, 1962, 156 с.
- Скулачев В.П. Старение организма - основная биологическая
функция, а не результат поломки сложной живой системы. Химическо
обоснование гипотезы Вейсмана//Биохимия, 1997, т. 62, вып. 11, с.
1994-1999.
- Скулачев В.П. Трансформация энергии в биомембранах. -М.:
Наука, 1972, 197 с.
- Скулачев В.П. Энергетика биологических мембран. -М.: Наука.
1989, 564 с.
- Тейлор Б.С., Алерсон Л.Х., Биллиар Т.Р. Индуцибельная синтаза
окиси азота в печени: регуляция и функции//Биохимия, 1998, т. 63,
вып. 7, с. 905-923.
- Тимошин А.А., Лакомкин В.А., Рууге Э.К. Свободно-радикальные
центры в тканях изолированного сердца крысы в норме, при ишемии и
реперфузии//Биофизика, 1993, т. 38, вып. 1, с. 179-185.
- Третьякова Л.3. Окислительная модификация цитохрома Р-450 при
его работе. 1. Сравнительные исследования инактивации цитохрома
Р-450 L M2 в различных системах. Биохимия, т. 56, вып. 7, с.
1190-1199.
- Труфанов В.А., Кичатикова С.В., Шатилов В.Р. и др. Ферменты
тиол-дисульфидного обмена белков. Прикл. биохимия и микробиол.,
1990, т. 26, вып. 1, с. 3-10.
- Тулупов А.Н. Патогенез и коррекция гемореологических нарушений
у больных сепсисом. Автореф. дис. докт. мед. наук. -СПб.: ВМедА.,1991, 46 с.
- Федоров Б.М. Стресс и система кровообращения. - М.: Медицина,
1991, с. 5-31.
- Фананашвили Я.А., Демидов А.А. Корректирующее влияние эмоксина
и олифена на развитие артериальной гипертензии и церебральных
нарушений у спонтанно гипертензивных крыс. Биоантиоксидант.
Междунар. симп. в рамках междунар. выставки "Медицина и охрана
здоровья" (Тюмень, 16-19 сент. 1997г. ): Изд-во Тюменского гос.
Университета, 1997, с. 78.
- Xеифман Л. Смертность и бессмертие на клеточном уровне.
Биохимия, 1997, т. 62, вып. 11, с. 1380-1393.
- Чудакова В.В.,3ахарова В.И.,Алексеев С.М.и др. Образование
комплекса между α-токоферолом и гидроперикисями жирных кислот в
гомогенных растворителях. Докл. АН, 1992, т. 322, N4, с.
773-775.
- Шутенко Ж. В. Поиск антидиабетических и кардио-протекторных
средств среди ингибиторов р-окисления. Хим.-фарм. журн., 1991, т.
25, N7, с. 4-11.
- Реамберин в терапии критических состояний. Руководство для
врачей. СПб.2001, 157 стр.
- Эмануэль Н.М. Окисление углеводородов в жидкой фазе. -М.:
Изд-во Акад. наук, 1959, 334 с.
- Яльченко Н.А. Клиническая характеристика отдельных компонентов
системы антиоксиданов в процессе комплексной терапии больных раком
желудка. Эксп. онкология, 1996, т. 18, N 1, с. 59-63.
- Appleman M.M., Araino M. A., Takemoto D.J., Whitsоn R. H. Cyclic Nucleotide Phosphodiesterases //Cyclic Nucleotides/Eds.
J.A. Nathanson, J. W. Kabalian.-Berlin: Springer-Verlag, 1982,
vol.1, p. 261-300.
- Вisbу R.H. Interactions of vitamin E with free radicals and
membranes//Free Rad. Res. Comms.. 1990, vol. 8, N4-6, p.
299-306.
- Jaite M., Emilio deJ., InmacaladaS. Oxigen - induced
mitochrondrial damage and aging//Free radicals and aging. /Eds. J.
Emerit, B. Chance. - Basel: Birkhauser, 1992, p. 47-57.
- Lenaz G., De Santis A., A survey of the Function and
specificity ofUbiquinone in the Mitochrondrial respiratory
chain//Cocnzyme Q / Ed. G. Lenaz.- Chichester Wiles, 1985, p.
165-199.
- Mitchell P. Possible molecular mechanisms of the protonmetive
function of cytocrome systems//J. Theor. BioL, 1976, vol. 62, p.
327-367.
- Mitсhеll P. Coupling of phosphorylation to electron and
hydrogen transfer by a chemiosmotic type of mechanism//Nature,
1961, vol. 191, p. 144-148.
- Ozawa T. Formation of oxygen radicals in the electron transfer
chain and antioxydant properties ofcoenzyme Q//Coenzyme Q. /Ed. G.
Lenaz.-ChichesterWiles.. 1985, p. 441-457.
- Riсhtеr С. Do mitohondrial DNA fragment promote cancer and
aging 7//FEBS Lett., 1988, vol. 241, p. 1-5.
- Floyd R. Role of oxygen free radicals in brain ishemia
FASEB.-1990. 4, N 9., p 2587-2597.
- Fragata М .Model of singlet oxygen scavenging by α-tocoferol
in biomembrans. Chem. and Phis. Lipids. 1990. 27. n. 2. p.
93-99.
- Nakachima M. Involvement of free radicals in cerebral vascular
reperfushion injury evaluated in a trancient focal cerebral ishemia
model of rats Free. Radic. Biol. Med. -1999.-26 N 5-6, p
722-729.
|
|
|
Ліцензія Державної інспекції з контролю якості лікарських засобів МОЗ України з оптової торгівлі лікарськими засобами АВ №528116
| 2024 ТОВ "Аптечний склад медичної академії" |
|
* webmaster |
|