Под наблюдением в отделении дерматоаллергологии Российской
детской клинической больницы находилось 112 детей, страдающих
атопическим дерматитом, в возрасте от 10 до 15 лет. У всех детей
диагноз «атопический дерматит» был поставлен на основании
совокупности диагностических критериев, сформулированных и
основанных на работах Hanifin и Rajka (1980), дополненных и
признанных как международные Британской группой специалистов в
1994 году.
У всех детей заболевание носило упорный, хронически
рецидивирующий характер. Пациенты с давностью заболевания более 3,5
лет неоднократно получали традиционное лечение в амбулаторных
условиях и стационарах, которое включало антигистаминные препараты
(супрастин, тавегил, кларитин), гипосенсибилизирующие средства
(препараты кальция, тиосульфат натрия), седативные препараты
(седативные микстуры, ново-пассит, нередко – транквилизаторы),
ферментные препараты (фестал, мезим – форте, панзинорм),
витаминотерапию. Наружно использовались мази и пасты с ихтиолом,
нафталаном, различные смягчающие и увлажняющие кремы, а также мази
и кремы, содержащие стероидные препараты.
Однако, проводимая терапия в большинстве случаев была
малоэффективной, и вскоре после окончания лечения наступали
рецидивы заболевания.
Средняя продолжительность ремиссии до 1 месяца была
констатирована у 24,1%, от 1 до 3 месяцев – у 61,6%, а от 4 до 6
месяцев – у 10,7% , пациентов, более 6 месяцев лишь – у 3,6%
больных. У 71,4% больных – обострения наступали в осенне-зимний и
зимне весенний периоды с более или менее выраженным улучшением
кожного процесса в летнее время. Ухудшение атопического дерматита
в летний период было отмечено в 28,6% случаев. Длительный,
непрерывно – рецидивирующий характер течения заболевания наблюдался
у 21% подростков. Первые проявления атопического дерматита у 68,7%
больных возникли на 1-м году жизни, а у 31,3% только после
окончания грудного возраста.
У большинства наблюдаемых детей (62,6%) был выявлен
положительный семейно – наследственный анамнез по атопии: по линии
матери – в 25% случаев, по линии отца – в 17,9%, по линии обоих
родителей – в 13,4%, а по линии братьев и сестер – у 6,3%
наблюдаемых, у ближайших родственников – у 8,9% пациентов.
Сопутствующие заболевания отмечены у 82,1% обследуемых детей.
Среди них чаще всего встречались заболевания желудочно-кишечного
тракта – в 68,8% случаев, невротические реакции и вегето-сосудистые
расстройства – у 59,8% наблюдаемых, бронхиальная астма – у 29,8%
пациентов, эндокринопатии – в 10,7% случаев, риниты и
конъюнктивиты – в 9,8% случаев.
Группу больных – группу с легкой степенью тяжести течения
заболевания (kS до 20) – составили 24 больных детей (14 мальчиков
и 10 девочек), со средним значением kS = 17 в целом по группе.
Во II группу вошли 51 пациент со средней степенью тяжести
кожного процесса (kS от 20 до 40). Количество девочек здесь
составило 34, а мальчиков – 17 человек, что вместе составило 45,5%
от общего числа наблюдаемых нами детей. Значение kS в среднем по
группе равно 38. 37 человек (10 мальчиков и 27 девочек) составили
III группу больных с тяжелым течением заболевания (kS > 40).
Среднее значение kS в этой группе равнялось 69.
Таблица 1. Возможные причины развития заболевания
атопическим дерматитом у детей
|
Возможные причины заболевания
|
Возраст
|
Всего
|
|
До 1 года
|
Старше года
|
|
Абс.
|
%
|
Абс.
|
%
|
Абс.
|
%
|
|
Искусственное вскармливание или введение прикорма
|
59
|
52,7
|
-
|
-
|
59
|
52,7
|
|
Профилактические прививки
|
8
|
7,1
|
2
|
1,8
|
10
|
8,9
|
|
Перенесенные заболевания и медикаментозная терапия
|
7
|
6,3
|
7
|
9,8
|
18
|
16,1
|
|
Нервно-конфликтные (стрессовые) ситуации
|
-
|
-
|
13
|
11,6
|
13
|
11,6
|
|
Неустановленные причины
|
5
|
3
|
7
|
7,5
|
12
|
10,7
|
|
Всего
|
79
|
68,7
|
33
|
31,3
|
112
|
100
|
Для объективной оценки степени тяжести течения заболевания и
эффективности проводимой терапии использован коэффициент SCORAD,
учитывающий площадь поражения кожи, степень выраженности
объективных и субъективных симптомов.
В соответствии с полученными значениями коэффициента SCORAD
наблюдаемые больные разделены на 3 группы (табл. 2) по степени
тяжести течения кожного процесса.
Таблица 2. Распределение больных
по степени тяжести атопического дерматита (SCORAD)
|
Группы больных / Степень тяжести забо-
левания (kS)
|
Ср. знач. kS по груп-
пе
|
Мальчики
|
Девочки
|
Кол-во больных в группе
|
|
Абс.
|
%
|
Абс.
|
%
|
Абс.
|
%
|
|
I
Легкая
(0-20)
|
17
|
14
|
12,5
|
10
|
8,9
|
24
|
21,4
|
|
II
Средняя
(20-40)
|
38
|
17
|
15,2
|
34
|
30,4
|
51
|
45,5
|
|
III
Тяжелая (>40)
|
69
|
10
|
8,9
|
27
|
24,1
|
37
|
33,1
|
|
Общее количество больных АД
|
41
|
366
|
71
|
63,4
|
112
|
100
|
Проведенное обследование больных, включающее углубленный сбор
аллергологического анамнеза, клинический осмотр, оценку тяжести
течения заболевания (коэффициент SCORAD), позволило выделить
общепринятые клинические формы атопического дерматита:
эритемо-сквамозная с лихенификацией – 55 человек (49,1%) и
лихеноидная – 32 человек (28,6%) формы атопического дерматита.
Таблица 3. Распределение больных атопическим дерматитом
по степени тяжести заболевания
Результаты изучения процессов ПОЛ
и компонентов антиоксидантной системы
у больных атопическим дерматитом
Одним из важных патогенетических механизмов атопического
дерматита являются нарушения кровообращения и микроциркуляции с
формированием спазма артериол, венозного застоя, нарушением
транскапиллярного обмена. По напряжению кислорода в коже, скорости
его доставки и утилизации можно судить о степени развития гипоксии
и прогнозировать степень дальнейшего повреждения (Л.В. Епишева,
1992; Е.Т. Маруденко, 1998).
Оценивался кислородный режим в очагах поражения и в
непораженной коже у детей с различной степенью тяжести
атопического дерматита. У больных атопическим дерматитом исходное
напряжение кислорода (рО2 исх.) в очагах поражения и в
непораженной коже было достоверно ниже, чем у детей в контрольной
группе.
Анализ полученных данных свидетельствовал о развитии
генерализованной гипоксии у больных атопическим дерматитом,
причем развитие гипоксического состояния сопровождалось
уменьшением доставки кислорода, снижением способности к его
утилизации. Тяжесть гипоксии также зависела от рО2 и
коррелировала с тяжестью течения атопического дерматита. При
тяжелом течении атопического дерматита у больных не выявлено
статистически достоверных различий показателей в очагах поражения и
в непораженной коже, свидетельствуя в пользу развития
генерализованной гипоксии.
Таким образом, наличие гипоксии в коже, коррелирующее со
степенью тяжести атопического дерматита, может служить одним из
ключевых факторов активации процессов ПОЛ, приводящим к
значительным повреждениям.
Перекисное окисление липидов – универсальный механизм
повреждения клеток; играет ключевую роль в патогенезе многих
заболевании, в том числе и атопического дерматита (Е.И. Прахин и
соавт., 1997).
Таблица 4. Результаты полярографического исследования
кислородного режима кожи у детей различной степени тяжести
атопического дерматита после проведенной терапии реамберином
Состояние процессов ПОЛ оценивалось по степени окисленности
липидов, содержанию первичных (диеновых конъюгатов – ДК) и
вторичных продуктов (малонового диальдегида – МДА) ПОЛ в сыворотке
крови у детей, больных атопическим дерматитом различной степени
тяжести.
У всех детей с различной степенью тяжести атопического
дерматита степень окисленности липидов, а также содержание
диеновых конъюгатов и малонового диальдегида выше, по сравнению с
контрольными значениями (табл. 5). Следовательно, у больных
атопическим дерматитом процессы перекисного окисления липидов
протекают значительно интенсивнее, чем у здоровых детей той же
возрастной группы, свидетельствуя о высокой активности липидной
пероксидации при атопическом дерматите.
Таблица 5. Оценка интенсивности процессов ПОЛ
у детей с различной степенью тяжести атопического дерматита
|
Группа и число больных
|
СО
(усл. ед.)
|
Дк
(Д233/мл.мг)
|
МДА
(нмоль/мл)
|
|
I группа,
n = 24
|
0,64 ± 0,04*
|
1,31 ± 0,04*
|
2,71 + 0,06*
|
|
II группа,
n = 51
|
0,83 ± 0,04* **
|
1,60 ± 0,07* **
|
2,87 ± 0,04* **
|
|
III группа,
n = 37
|
0,97 ± 0,03* **
|
1,73 ± 0,03* **
|
2,96 ± 0,05* **
|
|
Контроль,
n = 40
|
0,54 ± 0,02
|
0,62 ± 0,03
|
1,24 ± 0,07
|
Р1 < 0,05 - по сравнению с контролем;
** р2 < 0,05 - по сравнению с I группой.
Оценка состояния некоторых
компонентов
антиоксидантной системы
у больных с различной степенью тяжести
атопического дерматита
Важнейшим представителем АОС является жирорастворимый
антиоксидант α-токоферол, эффективно ингибирующий процессы
перекисного окисления липидов. Одним из основных сывороточных
антиоксидантов (АО), предотвращающих неконтролируемую
липопероксидацию является церулоплазмин. Общая антиокислительная
активность (АОА) сыворотки также отражает состояние антиоксидантной
защиты организма. Эти показатели изучены у больных с различной
степенью тяжести атопического дерматита и проведен анализ степени
дисбаланса в системе ПОЛ/АОЗ, с применением интегрального
показателя К.
Содержание ±-ТФ, ЦП и общей АОА сыворотки у больных II группы
(средняя степень тяжести) было ниже, чем в контрольной группе и
ниже, чем у больных I группы с легкой степенью тяжести. Коэффициент
К превышала контрольные значения в 4,4 раза (табл. 6).
У больных III группы (тяжелое течение) уровни ±-ТФ и ЦП были
ниже, чем у больных в контрольной группы, а среди больных I и II
группы, показатель общей АОА сыворотки – в 1,4 раза ниже уровня
контрольных значений, при этом коэффициент К в 6,2 раза превышает
уровень нормы.
Таблица 6. Результаты исследования
компонентов антиоксидантной системы у больных
атопическим дерматитом различной степени
|
Группа и число больных
|
α-ТФ
(мкг/мл мг)
|
ЦП
(мг/100 мл)
|
Общая АОА
(мМ, аск.ед)
|
К
(усл. ед.)
|
|
I группа,
n=24
|
4,01 + 0,48
|
28,81 ± 1,9
|
1,10 + 0,11
|
2,98 ± 0,16*
|
|
II группа,
n=51
|
2,1 ± 0,09* ***
|
25,26 ± 1,3* ***
|
0,71 ± 0,08* ***
|
4,86 ± 0,19*
|
|
III группа,
n=37
|
1,7 + 0,19* **
|
24,32 ± 2,2* **
|
0,64 + 0,09* **
|
6,91 ± 0,08*
|
|
Контроль,
n=40
|
3,24 + 0,35
|
31,80 + 2,1
|
0,91 ± 0,09
|
1,12 + 0,10
|
* р1 < 0,05 различия достоверны по сравнению с
контролем;
** р2< 0,05 по сравнению с I и II группой;
*** р3< 0,05 по сравнению с I группой.
Таким образом, установлено снижение антиоксидантных механизмов
у больных атопическим дерматитом с выраженным дисбалансом в
системе ПОЛ/АОС (К) при средней степени тяжести и тяжелом течении
дерматоза.
Клиническая эффективность реамберина
в терапии атопического дерматита
Учитывая результаты исследований кислородного режима кожи,
процессов ПОЛ и состояния АО С у больных атопическим дерматитом
различной степени тяжести, применение реамберина было
патогенетически обосновано и направлено на коррекцию метаболических
нарушений.
Схема применения 1,5% раствора реамберина
Препарат вводился внутривенно капельно, 1-я и 2-я инфузии –
через день, затем – 2 раза в неделю. Всего 5 инфузий. Доза
препарата назначалась из расчета 10 мл 1,5% раствора
натрий-метилглюкаминовой соли янтарной кислоты на килограмм массы
ребенка.
Все дети получали следующее лечение: гипоаллергенная диета,
антигистаминные препараты (супрастин, тавегил, фенкарол) 1-2 раза в
день в течение всего времени пребывания в стационаре.
Наружно на очаги поражения наносили индифферентные и смягчающие
кожу кремы – крем Унны, крем «Роса», «Тик-Так».
Оценивалась динамика клинических проявлений SCORAD у детей с
различной степенью тяжести атопического дерматита в процессе
проводимой терапии на 5-й, 10-й, 15-й и 20-й день лечения.
После первой инфузии у всех детей (I группа KS = 17)
практически полностью прекратился зуд в дневное время, и
значительно уменьшилась его интенсивность в ночное время.
После второй инфузии на коже отсутствовали следы расчесов и
геморрагические корочки, побледнела эритема. После пятой инфузии
полностью прекратилось шелушение, уменьшилась сухость кожи,
отсутствовала инфильтрация, улучшилось настроение и аппетит.
Констатирована клиническая ремиссия у 24 детей I группы.
В группе больных средней степени тяжести атопического дерматита
также наблюдалась положительная динамика на фоне проводимой
терапии. У 42 больных из 51 после двух инфузий реамберина зуд в
дневное время полностью прекратился, значительно побледнела
эритема и уменьшилось шелушение. После третьей инфузии реамберина
у 38 больных на коже не было следов расчесов, эритема полностью
разрешилась, при этом сохранялись очаги лихенификации, а также
небольшая сухость кожи и шелушение в периорбитальных областях,
нормализовался сон.
Клиническая ремиссия констатирована у 33 детей со средней
степенью тяжести атопического дерматита (II группа больных), кожа
была чистой, зуд не беспокоил.
У 13 больных этой группы наблюдалось значительное улучшение
(нормализация сна, отсутствие зуда, регресс воспалительных
инфильтрированных очагов, но сохранялась пигментация в
периорбитальных областях, а в бывших очагах поражения отмечалось
легкое шелушение).
У 5 больных отмечено улучшение (прекращение зуда, исчезновение
воспалительных явлений в очагах поражения, уменьшении сухости и
шелушения, но сохранялась легкая инфильтрация в области
лучезапястных суставов и явления хейлита).
В III группе (n = 37) больных (тяжелое течение, kS = 69),
применение реамберина привело к интенсивному снижению kS и
клинических проявлений атопического дерматита.
После двух инфузий реамберина значительно уменьшился зуд и
эритема, улучшился сон у 33 из 37 больных. После третьей инфузий
отмечалось уменьшение сухости кожи и шелушения.
Констатирована клиническая ремиссия у 23 из 37 больных. У 10
отмечено значительное улучшение (полностью прекратился зуд, исчезла
инфильтрация, но сохранялось легкое шелушение на месте бывших
высыпаний, заслуживает факт более быстрого регресса на фоне
применения реамберина клинических проявлений атопического
дерматита в тех случаях, когда течение воспалительного процесса
сопровождалось бактериальными осложнениями). Лечение реамберином
одного ребенка с тяжело протекающим атопическим дерматитом не
сопровождалось выраженной динамикой клинических проявлений. Однако
и в этом случае улучшился сон, и несколько уменьшилась
интенсивность зуда.
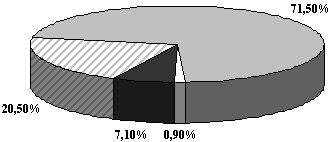
Рис. 1. Клиническая эффективность реамберина
Лечение реамберином привело к клинической ремиссии у 80 больных
(71,5%), значительное улучшение отмечено у 23 больных (20,5%), у 8
детей (7,1%) констатировано улучшение в течении заболевания и лишь
у 1 ребенка (0,9%) выраженного эффекта от проведенной терапии не
было.
Таким образом, продемонстрирована высокая клиническая
эффективность реамберина. Терапия не сопровождалась осложнениями
и побочными явлениями, хорошо переносилась больными.
Влияние реамберина на показатели
напряжения кислорода
и состояние АОС у больных атопическим дерматитом
Изучена динамика показателей кислородного режима кожи, процессов
ПОЛ и АОС после проведенной терапии реамберином.
У детей I и II группы РО2 после проведенной терапии повысилось
и не отличалось от контрольных значений. В III группе напряжение
кислорода под влиянием реамберина также увеличилось, по сравнению
исходным уровнем, но оставалось несколько ниже контрольного.
Скорость доставки кислорода (Vt) у детей I группы превышала
значение этого показателя до лечения и у детей в контрольной
группе, а у больных III-й группы скорость доставки кислорода
повысилась в 1,4 раза, но оставалась ниже, чем у больных в
контрольной группе.
Скорость потребления кислорода (V2) после лечения реамберином у
больных I группы превышала уровень контрольных значений. Во II
группе этот показатель под влиянием терапии нормализовался. После
проведенной терапии у больных III группы скорость утилизации
кислорода имела тенденцию к нормализации, но не достигла
контрольного уровня.
Таким образом, изменение кислородного режима кожи под влиянием
реамберина подтверждает его корригирующее влияние на доставку и
утилизацию кислорода в коже.
Степень окисленности липидов у детей I группы после проведенной
терапии нормализовалась, а уровень ДК и МДА снизился в 2 раза, по
сравнению с исходными значениями и практически нормализовался.
Во II группе отмечали нормализацию показателей СО, ДК и МДА
после лечения реамберином.
У детей с тяжелым течением атопического дерматита (III группа)
среднее значение показателей степени окисленности липидов, под
влиянием антиоксидантного и антигипоксантного лечения снизилось в
1,5 раза, по сравнению с исходным уровнем, при этом уровень ДК и
МДА практически нормализовался.
Исходный уровень α-ТФ, ЦП, общей АОА и интегрального показателя
К до лечения у детей с различной степенью тяжести АД
свидетельствовал о значительном напряжении защитного механизма АОС
на фоне интенсификации процессов ПОЛ и коррелировал со степенью
тяжести АД.
Повышение уровня ЦП, под влиянием терапии реамберином, отмечено
у больных I группы – в 1,1 раза; у больных II группы в 1,2 раза и в
1,4 раза у больных III группы. Эти показатели близки к уровню –
контрольных значений у больных I и II групп, а у детей с тяжелым
течением уровень ЦП превышал контрольную величину.
Весьма значимыми были отличия общей АОА сыворотки до и после
лечения (Таблица 9.).
Вместе с тем, анализ целостной взаимосвязанной системы ПОЛ-АОС
приобретает особое значение при оценке эффективности экзогенных
антиоксидантов в коррекции ПОЛ при атопическом дерматите, когда
дисбаланс процессов липопероксидации обусловлен как усилением ПОЛ,
так и низким содержанием α-токоферола и ЦП (В.А. Волнухин, 1992;
П.И. Герасимов и соавт., 1998).
К – интегральный показатель, до начала лечения был достоверно
выше контрольного значения: в I группе – в 2,6 раза, во II группе –
в 4,3 раза и в III группе – в 5,3 раза, соответственно.
После проведенной терапии реамберином интегральный показатель К
у всех больных не отличался от нормальных значений.
Таблица 7. Динамика уровня ПОЛ после терапии реамберином
у детей с различной степенью тяжести атопического дерматита
Таблица 8. Показатели α-ТФ и ЦП
после проведенной терапии реамберином
|
Группа
и число больных
|
Значения
α-токоферола
|
Значения
церуллоплазмин
|
|
До
лечения
|
После
лечения
|
До
лечения
|
После
лечения
|
|
I группа,
n = 24
|
4,01 ± 0,48
|
3,04 ± 0,12
|
28,81 ± 1,9
|
29,4 ± 2,3
|
|
II группа,
n = 51
|
2,1 ± 0,09
|
3,01 ± 0,17
|
26,26 ± 1,7
|
32,04 ± 1,6**
|
|
III группа,
n= 37
|
1,7 ± 0,19
|
2,9 ± 0,14*
|
24,32 ± 2,2
|
35,07 ± 1,1* **
|
|
Контроль,
n = 40
|
3,24 ± 0,15
|
31,8 ± 2,10
|
* р1 < 0,05 - различия достоверны по
сравнению с контролем;
** р2 < 0,05 - различия достоверны по сравнению с
показателями до лечения.
Таблица 9. Динамика показателей АОС(общей ДОС и К)
после проведенной терапии реамберином у детей
с различной степенью тяжести атопического дерматита
|
Группа
и число больных
|
Общая АОА
|
К
|
|
До
лечения
|
После
лечения
|
До
лечения
|
После
лечения
|
|
I группа,
n = 24
|
1,12 ± 0,10
|
0,81 ± 0,1
|
2,9 ± 0,16
|
1,10 ± 0,1**
|
|
II группа,
n = 51
|
0,71 ± 0,08
|
0,84 ±0,06
|
4,8 ± 0,19
|
1,10 ± 0,09**
|
|
III группа,
n = 37
|
0,64 ± 0,09
|
0,88 ± 0,06**
|
6,01 ± 0,08
|
1,2 ± 0,1**
|
|
Контроль,
n = 40
|
0,91 ± 0,09
|
1,12 ± 0,1
|
* р1 < 0,05 - различия достоверны по сравнению с
контролем
** р2 < 0,05 - различия достоверны по сравнению с
показателями до лечения.
Таким образом, патогенетически обоснованная антиоксидантная и
антигипоксантная терапия реамберином повышает способность сыворотки
крови больных тормозить процесс пероксидации собственных липидов,
повышает защитные возможности АОС, устраняя дисбаланс в системе
ПОЛ/АОС.



