Рис. 1. Активность системы протеина С
как маркер прогноза у септических больных
Днепропетровская областная клиническая больница им. И.И. Мечникова
А.В. Коломоец
Проведено открытое рандомизированное исследование для сравнения методов комплексного лечения печеночной дисфункции-недостаточности у 80 больных сепсисом, рандомизированных на 4 группы: 1 – контрольная, 2, 3, 4 – основные в зависимости от применяемых фармакологических препаратов (перфторан, реамберин, перфторан + реамберин). Оценку эффективности лечения проводили по промежуточным (3-и, 5-е сутки) и конечной (28-е сутки) точкам. Острофазовая реакция печени у больных сепсисом на исходном этапе характеризовалась значительным увеличением концентрации С-реактивного белка (СРБ) и фибриногена, умеренным снижением содержания альбумина, что сопровождалось выраженным снижением активности системы протеина С. Достоверное снижение концентрации СРБ наблюдали на 3-и сутки во всех группах сравнения, но наиболее выраженное в группе перфторан + реамберин. Выявлено, что под влиянием перфторана и реамберина восстанавливаются кровоток и оксигенация, устраняется митохондриальная депрессия, улучшается функция печени, повышается синтез протеина С, который активируется тромбомодулином эндотелиальных клеток и в свою очередь оказывает саногенный эффект на микроциркуляторный гомеостаз. При этом перфторан выступает в роли пускового агента восстановления микроциркуляторных нарушений, а реамберин – инициального модулятора митохондриальной дисфункции. Оценка эффективности примененных лекарственных средств по конечной точке подтвердила положительное влияние перфторана, реамберина и особенно их комбинации на течение септического процесса, что способствовало улучшению когнитивной функции, качества жизни и снижению летальности.
Значительное увеличение частоты заболеваний печени и ежегодный ее прирост на 10-12% [1-3] сопровождается развитием печеночной недостаточности – полисистемного состояния с летальностью до 80% [4-7], а при развитии септических осложнений она достигает 95-100% [8]. Печеночная дисфункция рассматривается как маркер неблагоприятного прогноза у больных, находящихся в критических состояниях [1,9-11].
Несмотря на то, что большинство исследователей рассматривают печень как центральный орган в регуляции гомеостаза при сепсисе, роли и значению острофазовой реакции печени, отдельных реактантов острой фазы в патогенезе сепсиса уделено недостаточно внимания.
Больших систематизированных исследований для разработки методов ранней диагностики, эффективной профилактики и лечения проведено очень мало. Определение роли печени в регуляции патофизиологических реакций, развивающихся при критических состояниях и печеночной дисфункции, значимого, но недостаточно изученного компонента У септических больных, является темой нашего исследования/
Под руководством члена-корреспондента НАН и АМН Украины, проф. Л.В. Усенко на базе Днепропетровской областной клинической больницы им. И. Мечникова проведено открытое рандомизированное исследование для сравнения методов комплексного лечения печеночной дисфункции-недостаточности; больных сепсисом в отделении интенсивной терапии сепсиса клиники анестезиологии и интенсивной терапии Днепропетровской государственной медицинской академии, Отбор больных осуществляли по следующим критериям: возраст от 18 до 70 лет, наличие признаков синдрома системного воспалительного ответа (ССВО), обусловленного инфекцией, по определениям Согласительной комиссии по сепсису, документированное наличие и локализация гнойно-воспалительного очага, наличие одного или нескольких маркеров печеночной дисфункции, исходная тяжесть состояния по шкале APACHE II от 10 до 25 баллов.
Критерии исключения: ССВО, не связанный с инфекцией, нерадикальное хирургическое лечение, исходная тяжесть состояния по шкале APACHE II более 25 баллов, повышенная чувствительность к препаратам, используемым согласно протоколу исследования.
Гепатобилиарную систему исследовали на ультразвуковом сканере Logic 5 (США).
После биохимического обследования больные сепсисом без заболеваний печени, имеющие признаки печеночной дисфункции были рандомизированы на четыре группы: 1 – контрольная, 2, 3, 4 – основные в зависимости от фармакологических препаратов (перфторан, реамберин, перфторан + реамберин).
Интегральную оценку тяжести состояния больных по шкале APACHE II и выявление признаков полиорганной дисфункции-недостаточности по шкале SOFA осуществляли в 1-е сутки поступления больных в отделение.
В исследование включено 80 больных сепсисом без заболеваний печени, у которых согласно шкале MEDS был высокий или очень высокий риск летальности. Клиническая характеристика больных представлена в табл. 1.
Таблица 1.
Клиническая характеристика больных
| Показатель | Группа | |||
|---|---|---|---|---|
|
Контрольная (n = 21) |
Перфторан (n = 20) |
Реамберин (n = 20) |
Перфторан + реамберин (n=19) |
|
|
Пол, м/ж |
12/9 |
11/3 |
10/10 |
9/10 |
|
Возраст, лет |
49,1 |
47,9 |
49,3 |
48,7 |
|
Средняя масса тела, кг |
73,6 |
71,3 |
74,1 |
70,6 |
|
Оценка по MEDS, |
14,8 |
13,9 |
14,3 |
15,1 |
|
Количество больных, требовавших хирургического лечения, % |
17 |
16 |
16 |
16 |
|
Наличие 3 и более признаков ССВО |
19 |
19 |
17 |
17 |
|
Оценка по APACHE II, баллы |
16,8 |
15,7 |
17,1 |
17,1 |
|
Оценка по SOFA, баллы |
2,6 |
2,4 |
2,7 |
2,7 |
|
Печеночная дисфункция, баллы |
0,64 |
0,55 |
0,76 |
0,68 |
|
Течение в первые 6 ч: запоздалая РЦТ |
6 |
5 |
5 |
5 |
|
Своевременное хирургич. вмешательство (в первые 2 ч после после поступления в ОРИТ) |
15 |
14 |
14 |
13 |
Достоверных различий между показателями в группах сравнения не выявлено, что свидетельствует об адекватности рандомизации. Оценку эффективности лечения проводили по промежуточным (3-и, 5-е сутки) и конечной точке (28-е сутки).
Для оценки острофазовой реакции печени определяли концентрацию альбумина, С-реактивного белка (СРБ) в сыворотке крови с помощью полуавтоматического биохимического анализатора РА-50 Bayer Diagnostics (США) с наборами стандартных реактивов.
Концентрацию фибриногена в сыворотке крови и активность системы эндогенного протеина С определяли с помощью коагулометра Amelung KC-4A (Германия).
Для оценки когнитивной дисфункции использовали короткий тест по ориентации и концентрации памяти SOHCT [12], для оценки качества жизни - модифицированную шкалу Ранчо Лос Амигос (RLAS).
Статистический анализ проводили с помощью пакетов прикладных программ MS Excel 5.0, Statistica 6.0 [13 14].
Острофазовая реакция печени на исходном этапе характеризовалась значительным увеличением концентрации позитивных реактантов - СРБ и фибриногена, умеренным снижением содержания альбумина, как негативного маркера острой фазы, что сопровождалось выраженным снижением активности системы протеина С (табл.2).
Исходная концентрация СРБ в среднем составляла 279,0±29,0 мг/л (от 36 до 800 мг/л) без различий между группами сравнения.
Корреляционный анализ выявил прямую достоверную связь между концентрацией СРБ и количеством признаков системного воспалительного ответа (r = 0,863±0,079; р = 0,012), оценкой по шкале APACHE II (r = 0,063±0,083; р = 0,036), шкале SOFA (r = 0,536±0,061; р = 0,046), шкале P.E.Sponk(r = 0,544±0,057; р = 0,044). Слабая недостоверная прямая корреляция между исходной концентрацией СРБ и летальностью (r = 0,217±0,098; р = 0,18) свидетельствует о невозможности использования этого показателя как прогностического у больных сепсисом. Вместе с тем информативность СРБ, как маркера активности ССВО определяется операционными характеристиками чувствительности (Se) и специфичности (Sp), соотношением правдоподобности (LR) в зависимости от точки распределения данного показателя. Его диагностическая ценность существенно увеличивается, когда точка распределения возрастает до 240 мг/л (Se = 0,875; Sp = 0,86; LR = 6,25), т.е. практически в 6 раз. Уровень фибриногена на исходном этапе составлял в среднем (5,58±1,2) г/л (от 2,2 до 7,8 г/л) и также не отличался достоверно между группами сравнения. Он коррелировал с количеством признаков ССВО (r = 0,793±0,068; р = 0,016), оценкой по шкале APACHE II (r = 0,547±0,053; р = 0,044), шкале SOFA (r = 0,613±0,068; р = 0,045), шкале P.E. Spronk (r = 0,561±0,054; р = 0,039), имел прямую, но недостоверную связь с летальностью (r = 0,168±0,240; р = 0,21). Последнее свидетельствует о его слабых прогностических возможностях. Как маркер активности системного воспаления уровень фибриногена приобретает значимость при точке распределения 4 г/л (Se = 0,85; Sp = 0,85; LR=5,66).
Таблица 2.
Динамика показателей острофазовой реакции печени
| Показатель | Этап исследования | Группа больных | |||
|---|---|---|---|---|---|
|
Контрольная (n = 21) |
Перфторан (n = 20) |
Реамберин (n = 20) |
Перфторан + реамберин (n = 19) |
||
|
СРБ, мг/л |
1 |
276,3±47,9 |
274,0±18,6 |
269,7±19,3 |
298,0±9,6 |
|
2 |
104,7±17,1* |
78,1±8,1* |
76,4±6,1* |
64,0±6,1*,** |
|
|
3 |
71,6±*9,8 |
61,3±6,4 |
48,6±5,2*,** |
33,1±4,3*,** |
|
|
Фибриноген, г/л |
1 |
6,1±1,2 |
5,3±0,9 |
5,0±0,9 |
6,3±1,4 |
|
2 |
4,8±0,8 |
3,4±0,5 |
2±0,8*,** |
2,6±0,6*,** |
|
|
3 |
3,9±0,7 |
2,4±0,4* |
2,3±0,3 |
2,4±0,4 |
|
|
Альбумин, г/л |
1 |
26,8±4,3 |
27,6±3,7 |
28,4±4,7 |
27,1±3,3 |
|
2 |
28,6±3,9 |
29,7±4,1 |
28.8±4,3 |
29,4±3,6 |
|
|
3 |
27,8±3,3 |
29,1±3,3 |
29,3±3,3 |
29,1±3,1 |
|
|
Активность протеина С, ЄД.Н.С. |
1 |
0,31 ±0,04 |
0,33±0,04 |
0,37±0,03 |
0,38±0,07 |
|
2 |
0,39±0,02 |
0,67±0,06*,** |
0,87±0,04*,** |
0,89±0,10*,** |
|
|
3 |
0,54±0,04* |
0,73±0,06** |
0,88±0,06** |
0,94±0,07** |
|
Примечание:
1 – исходные показатели;
2 – 2-3-и сутки;
3 – З-5-е сутки;
* – достоверное отличие от предыдущего этапа,
**– достоверное отличие от исходных показателей
Главный отрицательный реактант острой фазы – альбумин, концентрация которого должна снижаться, – для анализа острофазовой реакции печени малоинформативен. Не выявлено значимой корреляционной связи его с количеством признаков ССВО (r = 0,063±0,003; р>0,1), оценкой по шкале APACHE II (r = 0,096±0,008; р>0,1), шкале SOFA (r = 0,112±0,020;р>0,1).
Активность системы протеина С (АСПС), зависящая в первую очередь
от концентрации серинпротеазы, которая синтезируется в печени [15],
исходно была снижена и составляла в среднем 0,366 ед. н.с. (от0,1
до 0,56 ед. н.с.) без достоверных различий между группами
сравнения. Корреляционный анализ выявил сильную обратную связь
между АСПС и количеством признаков ССВО (r = -0,927±0,091; р =
0,001), оценкой по шкале APACHE II (r = -0,886±0,093; р = 0,01),
шкале SOFA (r=-0,863±0,091; p = 0,016), шкале P.E. Spronk(r =
-0,913±0,096; р = 0,003), признаками тяжелой и среднетяжелой
печеночной дисфункции (r = -0,903±0,093; р = 0,003), исходом
заболевания
(r = -0,933±0,097; p = 0,004), что позволяет рассматривать этот
показатель как значимый прогностический маркер у больных сепсисом.
Характеристики теста с точкой распределения 0.4 ед. н.с. (Se =
0,94; Sp = 0,73; LR = 3,48) свидетельствуют о возрастании
вероятности летального исхода болезни почти в 3,5 раза, а при
снижении точки аспределения до 0,3 ед. н.с. соотношение
правдоподобности увеличивается до 7,23. Таким образом, абсолютные
значения оложительных реактантов острофазовой реакции печени на
исходном этапе указывали на наличие скрытого шока и
микроциркуляторной дисфункции, но возможности этих показателей для
прогноза заболевания ограничены.
Альбумин является малочувствительным индикатором активности системного воспалительного ответа, но вследствие сильной его связи с проявлениями печеночной дисфункции он заслуживает внимания.
АСПС представляется надежным информативным ркером активности системного воспаления и значимым прогностическим индикатором. Нами поведен анализ динамики показателей острой фазы под влиянием различных терапевтических средств. Достоверное снижение концентрации СРБ наблюдали на 3-и сутки во всех группах сравнения, но наиболее выраженным снижение было в группе перфторан + реамберин (см. табл. 2).
На 5-е сутки концентрация СРБ продолжала снижаться, и в группах реамберин и перфторан + реамберин это снижение достоверно опережало такое в группе контроля (р<0,05). Концентрация фибриногена в группе контроля снижалась на 3-и сутки лишь на 21,3% и к 5-м суткам - на 3,6% по отношению к исходной величине, в группе перфторана соответственно на 35,8 и 53,9%, в группе реамберина - на 53,3 и 55% по сравнению с контрольной группой. После совместного применения перфторана и реамберина концентрация фибриногена регрессировала на 58,7% (р = 0,02) к 3-м суткам, достоверно отличаясь от группы контроля (р = 0,038), тенденция к снижению фибриногена сохранялась до 5-х суток.
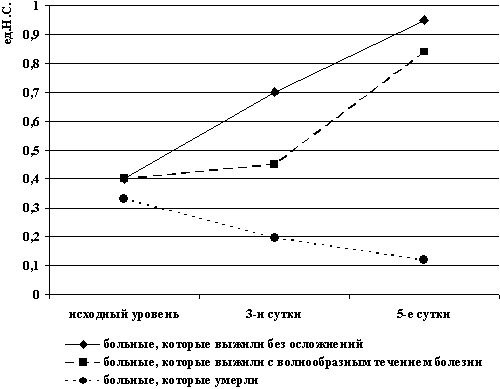
Содержание альбумина. оставалось на субкритическом уровне вплоть до 5-х суток с малозаметной тенденцией к его повышению во всех группах исследования (от 7,4% в группе перфторан + реамберин до 3,7% в контрольной). Вместе с тем, если в группе контроля АСПС возросла только на 26% (р>0,1), то в группе перфторана прирост активности составил 103% (р<0,001), в группе реамберина-123% (р = 0,001), а при совместном их использовании -134% (р<0,0001). К 5-м суткам прирост АСПС в группах сравнения составлял соответственно 74; 121; 126 и 147% с достоверной разницей между группами исследования и контролем (см. табл. 2). Динамика этого показателя у больных, которые выжили, с неосложненным течением болезни (n = 50), у больных, которые выжили, но имели волнообразное течение болезни (n = 12), и у умерших (n = 18) свидетельствует о значительных прогностических возможностях АСПС (рис. 1).

Рис. 1. Активность системы протеина С
как маркер прогноза у септических больных
Таким образом, увеличение АСПС к 3-м суткам в среднем до (0,69±0,07) ед. н.с. обеспечило дальнейшую позитивную динамику септического процесса без осложнений, повышение этого показателя выше 0,4 ед. н.с. способствовало улучшению состояния после оптимизации лечения и, напротив, снижение его ниже 0,3 ед. н.с. сопровождалось ухудшением течения болезни и летальным исходом. Из этого следует, что исходный уровень протеина С ниже 0,4 ед. н.с. к 3-м суткам и тенденция к его снижению являются надежным маркером неблагоприятного прогноза у больных сепсисом.
Учитывая то, что продукция реактантов острой фазы является результатом напряженной деятельности печени, когда синтез позитивных маркеров осуществляется в ущерб синтезу таких необходимых соединений, как альбумин, трансферин, антитромбин III, протеины С и S, представляет интерес изучение соотношения концентраций позитивных реактантов и АСПС как показателя напряженности острофазовой реакции печени.
Соотношение концентрации СРБ к активности АПС у больных с неосложненным течением болезни, волнообразным характером процесса и умерших представлено на рис. 2. На данном рисунке наглядно видно преимущество показателя напряженности острофазовой реакции печени как прогностического индикатора течения болезни.
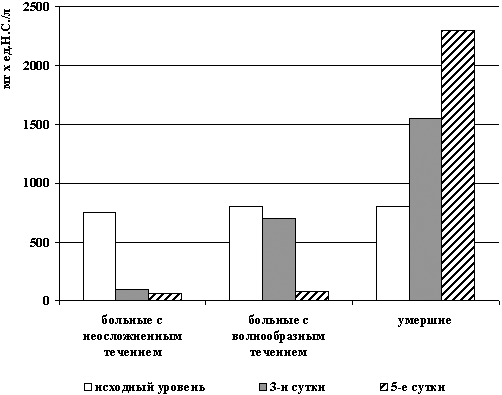
Рис. 2. Показатель напряженности
острофазовой реакции печени
(СРБ/АСПС)
в зависимости от прогноза
Динамика индекса напряженности острофазовой реакции (ИНОР) в зависимости от примененных средств лечения в группах сравнения представлена на рис. 3.
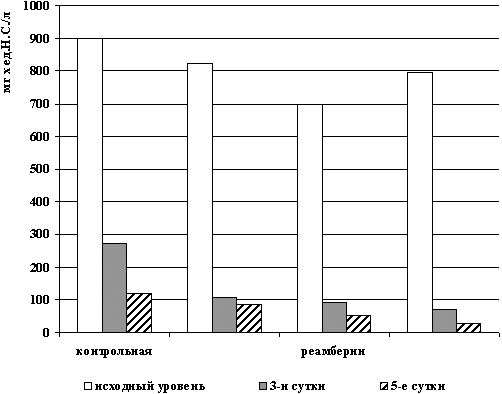
Рис. 3. Величина индекса напряженности
острофазовой реакции
печени СРБ /АСПС в группах сравнения
Величина соотношения концентрации фибриногена и АСПС также достоверно отличалась между группами сравнения на всех этапах.
Таким образом, острофазовая реакция печени является результатом ее напряженной деятельности, когда синтез позитивных реактантов осуществляется во вред продукции негативных компонентов острой фазы, в частности протеина С, как интегрального регулятора в системах воспаления, коагуляции фибринолиза [16-18]. Печень является критическим органом в патогенезе микроциркуляторно-митохондриальной дисфункции -универсального) звена развития полиорганной недостаточности.
Под влиянием перфторана и реамберина Ц восстанавливается кровоток и оксигенация в тканях, в частности в печени, устраняется митохондриальная депрессия, функция печени улучшается с ростом (о чем свидетельствует повышение синтеза протеина С, который активируется тромбомодулином эндотелиальных клеток и в свою очередь оказывает саногенный эффект на микроциркуляторный гомеостаз).
Перфторан представляется пусковым агентом для устранения микроциркуляторных нарушений, а реамберин - инициальным модулятором митохондриальной дисфункции за счет сукцинатного механизма действия.
Результаты лечения по конечной точке (28-е сутки заболевания) представлены на рис. 4.
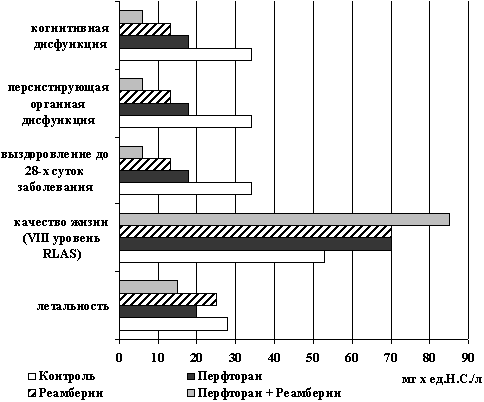
Рис. 4. Результаты лечения по конечной точке
Таким образом, оценка эффективности примененных лекарственных средств по конечной точке свидетельствует о положительном влиянии перфторана, реамберина и особенно их комбинации на течение септического процесса, которое ассоциируется с улучшением когнитивной функции, качества жизни и снижением летальности.