Источник:
журнал «Акушерство и гинекология»,
2011, №2, С.1-4
1ГУЗ Нижегородская областная клиническая больница им. Н.А. Семашко;
2МЛПУ Городская больница № 33, Нижний Новгород
Динамика метаболических показателей
при антигипоксической терапии акушерского сепсиса
А.Ю. Яковлев1, Р.М. Зайцев1, П.С. Зубеев2,
К.В. Мокров2, А.В. Баландина2, В.Е. Кучеренко1
Цель исследования:
Оценить вклад сукцинатсодержащего инфузионного препарата реамберин в коррекцию метаболических показателей крови у больных акушерским послеродовым сепсисом. Материал и методы. Проведены исследования динамики метаболических показателей крови (лактат, пируват, глюкоза, индексы лактат/пируват, глюкоза/лактат) и азотистого баланса при инфузии реамберина (800 мл/сут в течение 8 сут интенсивной терапии) у 43 больных акушерским послеродовым сепсисом.
Результаты исследования:
Установлена исходная декомпенсация метаболизма в раннем послеоперационном периоде у больных акушерским послеродовым сепсисом, резистентная к проводимой антибактериальной, инфузионной терапии и нутритивной поддержке. Применение реамберина позволяет сократить сроки декомпенсации метаболических нарушений – к 8-м суткам значения изучаемых метаболических показателей снизились до уровня верхней границы должных величин. В первые 2 сут инфузии 800 мл реамберина недостаточно для быстрой коррекции исходных метаболических нарушений.
Заключение:
Определено положительное влияние реамберина на исходно выраженные нарушения метаболизма с повышением эффективности нутритивной терапии. Выраженность исходных метаболических нарушений требует усиления антигипоксической направленности интенсивной послеоперационной терапии.
Высокая медико-социальная значимость снижения материнской смертности от акушерского сепсиса требует от клиницистов поиска новых, альтернативных направлений коррекции нарушений гомеостаза, особенно в случае развития полиорганной недостаточности (ПОН), обусловленной в основном нарушениями метаболизма клетки [1, 2, 4, 11, 12, 19, 22]. Формирование гипоксических повреждений многофакторно: нарушения легочной оксигенации, контрактильности миокарда, периферической микроциркуляции, синдром гиперкатаболизма-гиперметаболизма и развитие патологии тканевого метаболизма [14, 21]. Но независимо от вида гипоксии в основе всех характерных для нее нарушений лежит недостаточность главной клеточной энергообразующей системы всех органов, повреждаемых при ПОН вследствие сепсиса, – митохондриального окислительного фосфорилирования [16], что служит причиной разработки методов целенаправленной фармакологической коррекции внутриклеточного метаболизма. Однако активно развивающееся в последнее десятилетие антигипоксическое направление интенсивной терапии не получило окончательной оценки, в том числе и вследствие небольшого количества клинических исследований прямых метаболических эффектов, непосредственно связанных с введением антигипоксантов.
Целью настоящего исследования являлась оценка вклада сукцинатсодержащего инфузионного препарата реамберин в коррекцию метаболических показателей крови у больных акушерским послеродовым сепсисом.
Материал и методы исследования
Проспективные рандомизированные исследования проведены в
2002-2008 гг. у 43 больных послеродовым акушерским сепсисом,
осложненным ПОН (оценка по шкале SOFA 8-10 баллов). Диагноз сепсиса
устанавливался по клиническим, лабораторным критериям и
подтверждался положительными результатами посевов крови. Всем
больным проводилась антибактериальная, инфузионная терапия,
коррекция нарушений ВЭБ, парентеральное и энтеральное питание (до
3000 ккал/сут). Адекватная оксигенация обеспечивалась длительной
искусственной вентиляцией легких в связи с развитием у больных
респираторных осложнений. В зависимости от применения реамберина
больные были разделены на 2 группы (1-я группа – 19 больных, 2-я
группа – 24 пациентки), сравнимые по тяжести исходного состояния,
сопутствующей патологии и сложности оперативного вмешательства. Во
2-й группе дополнительно с момента начала послеоперационной
интенсивной терапии в течение 8 сут со скоростью 180 мл/ч вводили
реамберин в количестве 800 мл/сут. Концентрацию молочной,
пировиноградной кислот, глюкозы в венозной крови определяли по
унифицированным методикам [8].
Статистическую обработку полученных результатов проводили с
помощью программ Microsoft Excel и Statistica 6.0 по критериям
непараметрической статистики, используя критерий сравнения
Краскела-Уоллиса ANOVA. Различия считали достоверными при
pd0,05.
Результаты исследования и обсуждение
Определение уровня лактата в крови представляет собой важный
метод мониторинга пациентов в критических состояниях, так как
гиперлактатемия напрямую связана с повышением риска
неблагоприятного исхода заболевания [7, 10]. Более чем троекратное
превышение должных величин лактатемии, определяемое при поступлении
больных в отделение реанимации, свидетельствовало о сохранении
нарушений тканевой оксигенации, проявляющихся в значительном росте
потребности в кислороде при снижении его доставки и утилизации, а
также о регионарной гиперпродукции лактата в связи с анаэробным
дисбалансом метаболизма в поврежденных при ПОН органах [17].
Дополнительное включение реамберина в комплекс интенсивной
терапии больных 2-й группы привело к увеличению темпов коррекции
этого показателя клеточной гипоксии – на 5-е сутки отмечалось
приближение лактатемии к должным значениям: снижение относительно
исходных величин составило 63,2% (см. таблицу).
Корригирующий гиперлактатемию эффект реамберина, примененного у
больных 2-й группы, особенно важен для лечения и профилактики
усугубления степени тяжести ПОН у больных сепсисом [14]. Пик
снижения уровня лактатемии и других метаболических показателей
отмечался в конце единовременного введения максимально разрешенной
суточной дозы реамберина (800 мл за 5 ч). Следует отметить
определенную зависимость метаболических нарушений от поступления
антигипоксанта: по окончании введения реамберина регистрировалось
повышение значений лактатемии и других нарушенных метаболических
показателей венозной крови. «Эффект рикошета» был более выражен
после первой инфузии препарата, чем через сутки после радикального
оперативного санирования первичного септического очага. Данный факт
свидетельствует о зависимости эффектов метаболической терапии от
режима поступления экзогенного сукцината и от степени выраженности
исходных нарушений метаболизма. Необходимость срочной коррекции
анаэробной направленности метаболизма у больных акушерским сепсисом
не позволяет переходить на режим постоянной инфузии разрешенной
дозировки реамберина в начальный период интенсивной терапии и
ставит вопрос либо о возможном использовании в этих ситуациях
повышенных доз исследуемого препарата, либо о его комбинации с
другими субстратными и регуляторными антигипоксантами.
При поступлении в отделение реанимации определялась и
гиперпируватемия. Это, с одной стороны, служило доказательством
развития синдрома гиперметаболизма, а с другой –
свидетельствовало о нарушениях функционирования цикла Кребса и
дыхательной цепи митохондрий поврежденных органов [9]. В процессе
лечения у больных обеих групп происходил постепенный рост
утилизации пирувата со снижением циркуляции этого промежуточного
метаболита в крови. Темпы регресса гиперпируватемии у пациентов
2-й группы превосходили таковые у больных 1-й группы, что
позволило достигнуть достоверных межгрупповых отличий на 5-е сутки
интенсивной терапии. Следует отметить и факт кратковременного, но
достоверного повышения пируватемии во время второго введения
реамберина через сутки после начала послеоперационной интенсивной
терапии, что в совокупности с параллельным кратковременным
снижением лактатемии свидетельствовало о переориентировании
метаболических процессов в сторону аэробных процессов
энергообразования и о нарастании продукции пирувата при
сохраняющемся торможении его потребления в цикле трикарбоновых
кислот. Рост пируватемии был менее выраженным относительно
регресса гиперлактатемии. В целом этот эффект мы оцениваем
положительно, так как он был кратковременным и не создавал
отрицательного дисбаланса в соотношении анаэробных и аэробных
процессов энергообразования.
Кроме того, у больных обеих групп определялась гипергликемия, не
требующая активной инсулинотерапии. Нарастающие темпы коррекции
гипергликемии у больных с дополнительным введением реамберина
привели к достоверным межгрупповым различиям в интервале 2-5-х
суток интенсивной терапии. Известно, что гипергликемия при
отсутствии исходной патологии углеводного обмена является не только
одним из признанных маркеров степени выраженности синдрома
гиперметаболизма, но и неспецифическим признаком воспалительной
ответной реакции организма у больных в критических состояниях [20].
Развитие диссоциации между повышенной потребностью в энергетическом
субстрате и толерантностью структур, потребляющих глюкозу, связано
в первую очередь с повреждением клеточных органелл, участвующих в
процессе энергообмена. Поэтому возможно более ранней коррекции
гипергликемии в настоящее время придается особое значение [18], а
длительно сохраняющаяся гипергликемия у лиц, не страдающих
диабетом, служит одним из признаков неадекватности терапии сепсиса.
Следует отметить, что у больных 2-й группы в ходе исследования не
зарегистрировано случаев снижения уровня глюкозы в крови ниже
допустимых величин, что позволяет рассматривать антигипоксические
сукцинатсодержащие препараты как безопасное средство
патофизиологически обоснованной коррекции гипергликемии при
критических состояниях [15].
Отношения глюкоза/лактат и лактат/пируват отражают
направленность метаболических процессов [6]. Индекс глюкоза/лактат
при поступлении в отделение реанимации был значительно снижен за
счет более выраженного увеличения лактатемии по сравнению с
подъемом уровня глюкозы в венозной крови. На последующих этапах
исследования рост значений этого показателя напрямую зависел от
скорости коррекции лактатемии, поэтому регресс выявленных
нарушений был наименьшим у больных 1-й группы. На наш взгляд,
подъем индекса глюкоза/лактат до уровня должных величин отражает
восстановление процессов глюконеогенеза из лактата, а также
снижение активности анаэробного гликолиза у больных, получавших
реамберин в комплексе интенсивной терапии акушерского
послеродового сепсиса.
Таблица 1. Динамика метаболических показателей
венозной крови (М±SD)
|
Группа больных
|
Этап исследования
|
|
исходно
|
по окончании
1-й инфузии
реамберина
|
через 2 ч после
1-й инфузии
реамберина
|
1-е сутки после
операции (до введения реамберина)
|
1-е сутки после
операции (по окончании введения реамберина)
|
1-е сутки после операции (через 2 ч после введения
реамберина)
|
2-е сутки после операции
|
5-е сутки после операции
|
8-е сутки после операции
|
|
Лактат, ммоль/л
|
|
1-я
|
5,65 ± 0,34
|
-
|
-
|
5,24 ± 0,47*
|
-
|
-
|
4,30 ± 0,41*
|
3,15 ± 0,340
|
2,59 ± 0,33*
|
|
2-я
|
5,58 ± 0,41
|
4,18 ± 0,32*
|
4,97 ± 0,42
|
4,29 ± 0,33*,**
|
3,51 ± 0,40*
|
3,65 ± 0,47*
|
3,39 ± 0,31*,**
|
2,05 ± 0,17*,**
|
1,81 ± 0,20*,**
|
|
Пируват, ммоль/л
|
|
1-я
|
0,195 ± 0,014
|
-
|
-
|
0,206 ± 0,007
|
-
|
-
|
0,201 ± 0,011
|
0,192 ± 0,015
|
0,159 ± 0,014*
|
|
2-я
|
0,192 ± 0,016
|
0,220 ± 0,017
|
0,222 ± 0,021
|
0,219 ± 0,015
|
0,231 ± 0,013*
|
0,227 ± 0,015*
|
0,215 ± 0,013
|
0,161 ± 0,011*,**
|
0,146 ± 0,010*
|
|
Глюкоза, ммоль/л
|
|
1-я
|
9,35 ± 0,30
|
-
|
-
|
9,61 ± 0,22
|
-
|
-
|
7,84 ± 0,22*
|
6,51 ± 0,20*
|
5,59 ± 0,18*
|
|
2-я
|
9,89 ± 0,36
|
9,40 ± 0,29
|
9,51 ± 0,38
|
8,95 ± 0,26*,**
|
7,46 ± 0,40*
|
7,72 ± 0,29*
|
7,18 ± 0,25*,**
|
5,84 ± 0,22*,**
|
5,15 ± 0,15*
|
|
Глюкоза/лактат, ед.
|
|
1-я
|
1,64 ± 0,08
|
-
|
-
|
1,87 ± 0,09*
|
-
|
-
|
1,85 ± 0,10*
|
2,08 ± 0,09*
|
2,17 ± 0,07*
|
|
2-я
|
1,75 ± 0,07
|
2,23 ± 0,10*
|
1,94 ± 0,08*
|
2,09 ± 0,10*,**
|
2,15 ± 0,09*
|
2,10 ± 0,07*
|
2,12 ± 0,09*,**
|
2,81 ± 0,16*,**
|
2,86 ± 0,19*,**
|
|
Лактат/пируват, ед.
|
|
1-я
|
28,99 ± 1,46
|
-
|
-
|
25,48 ± 1,25*
|
-
|
-
|
21,36 ± 1,37*
|
16,41 ± 1,52*
|
16,25 ± 1,80*
|
|
2-я
|
29,07 ± 2,13
|
19,11 ± 1,67*
|
22,31 ± 1,85*
|
19,55 ± 1,77*,**
|
15,24 ± 1,62*
|
16,19 ± 1,75*
|
15,80 ± 1,48*
|
12,69 ± 0,96*,**
|
12,30 ± 1,02*,**
|
Обозначения в таблице:
* — достоверность различий по сравнению с
исходным уровнем (рd0,05),
** — достоверность различий по сравнению с 1-й
группой на аналогичных этапах исследования (рd0,05).
Индекс лактат/пируват рассматривается как основной биохимический
параметр баланса аэробных и анаэробных метаболических процессов
[3]. У больных 2-й группы уже после первой инфузии реамберина
отмечалась коррекция декомпенсированных значений данного показателя
до уровня субкомпенсации, преимущественно за счет снижения
лактатемии. Благодаря этому на 5-е сутки значения индекса
лактат/пируват достигли верхней границы должных величин. Анализ
динамики производных метаболических индексов в раннем
послеоперационном периоде также показал зависимость метаболических
процессов от поступления экзогенного сукцината, что указывает на
необходимость усиления антигипоксической направленности первых
этапов интенсивной терапии акушерского сепсиса.
Исследования азотистого баланса проводились путем подсчета
разницы вводимого больному с нутриентами азота белка и азота
мочевины суточной мочи (см. рисунок). Отсутствие клинически
значимых проявлений острой почечной недостаточности повышает
точность оценки эффективности влияния проводимой антигипоксической
терапии на белковый обмен. Однако следует признать тот факт, что у
больных в критических состояниях, в том числе и при акушерском
сепсисе, возрастает доля внемочевинных потерь эндогенного азота,
что затрудняет подсчет азотистого баланса. Все больные наряду с
энтеральными и парентеральными нутритивными препаратами в 1-е сутки
получали 20 г белка (3,2 г азота), к 3-м суткам количество белка
возрастало до 50 г (8 г азота), к 5-м суткам – до 80 г (12,8 г
азота), на 8-е сутки больные получали в основном энтеральным путем
до 100 г белка или 15 г азота с питательной смесью «Нутрикомп
стандарт».
В процессе лечения наблюдалась тенденция к более быстрой
коррекции синдрома гиперкатаболизма у больных 2-й группы.
Азотсберегающий, антикатаболический эффект экзогенно вводимого
сукцината связан, на наш взгляд, в первую очередь с коррекцией
метаболических нарушений, в основном гиперлактатемии,
сдерживающих эффективность нутритивной поддержки у больных в
критических состояниях [13]. За 8 дней послеоперационного периода
межгрупповые различия потерь азота с мочевиной мочи достигли 20
г. В пересчете на мышечную массу это составляет не менее 500 г
сохраненной мускулатуры при антигипоксической терапии, что,
несомненно, играет существенную роль в предупреждении и лечении
белково-энергетической недостаточности у этой категории
больных.
В целом следует отметить важность полученных результатов
применения реамберина, так как восстановление нарушенного аэробного
метаболизма и утилизации карбоновых субстратов может
способствовать не только профилактике усугубления проявлений
септического процесса и ПОН, но и их купированию при
своевременности лечебных мероприятий [5, 23].
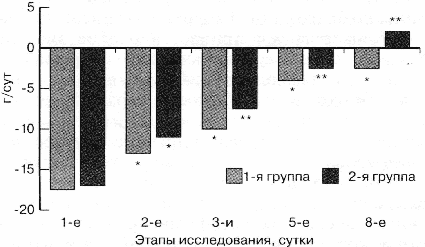
* – достоверность различий по сравнению с
исходным уровнем (p<0.05)
** – достоверность различий по сравнению с 1-й
группой
на аналогичных этапах исследования (p<0.05)
Рис. Динамика азотистого баланса
у больных исследуемых групп
Таким образом, дополнительное включение реамберина в комплекс
интенсивной терапии акушерского сепсиса значительно сокращает сроки
купирования нарушений метаболизма и повышает эффективность
нутритивной поддержки, способствуя купированию синдрома
гиперкатаболизма. Выявленная зависимость полученных результатов от
поступления экзогенного сукцината указывает на необходимость
усиления антигипоксической направленности интенсивной терапии в
раннем послеоперационном периоде после санации абдоминального очага
инфекции.
Литература
-
Алиев С.А., Султанов Г.А., Эфендиев М.А. Некоторые
аспекты патогенеза гипоксии и нефармакологические методы ее
коррекции при гнойном перитоните //Вестн. интенсивной терапии. –
2003. – №2. – С. 20–27.
-
Альес В.Ф., СтепановаН.А., Гольдина О.А.,
Горбачевский Ю.В. Патофизиологические механизмы нарушений
доставки, потребления и экстракции кислорода при критических
состояниях. Методы их интенсивной терапии // Вестн. интенсивной
терапии. – 1998. – № 2. – С. 8–12.
-
Гельфанд Б.Р., Сергеева Н.А., Макарова Л.Д. и др.
Метаболические нарушения при инфекционно-токсическом шоке у больных
перитонитом//Хирургия. – 1988. – № 2. – С. 84–88.
-
Гельфанд Е.Б., Гологорский В.А., Гельфанд Б.Р.
Клиническая характеристика абдоминального сепсиса у хирургических
больных // СошШшп medicum. Инфекция и антимикробная терапия. –
2000. – Т.4, № 2. -С. 9–15.
-
Гринев М.В., Голубева А.В. Проблема полиорганной
недостаточности // Вестн. хирургии им. И.И.Грекова. – 2001. – Т.
160, № 3. С. 110–114.
-
Корячкин В.А., Страшнов В.И., Чуфаров В.Н.
Клинические функциональные и лабораторные тесты в анестезиологии и
интенсивной терапии. – СПб., 2001.
-
Крузе Д.А. Клиническое значение определения лактата
крови //Анестезиол. и реаниматол. – 1997. – № 3. – С. 77–83.
-
Меньшиков В.В. Лабораторные методы исследования в
клинике. – М.: Медицина, 1987.
-
Пестряков Е.В., Яковлева И.И., Мороз В.В.
Патофизиологические механизмы развития острого паренхиматозного
поражения легких у больных с сепсисом и септическим шоком
//Анестезиол. и реанима тол. – 2003. – № 6. – С. 65–72.
-
Попова Т.С., Шестопалов А.Е., Тамазашвили Т.Ш.,
Лейдерман И.Н. Нутритивная поддержка больных в критических
состояниях. – М.: Издательский дом «М-Вести», 2002
-
Савельева Г.М., Курцер М.А., Шалина Р.И.
Материнская смертность и пути ее снижения // Акуш. и гин. – 2009. –
№ 3. – С. 11–15.
-
Серов В.Н., Маркин С.А. Критические состояния в
акушерстве. – М.: Медгиз, 2003.
-
Basics in clinical nutrition / Edited for ESPEN
Courses Second Edition, 2000. – P.300-389
-
Bone R. Reevaluation of the role of cellular
hypoxia and bioenergetic failure in sepsis // J.A.M.A. – 1992. –
Vol. 18. – P. 1503–1510.
-
Dhainiut J.F., Huyghebaert H.F., Monfssallier J.F.
et al. Coronar hemodinamics and myocardial metabolism of lactate,
free fatty acids, glucose and ketones in patients with septic shock
//Circulation. – 1987. – Vol. 75. – P. 533–541.
-
DongY.L., Sheng C.Y. Metabolic abnormalities of
mitochondrial redox potential in postburn multiple system organ
failure // Burns. – 1992. – Vol.18, № 4. – P. 283-286.
-
Douzinas E.E., Tsidemiadou P.D., Pitaridis I.A. The
regional production of cytokines and lactate in sepsis related
multiple organ failure //Am. J. Respir. Crit. Care Med. – 1997. –
Vol. 15, № 1. – P. 53–59.
-
Greet Van den Berghe. Intensive insulin therapy in
critically ill patients // New Engl. J. Med. – 2001. – Vol. 345, №
19. – P. 1359-1367.
-
Kinney J.M. Metabolic response of the critically
ill patient // Crit. Care Clinics. – 1995. – Vol. 11 , № 3. – P.
569– 585.
-
Longarela A., Olarra J., Suarez L. Metabolic
response to stress, can we control it? //Nutr. Hosp. – 2000. – Vol.
15, № 6. – P. 275-279.
-
Prondzinsky R., Witthaut R., Stache N. et al. The
heart in infection and MODS (multiple organ dysfunction syndrome)
//Wien. Klin. Wschr.(suppl.). – 1997. – № 1. – P. 3-24.
-
Small N., Messiah A., Edouards A. Role of systemic
inflammatory responsesyndrome and infection in the occurrence of
early multiple organ dysfunction syndrome following severe trauma
//Intens. Care Med. – 1995. – Vol. 21, № 10. – P. 813-817.
-
Taylor D.E., Piantadosi C.A. Oxidative metabolism
in sepsis and sepsis syndrome
//J. Crit.Care. – 1995. – Vol. 10, № 3. – P. 122-135.
