Рис. 1. Динамика ишемии миокарда
по данным прекордиального картирования
УДК 615.272.4.03:616.132.2-089.163/.168 |
Источник: Журнал "Терапевтический архив", 2011, №9 c. 35-40 |
Республиканский научно-практический центр "Кардиология",
Минск, Республика Беларусь
Г.И. Сидоренко, Л.Г. Гелис, Е.А. Медведева, Ю.П. Островский,
И.В. Лазарева, Т.В. Севрук, Н.А. Шибеко, Ю.П. Петров
Сведения об авторах:
Сидоренко Георгий Иванович – акад. НАНБ,
Республиканский научно-практический центр "Кардиология"
Гелис
Людмила Григорьевна – д-р мед. наук, лаб. хирургии сердца РНПЦ
"Кардиология"
Островский Юрий Петрович – д-р мед. наук,
проф., лаб. хирургии сердца РНПЦ "Кардиология"
Лазарева Ирина Валентиновна – канд. мед.
наук, зав. отделением кардиотерапии № 2 РНПЦ "Кардиология"
Севрук Татьяна Васильевна – зав отделением
ультразвуковой диагностики РНПЦ "Кардиология"
Шибеко Наталья Александровна – кардиолог,
кардиотерапия № 1 РНПЦ "Кардиология"
Петров Юрий Петрович – зав.
рентгеноэндоваскулярным отделением РНПЦ "Кардиология"
СОДЕРЖАНИЕ
|
1. Резюме
|
Цель исследования. Оценка эффективности использования реамберина для предоперационной подготовки и после коронарного шунтирования (КШ) у пациентов с крупноочаговым инфарктом миокарда (ИМ), осложнившимся постинфарктной стенокардией.
Материалы и методы. В исследование включены 45 пациентов с Q-позитивным ИМ, осложненным постинфарктной стенокардией. Основную группу (ОГ) составили 20 (44,4%) пациентов, которым в течение 3 сут до аортокоронарного шунтирования и 3-5 сут после него вводили 200-400 мл 1,5% раствора реамберина. Контрольную группу (КГ) составили 25 (55,6%) пациентов с базисной терапией без кардиопротекции. Перед КШ выполняли лабораторные исследования, ЭКТГ-60, ЭхоКГ, ХМ-ЭКГ. Всем пациентам КШ выполняли в условиях искусственного кровообращения.
Результаты. На госпитальном этапе у 25 (100%) больных ОГ и у 22 (88%) пациентов КГ после прямой реваскуляризации миокарда отмечалась клиническая стабилизация состояния. В раннем послеоперационном периоде острая сердечная недостаточность (ОСИ) развилась у 3 (12%) пациентов из ОГ и у 9 (36%) из КГ (р = 0,04), нарушения ритма сердца наблюдались у 2 (8%) пациентов из ОГ и у 8 (32%) из КГ (р = 0,03). Двое (8%) больных КГ умерли в раннем послеоперационном периоде от ОСН. Периоперационный ИМ зарегистрирован у 2 (8%) лиц из КГ. Через 12 мес наблюдения у пациентов из ОГ случаев возвратной стенокардии не зарегистрировано, в то время как в КГ стенокардия напряжения III функционального класса выявлена у 4 (16%) пациентов. После хирургического вмешательства при выписке и через 12 мес наблюдения у пациентов обеих групп отмечалось улучшение систолической и диастолической функции левого желудочка. Нормализация показателей диастолической функции произошла у 80% лиц из ОГ (р < 0,001) и у 44% из КГ (р < 0,001) через 1 год наблюдения.
Заключение. Использование реамберина уменьшает количество послеоперационных осложнений, оказывает достоверное улучшение систолической и диастолической функции миокарда левого желудочка, уменьшает степень ишемического повреждения миокарда.
Ключевые слова: коронарное шунтирование, постинфарктная стенокардия, реамберин, послеоперационные осложнения
|
ББИМ – безболевая ишемия миокарда |
КСО – конечный систолический объем |
Восстановление коронарного кровотока в ишемизированном миокарде наряду с несомненным положительным эффектом может оказывать негативное действие, вызывая обратимые и необратимые реперфузионные повреждения [1–9]. Поэтому фармакологическая защита миокарда, направленная на уменьшение постишемического и реперфузионного повреждения кардиомиоцитов, является одним из ключевых факторов, влияющих на результаты инвазивного лечения больных ИБС. В настоящее время для повышения эффективности инвазивного лечения и улучшения прогноза, как правило, используются В-блокаторы, ингибиторы ангиотензинпревращающего фермента (АПФ), статины, триметазидин. Для восстановительного лечения в качестве метаболической базисной терапии используется также реамберин, который регулирует тканевый метаболизм и связанные с этим процессы продукции энергии. Интраоперационное введение раствора реамберина вызывает снижение содержания продуктов свободнорадикального окисления липидов и концентрации фракции MB креатинфосфокиназы (МВ-КФК) уже через 1 сут после операции, что указывает на антиоксидантное действие реамберина [2, 5]. Необходимо отметить, что этот препарат также снижает концентрацию молекул низкой и средней молекулярной массы, которые служат маркерами метаболических нарушений и тяжести эндотоксикоза.
С учетом изложенного одной из задач нашего исследования явилась оценка эффективности использования реамберина для предоперационной подготовки и после коронарного шунтирования (КШ) у пациентов с ранней постинфарктной стенокардией (ПС) после Q-инфаркта миокарда (ИМ).
Цель исследования – оценка эффективности использования реамберина для предоперационной подготовки и после КШ у пациентов с крупноочаговым ИМ, осложнившимся ПС.
В исследование включили 45 пациентов с Q-позитивным ИМ, осложненным ПС. Основную группу (ОГ) составили 20 (44,4%) пациентов, которым в течение 3 сут до АКШ и через 3–5 сут после него вводили 1,5% раствор реамберина в количестве 200–400 мл. Контрольную группу (КГ) составили 25 (55,6%) пациентов с базисной терапией без кардиопротекции. Средний возраст в ОГ составил 56,2 ± 7,2 года, в КГ – 57,4 ± 6,4 года. Пациенты обеих групп были сопоставимы по сопутствующей патологии, количеству пораженных артерий, фракции выброса (ФВ) левого желудочка – ЛЖ (табл. 1). АГ выявлена у 16 (80%) лиц ОГ и у 20 (80%) больных КГ, ИМ в анамнезе – у 12 (60%) и 14 (56%), СД 2-го типа – у 8 (40%) и 10 (40%) больных соответственно.
Таблица 1. Клинико-функциональная характеристика пациентов
в группах наблюдения
| Показатель | ОГ (n = 20) | КГ (n = 25) |
|---|---|---|
|
Средний возраст, годы |
56,2 ± 7,2 |
57,4 ± 6,4 |
|
СД |
8(40) |
10(40) |
|
АГ |
16(80) |
20(80) |
|
ИМ в анамнезе |
12(60) |
14(56) |
|
Сердечная недостаточность по NYHA (среднее) |
2,4 ± 0,2 |
2,6 ± 0,4 |
|
Данные КАГ |
3,5 ± 1,2 |
3,53 ± 1,60 |
|
Стеноз ствола ЛКА |
4(20) |
2(8) |
|
Однососудистое поражение КА |
1(5) |
2(8) |
|
Двухсосудистое поражение КА |
3(15) |
5(20) |
|
Множественное поражение КА |
16(80) |
18(72) |
|
ФВ ЛЖ, % |
46,5 ± 6,6 |
43,2 ± 6,4 |
Примечание.
СД – сахарный диабет; АГ – артериальная
гипертония;
ЛКА – левая коронарная артерия;
КА – коронарная артерия.
Дислипидемия наблюдалась в 40 (88,8%) случаях, гиперфибриногенемия – в 31 (68,8%). Повышенный уровень С-реактивного белка (СРВ) выявлен в 24 (53,3%) случаях.
Всем пациентам выполняли биохимические исследования крови, определение кардиоспецифичных ферментов (миоглобин, МВ-КФК, тропонин I) и коагулограмму. Инструментальная диагностика включала электрокардиотопографию (ЭКТГ-60), эхокардиографию (ЭхоКГ), холтеровское мониторирование ЭКГ (ХМ-ЭКГ) с помощью систем "Кардиан" и "Зимед", коронароангиографию (КАГ) по стандартным методикам. Клинико-инструментальные исследования проводили при поступлении в стационар, при выписке и через 12 мес наблюдения.
С помощью ЭКТГ-60 оценивали площадь ишемического поражения (nST + nT, ЈR) и площадь некроза (nQ, nQS) как левого, так и правого желудочков.
При ЭхоКГ измеряли и рассчитывали конечный диастолический размер (КДР), конечный диастолический объем (КДО), конечный систолический размер (КСР), конечный систолический объем (КСО), ФВ ЛЖ, индекс локальной сократимости миокарда (ИЛСМ). Для оценки процессов ремоделирования ЛЖ рассчитывали индекс относительной толщины стенки ЛЖ (ИОТ = ТМЖП + ТМЗС/ КДД), миокардиальный стресс (МС = 0,334 • АДСИСТ • КСД/ТМЗСд • (1+ТМЗСд/КСД). Диастолическую функцию (ДФ) изучали с помощью допплерэхокардиографии. Для этого использовали максимальную скорость кровотока в фазу быстрого наполнения (пик Е, см/с), максимальную скорость кровотока в систолу предсердия (пик А, см/с), отношение Е/А, время изоволюмического расслабления ЛЖ (ВИР, мс), время замедления кровотока раннего диастолического наполнения (ДТ, мс), Аг, см/с – максимальную скорость диастолического ретроградного кровотока в легочных венах.
С помощью ХМ-ЭКГ оценивали нарушения ритма сердца: количество желудочковых экстрасистол (ЖЭ) в сутки; ишемию миокарда (суммарная продолжительность ишемических эпизодов, количество и продолжительность эпизодов болевой и безболевой ишемии миокарда – БИМ и ББИМ).
С помощью КАТ оценивали степень и локализацию сужений КА, тип кровоснабжения сердца, выраженность коллатерального кровотока.
Пациенты ОГ и КГ получали комплексную медикаментозную терапию, включающую аспирин, низкомолекулярные гепарины, нитраты, ингибиторы ангиотензинпревращающего фермента, І - блокаторы, статины. Всем пациентам КШ выполняли в условиях искусственного кровообращения (ИК). Продолжительность ишемии составила 70,2 ± 20,10 мин в ОГ и 74,16 ± 29,80 мин в КГ, продолжительность ИК – 102,20 ± 28,6 и 110,86 ± 36,10 мин соответственно. Среднее количество шунтов в ОГ достигало 3,3 ± 1,1 шунта, в том числе 1,7 ± 0,4 артериального анастомоза и 1,6 ± 0,6 венозного, в КГ – 3,15 ± 0,80 шунта, из них 1,5 ± 0,6 артериальных анастомоза и 1,65 ± 1,12 венозного. Полнота реваскуляризации миокарда в ОГ составила 94,2%, в КГ – 89,2%. У всех пациентов в качестве шунта использовали внутреннюю грудную артерию. Аортокоронарное шунтирование (АКШ), маммарокоронарное шунтирование (МКШ) с реконструктивными операциями выполнено у 4 (20%) пациентов из ОГ (у 4 –пластика митрального клапана, в том числе с пластикой аневризмы ЛЖ –у одного) и у 6 (24%) больных из КГ (у 5 – пластика митрального клапана, у одного – пластика трикуспидального клапана). Сроки хирургического вмешательства представлены в табл. 2.
Таблица 2. Сроки КШ в группах наблюдения
|
Сроки вмешательства, сут после ИМ |
ОГ (n = 20) | КГ (n = 25) |
|---|---|---|
|
3-4 |
4 (20) |
4 (16) |
|
15-30 |
6 (30) |
11 (44) |
|
31-60 |
10 (50) |
10 (40) |
У всех пациентов хирургическое лечение проводилось по неотложным показаниям, в связи с ангинозным синдромом, рефрактерным к медикаментозной терапии и/или нестабильной гемодинамикой. При этом в большинстве случаев наблюдалось увеличение уровня СРБ до 8 ± 2,2 г/л и фибриногена – до 5,2 ± 1,1 г/л, что свидетельствовало об активности воспалительного процесса и повышенном тромбогенном риске у этой категории лиц. В предоперационном периоде у больных с ранней ПС (3–14 сут) средний уровень тропонина I составил 6,2 ± 4,5 нг/ мл.
Анализ результатов исследования проводили на основе биостатистических методов программы MS EXCEL XP, STATSOFT Statistica для Windows (версия 6.0). Для выборок с нормальным распределением использовали методы вариационной статистики и параметрические критерии. Из числовых характеристик выборок определяли среднюю арифметическую величину (М), ошибку средней (m) и стандартное отклонение. Достоверность межгрупповых различий средних величин изучали при помощи t-критерия Стьюдента и определяли уровень значимости р. Значение р < 0,05 считали статистически достоверным. Проводили оценку различия между двумя независимыми выборками по частоте исследуемого признака на основе точного критерия Фишера, между зависимыми выборками – с помощью критерия Мак-Немара.
У пациентов из ОГ (реамберина) развитие ОСН наблюдалось достоверно реже, чем в КГ. Значительно уменьшилось и число послеоперационных нарушений ритма (р = 0,03), что свидетельствует об уменьшении последствий ишемических и реперфузионных повреждений миокарда. Наряду с этим в ОГ значительно реже развивался ПКТС, который протекал с менее выраженными клиническими проявлениями.
На госпитальном этапе у 25 (100%) больных ОГ и у 22 (88%) пациентов КГ после прямой реваскуляризации миокарда отмечалась клиническая стабилизация состояния, что подтверждалось уменьшением числа приступов стенокардии, положительной динамикой на ЭКГ, нормализацией уровня кардиоспецифичных ферментов, уменьшением признаков воспалительной активности. Из КГ 2 (8%) пациента умерли в раннем послеоперационном периоде от острой сердечной недостаточности (ОСН). Периоперационный ИМ зарегистрирован у 2 (8%) больных из КГ. ОСН развилась у 3 (12%) пациентов из ОГ и у 9 (36%) из КГ (р = 0,04) (табл. 3). Всем пациентам с ОСН инотропную поддержку допамином проводили в дозе 3-5 мгк/кг/мин в течение 3-5 сут. Нарушения ритма сердца в виде пароксизмов мерцательной аритмии и частой ЖЭ наблюдались у 2 (8%) пациентов из ОГ и у 8 (32%) из КГ (р = 0,03), купировались с помощью І-блокаторов или внутривенного введения кордарона. Посткардиотомный синдром (ПКТС) выявлен у 5 (20%) пациентов ОГ и у 10 (40%) из КГ (р > 0,05), причем плевральную пункцию выполняли 3 (12%) больным из ОГ и 7 (28%) из КГ.
Таблица 3. Клинические исходы заболевания у лиц с ПС
после КШ на госпитальном этапе
| Показатель | ОГ (n = 25) | КГ (n = 25) |
|---|---|---|
|
Клиническая стабилизация |
25(100) |
22(88) |
|
ОСН |
3(12) |
9(36)* |
|
Нарушения ритма |
2(8) |
8(32)* |
|
ИМ |
– |
2(8) |
|
Возрастная стенокардия |
– |
1(4) |
|
Летальность |
– |
2(8) |
Примечание.
* – здесь и в табл. 4 достоверность различий между
группами (р < 0,05), критерий Фишера.
При выписке возвратная стенокардия зарегистрирована у одного (4%) пациента КГ. Класс сердечной недостаточности по NYHA в ОГ уменьшился при выписке с 2,8±0,13 до 1,30±0,11 (p<0,05), а в КГ - с 2,84±0,14 до 1,4±0,12 (р<0,05).
Через 12 мес наблюдения у лиц из ОГ случаев возвратной стенокардии не зарегистрировано, в то время как в КГ стенокардия напряжения III функционального класса выявлена у 4 (16%) пациентов (табл. 4). Повторных госпитализаций по поводу нестабильной стенокардии в ОГ не было, а в КГ повторно госпитализированы 2 (8%) пациента. Таким образом, к концу периода наблюдения клиническая стабилизация состояния выявлена у 76% больных из КГ, что достоверно меньше (р = 0,01), чем в ОГ. Класс сердечной недостаточности по NYHA через 12 мес наблюдения в ОГ составил 1,34±0,21, в КГ – 1,68±0,24 (р > 0,05).
Таблица 4. Клинические исходы заболевания у больных с ПС
после КШ за 12 мес наблюдения
| Показатель |
ОГ (n = 25) |
КГ (n = 25) |
|---|---|---|
|
Клиническая стабилизация |
25(100) |
19 (76)* |
|
Возрастная стенокардия |
– |
4 (16)* |
|
Повторная госпитализация |
– |
2 (8) |
|
Летальность |
– |
2 (8) |
Полученные данные свидетельствуют о том, что применение реамберина у лиц с ранней ПС до и после КШ способствует уменьшению количества послеоперационных осложнений, что доказывает эффективность реамберина при электрической нестабильности миокарда, приводящей к многообразным нарушениям ритма сердца и проводимости.
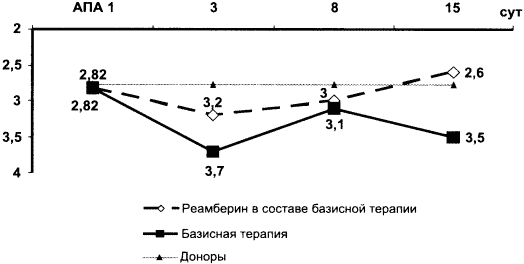
Противоишемический эффект реамберина подтверждается данными прекордиального картирования (табл. 5, рис. 1).
Таблица 5. Динамика показателей прекордиального картирования (ЭКТГ-60)
| Показатель | Исходно | 1 мес | 3 мес | 6 мес | 12 мес |
|---|---|---|---|---|---|
|
nqR: |
|||||
|
ОГ |
21,1 ± 1,4 |
18,6 ± 1,35* |
18,4± 1,2* |
15,9 ± 1,7** |
15,6 ± 1,8** |
|
КГ |
23,1,9 ± 2,6 |
20,8 ± 2,0 |
21,8 ± 3,2 |
20,9 ± 3,8 |
20,1 ±4,9 |
|
nST ± nT: |
|||||
|
ОГ |
26,2 ± 4,2 |
18,7 ± 1,5* |
16,7 ± 2,4** |
16,1 ± 2,5** |
16,0± 1,4** |
|
КГ |
24,6 ± 3,8 |
20,6 ± 3,7 |
20,5 ± 5,1 |
19,6 ± 4,6 |
19,2 ± 4,1 |
Примечание.
Достоверность различий между рассматриваемым и исходным
показателем (по Вилкоксону): *– р < 0,05, ** – p<0,01.

Рис. 1. Динамика ишемии миокарда
по данным прекордиального картирования
Анализ показателей ЭКТГ-60 выявил положительную динамику в обеих группах пациентов, однако в группе лиц с использованием реамберина на всех этапах наблюдения отмечено достоверное уменьшение зоны ишемии (nST + nТ) и зоны повреждения. Это означает, что использование реамберина у больных с ранней ПС после Q-ИМ в большей мере способствует устранению ишемической дисфункции миокарда, чем у лиц с традиционными препаратами.
Высокая эффективность методов прямой реваскуляризации миокарда подтверждалась также данными ХМ-ЭКГ. При выписке в обеих группах пациентов достоверно уменьшилось количество ЖЭ, причем в ОГ на 93,4% (р < 0,01), в КГ на 72,9% (р < 0,05). На следующих этапах наблюдения сохранялось достоверное уменьшение количества ЖЭ в обеих группах больных. В ОГ и КГ зафиксировано достоверное уменьшение суммарной продолжительности эпизодов ишемии миокарда как при выписке, так и на протяжении всего времени наблюдения (рис. 2). Однако в ОГ в отличие от КГ при выписке, через 3 и 6 мес наблюдения отсутствовали БИМ и ББИМ (р > 0,05). У пациентов из группы реамберина при выписке и на всех этапах наблюдения, отсутствовали БИМ, в то время как в КГ число БИМ составило 1,4 ± 1,0 при выписке и концу периода наблюдения – 4,0 ± 1,2. Продолжительность ББИМ в ОГ уменьшилась с 88,6 ± 8,2 до 2,4 ± 1,0 мин (р < 0,001) через 12 мес наблюдения, а в КГ – с 72,6 ± 6,7 до 12,2 ± 1,8 мин (р < 0,001), при этом в ОГ продолжительность ББИМ была достоверно меньше, чем в КГ (р < 0,05). Помимо этого, у лиц из ОГ при выписке, через 3 и 6 мес наблюдения, отсутствовали эпизоды ББИМ, в то время как у лиц КГ их продолжительность составила 4,6 ± 1,2, 10,6 ± 2,5 и 10,1 ± 2,2 мин соответственно. Полученные данные свидетельствуют о длительном влиянии КШ на уменьшение ишемии миокарда, а также о противоишемическом и антиаритмическом эффектах реамберина у больных с ранней ПС после Q-ИМ и КШ.
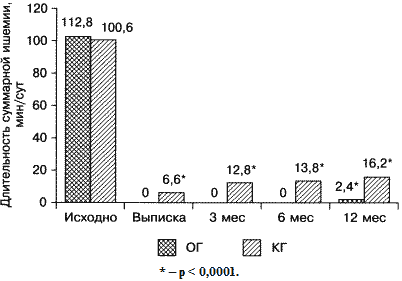
Рис. 2. Динамика суточной ишемии миокарда у пациентов ОГ и
КГ
на различных сроках наблюдения
При ЭхоКГ у пациентов двух групп исходно отмечалось нарушение систолической и ДФ ЛЖ. Динамика показателей ЭхоКГ отражена в табл. 6. После хирургического вмешательства при выписке и через 12 мес наблюдения у пациентов обеих групп отмечалось улучшение систолической и ДФ ЛЖ, а соответственно и уменьшение числа лиц с дезадаптивным типом ремоделирования. У пациентов ОГ на всех этапах наблюдения отмечалось достоверное уменьшение КДИ, КСИ и увеличение ФВ через 1 год (р < 0,01), что свидетельствовало об улучшении систолической функции ЛЖ (см. табл. 6). Об изменении характера ремоделирования ЛЖ свидетельствовало уменьшение показателя миокардиального стресса уже при выписке со 186,7 ± 12,1 до 155,3 ± 4,1 г/см2 (р < 0,05) и до 161,1 ±6,2 г/см2 через 12 мес наблюдения (р < 0,05). Индекс массы миокарда (ИММ) ЛЖ в ОГ также достоверно уменьшился уже при выписке (со 154,1 ± 16,3 до 128,1 ± 7,3 г/м2) и через 1 год составил 126,9 ± 8,8 г/м2 (р < 0,05). Лица ОГ также характеризовались достоверным уменьшением ИЛСМ, который исходно составил 1,64 ± 0,03, при выписке – 1,53 ± 0,05, через 1 год контроля – 1,50 ± 0,01 (p < 0,01).
Таблица 6. Динамика показателей ЭхоКГ у больных с ранней
ПС
в группах наблюдения (М ± m)
| Показатель | Исходно | 1 мес | 3 мес | 6 мес | 12 мес | |
|---|---|---|---|---|---|---|
|
КДИ, мл/м2: |
||||||
|
ОГ |
76,5 ± 9,1 |
60,2 ± 4,4* |
61,0 ± 3,1* |
61,3 ± 3,5* |
62,2 ± 2,4* |
|
|
КГ |
80,8 ± 7,1 |
66,1 ± 4,6* |
68,1 ± 2,8* |
71,3 ±9,0 |
74,5 ± 8,4 |
|
|
КСИ, мл/м2: |
||||||
|
ОГ |
44,5 ± 7,5 |
32,2± 1,8** |
32,4 ± 2,0** |
33,1 ±4,2* |
35,7 ± 2,8* |
|
|
КГ |
43,5 ± 8,2 |
34,0 ± 6,1* |
35,1 ± 7,0* |
36,0 ± 4,0* |
38,7 ± 9,8 |
|
|
ФВ, %: |
||||||
|
ОГ |
45,5 ± 5,6 |
48,4 ± 4,2* |
50,1 ± 1,8* |
50,6 ±4,1* |
52,9 ± 2,0** |
|
|
КГ |
43,2 ± 4,4 |
44,3 ± 5,6 |
48,3 ± 2,5* |
48,1 ± 3,6* |
50,5 ± 6,9* |
|
|
ИЛСМ, баллы: |
||||||
|
ОГ |
1,64 ± 0,03 |
1,53±0,05** |
1,51 ±0,04** |
1,50 ± 0,02** |
1,50 ± 0,01** |
|
|
КГ |
1,69 ± 0,09 |
1,60 ± 0,1 |
1,61 ± 0,01 |
1,64 ± 0,08 |
1,66 ±0,1 |
|
|
МС, г/см2: |
||||||
|
ОГ |
186,7 ± 12,1 |
155,3 ±4,1* |
154,2 ± 2,8* |
160,1 ± 5,1* |
161,1 ±6,2* |
|
|
КГ |
178,4 ± 19,8 |
180,6 ± 10,0 |
186,1 ± 10,9 |
190,3 ± 11,2 |
184,2 ± 7,0 |
|
|
ИММЛЖ, г/м2: |
||||||
|
ОГ |
154,1 ± 16,3 |
128,1 ± 7,3* |
126,3 ± 6,6* |
128,1 ± 3,5* |
126,9 ± 8,8* |
|
|
КГ |
148,7 ± 10,2 |
138,1 ± 9,8 |
136,2 ± 7,7 |
134,3 ± 7,8 |
134,2 ± 10,4 |
|
Примечание.
Достоверность различий между рассматриваемым и
исходным показателем:
* – р < 0,05, р< 0,01.
У пациентов КГ при выписке достоверно уменьшились КДИ и КСИ. Однако через 1 год контроля различия стали недостоверными. ФВ увеличилась достоверно через 3 мес наблюдения с 43,2 ± 4,4 до 48,3 ± 2,5 % и через 1 год контроля составила 50,5 ± 6,9% (р < 0,05). ИЛСМ имел тенденцию к уменьшению на протяжении всего периода наблюдения (исходно – 1,69 ± 0,02 балла, через 1 год – 1,66 ± 0,1 балла). Показатели миокардиального стресса и ИММ ЛЖ, характеризующие процессы ремоделирования миокарда, достоверно не изменились, что свидетельствует о задержке патологического ремоделирования. Анализируя указанную динамику показателей ЭхоКГ в группах пациентов, можно констатировать, что назначение реамберина до и после КШ позитивно влияет на сократительную функцию и процессы ремоделирования миокарда. Это подтверждается положительной динамикой ДФ у пациентов с ПС после АКШ, МКШ, которым проводилась защита миокарда реамберином (табл. 7).
Таблица 7. Динамика ДД в группах наблюдения
| Тип ДД | Исходно | 1 мес | 3 мес | 6 мес | 12 мес |
|---|---|---|---|---|---|
|
I тип: |
|||||
|
ОГ |
12(48) |
6(24) |
6(24) |
2(8)** |
2(8)** |
|
КГ |
11(44) |
7(28) |
6(24) |
6(24) |
6(24)* |
|
p |
н/д |
н/д |
н/д |
н/д |
н/д |
|
II тип: |
|||||
|
ОГ |
10(40) |
5(20) |
5(20) |
3(12)* |
3(12)* |
|
КГ |
10(40) |
6(24) |
5(20) |
5(20) |
5(20) |
|
p |
н/д |
н/д |
н/д |
н/д |
н/д |
|
III тип: |
|||||
|
ОГ |
3(12) |
1(4) |
– |
– |
– |
|
КГ |
4(16) |
3(12) |
3(12) |
3(12) |
3(12) |
|
p |
н/д |
н/д |
н/д |
н/д |
н/д |
|
Нормальная ДФ: |
|||||
|
ОГ |
– |
13(52)*** |
20(80)*** |
20(80)*** |
20(80)** |
|
КГ |
– |
9(36)*** |
11(44)*** |
11(44)*** |
11(44)** |
|
p |
н/д |
н/д |
0.009 |
0.009 |
0.009 |
Примечание.
Достоверность различий между ОГ2 и КГ2 (р <
0,05, критерий Фишера); достоверность изменений в группе:
* – р < 0,05;
**– р< 0,01;
*** – р < 0,001 (критерий Мак-Немара).
После хирургической реваскуляризации в обеих группах отмечено улучшение ДФ ЛЖ. К концу периода наблюдения количество лиц с I типом (анормального расслабления) диастолической дисфункции (ДД) уменьшилось на 83,3% (р < 0,01) в ОГ и на 45,5% (р < 0,05) в КГ (см. табл. 7; рис. 3), со II (псевдонормальным) типом – на 70 и 50% соответственно и рестриктивным типом – на 100% в ОГ и на 25% в КГ. Нормализация показателей ДФ произошла у 80% лиц из ОГ (р < 0,001) и у 44% из КГ (р < 0,001), причем у лиц из ОГ нормальная ДФ выявлялась достоверно чаще, чем у лиц КГ (р = 0,009).
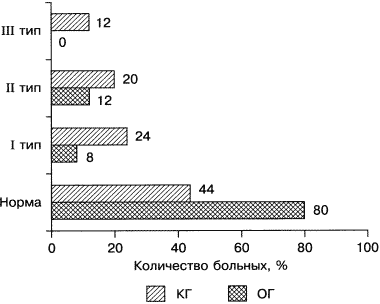
Рис. 3. Типы диастолической дисфункции у пациентов ОГ и КГ
через 12 мес наблюдения
Таким образом, в ходе исследования установлено, что у лиц ОГ (реамберина) отмечалось более благоприятное, чем в контрольной группе, течение послеоперационного периода: реже регистрировались ОСН, нарушения ритма, уменьшилась выраженность проявлений ПКТС. При выписке и через 12 мес наблюдения у пациентов ОГ отмечалась также достоверная положительная динамика по данным ЭКТГ-60, ХМ-ЭКГ и ЭхоКГ. Полученные результаты свидетельствуют о кардиопротекторном и антиишемическом свойствах реамберина, благодаря которым данный препарат может быть рекомендован к использованию в качестве фармакологической защиты миокарда у больных с ранней ПС при подготовке к КШ и в раннем восстановительном периоде после АКШ, МКШ.
Использование реамберина в качестве предоперационной подготовки и после хирургического лечения у лиц с Q-ИМ, осложненным ранней ПС, уменьшает количество таких послеоперационных осложнений, как ОСН (р – 0,04), нарушения ритма сердца (р = 0,01) и ПКТС (р = 0,056).
Применение реамберина способствует уменьшению числа случаев возвратной стенокардии через 12 мес наблюдения (р = 0,03), что подтверждается данными ХМ-ЭКГ о достоверном снижении суммарной продолжительности ишемии миокарда, количества и продолжительности БИМ и ББИМ за весь период наблюдения и данными ЭКТГ-60 – об уменьшении зоны ишемии миокарда.
Прямая реваскуляризация миокарда препятствует патологическому ремоделированию миокарда у пациентов с ранней ПС. Использование реамберина способствует более быстрому восстановлению как систолической, так и диастолической функции миокарда, что связано с кардиопротекторными и противоишемическими свойствами препарата.