Рис. 1. Выраженность оксидативного стресса у больных с ЖКК
при
различной остроте процесса
Источник:
Хирургия. Хирургия. Журнал им. Н.И. Пирогова, 2011; №12: 64-70
1Кафедра госпитальной хирургии №1 лечебного факультетаРоссийского национального исследовательского медицинского университета им. Н.И. Пирогова Минздравсоцразвития;
2Кафедра патологии человека ФППО врачей Первого Московского государственного медицинского университета им. И.М.Сеченова Минздравсоцразвития. Москва
Силина Е.В.2, Ступин В.А.1, Сабиров М.А.1,
Болевич С.Б.2,
Смирнова Г.О.1, Силуянов С.В.1,
Мартиросов А.В.1, Меньшова Н.И.2
Проведен анализ свободнорадикальных процессов (СРП) у больных с язвенными желудочно-кишечными кровотечениями (ЯЖКК) различного характера и тяжести, в результате которого выявлена значимость оксидантного стресса, выявляемого уже на 1-е сутки госпитализации и в наибольшей степени выраженного у тяжелобольных с острыми язвенными гастродуоденальными кровотечениями.
При нетяжелых ЯЖКК нарушения СРП затрагивают кислородный этап окислительного стресса и являет собой приспособительные компенсаторные механизмы. Интенсификация СРП по мере нарастания тяжести заболевания заключается в снижении активности кислородного и нарастании липидного дисбаланса.
Дисбаланс СРП продолжается длительное время вплоть до выписки больных из стационара. Полученные данные служат основанием для рекомендации максимально раннего включения в комплекс лечебных мероприятий антиоксидантной энергокоррегирующей терапии.
Выявлена эффективность применения терапии препаратом на основе янтарной кислоты реамберином у больных с ЯЖКК. Позитивное влияние реамберина на маркеры оксидантного стресса сопровождалось улучшением клинической картины заболевания и результатов лечения.
Болезни желудочно-кишечного тракта занимают лидирующее место среди хирургических заболеваний [11]. Желудочно-кишечные кровотечения (ЖКК) - грозное осложнение язвенной болезни желудка или двенадцатиперстной кишки, а также соматических заболеваний, сопряженное с высокой летальностью.
Поэтому лечение язвенных гастродуоденальных кровотечений, составляющих до 60-80% всех геморрагических осложнений при заболеваниях пищеварительного тракта, продолжает оставаться одной из самых актуальных проблем ургентной хирургии [1, 4, 5, 11].
Общепризнанным до недавнего времени было утверждение, что в структуре причин ЖКК преобладает кислотно-пептическая язвенная болезнь, однако создание различных высокоэффективных лекарственных средств, направленных на снижение кислотопродуцирующей функции желудка, в корне изменило это мнение.
Сейчас на первый план выступают не кровотечения, связанные с хроническими кислото-пептическими язвами, а кровотечения из острых язв, диагностируемые в 50–70% наблюдений [8, 9, 12, 14]. Основными причинами появления острых язв служат декомпенсация сопутствующих заболеваний и полиорганная недостаточность, экзогенная и эндогенная интоксикации, сочетанные травмы, увеличение числа и объема оперативных вмешательств, приемом различных лекарств, алкоголя [1, 3, 6, 7, 8, 10, 11].
При этом летальность при ЖКК из таких язв в отделениях реанимации и интенсивной терапии достигает 80% [1, 2, 15]. Данный факт объясним коморбидностью острых язв, сопряженных клеточным апоптозом в условиях органной гипоксии, ишемии и развития оксидативного стресса [1, 2, 7, 10, 12].
В связи с этим правильный выбор лечебной тактики обусловлен необходимостью учитывать пусковые причины ЖКК. Тактика лечения пациентов с кровотечением из гиперацидных язв с высокой кислотопродукцией основана на профилактике рецидива кровотечения и антисекреторной терапии. Лечение коморбвдных, симптоматических, язв должна основываться на коррекции микроциркуляторных, обменных и оксидантных нарушений. В этом отношении привлекают внимание препараты с антиоксидантными и антигипоксантными свойствами, с одной стороны, позволяющие уменьшать концентрацию активных свободных радикалов, с другой – способствующие нормализации синтеза АТФ, обеспечивая механизмы органного гомеостаза [2, 10, 12, 13].
Целью исследования являлось улучшение результатов лечения больных с язвенными желудочно-кишечными кровотечениями различного характера и тяжести путем системного изучения свободнорадикальных процессов и разработки алгоритма своевременной антиоксидантной коррекции.
Проведено рандомизированное сравнительное проспективное изучение данных обследования 70 больных в возрасте от 17 до 94 лет (в среднем 61 год) с язвенными желудочно-кишечными кровотечениями (ЯЖКК) различной этиологии и степени тяжести, поступавших в хирургические отделения ГКБ №15 им. О.М. Филатова (Москва) в период 2009-2011 гг., среди больных были 41 (58,6%) мужчина в возрасте от 21 года до 80 лет (в среднем 57 лет) и 29 (41,4%) женщин в возрасте от 17 до 94 лет (в среднем 71 год).
Длительность ЯЖКК у больных на момент поступления варьировала от 1,5 ч до 7 сут и в среднем составила 24 ч. 50 (71,4%) больных поступали в 1-е сутки, в том числе 24 (34,3%) – в первые 12 ч от дебюта кровотечения, 26 (37,1%) – в период 12-24 ч; 11 (15,7%) пациентов – на 2-е сутки и 9 (12,9%) – на 3-й сутки и в более поздние сутки от дебюта ЯЖКК. У 39 (55,7%) пациентов ЯЖКК развилось из острой язвы, у 31 (44,3%) – из хронической язвы. Кровотечение из хронических язв было у пациентов более молодого возраста (в среднем 51 год), кровотечение из острых язв – у пожилых (в среднем 67 лет) р<0,05). По результатам ЭГДС количество активных язв варьировало от 1 до 5, при этом у 48 (68,6%) больных язва была единственной, в остальных 22 (31,4%) наблюдениях выявлены множественные язвы. Размер язв по данным ЭГДС варьировал в пределах от 0,04 до 20,0 см3, при этом у 26 (37,1 %) больных объем кровоточащей язвы был менее 0,3 см3, у 29 (41,4%) обнаружена язва средних размеров – 0,3-1 см3, у 15 (21,4%) больных зарегистрирована язва размером более 1 см3.
При включении в исследование пациенты были рандомизированы на 2 группы: 1-ю группу сравнения составили 34 (48,6%) больных, получавших терапию, соответствующую стандартам оказания медицинской помощи данной категории больных, 2-ю – основную группу – 36 (51,4%) больных, получавших в составе стандартной терапии энергокорректор и антиоксидант на основе янтарной кислоты реамберин в дозе 400 мл в сутки внутривенно капельно с 1-х суток в течение 10 дней. При включении в исследование состав обеих групп был статистически сопоставим (табл. 1).
Таблица 1. Распределение больных исследуемых групп
в зависимости
от возраста, пола, характера, размера и степени тяжести ЯЖКК
|
Показатель |
Группа |
р |
Всего больных (n=70) |
|
|---|---|---|---|---|
|
1-я (n=34) |
2-я (n=36) |
|||
|
Возраст, годы |
58,03±2,77 |
59,95±2,85 |
>0,05 |
58,99±1,98 |
|
Пол: |
||||
|
мужской |
20 (58,8) |
21 (58,3) |
>0,05 |
41 (58,6) |
|
женский |
14 (41,2) |
15 (41,7) |
29 (41,4) |
|
|
Степень ЯЖКК: |
||||
|
легкая |
5 (14,7) |
6 (16,7) |
>0,05 |
11 (15,7) |
|
средняя |
13 (38,2) |
12 (33,3) |
25 (35,7) |
|
|
тяжелая |
16 (47,1) |
18 (50,0) |
34 (48,6) |
|
|
ЯЖКК из острых язв |
18 (52,9) |
21 (58,3) |
>0,05 |
39 (55,7) |
|
ЯЖКК из хронических язв |
16 (47,1) |
15 (41,7) |
31 (44,3) |
|
|
Размер язв, см3 |
||||
|
<0,3 |
12 (35,3) |
14 (38,9) |
>0,05 |
26 (37,1) |
|
0,3-1 |
15 (44,1) |
14 (38,9) |
29 (41,4) |
|
|
>1 |
7 (20,6) |
8 (22,2) |
15 (21,4) |
|
Примечание. В скобках – показатели в процентах.
Лечение больных проводилось консервативным и оперативным методом. Стандартная терапия ЯЖКК включала лечебно-диагностическую эзофагогастродуоденоскопию, остановку кровотечения и проведение антисекреторной терапии блокатороми протонной помпы или Н2-гистамин-блокаторами.
Состояние пациента оценивали в динамике (при поступлении, на 3, 8, 15-е сутки) на основе комплекса клинических, лабораторных, инструментальных методов исследования:
Хемилюминесцентные (ХЛ) показатели генерации активных форм кислорода лейкоцитами крови исследовали на адаптированном для хемилюминометрии хемилюминемометре ЛКБ «Wollac» (Швеция) при стандартной температуре 36,9°С. Определяли уровень базальной (спонтанной) ХЛ (ПИХЛб) в стандартном объеме взвеси лейкоцитов со стандартной их концентрацией (2500 в 1 мкл). После добавления неспецифического активатора (0,1 мл 1% раствора зимозана) определяли ПИХЛс. Рассчитывали показатель интенсивности ХЛ лейкоцитов по формуле: ПИХЛ=максимальная ХЛ·106/количество гранулоцитов и моноцитов в исследуемом объеме лейкоцитарной массы. ПИХЛб – это показатель, характеризующий спонтанную ХЛ лейкоцитов в покое, возникающую при поглощении ими микрочастиц, что сопровождается перестройкой окислительного метаболизма лейкоцитов и приводит к образованию активных форм кислорода. ПИХЛб отражает исходное состояние метаболических процессов, обусловленное равновесием между интенсивностью свободнорадикальных окислительных процессов и активностью биоантиоксидантных систем. ПИХЛс – интегральный показатель, отражающий присутствие АФК в системе. Коэффициент активности лейкоцитов, вычисляемый по формуле КА=ПИХЛс/ПИХЛб, характеризует активность кислородных СРП. Методика исследования антиперекисной АПА основана на измерении и сопоставлении показателей индуцированной перекисью водорода хемилюминесценции плазмы и ее спонтанной ХЛ (Инд/Сп ХЛ). Рассчитанный показатель отношения является величиной, обратно пропорциональной АПА. Чем меньше это отношение, тем больше АПА и наоборот. Для определения АПА исследовали спонтанную и индуциро ванную ХЛ вторичной плазмы. Вторичную плазму, не содержащую тромбоциты, получали путем двойного центрифугирования первичной плазмы. Спонтанная ХЛ вторичной плазмы отражала ХЛ-ответ плазмы в покое. Индуцированная ХЛ вторичной плазмы отражала ХЛ ответ плазмы после добавления 0,05 мл 3% раствора Н2О2. Малоновый диальдегид (МДА) – вторичный продукт свободнорадикального перекисного окисления липидов определяли по методике, описанной J. Douest (1983). Сущность реакции заключается во взаимодействии тиобарбитуровой кислоты (ТБК) с вторичной плазмой с последующим добавлением Н-бутанола для экстракции окрашенного ТБК-продукта. Оптическую плотность измеряли на спектрофотометре. Концентрацию МДА плазмы рассчитывали по формуле: С=Д·10р/1,56, где Д – оптическая плотность, р – степень разведения, 1,56 – поправочный коэффициент, и выражали конечный результат в микромолях на 1 л плазмы.
Исследуемые значения показателей СРП сравнивались с одноименными показателями здоровых доноров.
Статистическую обработку результатов проводили с применением программ Microsoft Excel и пакета статистического анализа данных Statistica 8.0 for Windows (StatSoft Inc., USA) и SPSS 15.0. Различия считали статистически значимыми при уровне ошибки р<0,05. Количественные переменные описывали средним арифметическим значением (M) ± стандартная ошибка среднего (m), в выборках, не подчиняющихся закону нормального распределения – медианы. Качественные переменные описывали абсолютными и относительными частотами (процентами). Для оценки полученных результатов использовали методы статистического анализа: З2-критерий Пирсона (анализ таблиц сопряженности), t-критерий Стьюдента, критерий Ньюмана-Кейлса для множественных сравнений. Для независимых непараметрических выборок использовали критерий Манна-Уитни, для множественного сравнения – критерий Краскелла-Уоллиса. Для зависимых непараметрических выборок использовали критерий Вилкоксона, для множественного сравнения – Фридмана.
Выявлена и объективизирована роль СРП в развитии и течении ЯЖКК уже в 1-е сутки госпитализации, при этом СР-дисбаланс затрагивал как кислородный, так и перекисно-липидный этапы. Так, у больных ЯЖКК в 1-е сутки повышается ПИХЛс в 3,10 раза (p<0,001), КА – в 4,28 раза (р<0,001) и МДА – в 1,41 раза (р=0,002). Наибольший дисбаланс зарегистрирован у больных с неблагоприятным исходом заболевания (табл. 2).
Таблица 2. СРП у больных с ЯЖКК при поступлении в стационар
по
сравнению с одноименными параметрами у здоровых доноров
|
Показатель |
ПИХЛб |
ПИХЛс |
КА |
Инд/Сп ХЛ |
МДА |
|---|---|---|---|---|---|
|
Доноры (n=33) |
63,37±5,04 |
435,83±32,49 |
8,28±1,20 |
2,73±0,14 |
2,92±0,17 |
|
62,5 |
469,85 |
6,89 |
2,78 |
2,75 |
|
|
ЯЖКК (n=70) |
60,05±11,14 |
1653,02±216,56 |
35,59±4,82 |
3,18±0,18 |
4,05±0,25 |
|
47,78 |
1455,00 |
29,49 |
2,82 |
3,87 |
|
|
р |
0,120 |
<0,001* |
<0,001* |
0,168 |
0,002* |
|
Анализ показателей у больных с ЯЖКК в зависимости от исхода заболевания |
|||||
|
Благоприятный исход (выписанные) (n=59) |
52,94±9,27 |
1347,15±233,29 |
33,23±5,13 |
2,92±0,18 |
3,89±0,21 |
|
46,32 |
1431,00 |
29,55 |
2,70 |
3,76 |
|
|
р |
0,043* |
<0,001* |
<0,001* |
0,418 |
0,005* |
|
Неблагоприятный (летальный) исход (n=11) |
92,02±46,14 |
1935,93±589,90 |
36,75±14,10 |
4,39±0,63 |
5,27±1,03 |
|
79,10 |
1698,0 |
27,27 |
4,12 |
4,90 |
|
|
р |
0,556 |
<0,001* |
0,007* |
0,009* |
0,007* |
|
р |
0,199 |
0,496 |
0,785 |
0,048# |
0,187 |
Примечание.
Статистические результаты (при каждом показателе) представлены в
виде следующих данных: первая строка – M±m, вторая строка –
медиана.
* – статистически значимое при p<0,05 отличие показателя по
сравнению с нормой;
# – статистически значимое при p<0,05 отличие показателя в
зависимости от исхода заболевания.
При благоприятном исходе ЯЖКК зарегистрирован в большей степени кислородный дисбаланс СРП с нерезко выраженными изменениями перекисно-липидной стадии в виде умеренного повышения уровня МДА плазмы, компенсирующийся нормальным уровнем АЛА. При неблагоприятном исходе заболевания выявленный СР-дисбаланс преимущественно затрагивал конечный перекисно-липидный этап окислительного стресса, что выражалось в значимом снижении АПА при выраженном росте МДА. Это свидетельствует о разрушении мембран клеток ввиду недостаточности компенсаторных кислородных и энергетических механизмов. Таким образом, показатель АПА может быть использован в качестве раннего прогностического маркера течения и исхода заболевания.
Дифференцированный анализ СРП у больных с ЯЖКК с различной степенью тяжести выявил, что нетяжелые ЯЖКК сопровождаются дисбалансом исключительно кислородной части каскада окислительного стресса (повышается ПИХЛс и КА), что является признаком включения компенсаторных механизмов, таких как выход крови из депо и др. У больных с тяжелыми ЯЖКК имеет место незначимое стихание активности кислородного дисбаланса с одновременной интенсификацией липидного дисбаланса СРП. Уровень повышения МДА свидетельствовал о необратимой гибели клеток и коррелировал с выраженностью клинических проявлений.
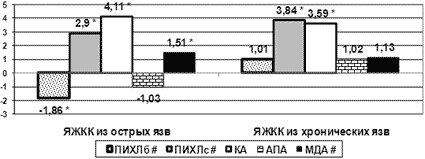
Следует отметить, что у больных с ЯЖКК, развившихся из острых язв, значимо превосходили норму показатели ПИХЛс, КА (р<0,001), МДА (p<0,01) наряду со снижением ПИХЛб (p<0,05) и тенденцией к депрессии АПА. У больных с ЯЖКК из хронических язв значимые изменения СРП касались только кислородных маркеров: превосходили норму показатели ПИХЛс (р<0,001), КА (р<0,001). Поэтому при острых ЯЖКК активность ПИХЛб была в 1,94 раза ниже, чем при хронических (р<0,05), в то время как при хронических кровотечениях ПИХЛс активизировался в 1,33 раза больше, чем при острых (р<0,05). Перекисно-липидный этап окислительного стресса в наибольшей степени нарушен при ЯЖКК из острых язв, что проявлялось повышением уровня МДА на 51% нормального и на 33% по сравнению с МДА у больных с ЯЖКК из хронических язв (р<0,05). Кроме того, обращает на себя внимание разнонаправленность векторов АПА. Данное сочетание может быть свидетельством достаточных компенсаторных резервов при кровотечениях из хронических язв (рис. 1).

Рис. 1. Выраженность оксидативного стресса у больных с ЖКК
при
различной остроте процесса
Указаны отклонения от нормы:
* – p<0.05 – отличие от нормы;
# – p<0.05 – различие по характеру язв.
Подтверждением этого является наибольшая выраженность окислительного стресса на фоне де прессии защитной АПА плазмы у пациентов в 1-е сутки ЯЖКК, в то время как у пациентов, госпитализированных в период с 3-х и более суток от дебюта ЯЖКК, СР-дисбаланс выражен в меньшей степени, при этом АПА проявляет тенденцию к росту (рис. 2).
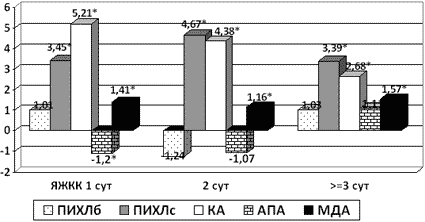
Рис. 2. Дисбаланс СРП у больных с ЖКК
в различные сроки от дебюта заболевания
Указаны отклонения от нормы:
* – p<0.05 – отличие от нормы;
Анализ динамики СРП у больных с ЯЖКК выявил длительно не затухающие явления окислительного стресса вплоть до 15-х суток исследования, при этом отмечается тенденция к постепенному регрессу кислородной части спектра окислительного ка скада с одновременной перекисно-липидной дизрегуляцией, усиливающейся к 15-му дню, что объективизирует актуальность раннего назначения антиоксидантных энергокорригирующих препаратов больным с ЯЖКК (рис. 3).
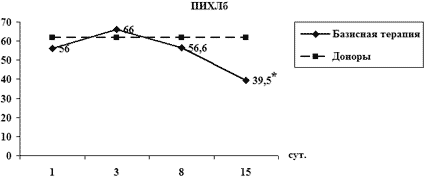
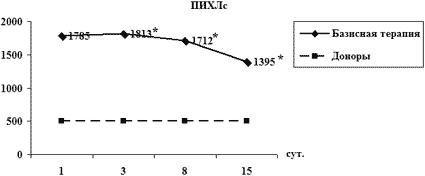
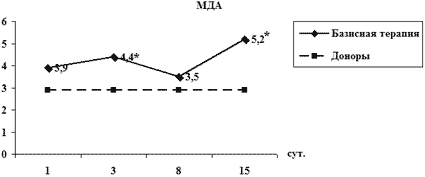
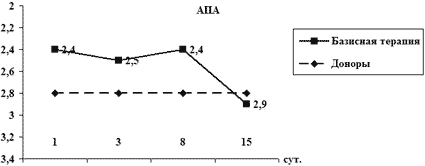
Рис. 3. Динамика СРП у больных с ЖКК
* – p<0.05 – отличие от нормы;
Для восполнения оксидативного баланса и клеточного энергодефицита использовали препарат янтарной кислоты реамберин, стимулирующий цикл Кребса и выработку дополнительного количества АТФ. При оценке действия антиоксидантной терапии у больных с ЯЖКК различного генеза и тяжести были получены результаты, позитивно оценивающие динамику как кислородного, так и липидного спектра СРП. Отмечено уменьшение негативного действия АФК, уменьшение выраженности реакций ПОЛ и, вероятно, сохранение жизнеспособности и жизнедеятельности клеток (рис. 4). Однако, несмотря на выраженное позитивное действие реамберина на показатели окислительного стресса, его полной нормализации не наблюдалось, что говорит о необходимости рассмотрения вопроса о проведении более высокодозной (более 500 мл/сут) и более длительной терапии.
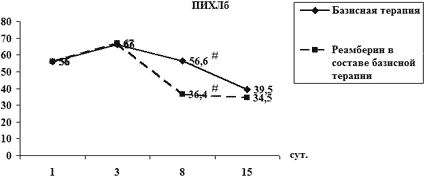
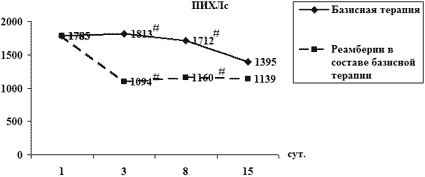
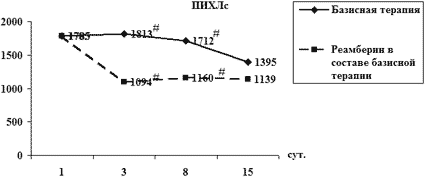
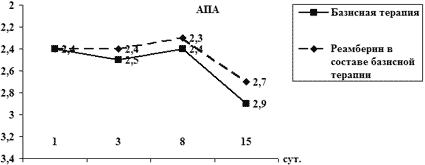
Рис. 4. Влияние антиоксидантной терапии на СРП
у больных с ЖКК
# – p<0.05 – межгрупповое различие показателя в определённой точке исследования;
Положительная динамика параметров окси-дантного стресса коррелировала с улучшением клинической картины заболевания, снижением частоты осложнений, что уменьшило сроки пребывания больных в дорогостоящих палатах интенсивной терапии в среднем в 1,9 раза. Длительность пребывания в реанимации в группе стандартной терапии составила 10,44±3,43 сут, в группе антиоксидантной энергокоррекции – 5,47+1,72 сут (р<0,05). В группе больных, получавших в комплексной терапии антиоксидант реамберин, рецидив кровотечения возник в 7 (19,4%) наблюдениях в отличие от группы срав нения, где частота рецидивов составила 26,5%.
Таким образом, на основании проведенного анализа свободнорадикальных процессов у больных с язвенными желудочно-кишечными кровотечениями выявлена значимость оксидантного стресса, который в наибольшей степени выражен у тяжелобольных с острыми язвами. При нетяжелых язвенных желудочно-кишечных кровотечениях (ЯЖКК) нарушения свободнорадикальных процессов (СРП) затрагивают кислородный этап окислительного стресса и являют собой приспособительные компенсаторные механизмы. Интенсификация СРП по мере нарастания заключается в снижении активности кислородного дисбаланса и выраженного нарастания липидного дисбаланса СРП. Уровень анти-перекисной активности может быть рекомендован в качестве раннего прогностического маркера течения и исхода заболевания. Дисбаланс СРП продол ается длительное время вплоть до выписки больных из стационара. Полученные данные служат основанием для рекомендации максимально раннего включения в комплекс лечебных мероприятий больных с ЯЖКК антиоксидантных энергокорригирующих препаратов.
Подтверждена эффективность применения энергокорригирующей антиоксидантной терапии реамберином в суточной дозе 400 мл на примере коррекции оксидантного стресса у больных с ЯЖКК различного генеза и тяжести. Позитивное влияние реамберина на маркеры оксидантного стресса сопровождалось улучшением клинической картины заболевания и результатов лечения.