МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГУ ИНСТИТУТ ТОКСИКОЛОГИИ
САНКТ-ПЕТЕРБУРГСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
ПОСЛЕДИПЛОМНОГО ОБРАЗОВАНИЯ
В.В. Афанасьев
Клиническая фармакология реамберина
(очерк)
(пособие для врачей)
Санкт-Петербург
2005
Рецензенты
Доктор медицинских наук, профессор В.Е. Марусанов;
Доктор медицинских наук, профессор М.Я. Малахова.
Пособие о реамберине написано в форме очерка, в котором
представлены основные показания к применению этого препарата в
медицине критических состояний. Оригинальная форма изложения
позволила автору рассмотреть не только механизмы действия
реамберина, но и его системные эффекты, описанные в традиционной
манере изложения, а также основные комбинации реамберина с
препаратами других фармакологических групп.
Отличительной особенностью является анализ фармакологических
комбинаций при применении реамберина с препаратами других
фармакологических групп, выполненный на примере конкретных
клинических ситуаций, что является весьма полезным в качестве
образца подходов к рациональной фармакотерапии.
Настоящее пособие ориентировано на широкий круг врачей,
студентов медицинских вузов, клинических ординаторов и
аспирантов.
СОДЕРЖАНИЕ
Список сокращений
1. ВВЕДЕНИЕ
1.1. Основные источники энергии, необходимые для работы функциональных систем организма человека
1.2. Роль гипоксии в развитии критических состояний
2. МЕХАНИЗМ ДЕЙСТВИЯ РЕАМБЕРИНА
2.1. Биохимические основы действия реамберина
2.2. Системные эффекты реамберина
3. ОСНОВНЫЕ ПОКАЗАНИЯ К НАЗНАЧЕНИЮ
4. ОСОБЕННОСТИ ПРИМЕНЕНИЯ РЕАМБЕРИНА ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ
4.1. Острые отравления
4.2. Применение реамберина для лечения больных, перенесших постреанимационные повреждения
4.3. Применение реамберина при цитолитических процессах
5. СОЧЕТАНИЕ РЕАМБЕРИНА С ПРЕПРАТАМИ ДРУГИХ ФАРМАКОЛОГИЧЕСКИХ ГРУПП
5.1. Сочетание с тиамином, липоевой (тиоктовой) к-той, ионами магния и кальция
5.2. Сочетание с растворами глюкозы
5.3. Сочетание с глиатилином
5.4. Сочетание с панангином (калия-магния аспаргинатом)
5.5. Сочетание с нимодипином
5.6. Сочетание со средствами инотропной поддержки миокарда и вазопрессорами
5.7. Сочетание с антиоксидантами других функциональных классов
5.8. Сочетание с растворами для парентерального питания
5.9. Сочетание с мафусолом
5.10. Сочетание с хлорамфемиколом
6. ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ РЕАМБЕРИНА В МЕДИЦИНСКОЙ ПРАКТИКЕ
7. СПИСОК ЛИТЕРАТУРЫ
Список сокращений
|
ААС
|
Алкогольный абстинентный синдром
|
|
АД
|
Артериальное давление
|
|
А-КоА
|
Ацетил-коэнзим А
|
|
АнГ
|
Анаэробный гликолиз
|
|
АОС
|
Антиоксидантные системы (организма)
|
|
АцХ
|
Ацетилхолин
|
|
АЭ
|
Аэробный гликолиз
|
|
БСЛР
|
Базовая сердечно-легочная реанимация
|
|
ГАМК
|
Гамма аминомасляная кислота
|
|
ЖК
|
Жирные кислоты
|
|
ИВЛ
|
Искусственная вентиляция легких
|
|
ИВЛ с ПДКВ
|
Искусственная вентиляция легких с положительным давлением на
конце выдоха
|
|
МК
|
Молочная кислота
|
|
НМДА
|
НМДА рецепторы
|
|
ПВК
|
Пировиноградная кислота
|
|
ПОЛ
|
Перекисное окисление липидов
|
|
ПОН
|
Полиорганная недостаточность
|
|
ФУС
|
Функциональные системы организма
|
|
ХНК
|
Хроническая недостаточность кровообращения
|
|
цАМФ
|
Циклический аденозинмонофосфат
|
|
цГТФ
|
Циклический гуанозинмонофосфат
|
|
ЦТК
|
Цикл трикарбоновых кислот
|
|
ЯК
|
Янтарная кислота
|
|
ED50; Vинф
|
Средняя стандартная доза; скорость инфузии
|
1. ВВЕДЕНИЕ
При нормальном обеспечении кислородом, все три типа питательных
веществ, используемых в клинической практике, проходят ряд
метаболических превращений, в ходе которых образуется энергия,
необходимая для работы функциональных систем (фус) организма
больного. Из глюкозы образуется пировиноградная кислота (ПВК),
высвобождаются окислительные эквиваленты (НАДН), которые
переносятся в матрикс митохондрий и, далее, включаются в цикл
трикарбоновых кислот (ЦТК или цикл Кребса/цКребса). Таким образом,
экзогенно вводимая глюкоза, становится участником ЦТК. Аминокислоты
непосредственно участвуют в реакциях цКребса. При их окислении
генерируется восстановительные эквиваленты (НАД+), которые
переносятся дыхательной цепью на кислород. Энергия, высвобождаемая
при этих реакциях, используется для синтеза АТФ. Жирные кислоты
(ЖК) поступают в кровь и в виде ацилкарнитина они также поступают в
матрикс митохондрий, где подвергаются β-окислению с образованием
Ацетил-КоА и, далее, также «вливаются» в ЦТК. Таким образом,
основные реакции биотрансформации питательных веществ, при которых
образуется энергия, замыкаются на цКребса или аэробный гликолиз
(АЭ).
АЭ тесно связан с окислительным фосфорилированием. Вместе они,
определяют выход 38 молей АТФ на 1 г глюкозы. В ходе этих двух
процессов некоторые из их реакций обеспечивают регенерацию НАД+.
Окислительное фосфорилирование самый эффективный способ синтеза
АТФ, в результате которого компоненты дыхательной цепи катализируют
перенос электронов от НАДН (или восстановленного убихинона/QH2) на
молекулярный кислород. При этом образуется энергия для синтеза АТФ
(всего образуется до 60% от общего количества энергии клетки). Это
постоянно действующий и наиболее эффективный путь
энергообразования в клетках всех типов, т.к. в нем наряду с
глюкозой, могут быть использованы не только жирные кислоты, но и
кетоновые тела. Подчеркнем, что при снижении р02арт до 90
мм.рт.ст., скорость аэробного гликолиза и окислительного
фосфорилирования существенно снижаются. Клиническим эквивалентом
этого снижения являются слабость, «разбитость», «плохое
самочувствие» в целом.
Таким образом, для успешного синтеза энергии необходимы редокс-
пара НАДН/НАД+ и достаточные концентрации субстратов, участников
гликолиза и ЦТК.
На всех уровнях регуляции гомеостаза существуют системы
надежности, предназначенные для восполнения утраченных при болезни
функций. В метаболических путях такими системами могут быть
альтернативные источники получения энергии, такие как:
- анаэробный гликолиз (АнГ) – определяет выход 2-х молей АТФ на 1
г глюкозы, – процесс образования фосфорилированных углеводов,
которые превращаются в ПВК. Без существенных последствий для
организма АнГ может покрывать кратковременные энергетические
нагрузки, даже субмаксимальные (например, у спортсменов,
космонавтов, лиц, выполняющих экстремальные задачи и т.д.).
Однако, отмечено, что даже при кратковременной экспозиции
нагрузкой, впоследствии требуется метаболическая адаптация
(Афанасьев В. В. 1999). При заболеваниях, тем более при критических
состояниях, АнГ не обеспечивает расхода энергии и развивается с
накоплением кислот (ПВК переходит в МК). В результате этого
возникает недостаточность функциональных систем, в т.ч. не
связанных напрямую с пораженной системой или органом.
- субстратное фосфорилирование (перенос неорганического фосфора на
АДФ и образование АТФ в ходе метаболического цикла или
«субстратной цепи»). К сожалению, одна из таких реакций –
образование ГТФ локализована в ЦТК (переход сукцинат-КоА в
сукцинат), две другие
связаны с образованием АТФ при гликолизе (гидролиз
1.3-дифосфоглицерата и образование ПВК). Эти реакции способны на некоторое время
поддерживать жизнедеятельность организма в отсутствие
окислительного фосфорилирования.
- гексозомонофосфатный путь окисления глюкозы (или «пентозный
шунт») необходим для ресинтеза жирных кислот и предшественников
нуклеотидов. Этот метаболический путь – поставщик НАДФН и
рибозо-5-фосфата. Однако, глюкоза в этом цикле окисляется в
небольшом количестве (от 5 до 8%) [Siegel, 1994] и для этого
необходим ряд условий, которые отсутствуют при гипоксии (см. раздел
1.2.). Отметим, что продукты восстановительной части пентозного
пути (глицеральдегид-3-фосфат и фруктозо-6-фосфат) способны
включаться в гликолиз и далее в ЦТК. При этом образуется 12 молей
НАДФН+ и около 150 молей АТФ.
- гидролиз креатинфосфата, – очень быстрый и кратковременный путь
получения энергии. В головном мозге концентрация креатинфосфата
превосходит концентрацию АТФ, однако, киназа деградации
креатинфосфата чрезвычайно чувствительна к гипоксии и расход
креатинфосфатного резерва осуществляется в течение нескольких минут
после снижения концентрации кислорода в крови (Clarck, 1994)
- образование инозинмонофосфата в результате конверсии АДФ в АТФ и
АМФ, катализируемое аденилатциклазой. Образует незначительное
количество энергии.
- окисление жирных кислот (ЖК) или β-окисление – происходит в
митохондриях, однако, для успешного β-окисления также необходим ряд
условий: низкая концентрация ПВК и высокое содержание НАД+.
Таким образом, основным источником образования энергии и
свободных аминокислот является ЦТК. Главным и быстро мобилизуемым
исходным субстратом служит глюкоза. Ее метаболизм покрывает
основной обмен и обеспечивает жизнедеятельность организма. Главным
регуляторным механизмом ЦТК и, отчасти окислительного
фосфорилирования, является кругооброт
окислительно-восстановительных эквивалентов, которые обозначают
отношением НАДН/НАД+.
Гипоксия, в различных формах и степенях своего проявления,
является одним из базисных состояний, возникающих при заболеваниях
человека. Биохимическим эквивалентом гипоксии считают изменение
концентрации субстратов в основных метаболических путях клеток и
снижение энергопродукции в них, в результате чего возникают
нарушения фосфорилирующих процессов и химических синтезов в клетках
в целом. Интенсивность этих нарушений может быть различной и
определяется характером заболевания, однако, общим механизмом
энергодефицитных состояний является недостаточность акцепторов
электронов дыхательной цепи, из-за чего НАДН и QH2
(убихинон или ко-энзим Q) не могут окисляться повторно. Это
ключевая биохимическая «поломка», которая приводит к замедлению не
только митохондриального синтеза АТФ, но и к расстройству всего
обмена веществ в митохондриях, в т.ч. к невозможности окисления
жиров в их матриксе. Представленное положение является очень
важным, оно, отчасти, объясняет, почему при введении тяжелым
больным глюкозы, аминокислотных смесей, жировых эмульсий, лечебный
эффект от их действия часто не выражен, или полностью
отсутствует.
Главная причина этого явления – высокая концентрация НАДН.
|
Гипоксия снижает скорость окисления глюкозы,
жиров и аминокислот,
и приводит к снижению синтеза АТФ
|
Последствия этого процесса очень велики: в результате накопления
НАДН блокируются ЦТК, активность пируватдегидрогеназы, скорость
β-окисления и работа транспортных систем (особенно «малатного
челнока», активность которого целиком зависит от уровня
НАД+). Таким образом, энергия от биотрансформации
аминокислот не может быть получена, единственным ее источником
становиться АэГ. Гликолиз должен осуществляться любой ценой, иначе
клетки погибнут. Это означает, что обязательным условием
метаболизма глюкозы является окисление НАД+, которое
может быть осуществлено только за счет перехода ПВК в МК.
|
Любой тип гипоксии сопровождается
ацидозом
|
Еще раз отметим, что различные заболевания сопровождаются
различной степенью гипоксического повреждения, от быстрого развития
критического состояния (например, при «глубоких» ишемических
инсультах, обширных инфарктах, тяжелой кровопотери и т.д.); до
медленно текущих и длительно формирующихся
дегенеративно-дистрофических и апоптозных процессов, (например,
болезни Альцгеймера, рассеянном склерозе, ХНК и т.д.).
Различные ткани обладают различной чувствительностью к
недостатку кислорода и питательных веществ. В первую очередь от
гипоксии страдают те из них, которые осуществляют регуляторные
функции, либо являются ключевым звеном ФУС (например, легкие,
миокард и т.д.) Это обусловлено особенностями генетического
контроля их биохимических реакций. Чем больше мРНК содержит
клеточный кластер, тем более разнообразными будут биохимические
ответы клеток, тканей, систем на гипоксию. Это обстоятельство легло в основу
современного представления о повреждающем (патохимическом) действии
гипоксии и ишемии на органы и ткани.
|
Гипоксия и связанная с ней ишемия тканей
вызывают развитие патохимических реакций, действие которых
осуществляется по каскадному принципу
|
Органы жизнеобеспечения, такие как головной мозг, миокард,
кишечник и др., являются наиболее чувствительными даже к легким
степеням дефицита энергии.
Несмотря на достигнутые успехи в изучении биохимических и
молекулярных процессов, возникающих в клетках в условиях гипоксии,
клинически эффективных антигипоксантов совсем не много. Это связано
с тем, что многие «участки» метаболических переходов, возникающие
при гипоксии в организме человека изучены не до конца. Не полностью
расшифрованы патохимические процессы, образующиеся при
сопутствующей гипоксие ишемии тканей. Дополнительные трудности
для понимания практикующих врачей представляет объем информации о
новых эндогенных лигандах, белках-рецепторах и других регуляторов
жизнедеятельности клеточных систем организма человека. Поэтому,
особенности действия новых лекарственных средств, особенно при
применении в сочетании с известными препаратами, познаются только
на практике.
На сегодня ясно одно:
- гипоксия и, связанная с ней ишемия тканей, блокируют образование
энергии в метаболических путях
- гипоксия сопровождается ацидозом и внутриклеточным отеком
- гипоксия и связанная с ней ишемия тканей вызывает развитие
патохимических каскадных реакций таких как образование свободных
радикалов, эксайтотоксический эффект в нейронах и других клетках и
стимулирует накопление молекул средней и низкой молекулярной массы
(т.е. эндогенной интоксикации)[см.ниже].
Необратимость системных нарушений, возникающих при гипоксии
тканей при критических состояниях, зависит от длительности и
глубины метаболических расстройств (Лабори 1970; Зильбер А. П.,
1976; Лукьянова Л.Д., 2001; Taylor, 1982; Siegel, 1995).
Еще раз подчеркнем роль патохимических последствий (каскадных
реакций) гипоксии, в результате которых первично возникшее
заболевание может прогрессировать, а критическое состояние
становиться необратимым. С этими последствиями связывают
безуспешность фармакотерапии у тяжелых больных. Наиболее значимые
из них следующие:
- снижение скорости окислительного фосфорилирования, которое может
полностью прекращаться, в течение нескольких секунд, в зависимости
от заболевания (или состояния), вызвавшего гипоксию.
- несостоятельность альтернативных путей образования АТФ.
- сдвиг равновесия НАДН/НАД+ влево и изменение
поляризации мембран клеток. Это явление считают универсальным в
развитии большого числа различных, по своей природе, заболеваний
(опухолей, травмы, гормональных болезней и т.д.) [Leiber, 1998].
Потенциал клеток становится более негативным по сравнению с
исходным потенциалом, скорость сдвига отчасти обуславливает
динамику развития процесса, т.к. Страдают функции транспортных
насосов мембран. Это ведет к двум клинически значимым явлениям:
изменению электролитного состава клеток (трансминерализации) и
изменению силы действия лекарственных веществ.
- внутриклеточный ацидоз (за счет аккумуляции лактата,
рСО2, и ионов водорода [протонов]). Ацидоз еще больше
угнетает транспортные системы мембран клеток, блокирует обратный
захват медиаторов, приводит к развитию внутриклеточного отека и
является фактором образования активных форм кислорода (Siegel,
1994). Клиническим эквивалентом этого является увеличение легочного
шунтирования крови, гипернатриемия, гипокалиемия, нарастание
эндогенной интоксикации.
- нарушение кальциевого гомеостаза клетки (особенно в нейронах и
глие головного мозга), эксайтотоксические эффекты (Одинак М.М.,
2002; Lipton, et al., 1994)
- оксидативный стресс и нарушение композиции фосфолипидной части
мембран (Кольман Я, 2000; Петрова Н.В.,2005)
- нарушение транкрипционных процессов в результате которых могут
образовываться проапоптозные белки («белки-убийцы» [Pantoni,
1998]), снижение скорости химических синтезов в целом, что
сопровождающейся дезорганизацией каркасной и матричной функций
биологических мембран. С этими явлениями связывают снижение
эффективности фармакотерапии у тяжелых больных (Leker, et al.,
2002), развитие дегенеративно-дистрофических и аутоиммунных
процессов в тканях (в нейронах головного мозга, нервных стволах, в
миокарде и т.д.), а также развитие астенических синдромов после
реконвалесценции.
В современной фармакологии проблема изыскания и изучения новых
антигипоксанов, предназначенных для коррекции базовых системных
нарушений во многом связана с разработкой новых средств, способных
воздействовать на указанные выше процессы. В практике неотложной
медицины и интенсивной терапии критических состояний в НПО
«Полисан» эту проблему решали двумя путями:
А). За счет «протезирования» субстратов (ферментов)
энергообеспечивающих реакций
Б). За счет снижения интенсивности патохимических последствий
гипоксии.
Результатом этих исследований явилась разработка и внедрение в
широкую клиническую практику реамберина, препарата,
соответствующего двум изложенным требованиям.
В настоящей работе мы рассмотрим наиболее важные механизмы его
действия, системные эффекты Реамберина, а также биохимические
особенности течения некоторых критических состояний, при которых
применение реамберина оправдано при комплексной терапии в
комбинациях с препаратами других фармакологических групп.
2. МЕХАНИЗМ ДЕЙСТВИЯ РЕАМБЕРИНА
- Входящий в состав реамберина сукцинат, является естественным
эндогенным субстратом клетки. Назначение экзогенного сукцината
сопровождается двумя основными изменениями, которые происходят в
углеводном обмена веществ и окислительном фосфорилировании:
- Янтарная кислота (ЯК) ускоряет оборот дикарбоновой части ЦТК
(сукцинат – фумарат – малат) и снижет концентрации лактата,
пирувата (в меньшей степени) и цитрата, которые накапливаются в клетках во время
гипоксии. Таким образом, она повышает кругооброт ЦТК,
следовательно, увеличивает объем энергии, необходимой для синтеза
АТФ (и других химических синтезов, например ГАМК).
- Увеличение количества субстрата (сукцината) позволяет
осуществлять фосфорилирование белков, вследствие активации
субстратом тропного ему фермента
- ЯК увеличивает потребление кислорода тканями и улучшает тканевое
дыхание за счет усиления транспорта электронов в митохондриях,
воссоздания протонного градиента на их мембранах и смещения кривой
диссоциации оксигемоглобина вправо (Розенфельд А. Д., 1983), т.е.
усиливает отдачу кислорода тканям.
- Интенсивность окисления сукцината зависит от его концентрации в
клетке, а также от присутствия активаторов биотрансформации ЯК
(Нарциссов Р. П., 1997), т.е. от наличия предшествующих сукцинату и
следующих после нее биохимических субстратов. Это очень важное
положение для практического применения реамберина в сочетании с
препаратами других фармакологических групп (см. главу 4). При
низких и средних концентрациях сукцината восстанавливается пул
НАД+, при высоких - возникает сукцинатоксидазное
окисление, возрастает антиоксидантная функция системы глютатиона
(Ивницкий Ю.Ю, 1998).
- В условиях гипоксии экзогенно вводимый сукцинат (входящий в
состав реамберина) может поглощаться через альтернативный
метаболический путь сукцинатоксидазной системы с последующим
потреблением ЯК в дыхательной цепи митохондрий.
- Участие в ресинтезе эндогенного ГАМК через ±-кетоглютаровую к-ту
и янтарный полуальдегид (в нервной ткани). Здесь ЯК обеспечивает
кругооборот ЦТК, выход α-КГ из митохондрий, при наличии которого
возможен ресинтез ГАМК. Как холинореактивные системы эволюционно
призваны защищать нейроны головного мозга от избытка
катехоламинергических воздействий, так ГАМК противодействует НМДА
рецепторам, возбуждение которых сопровождается
эксайтотоксичностью. Это свойство ЯК расширяет возможности
применения реамберина, т.к. создает основу для его назначения в
терапии хронических дегенеративно-дистрофических неврологических
заболеваний, постабстинентных синдромов, в основе которых лежит
эксайтотоксичность (таких как демиелинизирующие процессы,
сирингомиелия, рассеянный склероз и т.д., или адренергический
синдром при алкогольном абстинентном синдром)
Улучшение микроциркуляции в органах и тканях, которое
проявляется:
- снижением зоны некроза в миокарде (Клигуленко Е. Н., 2004);
- редукцией зоны пенумбра при ЧМТ (Цивинский А. Д., 2004);
- сокращением зоны «ишемической» пенубры при инсульте (Румянцева
С. А., 2001);
- восстановлением моторной функции кишечника; снижением
интенсивности эндогенной интоксикации (Клигуленко Е. Н., 2004);
- снижением интенсивности ацидоза по метаболическим показателям
КОС (таким как ВВ и ВЕ) [Оболенский С. В, 2003];
Введение реамберина сопровождается незначительным ростом ЦВД
(через 12 ч после начала лечения) без признаков гиперволемии
(Челнов И. Г., 2002).
Положительная динамика воспаления. Проявляется улучшением
показателей «белой» крови (снижение лейкоцитоза, с нормализацией
палочкоядерного сдвига, в среднем, на 5 сутки от момента введения
препарата, нарастанием числа лимфоцитов, снижение СОЭ и
концентраций провоспалительных цитокинов) [Куликова О. Д., 2002;
Челнов И. Г., с соавт, 2002]
Повышение антитоксической функции печени: снижение интенсивности
гиперферментемии (АЛТ, АСТ), билирубинемии, повышение уровня
сульфгидрильных групп (Оболенский С. В., 2003).
Редукция адренергических проявлений абстинентного синдрома
(Афанасьев В.В., 2002), антистрессорное действие (Романцов М. Г.,
2002).
Улучшение функциональной активности головного мозга [при лечении
энцефалопатии] (Румянцева С. А., 2001), положительная динамика
спектрограмм ЭЭГ (Оболенский С.В,, 2003), ускоренное
восстановление ВНД за счет снижения клинических проявлений
астено-вегетативного синдрома (Корнилова Н. Н., 2002), инициация и
поддержание адаптогенных реакций организма (Высочина И. В., 1997;
Гаркави Л. Х., 1997).
Диуретическое действие (максимально выраженное через 6-12 ч от
начала лечения,
сопровожающееся повышением рН мочи (Оболенский С. В., 2003).
Улучшение транспорта кислорода, сдвиг кривой диссоциации
оксигемоглобина влево и повышение потребления кислорода различными
тканями, включая кожный покров, Розенфельд А. Д., 1983; Куликова О.
Д., 2002).
Повышение пула естественных антиоксидантов и торможение процесса
пероксидации собственных липидов, улучшение равновесия системы
ПОЛ/АОС.
Снижение уровня глюкозы крови, с интервале от 48 – до 72 ч от
начала лечения
Разнообразие системных эффектов реамберина вытекает из
молекулярных механизмов его действия, обобщающими компонентом
которого служат антигипоксический и антиоксидантый эффекты
препарата. Перечисленные молекулярные и системные эффекты
реамберина сопровождаются отчетливым положительным клиническим
действием препарата: снижением летальности и сокращением сроков
пребывания больных в ОРИТ, в т.ч. наиболее тяжелых пациентов с
перитонитом и ПОН (Оболенский С.В., 2003; Клигуненко Е. Н., 2004).
Эти благоприятные стороны действия Реамберина открывают новые
возможности интенсивной терапии тяжелых больных.
3. ОСНОВНЫЕ ПОКАЗАНИЯ К НАЗНАЧЕНИЮ
- Неотложные состояния в токсикологии
(ЕД50=10-30 мл/кг; Vинф=1-2,5 мл/кг м.т.,
курс 5-10 дней);
- острые отравления гепатотропными ядами;
- острые отравления нейротропными ядами (в т.ч. стимуляторами
ЦНС);
- состояния посттоксической астении
(применение в соматогенной
фазе интоксикации);
- абстинентные синдромы (алкогольный, героиновый);
- метаболический ацидоз и алкогольный кетоацидоз;
- острые отравления с длительным периодом экспозиции яда, либо с
длительным догоспитальным этапом (в среднем, после 9 и более ч.
экспозиции);
- в качестве компонента форсированного диуреза.
- Полиорганная дисфункция и полиорганная недостаточность
(ЕД50 =10 мл/кг; Vинф=1-2,5 мл/кг м.т., курс
5-7 дней);
- Ожоговая болезнь
(ЕД50=10-20 мл/кг; Vинф= 1-2 мл/кг м.т., курс
7-21 день)
- Сепсис (септикопиемия)
- Комплексная предоперационная подготовка больных перед
хирургической операцией, комплексная терапия осложненного
постоперационного периода
(ЕД50=10-30 мл/кг; Vинф=от 0,5 до 2 мл/кг
м.т., курс от 1 до 10 и более дней, в зависимости от состояния
больного)
- Гнойно-воспалительные заболевания легких
(ЕД50=10-20 мл/кг; Vинф=1-2 мл/кг м.т., курс
7 – 10 дней)
- Токсикозы кишечника
(ЕД50 = 10 мл/кг; 30 мл/кг при 3-4 степенях
интоксикации,
по М.Я. Малаховой, Vинф= 1-2 мл/кг м.т., курс 7 и более
суток)
- Вирусные гепатиты
(ЕД50 = 10 - 20 мл/кг; Vинф= 1-2 мл/кг м.т.,
курс 7 – 10 дней).
- Нейроинфекции
(ЕД50=10-20 мл/кг; ЕД50=10-20 мл/кг;
Vинф=0,5-1,5 мл/кг м.т., курс 3-5 дней)
4. ОСОБЕННОСТИ ПРИМЕНЕНИЯ РЕАМБЕРИНА
ПРИ КРИТИЧЕСКИХ СОСТОЯНИЯХ
При острых отравлениях Реамберин назначают как в составе
инфузионной программы, так и в качестве самостоятельно действующего
препарата.
В составе инфузионной терапии реамберин применяют в
токсикогенной фазе отравлений, при проведении регидратации и
гемодилюции, а также при проведении форсированного диуреза. В
соматогенной фазе его используют в периоде осложнений и
последствий. Это положительно воспринимается больными, особенно
теми из них, которые длительное время находились в состоянии
токсической астении, после перенесенных отравлений центральными
холинолитиками, психостимуляторами и веществами, истощающими запасы
катехоламиновых депо.
Оптимальными растворами для совместного введения при проведении
гемодилюции в сочетании с реамберином, являются гипотонические
и/или изотонические растворы глюкозы (2,5% или 5%).
Первичная доза Реамберина в составе гемодилюции составляет 400
мл. Скорость инфузии, на наш взгляд, должна быть минимальной (0,5 -
1 мл/мин), т.к. на сегодня данные о действии реамберина при
отравлении веществами, биотрансформация которых в организме
человека протекает по пути «летального синтеза», отсутствуют. В
этих случаях, может возникать вероятность усиления функциональной
активности печени и ее антитоксической функции, что может приводить
к интенсификации «летального синтеза» и сопровождаться ухудшением
состояния больных. Этот вопрос требует отдельного изучения.
При отравлении веществами, биотрансформация которых протекает по
варианту детоксикации, дозы вводимого реамебрина можно увеличивать
до 2 и более мл/мин.
При отравлении веществами, способными вызывать гипогликемические
состояния (такими как ацетазоламид, бета-блокаторы, клофибрат,
котримазол, доксепин и т.д.), скорость введения раствора Реамберина
снижают до 20-40 капель/мин, и наоборот, при отравлении веществами,
способными вызывать гипергликемические состояния, скорость введения
раствора Реамберина увеличивают до 60 и более капель/мин.
После проведения форсированного диуреза и самостоятельном оттоке
мочи зарегистрированном в ходе его проведения (т.е. до стимуляции
диуреза лазиксом) реамберин вводят повторно, в дозе 400 мл,
соблюдая указанные выше общие положения. Поскольку реамберин
ощелачивает мочу, то выведение веществ, обладающих кислыми
значениями рК в его присутствии, может увеличиваться. При
проведении щелочного форсированного диуреза следует оценивать рН
крови, рН мочи и метаболический компонент КОС. Это даст возможность
оптимизировать (в данном случае снизить) дозы натрия гидрокарбоната
при проведении щелочного диуреза.
4.1.1. Особенности назначения реамберина
при отдельных нозологических формах острых отравлений
Отравления гепатотропными ядами (парацетамолом, препаратами
группы ГИНК, кордароном, гидразинами, алкоголями и др). После
верификации гепатотоксического яда реамберин назначают совместно со
специфической и детоксикационной терапией, из расчета 400,0 мл два
раза в сутки до нормализации уровня аминотрансфераз и протромбина
плазмы крови.
Отравления нейротропными ядами, поражающими терминальный отдел
сосудистого русла (седативные нейролептики, антидепрессанты с
длительным временем экспозиции). Реамберин назначают с препаратами
волюмтерапии и средствами инотропной поддержки. Препарат
целесообразно вводить медленно, со скоростью не более 1 мл/мин.
Следует помнить, что при этих отравлениях возникает десенситизация
терминального отдела сосудистого русла к экзогенным катехоламинам,
а реамберин, стимулирует ресинтез эндогенных катехоламинов (см.
ниже).
Отравления антигипертензивными средствами (не β-блокаторами)
Токсическая и постгипоксическая энцефалопатии. В практике
токсиколога токсическая (гипертензивная) энцефалопатия возникает
после перенесенных отравлений амфетаминами, кокаином), препаратами
для лечения «простуды», фенциклидином, ЛСД, кортикостероидами,
НПВС, пропранололом (у больных с гипогликемией), трициклическими
антидепрессантами, некоторыми алкалоидами (Heilpern, 1994).
Реамберин здесь выполняет роль метаболотропного агента. Препарат
назначают совместно с инфузионной, антигипертензивной терапией.
Антагонисты из группы холиномиметиков способны оказывать
ко-эргичное реамберину действие.
Диффузная постаноксическая (ишемическая) энцефалопатия является
результатом действия патохимических процессов, обусловленных
гипоксией, может также возникать при отравлении СО, в периоде
постреанимационной болезни и т.д (Lee, 1996). В этом случае
Реамберин назначают в качестве антиоксиданта и метаболотропного
средства.
Препарат целесообразно вводить в объеме 400 мл два раза/сутки.
Введение осуществлять медленно, длительно, при возможности, через
перфузомат, с целью поддержания стационарной концентрации сукцината
для минимального обеспечения ЦТК.
Применение реамберина сопровождалось снижением длительности комы
у больных с отравлениями депримирующими средствами, снижением
уровня эндогенной интоксикации, легочных осложнений и приводило к
сокращению сроков пребывания больных в ОРИТ и летальности в целом
(Ливанов Г. А., соавт, 2002)
После восстановления системного АД, у больных могут сохраняться
прогрессирующие поражения органов, связанных с продолжающейся
ишемией и гипоперфузией органов. Гипоперфузию связывают с тремя
основными явлениями:
4.2.1. «Не восстанавливаемый» органный кровоток
Это состояние возникает при устойчивой гипоперфузии органов,
которая временно устраняется в результате реанимационных
мероприятий, позволяющих восстановить элементы жизнедеятельности
организма, однако, в период, следующий за восстановлением АД,
происходит рецидив и стаилизация гипотензии, приводящей к
прогрессирующим поражениям органа(ов), развитию синдрома ПОН и
неблагоприятному исходу в целом.
В этих условиях, преимущества включения реамберина в инфузионную
программу заключаются не только в его сбалансированном, для условий
постреанимационной патологии, электролитном составе (см. табл. 1),
но также в том, что в его состав входит активный метаболотропный
компонент, способный оказывать противодействие патохимическим
реакциям, возникающим при ишемии.
Известно, что восстановление кровотока после перенесенной
ишемии происходит более успешно при отсутствии кальцийсодержащих
препаратов в составе инфузионной программы (Marino, 1998). «Не
восстанавливаемый» кровоток связывают с накоплением ионов кальция в
матриксе и цитозоле эндотелиоцитов, нейронов, энтероцитов и других
клетках, которое происходит в результате ишемии. С нарушением
гомостаза кальция связывают один из наиболее жестких по
последствиям патохимических каскадов гипоксии: феномен «кальциевой
смерти клетки» и плохого восстановления (или «не восстановления»)
кровотока при проведении лечебных мероприятий. Это явление
зарегистрировано при ишемическом инсульте, ЧМТ, крайне тяжелых
абстинентных синдромах, тяжелых формах мигрени, осложняющихся
нарушением мозгового кровообращения (Федин А.И., 2001; Одинак М.
М., 2002; Афанасьев В. В., 2002; Siegal G., 1994; Sahuquillo J.,
2001) и многих других заболеваниях.
Таблица 1. Сравнительная характеристика изотонического растворов
натрия хлорида, Рингера-лактата, реамберина и плазмы крови
по составу электролитов (мэкв/л) и осмолярности (мосм/кг Н20)
|
Показатель
|
Плазма
крови
|
0,9% р-р
NaCl
|
Р-р Рингера-лактата
|
1,5% р-р
Реамберина
|
|
Натрий
|
141
|
154
|
130
|
142
|
|
Хлор
|
103
|
154
|
109
|
109
|
|
Калий
|
4-5
|
-
|
4
|
4
|
|
Кальций
|
5
|
-
|
3
|
-
|
|
Магний
|
2
|
-
|
0
|
1,2
|
|
рН
|
7,4
|
5,7
|
6,7
|
?
|
|
Буфер
|
Бикарбонат (26 – 28)
|
-
|
Лактат
(26 –28)
|
?
|
|
Осмолярность
|
289
|
308
|
|
290
|
|
Метаболотропные компоненты
|
В-ва плазмы крови
|
-
|
-
|
сукцинат
|
Подчеркнем, что раннее применение Реамберина в условиях «не
восстанавливаемого» кровотока, до периода развития ПОН, является
важным фактором фармакотерапии, после того как врачом «первого
контакта» определен предварительный диагноз, указывающий на крайнюю
степень тяжести состояния, например:
- ишемический инсульт в бассейне правой СМА, левосторонняя гемиплегия, кома 3, постоянная форма мерцательной аритмии;
- ИБС. Острый инфаркт миокарда. Кардиогенный шок.
- сепсис, полиорганная недостаточность.
Здесь следует обратить внимание на весьма важный, в клиническом
отношении, факт. В продолжение работ Лабори (1979), А. М. Бабским с
соавт (1985), была выдвинута рабочая гипотеза о
гормонально–субстратно–нуклеотидных регуляторных системах (т.н.
«метаболические петли» по Лабори). Применительно к действию
Реамберина, одна из таких систем может быть представлена
метаболической цепью катехоламины”ЯК”цАМФ, в которой существует
клинически значимая, в отношении лечения гипотензивных состояний,
обратная связь, образуемая между концентрацией ЯК и эндогенными
катехоламинами (Маевский Е. И., 1982). В свою очередь, катехоламины
способны выполнять функцию аллостерических стимуляторов
сукцинатдегидрогеназы [СДГ] (Sivaramakrishnan, et al., 1983),
окисляющей сукцинат в фумарат. Напомним, что в отличие от других
ферментов цикла Кребса, СДГ является интегральным белком внутренней
мембраны митохондрий. Это означает, что она непосредственно
переносит электроны в дыхательной цепи, тем самым участвует в
образовании энергии.
Резюмируя изложенное выше сформулируем два важных, в клиническом
отношении, положения:
Обоснование применения Реамберина в составе инфузионной
терапии:
- резистентных к действию волюмтерапии и экзогенных катехоламинов гипотензиях
- гипотензиях, связанных с истощением запасов катехоаминовых депо
(постнаркозные гипотензии, и трудно восстанавливаемое АД у после
операционных больных, связанное с приемом лекарственных веществ до
хирургического вмешательства, например, резерпина, допегида)
- гипотензии при отравлении антигипертензивными препаратами.
О целесообразности применения фармакологических комбинаций между
реамберином, вазопрессорами и средствами инотропной поддержки
миокарда, в частности, допмином, норадреналином, добутрексом,
амриноном и другими активаторами цАМФ, тем более что реамберин в
изолированном виде практически не изменяет уровень АД.
Эти положения сформулированы на основании анализа
экспериментальных работ, выполненных под руководством М. Н.
Кондрашовой (1989 – 1999), однако, оптимизация доз и режимов
введения препаратов нуждается в дополнительном клиническом
подтверждении.
При составлении плана лечения следует обратить внимание, что в
сочетании с допмином, добутрексом, норадреналином, реамберин
целесообразно назначать как можно раньше и вводить его на
максимально высоком уровне достигнутого АД. При этом (в условиях
ОРИТ) важно оценивать системную гемодинамику (т.н. «малые
гемодинамические профили») и транспорт кислорода, что позволяет
маневрировать дозами вазопрессора (не реамберина!). Назначение
реамберина в этих условиях обосновано с патохимической и
патофизиологической точек зрения, и оправдано с клинических
позиций. Конечно, биохимические особенности развития
«невосстанавливаемого» кровотока, следует учитывать в каждом,
отдельно взятом нозологическом варианте. Так, например, при
мозговых катастрофах (инсульт + гипотензия) реамберин не следует
сочетать с растворами глюкозы до получения доказательств его
безопасности.
4.2.2. Реперфузионные повреждения
Реперфузионные повреждения возникают вследствие «вымывания» из
капиллярона агрессивных аутокоидов (Зильбер А. П., 1976; Неговский
В. А, с соавт, 1987; Chien, 1984), например, после мероприятий по
реканализации инфаркта миокарда, при трансплантации органов, при
постреанимационной болезни. Здесь, наиболее агрессивным
биохимическим субстратом являются свободные радикалы. Их
образование приводит к развитию перекисных процессов, которые
усиливаются после реперфузии (de Vries et al., 1997). Последнее
обстоятельство приводит к окончательной блокаде мембранных насосов,
ишемия тканей усугубляется, несмотря на то, что АД может быть
сохранено. Последствия оксидативного стресса необходимо
рассматривать и с конкретных практических позиций. Это означает,
что вводимые больному лекарственные препараты либо не оказывают
нужного действия, либо вызывают неожиданные эффекты, на которые не
рассчитывали, т.е. врач теряет ощущение вектора фармакотерапии и
работает на симптоматическом уровне (например, ухудшение состояния
больного от введения глюкозы).
Приведем еще один важный в практическом плане биохимический
эквивалент повреждающего действия оксидативного стресса -
активизацию полимеразных реакций, в результате которой свободные
радикалы «расшнуровывают» ДНК (Cooper, 2003), тем самым они
блокируют транкрипционные процессы. Это обстоятельство приводит к
замедлению скорости химических синтезов пластических и сигнальных
белков. В результате этого, увеличивается длительность
искусственного замещения функции органа, осуществляемая в ОРИТ.
«Протезирование» функциональной системы, выполняемое врачом
интенсивной терапии, затягивается на более длительный срок, образуя
«устойчивое патологическое состояние», в результате которого
формируются осложнения реанимации и вся система искусственного
замещения функции органа ставиться под сомнение.
Установлено, что ЯК, входящая в состав Реамберина активирует
систему глютатиона – одну из наиболее мощных эндогенных
антиоксидантных систем организма человека (Ивницкий Ю. Ю. с соавт.
1998). Однако, это отнюдь не исключает применение антиоксидантов
других функциональных классов (см. п. 4.8.), особенно при
назначении реамберина в условиях ИВЛ. Здесь, важно подчеркнуть, что
образование АФК и пероксидация – естественные, генетически
закрепленные, по ферментам процессы, поэтому, повышение оксигенации
тканей путем увеличения вентиляции, может приводить не столько к
снижению интенсивности ПОЛ, а, наоборот, к его увеличению, за счет
образования активных форм кислорода в условиях «гипоксидации» (цит
по Зильберу А. П., 1970). Таким образом, ПОЛ может
увеличиваться.
В этой связи, назначение Реамберина, особенно, в условиях
вспомогательной вентиляции легких (любого типа) является мерой,
способной ограничивать эффекты АФК при реперфузии, в т.ч. при при
проведении ИВЛ, с сохранением положительного давления к концу
выдоха (ПДКВ), хотя в последнем варианте, от назначения реамберина
имеется двойная польза – препарат работает в качестве
энергетического и антиоксидантного средства, при этом препятствует
снижению сердечного выброса, основного осложнения ПДКВ.
Поскольку реамберин препарат новый, клинических исследований,
связанных с проведением реперфузии с его применением мы не
обнаружили, поэтому дозы и, особенно, режимы назначения препарата
следует изучать. Здесь уместно привести данные экспериментальных
исследований, проведенные с НИИ общей реаниматологии РАМН о не эффективности лечебного
действия натрия сукцината, назначенного на ранних сроках
постреанимционного периода и, наоборот, о его эффекте при
назначении на 3-7 сутки (Заржецкий Ю.В., с соавт, 1997).
Несомненно одно, оптимальные условия назначения Реамберина
больным с реперфузионными осложнениями, продиктованы правилами
«хорошей» реанимации и должны включать мониторирование
гидро-ионного и кислотно-основного равновесия, оценкой газового
состава крови и показателей системной гемодинамики.
Это важно не потому, что Реамберин способен оказать
нежелательное действие, скорее наоборот, это необходимо выполнять
для того, чтобы максимально эффективно использовать метаболотропные
свойства этого препарата, путем манипуляции с режимами его введения
и назначения других средств нормализации кровообращения и обмена
веществ (возможно блокаторов каналов кальция и ионов магния).
Отметим, что за рубежом, при фармакотерапии реперфузионных
средствами метаболотропного действия, широко используют показатель
лактата, потребления кислорода и измерение анионного промежутка, в
качестве дополнительных маркеров усвоения кислорода тканями.
4.2.3. Увеличение «кислородного долга»
Увеличение «кислородного долга» тканей в целом, например, в ходе обширных травматичных хирургических вмешательств (Marino,
1998), особенно тех, которые выполнены после длительного
догоспитального этапа. Рост кислородного долга тканей –
невозможность потребления кислорода входящими в их состав клетками,
вследствие угнетения метаболических процессов в них.
В этих условиях реализуется способность Реамберина
растормаживать гликолиз, блокада которого на уровне ПВК – цитрат
может приводить к росту кислородного долга. Такие состояния
проявляются нарастающим ацидозом (лактат-ацидозом) и прогредиентным
угнетением сознания больных. К сожалению, развитие компенсаторной
реакции (в виде усиленного потребления тканями кислорода, после
перенесенной ишемии) предугадать у больных не возможно, – она
связана с индивидуальными особенностями обмена веществ, которые не
подлежат практической оценке в настоящий период времени. Поэтому, в
целях профилактики «кислородного долга» и для снижения риска
ишемического повреждения органов, которое может возникать как в
ходе, например, хирургического вмешательства, или после него,
реамберин следует назначать «профилактически», в предоперационном
периоде, из расчета на то, что кислородный долг растет у всех, без
исключения, пациентов.
В отличие от апоптоза, острый цитолиз – универсальная реакция
погибающей клетки. В клинике острый цитолиз чаще всего наблюдается
при патологии печени (гепатиты, печеночные комы) и болезнях
миокарда (инфаркт миокарда).
При печеночной коме, гипоксиия и отек гепатоцитов приводит к
гипопротеинемии, увеличивается венозное шунтирование крови в
легких, не устраняемое инсуфляцией 100% кислорода. Здесь важна
дегидратация. Усиление мочегонного компонента действия реамберина
достигается его сочетанием с диуретиками (осмотическими). При этом
эффективной методикой кислородотерапии, которая улучшает функции
самой печени, является артериализация крови воротной вены. Ее
проводят путем:
- зондового введения кислорода в кишечник
- сочетанием реамберина с рибоксином, или с допмином, при
применении последнего в дофаминергических дозах (не более 0,5-1
мкг/кг.мин). Выбор осуществляется в зависимости от клинической
ситуации (в частности, гемодинамики больного), КОС (крови и
измерения рН мочи) и гидро-ионного равновесия, особенно
концентрациии ионов калия.
- наполнением кишечника «углеводно-кислородным муссом», то
увеличивает кровоток в печени и укладывается в механизм действия
реамберина.
- инфузии глюкозы с целью улучшения утилизации кислорода.
В комплексной терапии гепатитов тяжелого течения (вирусные
гепатиты В и С, лекарственные гепатиты) реамберин также оказывал
существенный лечебный эффект, который проявлялся в снижении
гиперферментемии, снижении эндогенной интоксикации, уменьшении
суточных доз гормонов, по сравнению с группой контроля (Оболенский
С.В., 2003). Реамберин был также рекомендован к применению в
качестве этиотропного средства в терапии эндогенной интоксикации у
больных с «механической желтухой».
5. СОЧЕТАНИЕ РЕАМБЕРИНА С ПРЕПРАТАМИ ДРУГИХ ФАРМАКОЛОГИЧЕСКИХ ГРУПП
Представленные вещества играют самостоятельную роль в регуляции
углеводного обмена веществ. Они являются ко-факторами пируват-,
α-кетоглютаратдегидрогеназных комплексов и дегидрогеназных
ферментов аминокислот (Micromedex, 2004). Тиамин и липоевая к-та
взаимодействуют со своими точками приложения в них, тем самым
контролируют вход ПВК в цКребса и кругооборот α-кетоглютаровой
к-ты. Таким образом, оба препарата являются важными компонентами
для реализации механизма действия реамберина.
Более того, фосфорилирование (в данном случае активация) белков
пируватдегидрогеназного комплекса, осуществляется двумя фосфатазами
(Mg2+ и Са2+- зависимыми фосфатазами) и одной
киназой (Mg-АТФ-зависимой протеинкиназой) [Кольман 2000].
Сочетания реамберина с тиамином и липоевой к-той может
способствовать увеличению силы действия реамберина при лечении
циррозов, гепатитов, диабета. Эффективность лечения способен
повысить третий компонент комбинации, унитиол, т.к. в процессе
биотрансформации SS группы липоевой к-ты, транформируются в SH
группы. Отметим, то только обе формы обеспечивают развитие
антиоксидантного эффекта и парциальное увеличение их концентраций
унитиолом, повышает силу действия комбинации, в целом (Suzuki,
1992). Липоевая к-та повышает вход глюкозы в клетки. Механизм этого
действия не известен (Baskan, 1993), однако, это очень важно иметь
в виду при проведении терапии реамберином. Более того, липоевая
к-та самостоятельно снижает концентрацию ПВК и усиливает
глюконеогенез (Micromedex, 2004). Таким образом, липоевая к-та
увеличивает широту терапевтического действия реамебрина в плане
возможного развития гипогликемии.
Отметим, что сочетание тиамин + липоевая к-та + реамерин +
магний + глюкоза, оказывает выраженный лечебный эффект при ААС
(Афанасьев В. В., 2002), возможно, за счет снижения
цитотоксического действия этанола на клетки крови (Micromedex,
2004).
На фоне введения реамеберина, мы рекомендуем средне страндартные
дозы тиамина и липоевой к-ты (ЕД50 200 мг/сутки и 300 мг/сутки,
соответственно). Добавление ионов магния, и особенно кальция, кроме
случаев ААС, целесообразно, проводить под контролем ионограммы (или
использовать дозы равные ЕДmin). При ААС магний можно назначать до
4 г сутки, т.к. его восстановление у лиц с хронической
интоксикацией этанолом очень медленное, несмотря на проводимую
терапию. При выраженных гипомагниемиях, сопровождающих ААС,
эклампсию беременных, нарушения ритма сердца, целесообразно к
раствору реамебрина также добавлять магний-содержащие препараты, в
виде панангина (см. ниже).
Подчеркнем, что реакция перехода ПВК в цитратный цикл является
многостадийной и каскадной, ходе которой образуются различные
метаболиты. Их образование можно усиливать или замедлять путем
изменения доз и режимов назначения вышеуказанных веществ, таким
образом модифицировать действие реамберина.
Особенности механизма действия препаратов, содержащих
субстратные антигипоксанты (фосфорилированные углеводы, гутимин,
янтарную и другие кислоты), обуславливают необходимость совместного
введения с ними растворов глюкозы. Растормаживание гликолиза,
вследствие усиления кругооборота ЦТК и метаболического «проворота»
в цепи реакций сукцинат – малат – фумарат (см. рис. 2), может
повлечь за собой гипогликемическое состояние. Это приводит к
необходимости введения растворов глюкозы и более частого контроля
ее концентрации в плазме крови больных:
- диабетом
- токсикологических больных (алкоголь, парацетамол, хлопротиксен и
др).
- находившихся на диете, до введения реамберина,
- принимающих гипогликемизирующие средства (в.т.
β-адреноблокаторы, глибурид, каптоприл, карведиол и др)
- длительное время, пребывающие в ОРИТ
Присутствие глюкозы в сукцинатсодержащих препаратах
препятствует развитию гипогликемии, тем самым стабилизирует
гликолиз, следовательно, обеспечивает не только большую силу
действия реамберина, но и большую терапевтическую широту его
действия в этом аспекте.
Известно, что воротным механизмом для глюкозы являются ионы
натрия и их содержание в р-ре реамберина (142 мэкв/л), вполне
позволяет обеспечивать транспорт глюкозы в клетки. Это особенно
важно при назначении гипертонических (10%) растворов, в условиях,
когда активный транспорт глюкозы гексокиназной системой не
осуществим (например, при острой интоксикации этанолом и другими
алкоголями).
Глиатилин – предшественник синтеза АцХ. Его образование
«ответвляется» в реакции Ас-КоА, таким образом, зависит от
концентрации коэнзима, интенсивности гликолиза, р02арт и активности
пируватдегидрогеназного комплекса. Реамберин способствует активации
этого комплекса, и, при достаточном напряжении кислорода, косвенным
путем, воздействует на синтез АцХ. Более того, существует еще одна
форма взаимодействия препаратов, может быть, более важная. Оно
касается образования цГТФ. Глиатилин, в качестве холинотропного
препарата, реализует свое действие через этот метаболит, реамберин,
в реакциях субстратного фосфорилирования, образует его
внутриклеточный и внутримембранный предшественник цГТФ. Это
означает, что метаболотропные эффекты реамберина и глиатилина
замыкаются на одинаковый G-белок. Иными словами, лечебные свойства
глиатилина реамберин способен усиливать и такая комбинация является
биохимически патогномоничной в отношении очень и очень многих
неврологических расстройств, от острого ишемического инсульта и
лечения его последствий, до лечения хронических нейродегеративных
заболеваний, в т.ч. при длительном применении компонентов
комбинации. На наш взгляд, имеет принципиальное значение
последовательность назначения веществ. При остром процессе
(инсульт) лечение следует начинать с назначения глиатилина, а
затем, при малейшем положительном сдвиге неврологической
симптоматики, в состав терапии вводить реамберин, от ЕДmin до
ЕД50.
Эта комбинация преследует 2 основные цели:
- эффективное устранение гипокалиемии в плазме крови, за счет
действия калия, содержащегося в составе р-ра реамберина, и снижение
гипокалигистии, за счет действия аспаргината калия, содержащегося в
р-ре панангина. На системном уровне, трудно проследить в какой мере
внутриклеточный калий распределяется в компартментах клеток и тем
более митохондрий, однако, ясно одно, что предотвращение потери
калия митохондриями, позволяет поддерживать уровень окислительного
фосфорилирования в них. Существует клинические данные о роли калия
в гликолитических процессах и окислительном фосфорилировании
(Лабори, 1970, Зильбер А. П., 1976, Gilman 1996) и четкие
экспериментальные свидетельства о сохранении калиевого гомеостаза
митохондрий (подеркнем, как энергезированных, так и
деэнергезированных) препаратами ЯК (Кудзина Л. Ю., 1997).
- обеспечение возможности протекания реакции субстратного
фосфорилирования (переход альфа-кетоглютарата в сукцинат), с
дополнительным получением энергии. Эта реакция осуществляется за
счет регенерации НАД+ в метаболической цепочке,
поддерживаемой аспаргинатом, исходным компонетом панангина ( рис.
1).
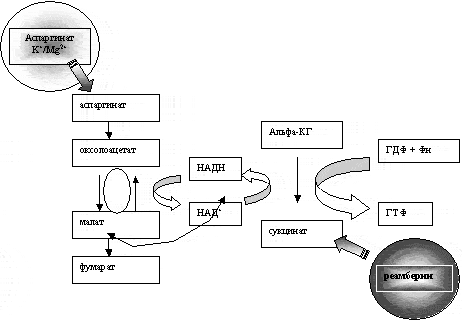
Рис.1. Иллюстрация аддитивного действия реамберина и
панангина.
Где: альфа-КГ – альфакетоглютаровая к-та;
ГТФ – гуфнозинмонофосфат; ГДФ – гуанозиндифосфат;
Фн – неорганический фосфат; НАД – никотинамиддинуклеотидфосфат
(окисленная и восстановленная формы)
Комбинация реамберина с панангином показана при:
- метаболическом алкалозе
- рвоте, сопутствующей тяжелым формам алкогольного абстинентного
синдрома
- при тяжелых формах заболеваний, протекающих с трудно
восстанавливаемой гипокалиемией (синдроме Бартера,
Цоллингера-Элисона, миелолейкозе, диабетическом кетоацидозе)
- при острых отравлениях препаратами, снижающими уровень калия
плазмы крови
- в комплексной терапии ИМ.
Сочетанное действие панангина и реамберина также может быть
использовано в качестве компонента рациональной фармакотерапии,
выполняемой при лечении различных соматических заболеваний, когда
сочетание применяемых ингредиентов сопровождается гипокалиемией
(бета-миметики, диуретики, аминогликозиды, карбенициллин, леводопа,
глюкокортикоиды с минералкортикоидной активностью, натриевые соли
антибиотиков и т.д.).
Подчеркнем важность измерения концентрации калия плазмы крови и,
если возможно, содержание калия в эритроцитах. Уровень последнего
может служить маркером внутриклеточной аккумуляции калия и,
соответственно, эффективности проводимой терапии.
Главным свойством нимодипина является предотвращение вторичных
последствий ишемии, в частности постишемического вазоспазма сосудов
головного мозга, путем снижения концентрации кальция в клетках.
Отмечают также метаболотропный эффект нимодпина, сопровождающийся
улучшением неврологической симптоматики у пациентов без вазоспазма
на ангиограммах (Philippon et al, 1986). Реамберин не оказывает
прямого действия на кальциевый гомостаз, его эффект реализуется
косвенным путем, через усиление образования энергии в клетках (см.
п. 1.2.). Если рассматривать эксайтотоксичность в качестве фазного
патохимического процесса (минуты после инсульта –
эксайтотоксичность нейронов, дни после инсульта -
эксайтотоксичность глии), то в ситуации ишемического инсульта
введение нимодипина должно предшествовать назначению реамберина.
При назначении нимодипина в дозе, превышающей 1 мкг/кг/мл, дозу
реамберина следует снизить до 0,5 – 1 мл/мин.
Каждый класс антиоксидантов реализует свое действие в конкретной
АОС. Реамберин можно назвать «метаболическим антиоксидантом», хотя
такое название вряд ли правомерно, поскольку все лекарственные
препараты в той или иной мере воздействуют на метаболизм и
биотрансформацию аутокоидов. Конкретный механизм антиоксидантного
действия изучен не до конца. Многочисленные исследования,
выполненные в этом направлении, указывают на конечный результат
антиоксидантного действия реамберина, констатируя увеличение
активности АОС организма и снижение показателей ПОЛ.
5.8.1. Жировые эмульсии
Жиры (триацилглицериды) – наиболее важный резерв энергии,
однако, при ишемии возникает нарушение регуляции деацетилирования и
реацетилирования жирных кислот в крови. При высоком содержании
неэстерифицированных ЖК в плазме крови и дефиците (или усиленном
потреблении) НАД+, жирные к-ты не способны окисляться в
глюкозу, скорее всего они будут оказывать кетогенное действие,
причем связанное с накоплением І-оксибутирата (который не
идентифицируется тест полосками на ацетон!). Есть сведения, о
пероксидации экзогенно вводимых жировых эмульсий и повреждении
легких, которое может возникать при их введении, однако,
большинство указаний свидетельствуют о безопасности введения
жировых эмульсий у тяжелых больных (Skeie, et al., 1988).
Поэтому жировые эмульсии, если это необходимо, следует назначать
после появления признаков положительной клинической динамики в
ответ на проведение комплексной терапии с реамберином.
5.8.2. Аминокислоты
Комбинации оправданы, т.к. многие аминокислоты имеют независимые
от глюкозы пути проникновения в клетки и собственные варианты
утилизации. В сочетании с реамберином целесообразно использовать
«гликогенные» аминокислоты. При смешивании аминокислотных смесей с
р-рами глюкозы необходим контроль над количеством введенной
глюкозы. Таким образом, при сочетании аминокислотного
парентерального питания и реамберина необходимо следить за:
- концентрацией глюкозы крови;
- гиперкапнией;
- АЛТ, АСТ, щелочной фосфатазой (маркер оценки интенсивности ресинтеза ЖК из-за возможного избытка глюкозы);
- контролировать электролитный баланс.
При стабилизации критического состояния развивается
ингибирование сукцинатдегидрогеназы (СДГ), которое плохо устранимо
изолированным введением ЯК. При добавлении активаторов ее
биотрансформации (предшествующих или последующих продуктов),
действие ЯК проявляется в полной степени (Нарциссов Р.П., 1997). В
дикарбоновой части ЦТК процесс биотрансформации в цепи сукцинат –
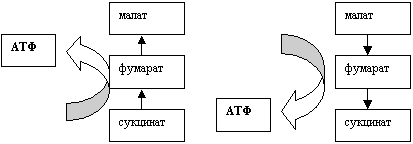
фумарат – малат может протекать в обоих направлениях, причем оба
направления способны формировать АТФ (см. рис. 2). Биохимическое
потребление сукцината может направлять ход реакций от малоната к
фумаровой к-те и наоборот. Важно, что при этом возникают
энергетические условия для восстановительного карбоксилирования ПВК
с превращением его в малат («малатный челнок»), т.к., еще раз
подчеркнем, реакции этой части ЦТК протекают в обоих направлениях.
С одной стороны, это означает, что из ПВК не образуется МК (на наш
взгляд это важнейшее противогипоксическое действие реамберина), а с
другой, - экономится молекула НАД+ и окисляется молекула НАДФН.
Оксиленный НАДФН может быть использован в других реакциях,
например, в глюконеогенезе, и тогда ситуация позволяет назначать
больному другие средства инфузионной терапии, например, полноценное
парентеральное питание в виде жировых эмульсий, не опасаясь
накопления кетонов и других недоокисленных продуктов жирового
обмена, или гипогликемии. Здесь возникает несколько благоприятных
возможностей для управления биохимическими реакциями у тяжелых
больных, т.к. и реамберин и мафусол являются официнальными
препаратами. Создание таких комбинаций бывает очень важным
подспорьем в лечении определенных патолических состояний, например,
алкогольного абстинентного синдрома (ААС) тяжелой степени, или
гепатотоксических нарушений, препятствующих специфической
фармакотерапии и т.д.
Важным условием для реализации действия комбинации является
поддержание оксигенации крови, причем ее следует проводить, на наш,
взгляд, до начала введения препаратов.
У больных, находящихся на самостоятельном дыхании это может быть
простая инсуфляция увлажненного кислорода, назначенная за 10 – 15
мин до введения веществ, при этом, терапию следует начинать с
реамберина, т.к. переход сукцината в малат будет создавать фонд
малата, необходимый для обратного хода энергообеспечивающих реакций
при возникновении осложнений заболевания (например, судорог,
делирия и т.д.)
Рис. 2. Взаимодействие сукцината с фумаратом
(объяснения в тексте)
Сукцинат и малат являются компонентами надежности в работе ЦТК,
т.к. они способны накапливаться в клетках. Это означает, что
оптимальные режимы введения реамберина (возможно и мафусола) должны
осуществляться в насыщающих и поддерживающих дозах, т.к. в отличии
от МК, сукцинат способен утилизироваться во многочисленных реакциях
– шунтах. Одним из таких шунтов, чрезвычайно значимых при многих и
многих состояниях, наблюдаемых в ОРИТ, является образование ГАМК.
При лечении ААС значение этого шунта трудно переоценить.
Мы отчетливо осознаем необходимость отдельного протокола для
уточнения клинических подробностей фармакотерапии (доз, интервалов,
скоростей введения перечисленных веществ), однако, стратегическое
направление в создании таких комбинаций, четко укладывается в
концепцию рациональной фармакотерапии, выдвинутой нами ранее
(Афанасьев В. В., с соавт. 2002, 2003) и было продемонстрировано
при лечении больных с ААС.
Комбинация не просчитываемая. Хлорамфемикол является блокатором
СДГ и его сочетание с реамерином (или назначение реамберина на фоне
предварительного введения хлорамфемикола, например, на
догоспитальном этапе) может сопровождаться избыточным накоплением
сукцината в клетках. Общей рекомендацией может служить назначение
реамберина через 4-5 ч после введения хлорамфемикола (т.е. через
период его полувыведения).
6. ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ РЕАМБЕРИНА
В МЕДИЦИНСКОЙ ПРАКТИКЕ
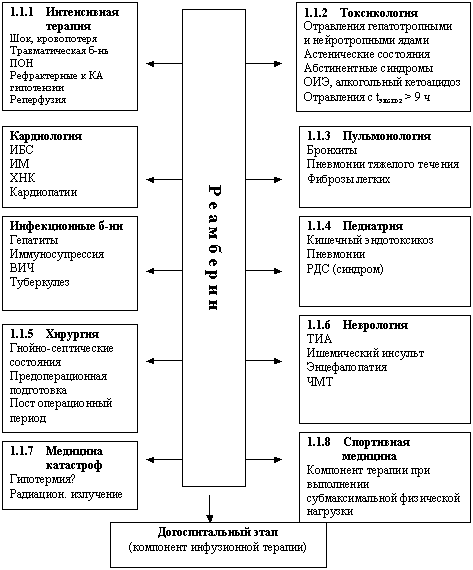
Рис 3. Основные состояния,
при которых применяется реамберин
7. СПИСОК ЛИТЕРАТУРЫ
- Афанасьев В.В., Лукьянова И.Ю., Гуло С.Л. Побочное действие
лекарственных веществ – возможно ли управление? Часть 1. Принципы
фармакокинетики. «Скорая мед. Помощь», СПбМАПО, 2003, 1, с 2
–13.
- Афанасьев В.В., Лукьянова И.Ю., Крензлок Э. Побочное действие
лекарственных веществ – возможно ли управление? Часть 2. Принципы
фармакодинамики. «Скорая мед. Помощь», СПбМАПО, 2003, 1, с 2
–13.
- Афанасьев В.В. Алкогольный абстинентный синдром. СПб 2002,
«Интермедика», 354 с
- Афанасьев В.В. Рубитель Л.Т., Афанасьев А.В. Острая интоксикация
этанолом. СПб, 2002, «Интермедика», 54 с
- Базаревич Г.Я., Богданович В.А., Волкова Г.Н Нейромедиаторы в
регуляции внешнего дыхания., М., «Медицина», 1982, 312 с.
- Вashan N, Burdett E & Klip A: Effect of thioctic acid on
glucose transport, in Gries/Wiesel (eds): Stellenwert von
Antioxidantien beim Diabetes mellitus. pmi Verlag GmbH, Frankfurt,
1993; pp 221-229.
- Высочина И.В., Колосовская В.П., Адамович В.В. Действие
сукцината натрия при гепатологических осложнениях химиотерапии
туберкулеза. В кн. «Янтарная кислота в медицине, пищевой
промышленности и сельском хозяйстве», М., Пущино, 1997, с. 84 –
89.
- Гаркави В.Х., Квакина Е.Б. Развитие реакции активации под
влиянием янтарной кислоты. В кн. «Янтарная кислота в медицине,
пищевой промышленности и сельском хозяйстве», М., Пущино, 1997, с.
89 – 91.
- Заржецкий Ю.В., Мутускина Е.А., Трубина И.Е, и др. Влияние
сукцината натрия на функциональные, биохимические и морфологические
показатели восстановления ЦНС у крыс после 10-минутной остановки
кровобращения. М.,Пущино, 1997, с 96 - 103.
- Зильбер А.П. Клиническая физиология для анестезиолога., М.,
«Медицина», 1976, 459 с.
- Зильбер А.П. Медицина критических состояний. Петрозаводск, изд.
ПГУ, 1995, 359 с.
- Ивницкий Ю.Ю., Головко А.И., Софронов Г.А. Янтарная к-та в
системе средств метаболической коррекции функционального состояния
резистентности организма. СПБ, «Лань», 1998, 82 с.
- Кольман Я., Рем К., Наглядная биохимия. М., «Мир», 2000, 469
с.
- Кудзина Л.Ю., Юрков И.С., Полтева Н.А. Активация и ингибирование
выхода ионов калияиз митохондрий субстратами окислительного
фосфорилирования. Антагонистическое действие неорганического
фосфора и сукцината. М., Пущино, 1997, с. 35 – 42.
- Лабори А. Регуляция обменных процессов. М., «Мир», 1970; с. 123
– 267.
- Лукьянова Л.Д. Гипоксия при патологиях. Молекулярные механизмы и
принципы коррекции. В кн. Перфторорганические соединения в биологии
и медицины. Пущино, 2001, с 56 – 69.
- Нарциссов Р.П., Петричук С.В., Духова З.Н. Цитохимическая
экспертиза качества жизни – вчера, сегодня, завтра. В кн. Янтарная
кислота в медицине, пищевой промышленности, сельском хозяйстве.
Пущино, 1997, с. 155 – 165.
- Неговский В.А., Гурвич А.М., Золотокрылина Е.С.
Постреанимационная болезнь. М., «Мед», 1987, 479 с.
- Одинак М.М., Вознюк И.А., Янишевский С.Н. Ишемия мозга.
Нейропротективная терапия. Дифференцированный подход. СПБ, ВМедА.,
2002, 77 с.
- Петрова Н.В. Комплексное применение антиоксидантов разлиных
функциональных классов при ЧМТ. Дисс. Канд. 2005, СПб, МАПО, 143
с.
- Розенфельд А.Д. Регуляция сукцинатом вклада митохондрий в
поддержание рН при АТФ-азных нагрузках. Авт. дисс. канд., 1983, 21
с.
- Романцов М.Г. (ред). Реамберин – инфузионный раствор для
интенсивной терапии в педиатрической клинике. СПб, «Полисан», 2002,
с 32 – 41.
- Романцов М.Г. Реамберин – инфузионный раствор для интенсивной
терапии в педиатрической клинике, СПб, 2002, 64 с.
- Румянцева С.А. Нейропротективная терапия ишемии мозга. Материалы
Научно-практ. конф.»Лечение ишемии мозга», М., 2001, с
- Самойлов В.О. Биофизика. Учебник для слушателей ВМедА, Л.,
«Медицина», 1984, с. 48 –146.
- Федин А.И. Современная концепция патогенеза и лечения острой
ишемии мозга. Материалы науч-практ конф «Лечение ишемии мозга». М.,
2001, с.5 – 23.
- Цивинский А.Д. Влияние препаратов антиоксидантного типа действия
на течение ЧМТ, полученной на фоне интоксикации этанолом. Дисс.
канд. мед. наук, СПБ, 2004, с. 22- 26.
- Челнов И.Г., Черемисин В.Е., Гордеев В.И. Эффективность
реамберина 1.5% раствора для инфузий при гнойно-септических
заболеваниях у детей. В кн.
- Amoroso P., Greenwood R. Posture and central venous pressure
measurement in the circulatory volume depletion. Lancet 1989; 1:
258 – 260.
- Chien S., Usami S., Skalak R. Blood flow in small tubes. In:
Renkin E., Mitchel C., (Ed): Handbook of physiology. Section 2. The
CV system. Vol 4. The microcirculation. Bethesda, APS, 1984.
- de Vries H., Kuiper J., de Boer A. The blood brain barrier
neuroinflammatory diseases. Pharmacol Reviews 1997; 49 (2): 143 –
156.
- Lee Y-J, Huang F-Y, Shen E-Y et al: Neurogenic diabetes
insipidus in children with hypoxic encephalopathy: six new cases
and a review of the literature. Eur J Pediatr 1996;
155:245-248.
- Leiber C. Metabolism of alcohol. Clinics in lever disease, 1998;
2(4): 673 – 702.
- Leker RR., Teichner A., Grigoriadis N. NAP, a femptmolar-acting
peptide, protects the brain against ischemic injury by reducing
apoptotic death. Stroke, 2002;33: 1085 – 1194
- Lipton SA., Rosenberg PA. Machanisms of disease: excitatory
amino acids as a final common pathway for neuroljgic disorders.
NEJM 1994; 330: 613 – 622.
- Marino P. The ICU book. Copyright@William and Wilkins, 1998, p
129 – 193.
- Pantoni L., Sarti C., Inzitari D. Cytokines and cell adhesion
molecules in cerebral ischemia. Arterioscl, Thromb, and Vascul
Biol, 1998; 18: 503 – 513.
- Philippon J, Grob R, Dagreou F et al: Prevention of vasospasm in
subarachnoid haemorrhage. A controlled study with nimodipine. Acta
Neurochir 1986; 82:110-114.
- Sahuquillo J., Poca MA., Amoros S. Current aspects of
pathophуsiology and cell dysfunction after severe injury. Curr.
Pharm des. 2001; 7(15): 1475 – 1503.
- Siegal G., Agranoff B., Albers R. Basic Neurochemistry
(molecular, cellular an medical aspects), 5th ed, Copyright 1994,
Raven Press, NY, 1080 p.
- Siesjo BK. Cerebral circulation and metabolism. J Neurosurgery
1984; 60: 883 – 908.
- Sivaramakrishnan S., Panini S., Romasarma F. Ind.J.Bioch,
Biophys, 1983; 20 : 23 – 28.
- Skeie B., Askanasi J., Rothkorpf M. Intravenous fat emulsions
and lung function. Review. Crit. Care Med., 1988; 16: 183 –
193.
- Suzuki Y, Aggarwal B & Packer L: Alpha-lipoic acid is a
potent inhibitor of NF-Kappa-B activation in human T cells.
Biochemical and Biophysical Res Commun 1992; 189(3):1709-1715.
- Taylor JR. Аlcohol and strokes, NEJM 1982; 306: 1111- 1121.