МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Эффективность использования
препаратов Реамберин и Циклоферон
в терапии кишечных инфекций у детей
Методические рекомендации
О.В. Тихомирова, М.К. Бехтерева, О.И. Ныркова
Санкт - Петербург
2003
Эффективность использования препаратов Реамберин и
Циклоферон в терапии кишечных инфекций у детей / О.В. Тихомирова,
М.К. Бехтерева, О.И. Ныркова. -СПБ., 2003.-44 с.
В методических рекомендациях изложены основные механизмы
лечебного действия реамберина и циклоферона при бактериальной
дизентерии, иерсинозной инфекции и псевдотуберкулезе у детей. Дан
анализ эффективности препаратов и клинико-теоретическое
обоснование использования реамберина и циклоферона при кишечных
инфекциях.
Методические рекомендации предназначены для терапевтов,
инфекционистов, врачей общей практики.
Методические рекомендации подготовлены на базе НИИДИ г. Санкт-Петербурга.
СОДЕРЖАНИЕ
1. Список сокращений
2. Введение
3. Цель и задачи исследования
4. Материалы и методы исследования
5. Эффективность использования реамберина 1,5% при бактериальной дизентерии у детей
6. Неспецифическая резистентность макроорганизма и гуморальный иммунный ответ при бактериальной дизентерии
7. Эффективность применения циклоферона при дизентерии у детей
8. Иммунный статус и характер течения иерсиниозной инфекции у детей
9. Эффективность циклоферона у детей при псевдотуберкулезе и кишечном иерсиниозе
10. Литература
Список сокращений
АО – антителообразование, антительный ответ
AT – антитела
АФК – активные формы кислорода
ВНСММ – вещества низкой и средней молекулярной
массы
ЕК – естественные киллеры
ИИ – иерсиниозная инфекция
ИКК – иммунокомпетентные клетки
ИЛ (IL) – интерлейкин
ИО – иммунный ответ
HФH(IFN) – интерферон
КИ – кишечный иерсиниоз
ЛПС – липополисахарид
НСТ – нитросиний тетразолий
ОКИ – острые кишечные инфекции
ПСТ – псевдотуберкулез
РА – реакция агглютинации
CD – cluster differentiation - кластеры дифференцировки
СРО – свободнорадикальное окисление
ФА – фагоцитарная активность
ФГА-РБТЛ – реакция блаеттрансформации лимфоцитов
на фитогемагтлютинин
ФИ – фагоцитарный индекс
ФНО (TNF) – фактор некроза опухолей
ЦИК – циркулирующие иммунные комплексы
ЦТЛ – цитотоксические лимфоциты
ЭИ – эндогенная интоксикация
Введение
Проблема острых кишечных инфекций (ОКИ) у детей до настоящего
времени остается актуальной, что обусловлено высокой частотой
заболеваемости и летальности, значительной ролью в формировании
гастроинтестинальной патологии. Ведущее место в структуре
расшифрованных ОКИ занимают инвазивные диареи, и прежде всего
бактериальная дизентерия. Современные шигеллезы характеризуются
превалированием возбудителей, обладающих высокими инвазивными и
патогенными характеристиками. С начала 90-х годов доминируют
штаммы шигелл Флекснера 2а, в последние годы отмечается включение
в эпидемический процесс шигелл Флекснера 3а (Тихомирова О.В. и
др., 2002). В связи с этим клиника современной дизентерии
характеризуется преобладанием среднетяжелых и тяжелых форм
заболевания, выраженным интоксикационным синдромом и, нередко,
формированием длительного бактериовыделения (Лобзин Ю.В., 1999;
Джихад Хусейн, 2002).
Тяжесть течения и исход инфекционного процесса во многом
обусловлены состоянием неспецифической резистентности
макроорганизма, специфического иммунного ответа и метаболических
сдвигов в клетках крови (Rohrdans Е., 1998; Ginn-Pease М.Е., 1998;
Ющук Н.Д. и соавт., 2002,). Повреждение, вызванное патогеном, кроме
местных изменений сопровождается развитием общей реакции
организма на инфекционный стресс. Активация процессов катаболизма,
чрезмерное накопление продуктов промежуточного и конечного обмена
при несостоятельности систем детоксикации приводят к развитию
синдрома эндогенной интоксикации (ЭИ) и изменению метаболизма
клеток макроорганизма (Владимиров Ю.А., 1998; Короткова М.Р.,
Пясецкая Е.С, 1999; Подопригорова В.Г., 2001). Несмотря на
многообразие веществ эндогенной природы, обладающих токсическими
свойствами, клинические проявления симптомокомплекса ЭИ
малоспецифичны и характеризуются общей слабостью, вялостью,
отсутствием аппетита, нарушением сна, головными болями и т. д.
Клиническими проявлениями синдрома являются также температурные
реакции, тахикардия, энцефалопатия, лейкоцитоз или лейкопения
(Ларионова В.Б., 1990; Николайчик В.В., 1991; Корякина Е.В. и др.,
2001).
В клинической практике объективная оценка степени интоксикации,
компенсаторных возможностей макроорганизма чрезвычайно важна и
актуальна из-за значительной вариабельности ответных реакций
заболевшего ребенка и необходимости индивидуальной коррекции
проводимой терапии. Объективным лабораторным показателем наличия
эндотоксикоза является определение уровня веществ низкой и средней
молекулярной массы (ВНСММ) в эритроцитах плазме крови, что
позволяет оценить не только выраженность интоксикации, но и
резервные возможности систем детоксикации (Малахова М.Я., 1995;
Акайзин Э.С, 1998; Савченко Р.П., 2001).
При инфекционном процессе значительная роль принадлежит
процессам свободнорадикального окисления (СРО), активация которых,
с одной стороны, играет роль неспецифической защиты организма, с
другой – способна приводить к существенным повреждениям клеточных
мембран, органов и систем (Дубинина Е.Е., 1998; Говорова Л.В.,
2002). Доказано выраженное влияние бактериальных токсинов
липополисахаридной природы на продукцию активных кислородных
метаболитов фагоцитами, что способствует развитию каскадного
механизма СРО (Фархутдинов Р.Р., 1995).
Как отечественные, так и зарубежные ученые, занимающиеся
клинико-иммунологическими проблемами дизентерии, отмечали, что у
больных шигиллезом развивается четко выраженный дисбаланс различных
звеньев иммуногенеза. Установлена тенденция (особенно при
формировании затяжных форм) к супрессии системного и местного
иммунного ответа (Буркин А.В. и др., 1991; Усыченко Е.М., Машилов
В.П., 1992; Ющук Н. Д., Фролов В.М.,. Пересадин Н.А, 1993).
Среди бактериальных ОКИ особое внимание исследователей
привлекает проблема иерсиниозной инфекции (ИИ), заболеваемость
которой имеет тенденцию к росту. Это связано, по-видимому, как с
истинным увеличением заболеваемости, так и с улучшением
клинической и лабораторной диагностики иерсиниозов. ИИ включает в
себя такие нозологические формы, как псевдотуберкулез, вызванный
Y. pseudotuberculosis I-VIII сероваров, и кишечный иерсиниоз,
обусловленный патогенными Y. enterocolitica различных
серовариантов. В последние годы в Санкт-Петербурге заболеваемость
детского населения иерсиниозами достигает 186-190 на 100 тыс., а
соотношение взрослые-дети среди заболевших псевдотуберкулезом
составляет 1 : 35, что позволяет считать заболевание
преимущественно детской инфекцией. Значимость диагностики и
терапии иерсиниозной инфекции обусловлена многообразием
клинических проявлений, отсутствием патогномоничных симптомов,
редкостью моносиндромных вариантов, частотой хронизации (3-11%)
(Ющук Н.Д., Кареткина Г.Н., 2000; Ценева Г.Я., 2000). В основе
клинического полиморфизма инфекции лежат как вариации вирулентности
отдельных штаммов иерсиний (Малов И.В. и др., 1999), так и
генетически обусловленные особенности иммунного ответа на различные
антигены возбудителя (Кузнецова Т.А., Беседнова Н.Н., 1997).
Иерсиниозная инфекция характеризуется циклическим течением,
которое может нарушаться развитием затяжного течения и рецидивов,
что определяется биологическими свойствами возбудителя,
обладающего антифагоцитарной устойчивостью, а также особенностями
иммунной реактивности организма (Исачкова Л.М. и др., 1996;
Беседнова Н.Н., Сомов Г.П., 2000; Бехтерева М.К. и соавт., 2001;
Васякина Л.И., 2002). Частота рецидивов при псевдотуберкулезе
колеблется от 10 до 53%, в различные годы она неодинакова
(Борисова М.А. и др., 2000). Различают острое, затяжное и
рецидивирующее (негладкое) течение ИИ. При остром течении ИИ общая
длительность болезни не превышает 4-8 недель. При негладком течении
наблюдаются обострения (затяжное течение), длительность
заболевания составляет не более 3 месяцев, и рецидивирующее течение
с длительностью заболевания от 3 до 6 месяцев и развитием от 1 до
4 рецидивов.
Доказана роль иерсиний в формировании хронических заболеваний
желудочно-кишечного тракта (Кузьмин А.В. и др., 1997; Климанова
Е.М. и др., 1998; Гордеец А.В. и др., 2000). Иерсиниозная инфекция
может быть триггером развития иммунопатологических процессов
(гемолитическая анемия, тромбоцитопения, тиреоидит,
гломерулонефрит, поражения сердца и суставов) (Ющенко Г.В., 1998;
Акбаров С.В., 1998, 2000).
Иммунный ответ осуществляется при тесном взаимодействии
клеточного и гуморального звеньев, взаимодействие которых
направлено на элиминацию патогена и восстановление иммунного
гомеостаза (Ковальчук Л.В., Чередеев А.Н., 1997; Фрейдлин И.С,
1999; Ярилин А.А., 2000). Иммунологическая реактивность, наряду с
особенностями возбудителя, обусловливает клинические проявления
болезни, ее течение и исход (Покровский В.И., 1994; Чередеев А.Н.,
1995). Иммунокомпетентные клетки посредством выработки различных
факторов защиты и иммунорегуляции (цитокинов, иммуноглобулинов
различных классов, компонентов системы комплемента) определяют
скорость и эффективность иммунного ответа на патоген (Хаитов Р.М.
и др., 2000). Изучение иммуно-патогенеза иерсиниозной инфекции
позволяет прогнозировать развитие затяжного и рецидивирующего
течения (Васякина Л.И., 2002; Железникова Г.Ф., 2002).
Все вышесказанное обосновывает необходимость дальнейшего
изучения патогенетических механизмов развития заболевания и поиска
рациональной патогенетической терапии.
Рациональная терапия больного предполагает воздействие на все
составляющие инфекционного процесса: возбудитель и его токсины,
реактивность организма и отдельные звенья патогенеза. В последнее
время отмечается тенденция к ограничению применения антибиотиков у
детей и разрабатываются строгие показания к их назначению при
кишечных инфекциях. Обусловлено это не только ростом удельного веса
заболеваний, вызванных антибиотикорезистентными штаммами, но и
ростом осложнений от применения традиционных антибактериальных
препаратов, особенно в раннем возрасте: нарушение биоценоза
кишечника, угнетение иммунитета, аллергические реакции,
токсические поражения почек, печени, органов слуха и др.
(Феклисова Л.В., 1992; Воротынцева Н.В. 1994; Нисевич Н.И.,
Учайкин В.Ф., 1967, 1992, 1995). Это определяет целесообразность и
приоритетность разработки новых подходов к патогенетической терапии
при лечении кишечных инфекций в современных условиях.
При бактериальной дизентерии в острый период интоксикационный
синдром является превалирующим, что обосновывает поиск новых
лекарственных препаратов, обладающих дезинтоксикационным
эффектом.
Реамберин – инфузионный препарат нового поколения. Основным
действующим веществом является соль янтарной кислоты,
обеспечивающая основные фармакологические эффекты. Доказано, что
экзогенная янтарная кислота обладает дезинтоксикационными
свойствами, корригирует метаболический ацидоз, улучшает перфузию
кислорода в ишемизированные ткани. Антиоксидантное действие
янтарной кислоты обеспечивается снижением уровня
свободнорадикальных процессов в сыворотке крови и
мембрано-стабилизирующим действием.
Терапия инфекционных заболеваний включает в себя и обоснованное
иммуномодулирующее воздействие. В связи с этим представляется
актуальным использование таблеток циклоферона при бактериальных
ОКИ у детей. Препарат является низкомолекулярным индуктором
интерферона и обладает иммуномодулирующим и противовоспалительным
действием, что практически значимо при лечении дизентерии и
иерсиниозной инфекции.
Циклоферон – таблетки по 0,15 г, содержащий активное вещество –
N-(1-дезокси-d-глюцитол-1-ил)-N-метиламмоний-10-метилкарбоксилат
акрид она. Основной фармакологический эффект препарата обусловлен
способностью индуцировать высокие титры α- и β-интерферона в
органах и тканях, содержащих лимфоидные элементы (слизистая
тонкого отдела кишечника, селезенка, печень, легкие).
Иммуномодулирующий эффект циклоферона выражается в коррекции
иммунного статуса организма при иммунодефицитных состояниях.
Элиминация происходит через печень и почки.
Цель и задачи исследования
Цель работы
Изучить эффективность препаратов Реамберин 1,5% раствор для
инфузий и Циклоферон таблетированная форма при бактериальной
дизентерии и иерсиниозной инфекции у детей путем оценки клинических
данных, маркеров эндогенной интоксикации, показателей
неспецифической резистентности, специфического иммунного ответа и
иммунного статуса макроорганизма.
Задачи исследования
Изучить клиническую эффективность препарата Реамберин 1,5% для
инфузий в комплексной терапии больных острыми кишечными
инфекциями
Определить клинические особенности течения иерсиниозной
инфекции у детей различного возраста, получавших в комплексе
терапии препарат Циклоферон.
Изучить эффективность иммуномодулирующего препарата Циклоферон
в терапии острых и затяжных форм кишечных инфекций.
Установить особенности формирования специфического иммунного
ответа и иммунного статуса у больных с различными формами
иерсиниозной инфекции.
Разработать показания к назначению и рациональные схемы терапии
циклофероном у детей с дизентерией и иерсиниозной инфекцией.
Материалы и методы исследования
Микробиологическое исследование штаммов шигелл включало изучение
антигенной структуры микроколоний, выросших на чашках с первичными
(диагностическими) посевами для установления сероварианта
возбудителя. Определение уровня специфических антител к шигеллам
Флекснера и Зонне в сыворотке крови проводили в реакции непрямой
гемагглютинации (РНГА) с использованием стандартного отечественного
антигенного эритроцитарного шигеллезного диагностикума Флекснера
1-5, Флекснера 6 и Зонне (производство РАО «Биопрепарат»,
предприятие по производству бактерийных препаратов НИИ вакцин и
сывороток, Санкт-Петербург).
У больных с диагнозом клиническая дизентерия для оценки степени
эндогенной интоксикации в плазме крови и эритроцитах определяли
уровень веществ низкой и средней молекулярной массы (ВНСММ) по
методу М.Я. Малаховой (1995), соотношение уровня этих показателей;
вычисляли лейкоцитарный индекс интоксикации. Для определения уровня
ВНСММ проводилось предварительное осаждение крупномолекулярных
веществ плазмы крови и эритроцитов раствором ТХУ и регистрация
спектральной характеристики водного раствора супернатанта при
различных длинах волн на спектрофотометре. Обследование проводилось
в первые сутки поступления, на 3-5-й день болезни и в период ранней
реконвалесценции (7-10-й день) Оценка интенсивности процессов
свободнорадикального окисления в плазме крови и эритроцитах
обследованных больных проводилась методом активированной
хемилюминесценции с использованием стандартных растворов и
реактивов. В качестве активатора использовалась 30%-ная
гидроперекись водорода. Оценивались пики максимальной и
минимальной хемилюминесценции, интенсивность свечения на 30, 60,
90 и 120-й секундах исследования (биохимическая лаборатория
НИИДИ).
Кроме этого, больным дизентерией проводилось лабораторное
обследование, включавшее клинические анализы крови, мочи,
копроцитограмму, биохимическое исследование крови с определением
уровня элекролитов, мочевины, креа-тинина стандартными
методами.
Определение противоиерсиниозных антител (AT) проводили
двукратно в стандартной серологической реакции агглютинации (РА),
используя иерсиниозные корпускулярные антигены Y. enterocolitica
ОЗ, Y. enterocolitica ОЗ, Y. pseudotuberculosis производства
«Предприятия по производству бактерийных препаратов НИИЭМ им.
Пастера» (Санкт-Петербург). Средний геометрический титр антител
выражали в обратных логарифмах (1/lg).
Для изучения специфических IgA, IgM и IgG в сыворотке крови и
копрофильтратах (секреторная фракция IgA) применялась реакция
непрямой иммунофлюоресценции (РНИФ) с использованием
моноспецифических сывороток против иммуноглобулинов человека (НИИ
эпидемиологии и микробиологии им. Н.Ф. Гамалеи, Москва),
модификация метода Д.С. Быценко (2000).
Определение фагоцитарной активности лейкоцитов крови проводили
методом В.М. Бермана и Е.М. Славской (1958). Поглотительную
способность нейтрофилов оценивали по фагоцитарной активности и
фагоцитарному числу. Окислительные процессы в лейкоцитах изучали с
помощью теста восстановления нитросинего тетразолия (НСТ-тест)
(Нагоев Б.С, 1983) (бактериологическая лаборатория НИИДИ).
Концентрацию иммуноглобулинов (Ig) A, M, G классов определяли
стандартным методом радиальной иммунодиффу-зии по Mancini (1965) с
использованием моноспецифических антисывороток предприятия по
производству бактерийных препаратов Нижегородского НИИЭМ.
Содержание общего IgE определяли методом твердофазного
иммуноферментного анализа (ИФА) с использованием коммерческих
тест-системТОО «Полигност» (Санкт-Петербург). Определение общего
пула ЦИК проводили методом преципитации полиэтиленгликолем по
Digeon (1977) в планшетной модификации (иммунологическая
лаборатория НИИДИ).
Определение уровня цитокинов в сыворотке крови (TNF-α, IFN-γ,
IL-4, IL-6) и в надосадочной жидкости (IL-2) проводили методом
твердофазного иммуноферментного анализа (ИФА) в соответствии с
инструкциями, прилагаемыми к наборам производства ТОО «Протеиновый
контур» (НИИ ОЧБ, Санкт-Петербург) (иммунологическая лаборатория
НИИДИ). Для ориентировочной оценки соотношения Thl/Th2 мы
использовали коэффициент IFN-γ/IL-4 (Mosmann Т., Sad S.,
1996).
Пролиферативную активность Т-лимфоцитов оценивали в реакции
бласттрансформации лимфоцитов (РБТЛ) на фитогемагглютинин (ФГА)
фирмы «Difco» (США) в конечной концентрации 10 мкг/мл в культурах
цельной крови с морфологическим учетом результатов (Новиков Д.К.,
1996). Супрессию пролиферативного ответа устанавливали по числу
бластных форм менее 65% – наименьшее значение показателя у
здоровых детей. Иммунофенотипирование лимфоцитов периферической
крови проводили с помощью панели моноклональных антител серии ИКО
производства НПЦ «Медбиоспектр» (Москва) в лимфоцитотоксическом
тесте (Кетлинский С.А., Калинина Н.М., 1998). Для оценки соотношения
«позитивной» и «негативной» (Ковальчук Л.В., Чередеев А.Н.,1998)
активации лимфоцитов мы ввели коэффициент CD25/CD95
(иммунологическая лаборатория НИИДИ).
Обследование больных бактериальной дизентерией и иерсининозной
инфекцией включало ежедневную клиническую оценку симптомов
интоксикации и лабораторный мониторинг.
Таблица 1. Иммунологические показатели
здоровых лиц (n=10)
|
Фенотипический состав лимфоцитов, пролиферативная
активность Т-лимфоцитов
|
Показатель
|
Цитокины,
факторы гуморального ответа
|
Показатель
|
|
ФГА-РБТЛ
|
75,0±2,0%
|
TNF-α,
|
124±33 пг/мл
|
|
CD8
|
21,2±1,8%
|
IFN-γ
|
92±24 пг/мл,
|
|
CD20
|
23,5±2,5%
|
IL-4
|
67±28 пг/мл
|
|
CD25
|
18,8±1,8%
|
IgE
|
100±32 кЕ/л
|
|
CD95
|
22,2±1,6%
|
ЦИК
|
0,115±0,10 ед. опт. пл.
|
|
CD25/CD95
|
0,85±0,07
|
|
|
Препарат Реамберин 1,5% для инфузий назначали больным в остром
периоде бактериальной дизентерии в первые 2-3 дня госпитализации.
Доза введения зависела от возраста ребенка и составляла в среднем
200-400 мл (10 мл/кг), скорость инфузий 8-10 капель в минуту.
Циклоферон назначали в острый период бактериальной дизентерии,
псевдотуберкулеза или кишечного иерсиниоза, а также в случаях
длительного бактериовыделения или в случае рецидива заболевания по
представленной схеме.
1-й день – 2-й день – 4-й день – 6-й день – 8-й день в
возрастной дозе:
до 3-х лет – 150 мг;
4-7 лет – 300 мг;
8-12 лет – 450 мг;
старше 12 лет – 600 мг 1 раз в день за 30 мин. до
еды не разжевывая.
Эффективность использования
реамберина 1,5%
при бактериальной дизентерии у детей
Комплексный анализ клинического течения бактериальной
дизентерии и результатов лабораторного обследования проведен у 68
детей в возрасте от 2 до 14 лет, больных бактериальной
дизентерией. Этиология дизентерии была расшифрована у 100% больных
на основании результатов бактериологического и серологического
исследований: дизентерия Флекснера 2а зарегистрирована у 47,0%
больных, Флекснера 3а – у 17,6%, дизентерия, вызванная шигеллами
Зонне, – у 35,4% детей (рис. 1).
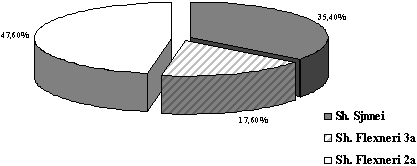
Рис. 1. Этиология бактериальной дизентерии
у обследованных больных
Больные в возрасте от 1 года до 3 лет составили 17,6% (12
детей), от 3 до 7 лет – 33,4% (23 ребенка) и старше 7 лет – 50% (34
больных). Мальчиков среди обследованных было 47,2%, девочек -
52,8%.
Все больные поступали на ранних сроках заболевания (первые 3
суток от начала болезни). Развитие шигеллеза характеризовалось
острым началом, выраженными симптомами интоксикации (вялость,
слабость, снижение аппетита вплоть до анорексии), повышением
температуры до фебрильных цифр, тошнотой, рвотой, болями в животе и
местными проявлениями – дистальным колитом.
43,3% детей при поступлении предъявляли жалобы на головную
боль, у 5 детей в возрасте до 2 лет отмечались судороги
тонико-клонического характера, у 3 подростков – нарушение
сознания, галлюцинации, психомоторное возбуждение, объективно
выявлялись менингеальные симптомы. Судорожный синдром, нарушение
сознания и менингеальные симптомы расценивались как проявления
неиротоксикоза и отмечались только у детей с дизентерией
Флекснера.
Клиническая оценка местных симптомов дизентерии включала анализ
таких проявлений дистального колита, как характер и частота стула,
наличие в испражнениях патологических примесей (слизи, зелени,
крови), интенсивность болевого синдрома, а также тенезмов и
метеоризма. Оценка тяжести клинического течения дизентерии у детей
проводилась в соответствии с классификацией И.Л. Гусарской, Г.А.
Тимофеевой (1979), согласно которой все случаи были разделены по
форме тяжести и характеру течения. Основными критериями тяжести
заболевания явились наличие и выраженность явлений интоксикации,
симптомов поражения желудочно-кишечного тракта, осложнений
заболевания. У абсолютного большинства больных с острой дизентерией
Зонне заболевание протекало в среднетяжелой форме (79,4%), при
дизентерии Флекснера тяжелое течение болезни отмечалось у 39,5%
детей.
В большинстве случаев заболевание носило типичный характер с
различной степенью выраженности основных симптомов интоксикации и
признаками воспалительных изменений в кишечнике. Ведущим
клиническим синдромом среди обследованных детей являлся
гастроэнтероколит (у 73,8% больных).
Таблица 2. Характеристика интоксикационного синдрома
при бактериальной дизентерии (частота встречаемости симптомов,
%)
|
Симптомы
|
Дизентерия Флекснера
|
Дизентерия Зонне
|
|
Среднетяжелая
|
Тяжелая
|
Среднетяжелая
|
Тяжелая
|
|
Лихорадка >39,0°С
|
73,4
|
96,3
|
61,8
|
76,6
|
|
Вялость
|
81,7
|
100
|
58,3
|
94,2
|
|
Анорексия
|
72,4
|
89,7
|
51,3
|
75,6
|
|
Головная боль
|
56,6
|
78,3
|
44,5
|
63,2
|
|
Тошнота, рвота
|
63,8
|
88,6
|
66,1
|
87,2
|
|
Судорожный синдром
|
0
|
9,1
|
0
|
0
|
Сравнительный анализ клинического течения среднетяже-лых форм
дизентерии у детей выявил более тяжелое течение дизентерии
Флекснера по сравнению с дизентерией Зонне. У всех больных этой
группы отмечались вялость, слабость, снижение аппетита. Больные
дизентерией Флекснера чаще предъявляли жалобы на головную боль (55%
против 30%). Длительность симптомов интоксикации в этой группе
больных составила 6,6±1,5 дня, в то время как при дизентерии Зонне
только 3,1±0,8 дня (р<0,05). Гипертермия выше 39°С в первые дни
болезни отмечалась у 60% больных дизентерией Флекснера и только у
20% – дизентерией Зонне (р<0,05). Лихорадочный период при
дизентерии Флекснера был более длительным, на 2-3 дня превышая
период температурной реакции при дизентерии Зонне. Выраженные
симптомы дис-тального колита наблюдались у 75% больных
среднетяжелой формой дизентерии Флекснера и у 30% – дизентерии
Зонне. Примесь крови в стуле у этих больных сохранялась на
протяжении 2,9±1,2 дня при дизентерии Флекснера и в течение
1,74±0,85 дня при дизентерии Зонне. Кроме того, у детей отмечались
выраженные боли в животе, тенезмы и метеоризм, причем при
среднетяжелых формах дизентерии Флекснера у 75% больных
длительность болевого синдрома превышала 3 суток, в то время как
при дизентерии Зонне аналогичные изменения были выявлены у 40%
больных с длительностью, не превышающей 2 суток.
При исследовании биохимических маркеров эндотоксико-за была
показана прямая зависимость их уровня от тяжести течения
инфекционного процесса. Исходно (при поступлении) показатели
эндогенной интоксикации были достоверно выше нормы в обеих группах
больных. При тяжелом течении уровень ВНСММ плазмы превысил
нормальные значения в 2,4 раза и составил 18,1+2,4 УЕ, при
среднетяжелой форме – зарегистрировано превышение в 1,8 раза по
сравнению с нормой. При анализе взаимосвязи уровня маркеров
эндогенной интоксикации и этиологии заболевания выявлены
максимальные показатели в острый период болезни при дизентерии
Флекснера (19,6+2,4 и 13,9+1,2 УЕ) при тяжелой и среднетяжелой
форме соответственно. Это соотносится и с клиническими данными
длительности и выраженности интоксикационного синдрома при данной
этиологии заболевания. Соотношение уровня ВНСММ плазмы крови и
эритроцитов при тяжелом течении дизентерии составило 0,7-0,8 (при
норме 0,4-0,5), что свидетельствует о субкомпенсированном
состоянии систем детоксикации.
Сравнительная оценка интенсивности процессов
свободнорадикального окисления в плазме крови и эритроцитах
показала, что при среднетяжелой форме течения дизентерии повышение
интенсивности свободнорадикальных процессов сопровождалось
своевременным включением систем антиок-сидантной защиты. При
тяжелой форме заболевания интенсивная продукция активных форм
кислорода происходила на фоне недостаточных механизмов
антиоксидантной защиты (рис.2).
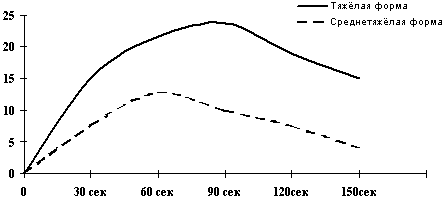
Рис. 2. Интенсивность хемилюминесценции в плазме крови
в острый период бактериальной дизентерии
Комплекс патогенетических мероприятий у 100% больных включал
парентеральное введение жидкости. Показаниями к назначению
инфузионной терапии являлась выраженность симптомов интоксикации и
дегидратации.
Методом случайной выборки все больные были распределены на 2
группы: опытную – 35 человек и группу сравнения – 33 ребенка (табл. 3). Обе группы были репрезентативны по возрасту, полу, структуре и
тяжести заболевания, получали традиционную этиотропную и
патогенетическую терапию, симптоматические средства.
В первой группе в качестве дезинтоксикационного раствора
применяли реамберин 1,5% для инфузий, в группе сравнения –
глюкозо-солевые растворы (хлосоль, раствор глюкозы 5%, раствор
Рингера, раствор глюкозы 10% с электролитами). Все больные
переносили реамберин 1,5% для инфузий хорошо, побочных эффектов и
осложнений не выявлено.
При сравнительной клинической оценке длительности
интоксикационного синдрома в исследуемых группах выявлено
уменьшение продолжительности лихорадки, головной боли, вялости,
анорексии у детей, получавших в качестве дезинтоксикационной
терапии реамберин, по сравнению с больными контрольной группы
(табл. 4).
Таблица 4. Продолжительность клинических симптомов у больных,
получавших реамберин, и в группе сравнения
|
Симптомы
|
Вид терапии и продолжительности симптомов (дни)
|
|
Получавшие Реамберин,
n=35
|
Группа сравнения,
n=33
|
|
Лихорадка
|
3,2±0,7
|
4,6±1,2
|
|
Головная боль
|
1,2±0,6
|
2,0±1,1
|
|
Вялость
|
3,8±+1,2
|
5,1±1,9
|
|
Анорексия
|
2,4±0,9
|
3,7±1,0
|
При динамической оценке показателей эндогенной интоксикации в
группе сравнения отмечена нормализация ВНСММ плазмы крови у детей
со среднетяжелой формой инфекции (у всех детей с дизентерией
Зонне и у 91% больных дизентерией Флекснера); при тяжелом течении
– достоверное снижение уровня ВНСММ в плазме крови в отличие от
исходного состояния и контрольной группы (рис. 3).
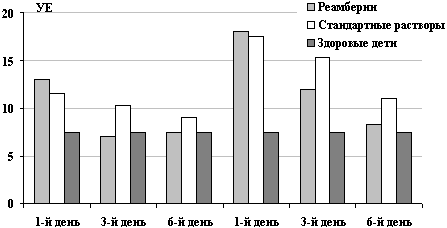
Рис. 3. Динамика показателей эндогенной интоксикации
в плазме крови больных бактериальной дизентерией
У детей контрольной группы в эти сроки отмечена лишь тенденция к
снижению показателей эндогенной интоксикации, а полная
нормализация наступала только в периоде ранней реконвалесценции
(9-10-е сутки заболевания), что характерно для тяжелого течения
дизентерии Флекснера.
Изменения интенсивности процессов СРО в сыворотке крови больных
бактериальными кишечными инфекциями носили однонаправленный
характер, и их выраженность зависела от тяжести инфекционного
процесса. В острый период заболевания при среднетяжелой форме
течения пик хемилюминисценции (12,8±1,3 ед.) отмечался на первой
минуте исследования и к началу третьей минуты снижался до
нормальных значений (4,5±0,6 ед.) Это свидетельствует о
своевременном включении систем антиоксидантной защиты. При тяжелом
течении активация процессов СРО отмечалась уже на 30-й секунде (пик
хемилюминесценции составлял 17,4±2,1 ед.) с максимальным
нарастанием интенсивности к 90-120-й секунде (23,6±2,4 ед.) и
сохранением повышенных показателей на третьей минуте.
Установленные сдвиги свидетельствуют об интенсивной продукции
активных форм кислорода на фоне недостаточных механизмов
антиоксидантной защиты при тяжелых формах кишечных инфекций.
Применение реамберина приводило к достоверному снижению
интенсивности свободнорадикальных процессов (по данным
хемилюминисценции) в эритроцитах уже к 3-му дню терапии, в то
время как в группе сравнения показатели хемилюминесценции
оставались на высоких цифрах (рис. 4).
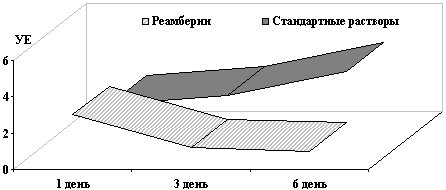
Рис. 4. Интенсивность хемилюминесценции в эритроцитах детей,
больных бактериальной дизентерией
Таким образом, проведенные исследования показали, что тяжелые
формы дизентерии характеризуются большей выраженностью
окислительно-метаболических процессов в острый период заболевания,
что является одним из критериев тяжести процесса. Высокий уровень
показателей эндогенной интоксикации (ВНСММ) при шигеллезе
Флекснера свидетельствует о большем повреждающем воздействии
возбудителя. Выявленная клинико-лабораторная эффективность
инфузионного препарата Реамберин доказывает целесообразность его
включения в комплексную терапию тяжелых и среднетяжелых форм
острых кишечных инфекций у детей.
Таблица 3. Формы тяжести
и этиология бактериальной дизентерии у детей
|
Группы
|
Серотип Флекснера
|
Серотип Зонне
|
|
Степень тяжести
|
Всего детей
|
Степень тяжести
|
Всего детей
|
|
Легкая
|
Средне-тяжелая
|
Тяжелая
|
Легкая
|
Средне-тяжелая
|
Тяжелая
|
|
Опытная группа
|
0
|
15
62,5%
|
9
37,5%
|
24
|
0
|
9
81,9%
|
2
18,1%
|
11
|
|
Группа сравнения
|
0
|
12
60,0%
|
8
40,0%
|
20
|
0
|
10
76,9%
|
3
23,1%
|
13
|
Неспецифическая резистентность макроорганизма
и гуморальный иммунный
ответ при бактериальной дизентерии
При бактериальных инфекциях высока значимость фагоцитарной
системы (Маянский А.Н., 1983; Хаитов Р.М, 1991). Изучение
показателей фагоцитоза при дизентерии показало, что на протяжении
всего заболевания фагоцитарное число и фагоцитарный индекс были
значительно ниже значений здоровых лиц, а к периоду выздоровления
(4-я неделя) отмечалось достоверное снижение активности фагоцитов
по сравнению с острой фазой. Прогрессивное снижение показателей
фагоцитарной активности от 1 -й недели болезни к 4-й можно связать
с иммуносупрессирующим действием ЛПС микробов-ассоциантов, частота
выделения которых растет на 2-3-й неделе болезни.
Выявлено, что выраженное снижение фагоцитарной активности в
начале заболевания сопровождалось развитием тяжелых форм инфекции
(табл. 5). Установлено, что у больных со среднетяжелой формой
дизентерии Флекснера при высокой поглотительной способности
лейкоцитов достоверно быстрее купировались общеинфекционные
симптомы (лихорадка, интоксикационный синдром), а также
определялась тенденция к сокращению воспалительного процесса в
толстой кишке, короче был период персистенции возбудителя на
слизистой (r=0,85). Показатели фагоцитарной активности и
фагоцитарного числа при дизентерии Флекснера За были достоверно
выше, чем при дизентерии Флекснера 2а (рис. 5). Это связано с более
высокими патогенными свойствами S. flexneri 2a, которые оказывали
выраженное подавляющее действие на функцию фагоцитов на протяжении
всего заболевания.
Таблица 5. Показатели фагоцитоза
у больных дизентерией Флекснера
|
Недели болезни
|
Среднетяжелая форма
|
Тяжелая форма
|
|
ФА (%)
|
ФИ
(число клеток)
|
n
|
ФА (%)
|
ФИ
(число клеток)
|
n
|
|
1-я
|
44,4±1,9 **
|
4,4±0,2 **
|
31
|
38,2±1,7 *
|
5,2±0,2
|
9
|
|
2-я
|
42,5±1,6
|
4,3±0,4
|
25
|
40,1±2,5
|
5,5±0,5
|
7
|
|
3-я
|
38,7±2,2
|
4,1±0,3
|
23
|
Н.д.
|
Н.д.
|
0
|
|
Здо-
ровые дети
|
67,3+2,8
|
9,2±1,9
|
10
|
67,3±2,8
|
9,2±1,9
|
10
|
* Достоверное отличие от показателей на 1-й неделе болезни при Б
по крайней мере <0,05.
** Достоверное отличие от показателей при тяжелой форме при Б по
крайней мере <0,05.
Жирным шрифтом показано достоверное отличие от показателей
здоровых лиц при Б по крайней мере <0,05.
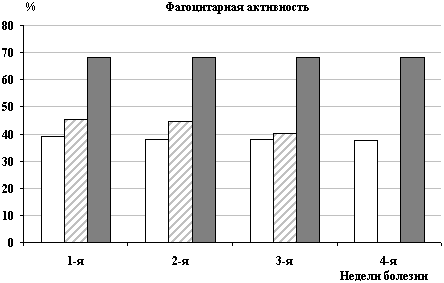
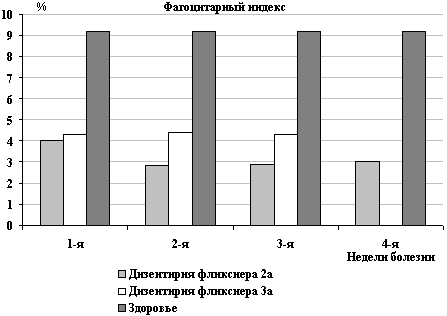
Рис. 5. Показатели фагоцитоза при дизентерии Флекснера
Кроме того, мы изучили метаболическую активность лейкоцитов
периферической крови в спонтанном и стимулированном НСТ-тесте.
Установлено, что независимо от тяжести дизентерии показатели
спонтанного НСТ-теста были достоверно ниже показателей здоровых
лиц. При среднетяжелой форме в ходе инфекционного процесса
происходила достоверная, но не достигающая «нормальных» значений
активация метаболической функции лейкоцитов, как спонтанной, так и
стимулированной. Несмотря на значительно сниженные показатели
спонтанного теста, на проведение стимулированного (эндотоксином Е.
coli) НСТ-теста фагоциты отвечали повышением поглощения
нитросинего тетразолия в 1,3-1,5 раза, что может свидетельствовать
об относительной сохранности их метаболической активности. При
тяжелых формах дизентерии показатели стимулированного НСТ-теста
оставались достоверно сниженными: 1-я неделя – 29,3±3,3%, 2-я –
27,3±1,6%, 3-я 30,3±2,7%, здоровые – 43,3±3,7% (р<0,05), по
сравнению со среднетяжелыми: 1-я неделя – 27,4±1,4%, 2-я –
31,74±1,1%, 3-я – 37,74±1,99%, здоровые 43,3±3,7% (р<0,05). Это
может быть связано с иммуносупрессирующим действием высоких доз
эндотоксина шигелл (Борисов Е.В. и др., 1997; O'Loughlin E.V. et
al, 2001).
При изучении специфического гуморального иммунного ответа у
детей с дизентерией Флекснера выявлено практически полное
отсутствие противошигеллезных AT на 1-й неделе болезни.
Максимальных значений уровни специфических AT достигали на 2-3-й
неделе болезни, с некоторым снижением к 4-й неделе заболевания.
Различий в динамике синтеза AT в зависимости от сероварианта
возбудителя выявлено не было (рис. 6). Более высокие показатели
противошигеллезных AT и в острую фазу, и в стадию реконвалесценции
определялись при тяжелых формах дизентерии (8,91+0,64 l/log2 против
7,17±0,19 l/log2 при среднетяжелых, р<0,01). Причем антительный
ответ при тяжелых формах инфекции у детей раннего возраста (1-3
года) на 1-й неделе болезни был достоверно более низким (4,32±0,05
l/log2 против 5,2±0,3 l/log2 y детей старше 7 лет, р<0,05), с
последующим ростом на 2-й неделе, причем рост продукции значительно
превышал показатели остальных возрастных групп (9,8±0,48 l/log2
против 8,5±0,4 1/log2 соответственно, р<0,05). Таким образом,
уровни специфических AT не зависят от сероварианта шигелл,
вызвавшего заболевание. При тяжелых формах инфекции имеется более
высокая продукция AT (см. табл. 6), в том числе у детей младшего
возраста, что не согласуется с литературными данными о поздней и
низкой продукции специфических AT у детей раннего возраста
(Исполатовская Э.О., 1983; Стефани Д.В., Вельтищев Ю.Е., 1996).
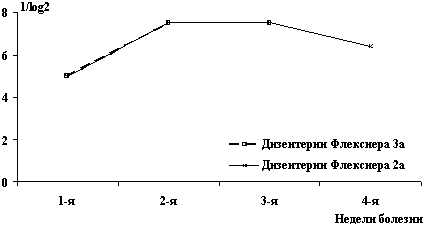
Рис. 6. Антительный ответ при дизентерии Флекснера
Нами изучен синтез специфических Ig классов A, G, М, как
системный, так и локальный. У больных, переносивших дизентерию
Флекснера За, выявлен достоверно более высокий уровень
специфического IgA в сыворотке крови на протяжении всего
заболевания, по сравнению с больными дизентерией Флекснера 2а (1-я
неделя 2,95+0,1 l/log2 против 2,3±0,2 l/log2; 2-я – 3,1±0,3 l/log2
против 2,3±0,2 l/log2; 3-я – 2,8+0,2 l/log2 против 1,8±0,3 l/log2
соответственно, при Б по крайней мере <0,05). Возможно, с этим
связано более легкое течение дизентерии Флекснера За. Возраст детей
не оказывал существенного влияния на системную продукцию
специфических AT различных классов в острую фазу инфекции. Однако к
периоду ранней реконвалесценции у детей старше 7 лет системная
продукция IgA была достоверно выше, чем у детей младшего возраста
(3,65±0,3 1/log2 против 2,7±0,2 l/log2 у детей 1-3 и 4-7 лет,
р<0,05).
Следовательно, высокий системный синтез противошигеллезного IgA,
по-видимому, является одной из составляющих, обеспечивающих более
легкое течение дизентерии Флекснера За. У детей в возрасте от 1 до
3 лет хотя и отмечена достоверно более высокая продукция
противошигеллезных AT на 2-й неделе болезни (в РНГА), но не за
счет специфических Ig класса А. Вероятно, именно с этим фактором
связано частое негладкое течение дизентерии Флекснера (41%) у
больных младшего возраста.
Локальный синтез специфических AT (SIgA, G, њ), определяемых в
копрофильтратах, на 1-й неделе болезни при среднетяжелой и тяжелой
дизентерии Флекснера однозначен (табл. 7). На второй неделе болезни
при тяжелых формах заболевания отмечен резкий рост синтеза SIgA, с
последующим резким снижением к 3-й неделе. Вероятно, при тяжелых
формах дизентерии высокая продукция секреторного IgA в
мукозноассоциированной ткани кишечника (на 2-й неделе) является
резервом, который обеспечивает санацию макроорганизма от
возбудителя в достаточно быстрые сроки, сопоставимые со
среднетяжелой формой инфекции
Показатели местного иммунного ответа при дизентерии Флекснера
имели возрастные особенности. Так, у детей в возрасте 1-3 лет
выявлена направленная супрессия синтеза SIgA, появляющаяся с конца
первой недели болезни (1,58+0,26 1/log, против 2,75±0,2 l/log2 у
детей старше 7 лет, р<0,01) и сохраняющаяся до начала 3-й недели
болезни (2,0±0,3 l/log2 против 2,95±0,31 l/log2 соответственно,
р<0,05), с некоторой активацией продукции противошигеллезных
AT класса IgA к периоду поздней реконвалесценции (2,75+0,46 l/log2
против 3,36±0,34 1/log, соответственно). Аналогичная, но менее
выраженная тенденция обнаружена и у детей в возрасте 4-7 лет. У
больных старшей группы (более 7 лет) продукция SIgA была достоверно
более высокой на начальном этапе болезни с дальнейшей активацией
синтеза в ходе инфекционного процесса.
Таким образом, для больных с дизентерией Флекснера характерен
адекватный гуморальный иммунный ответ, не зависящий от
сероварианта шигелл, более выраженный при тяжелых формах
заболевания. Дети раннего возраста отвечают на инфекцию высоким
синтезом сывороточных специфических Ig њ и G, но не класса Ig А,
что приводит к частому развитию негладкого течения. Можно
предположить, что достоверно более высокая системная продукция IgA
при дизентерии Флекснера 3а связана с меньшей выраженностью
патогенных факторов S. flexneri 3а (вероятнее всего, ЛПС), что и
обусловливает более легкое течение заболевания. Но определяющую
роль в тяжести течения, механизмах саногенеза играет не системная
продукция Ig, а синтез местных специфических SIgA, так как при
достаточно высоких уровнях специфических Ig в сыворотке крови
обнаруживаются низкие концентрации в копрофильтратах. Полученные
результаты согласуются с известными теориями автономного синтеза
Ig в мукозноассоциированной ткани (Бурмистрова А.Л., 1997; Тотолян
А.А., 1999).
Таблица 6. Уровень сывороточных противошигеллезных AT
у детей различного возраста (РНГА, l/log 2)
|
Недели болезни
|
Среднетяжелая форма
|
Тяжелая форма
|
|
1-3 года
|
4-7 лет
|
>7лет
|
1-3 года
|
4-7 лет
|
> 7 лет
|
|
1-я
|
5,2±0,4 n=14
|
4,99±0,2 n=18
|
5,0±0,2 n=35
|
4,32+0,0* n=4
|
5,0+0,3 n=7
|
5,2+0,3 n=9
|
|
2-я
|
7,3±0,7 n=4
|
6,8+0,3 n=8
|
7,3±0,2 n=20
|
9,8±0,48* n=3
|
8,5±0,4* n=5
|
-
|
|
3-я
|
7,3±0,5 n=9
|
6,6±0,4 n=8
|
7,2+0,3 n=9
|
-
|
-
|
-
|
* Достоверное отличие при p по крайней мере <0,05 по
сравнению с соответствующей возрастной группой больных
среднетяжелой формой.
Жирным шрифтом показано достоверное отличие
при p по крайней мере <0,05 по сравнению с возрастной группой
1-3 года.
Таблица 7. Локальная продукция противошигеллезных
иммуноглобулинов (1/log2)
|
Недели
|
Среднетяжелая форма
|
Тяжелая форма
|
|
N
|
SIgA
|
IgG
|
IgM
|
N
|
SigA
|
IgG
|
IgM
|
|
1-я
|
33
|
2,6±0,2
|
2,24±0,2
|
3,5±0,2
|
9
|
2,0±0,3
|
2,9±0,4
|
3,5±+0,3
|
|
2-я
|
29
|
2,7±0,2
|
3,7±0,2*
|
2,6±0,1*
|
8
|
3,7±0,3*
|
4,4±0,15
|
2,3±0,2*
|
|
3-я
|
25
|
2,3±0,1
|
3,9±0,2*
|
2,5+0,2
|
6
|
1,8±0,2
|
3,6±0,2
|
2,3±0,2*
|
|
4-я
|
15
|
3,2±0,2*
|
3,6±0,14 *
|
2,0±0,2*
|
-
|
Н.д.
|
Н.д.
|
Н.д.
|
* Достоверное отличие по сравнению с данными на первой неделе
болезни при p по крайней мере <0,05.
Жирным шрифтом показано достоверное отличие от тяжелой формы в
соответствующие сроки при p по крайней мере <0,05.
Эффективность применения
циклоферона
при дизентерии у детей
Учитывая все вышесказанное, мы использовали препарат Циклоферон
в таблетках у 22 детей (от 3 до 12 лет) в острый период
бактериальной дизентерии. Группа сравнения была репрезентативной по
полу, возрасту, срокам, форме и тяжести заболевания, проводимой
базисной терапии и состояла из 24 детей. Использование препарата
приводило к активации иммунного ответа: повышался уровень CD8+- и
СО20+-лимфоцитов по сравнению с группой больных, получавших
традиционную терапию (рис. 7). Происходила активация продукции
специфических иммуноглобулинов класса А (3,4±0,2 1/log2 против
2,5±0,3 l/log2 в группе сравнения, р<0,05) и неспецифических
иммуноглобулинов класса њ (4,3+0,1 l/log2 против 3,5+0,2 l/log2 в
группе сравнения, р<0,05). Кроме того, циклоферон оказывал
стимулирующее влияние на клеточное звено иммунного ответа, о чем
свидетельствовал более высокий уровень бласттрансформации
лимфоцитов на фитогемагглютинин.
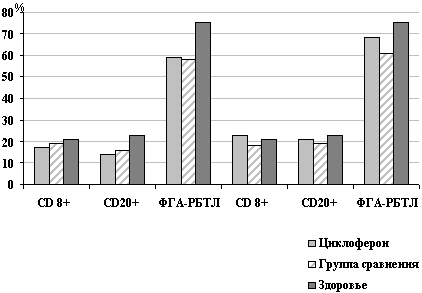
Рис. 7. Динамика иммунологических
показателей
при бактериальной дизентерии у детей
в зависимости от проводимой терапии
Клинический эффект использования циклоферона заключался в
гладком течении заболевания, причем повторного бактериовыделения ни
у одного больного зарегистрировано не было против 12,8% у больных,
получавших общепринятую терапию.
У 6 больных детей, получивших антимикробную терапию в острый
период заболевания, регистрировалось повторное выделение
возбудителя дизентерии на 10-15-й день болезни, что не
сопровождалось клиническими проявлениями. После проведения курса
циклоферона у этих пациентов отмечена в 100% случаев санация
организма от патогена.
Таким образом, полученные данные доказывают иммуномодулирующее
действие циклоферона при инвазивных кишечных инфекциях у детей.
Особую клиническую эффективность препарат оказывал на сроки
санации макроорганизма от возбудителя.
Иммунный статус и характер течения
иерсиниозной инфекции у детей
Современное клиническое течение иерсиниозной инфекции изучалось
на основании наблюдения за 152 детьми в возрасте от 2 до 14 лет. По
этиологической структуре у 65% из них был зарегистрирован
псевдотуберкулез, у 32% – иерсиниоз, а у 3% диагностирована
смешанная инфекция. Большинство обследованных переносили острые
формы заболевания, при псевдотуберкулезе такие больные составили
81,4%о, при кишечном иерсиниозе – 64,7%. Однако при иерсиниозе
частота рецидивов и затяжного течения заболевания в 2 раза
превышала таковые при псевдотуберкулезе (9,8% против 17,6% и 8,8%
против 17,6% соответственно). Для острой формы псевдотуберкулеза
было характерно острое начало заболевания с максимальной
клинической выраженностью на первой неделе болезни. Иерсиниоз в
трети случаев начинался постепенно, с нарастанием клинической
симптоматики на второй неделе заболевания. Проведенные
исследования показали, что острое течение иерсиниоза связано
преимущественно с серовариантом Y. enterocolitica O9, в то время
как затяжные и рецидивирующие формы инфекции ассоциировались, с
серовариантами Y. enterocolitica O3 и О6.
Форма и тяжесть инфекционного процесса зависит как от свойств
возбудителя, так и от иммунореактивности детей, переносящих
иерсиниозную инфекцию. Проведено сопоставление иммунологических
параметров у больных острой формой и с затяжным течением в
аналогичные сроки от начала болезни.
У детей с острым течением иерсиниозной инфекции в фазу
реконвалесценции в фенотипическом составе лимфоцитов выявлено
только увеличение числа В-лимфоцитов, а умеренно повышенное
содержание CD25+- и С095+-лимфоцитов сопряжено с высокой
пролиферативной активностью Т-лимфоцитов. Острое течение
характеризовалось также ранним и высоким антительным ответом.
При формировании затяжного течения установлены значимые
изменения во всех звеньях иммунного ответа. У детей, переносивших
затяжное течение иерсиниозной инфекции, имело место нарушение
активации Т-лимфоцитов. Так, уровень CD8+, CD25+ и CD95+ в группе
детей с затяжным течением как псевдотуберкулеза, так и иерсиниоза
ОЗ и О9 был достоверно ниже, чем у переносивших острые формы
заболевания. На протяжении первых двух недель обследования при
затяжном течении инфекции уровень ИЛ-2 был в 1,5-2 раза ниже, чем
при остром процессе. Следствием нарушения активации Т-клеток,
вероятно, была и супрессия в виде снижения ответа на ФГА, низкого
уровня ИФН-γ.
Значимым фактором при формировании затяжного течения
иерсиниозов следует считать и слабый антительный ответ у больных
этой группы. Выявлено, что титры специфических антител вне
зависимости от серотипа выделенной иерсинии на протяжении
заболевания были в 1,5-2 раза ниже, чем титры у больных,
переносивших острую форму. Недостаточность антителообразования,
по-видимому, служит причиной пролонгированной персистенции
иерсинии и индукции факторами их патогенности провоспалительного
монокина ФНО-α, уровень которого превышает таковой при острой форме
в среднем в 3 раза.
Таким образом, прогностически неблагоприятными признаками
негладкого течения иерсиниозов были: малосимптомные варианты
заболевания, начало инфекции с изолированного абдоминального
синдрома или с поражения печени. Установлены критерии негладкого
течения псевдотуберкулеза и кишечного иерсиниоза: сниженное число
CD3+ Т-лимфоцитов, отсутствие активации экспрессии CD25+ и CD95+,
сниженный ответ Т-лимфоцитов в ФГА-РБТЛ, усиление системной
продукции IL-4, повышенные концентрации общего IgE при «нормальном»
синтезе IFN-γ.
Следовательно, основные патогенетические механизмы негладкого
течения заболевания обусловлены особенностями иммунной
реактивности детей, а не вирулентными свойствами иерсиний. Это
диктует необходимость поиска иммунокорригирующих средств в
дополнение к этиотропным препаратам.
Эффективность циклоферона
у детей при псевдотуберкулезе
и кишечном иерсиниозе
Для оценки эффективности циклоферона при иерсиниозной инфекции
25 детям в острый период заболевания в комплексную терапию
заболевания была включена таблетированная форма препарата по
вышеназванной схеме. 34 ребенка с иерсиниозной инфекцией,
получавшие общепринятую этиотропную терапию, явились группой
сравнения. Группы были репрезентативны по полу, возрасту, форме и
тяжести течения заболевания.
Использование в острый период таблетированного препарата
Циклоферон приводило к значительному сокращению лихорадочного
периода и симптомов интоксикации, быстрее купировалась полиморфная
экзантема (3,5±0,2 дня против 4,9±0,5 дня, р<0,01). Длительность
стационарного лечения была достоверно более короткой в группе
больных, в комплексную терапию которых был включен циклоферон
(13,2±0,3 дня против 14,9+0,6 дня, р<0,05) (рис. 8). В процессе
катамнестического наблюдения установлено, что среди детей,
получавших в острый период циклоферон, имелась тенденция к более
редкому развитию рецидивов заболевания: 9% против 16% в группе
сравнения.
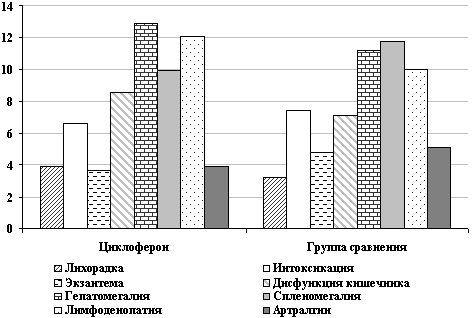
Рис. 8. Длительность основных клинических
симптомов
у больных, получавших циклоферон, и в группе
сравнения
Курсовая терапия циклофероном приводила к стимуляции иммунного
ответа – отмечался рост уровня цитотоксических лимфоцитов (CD8) и
числа клеток, несущих рецептор к интерлейкину-2 (CD25) (рис.
9).

Рис. 9. Фенотипический состав лимфоцитов и ФГА-РБТЛ
у больных иерсиниозной инфекцией
В группе детей, получавших циклоферон, уровни провос-палительных
цитокинов: ФНО-α и ИЛ-1β после терапии были достоверно ниже, чем в
группе сравнения (ФНО-α 169128 пг/мл против 280±31 пг/мл и ИЛ-1β
9,4+2,7 пг/мл против 26,1+6,3 пг/мл).
Отмечено стимулирующее влияние циклоферона на антительный ответ
(2,8±0,4 log2 против 1,54+0,3 log2 в группе сравнения, р<0,05),
но протективная роль специфических антител при иерсиниозной
инфекции остается дискутабельной. Таким образом, проведенные
исследования показали, что циклоферон обладает прямым и
опосредованным иммунотропным действием. Курсовое применение
таблетированнои формы циклоферона является эффективным при
иерсиниозной инфекции, что позволяет рекомендовать данный
препарат для предупреждения развития негладкого течения
заболевания.
Литература
- Акайзин Э.С. и др. Новые возможности оценки интоксикации и
ответной реакции клеток крови у больных с инфекционным токсикозом
// Клин. лаб. диагностика. 1998. № 3. С. 23-24.
- Беседнова Н.П., Сомов Г.П. Рецидивы псевдотуберкулеза и их
прогнозирование // Эпидемиология и инфекционные болезни. 2000.
№ 2. С. 52-56.
- Васякина Л.И. Клинические формы иерсиниозной инфекции и
механизмы иммунной защиты у детей: Автореферат дисс. . к. м. н.
СПб., 2002. 23 с.
- Владимиров Ю.А. Свободные радикалы и антиоксиданты // Вестник
РАМН. 1998. № 7. С. 43-45.
- Воскресенская Е.А., Ценева Г.Я. Иммунологические показатели при
патологии, обусловленной иерсиниозами // Ж. микробиол. 1996.
№ 5.
С. 68-73.
- Гордеец А.В., Малашенкова В.Г., Седудлина О.Ф. и др. Новое в
диагностике и лечении псевдотуберкулеза у детей // Новые
технологии в терапии и профилактике инфекционных заболеваний у
детей. СПб., 2000. С. 27.
- Гусак В.К, Фисталъ Э.Я. и соавт. Оценка тяжести интоксикации и
выбор метода детоксикационной терапии у обожженных // Клин. лаб.
диагностика. 2002. № 10. С. 36.
- Джихад Мухаммад Салих Хусейн. Роль этиопатогенетических
механизмов в обосновании антимикробной терапии дизентерии
Флекснера у детей: Автореферат дисс. ... к. м. н. СПб., 2002. 21
с.
- Добродеева Л.К, Добродеев К.Г., Миролюбова О.А. Содержание в
периферической крови СЭ95+-лимфоцитов // Иммунология. 1998.
№6.
С. 13-14.
- Железникова Г.Ф. Иммуноглобулин Е: биологическая роль при
инфекционных заболеваниях (обзор литературы) // Мед. иммунология.
2002. № 1. С. 27-32.
- Железникова Г.Ф., Иванова В.В., Васякина Л.И., Монахова Н.Е.,
Попова Н.А., Павленко М.А., Железова Л.И., Бехтерева М.К,
Тихомирова О.В. Иммунный ответ при остром псевдотуберкулезе у
детей // Мед. иммунология. 2002. Т. 4. № 1. С. 45-52.
- Исачкова Л.М., Жаворонков А.А., Антоненко Ф.Ф. Патология
псевдотуберкулеза. Владивосток, 1994.198 с.
- Исачкова Л.М., Тимченко Н.Ф., Недашковская Е.П. и др.
Патоморфологическая характеристика экспериментальной токсемии,
индуцированной термостабильным токсином Yersinia pseudotuberculosis
// Бюллетень экспер. биологии и медицины. 2000. № 11. С.
1123-1126.
- Ковальчук Л.В., Чередеев А.Н. Патогенетический принцип оценки
иммунной системы человека: дальнейшее развитие // Клин. лаб.
диагностика. 1995. № 6. С. 78-79.
- Кудрина Н.В., Беседнова Н.Н. Интенсивность катаболизма
клеточных рецепторов при кишечном иерсиниозе и псевдотуберкулезе //
Ж. микробиол. 1999. № 3. С. 65-67.
- Кудрина Н.В., Беседнова Н.Н. Роль системы комплемента в
патогенезе иерсиниозов // Ж. микробиол. 1997. № 5. С. 41-4.
- Лобзин Ю.В. Современные концепции и приоритеты терапии
инфекционных больных // Эпидемиология и инф. болезни. 1999. №
6. С. 50-54.
- Малахова М.Я. Метод регистрации эндогенной интоксикации:
Пособие для врачей. СПб., 1995.28 с.
- Малое И.В., Марамович А.С, Климов В.Т. и др. Некоторые
эпидемиологические аспекты и клинико-патогенетическая
характеристика псевдотуберкулеза в Восточной Сибири //
Патогенетические основы лечения острых инфекционных заболеваний.
М, 1999. С. 380-383.
- Маянский Д.Н, Маянская Н.Н. Биохимия воспаления. Новосибирск:
Медицина, 1995.256 с.
- Новиков Д.К. Медицинская иммунология. Минск, Витебск, 1999.
С. 80-88.
- Новые технологии в диагностике, терапии и тактике этапного
наблюдения иерсиниозной инфекции у детей / Сост. О.В. Тихомирова,
М.К. Бехтерева и др.: Учебное пособие. СПб., 2001. 32 с.
- Оберт А.С, Хилъчук В.П., Гончаренко А.И. Прогностическое
значение иммунной реактивности у детей, больных псевдотуберкулезом
// Педиатрия. 1996. № 2. С. 35-40.
- Подопригорова В.Г. Свободные радикалы и болезни человека //
Клиническая медицина. 2001. № 8. С. 66-69.
- Покровский В.И., Ющук Н.Д. Бактериальная дизентерия. М.:
Медицина, 1994. 367 с.
- Рыжикова М.А., Габитова Д.М. и др. Хемилюминес-центные методы
исследования в лабораторной диагностике // Клин. лаб. диагностика.
2001. № 11. С. 35-39.
- Соколовская Н.Е. и др. Применение спектрального анализа ВНСММ
плазмы и эритроцитов у пациентов отделения реанимации // Клин.
лаб. диагностика. 2000. № 11. С. 3.
- Сомов Г.П. Иерсиниозная инфекция на современном этапе // Ж.
микробиол. 1997. № 5. С. 7-11.
- Тихомирова О.В., Бехтерева М.К., Кветная А.С, Иванова В.В.,
Железова Л.И., Ныркова О.И. Особенности течения дизентерии
Флекснера и рациональная этиотропная терапия у детей на современном
этапе // Рос. вестник перинатологии и педиатрии. 2002. № 6. С.
46-52.
- Тотолян А.А., Фрейдлин И.С. Клетки иммунной системы (I-II).
СПб.: Наука, 1999.230 с.
- Учайкин В.Ф. Актуальные вопросы острых кишечных инфекций //
Педиатрия. 1991. № 3. С. 5-11.
- Учайкин В.Ф. Руководство по инфекционным болезням. М.:
Медицина, 1998.
- Фархутдинов Р.Р. и др. Хемилюминесцентные методы исследования
СРО в биологии и медицине. Уфа: Медицина, 1995. 192 с.
- Фрейдлин И.С. Иммунная система и ее дефекты: Руководство для
врачей. СПб.: НТФФ «Полисан», 1998. 113 с.
- Фрейдлин И.С, Назаров П.Г. Регуляторные функции
противовоспалительных цитокинов и острофазных белков // Вестник
РАМН. 1999. № 5. С. 28-32.
- Хаитов Р.М., Пинегин Б.В., Чередеев А.Н. Оценка иммунной системы
человека: современное состояние вопроса, сложности и достижения //
Иммунология. 1998. № 6. С. 8-10.
- Ценева Г.Я. Иерсиниоз и псевдотуберкулез: Пособие для врачей.
СПб., 1992. 84 с.
- Шувалова Е.П., Беляева Т.В., Осипова Г.И.
Клинико-морфологические особенности дизентерии Флекснера //
Эпидемиология и инфекционные болезни. 1997. № 6. С. 18-23.
- Шувалова Е.П., Осипова Г.И. и др. Актуальные вопросы дизентерии
и дисбиоза // Эпидемиология и инфекционные болезни. 1997. № 1. С.
44-48.
- Ющенко Г.В. Псевдотуберкулез и иерсиниоз: эпидемиологические и
экологические аспекты // Инфекции, обусловленные иерсиниями
(иерсиниоз, псевдотуберкулез), и другие актуальные инфекции. СПб.,
2000. С. 2.
- Ющук Н.Д., Розенблюм Д.Ю. и др. Клинико-морфологические
особенности шигиллеза Флекснера у больных с отягощенным
преморбидным фоном // Журн. микробиологии, эпидемиологии и
иммунобиологии. 2002. № 2. С. 77-79.
- Ярилин А.А. Основы иммунологии. М.: Медицина, 1999. 608 с.
- Mosmann T., Sad S. The expanding universe of T-cell subsets:
Th1, Th2 and more//Immunol. Todau. 1996.Vol. 17. P. 138-146.








