Министерство здравоохранения Украины
Академия Медицинских Наук Украины
Днепропетровская государственная медицинская академия
ПРОФИЛАКТИКА И КОРРЕКЦИЯ
ПОСЛЕОПЕРАЦИОННЫХ
КОГНИТИВНЫХ ДИСФУНКЦИЙ
У БОЛЬНЫХ ПОЖИЛОГО ВОЗРАСТА
(методические рекомендации)
Усенко Л.В., Ризк Шади Ейд, Криштафор А.А.,
Канюка Г.С., Кущ И.П.
Днепропетровск
2008
УДК 616.089.5–053.87/.9–02: 616.831–008.6–084–085.211
Организация-разработчик:
Днепропетровская государственная медицинская
академия,
кафедра анестезиологии и интенсивной терапии
Авторы:
Усенко Л.В., Ризк Шади Ейд, Криштафор А.А., Канюка
Г.С., Кущ И.П.
Рецензенты:
Чепкий Л.П. – профессор кафедры анестезиологии,
реаниматологии
и медицины катастроф Национального медицинского университета им.
А.А.Богомольца, заслуженный деятель науки и техники Украины,
лауреат Государственной премии Украины, д.мед.н., профессор.
Черний В.И. – член-корреспондент АМН Украины.
Заведующий кафедрой анестезиологии, интенсивной терапии ФУВ
Донецкого государственного медицинского университета им.
М.Горького, д.мед.н., профессор
Методические рекомендации утверждены на заседании Проблемной
комиссии «Анестезиология и интенсивная терапия» МЗ и АМН Украины от
23.02.07 года, протокол №1.
Голова Проблемної комісії - проф. В.В. Суслов
Секретар Проблемної комісії - В.О. Солодовніков
Оглавление
- Вступление
- Представление о когнитивных функциях
- Состояние когнитивных функций у лиц пожилого возраста
- Влияние различных видов анестезии на состояние когнитивных функций
- Понятие о фармакологической церебропротекции. Современные церебропротекторные препараты
- Общие сведения о собственных исследованиях, характеристика обследованных больных
- Характеристика периоперационного гомеостаза
- Методы исследования когнитивных функций у пожилых больных
- Исходное состояние когнитивных функций у больных с заболеваниями желудочно-кишечного тракта
- Состояние когнитивных функций при атаралгезии
- Профилактика и коррекция нарушений когнитивных функций при использовании реамберина
- Профилактика и коррекция нарушений когнитивных функций тиоцетамом
- Заключение
Вступление
Сложившаяся демографическая ситуация в современных условиях
характеризуется непрерывным увеличением числа больных пожилого и
старческого возраста [1]. Предполагается, что число лиц преклонного возраста к 2030
г. в Европе составит более 30% населения.
С повышением средней продолжительности жизни населения
цивилизованных стран пропорционально увеличивается и количество
хирургических вмешательств, выполняемых у больных в возрасте
старше 60 лет. По данным ВОЗ в 1987 г. за 10 лет их удельный вес
увеличился с 3,5% до 8% и продолжает расти [2].
Вместе с тем следует отметить, что у геронтологических больных
развиваются многочисленные возрастные изменения организма,
лимитирующие резервы кровотока в жизненно важных органах, повышая
риск развития ишемических и гипоксических повреждений, прежде всего
ЦНС, ведущих к нарушению ее когнитивных функций вплоть дo развития
деменции, что обуславливает снижение способности к обучению,
усвоению новой информации и вследствие этого уменьшению
профессиональной и социальной активности.
Мурашко Н., Паникарский В. (2004) [3] отмечают у 10-30% пожилых людей те или
иные изменения когнитивных функций центральной нервной системы.
Считается, что в норме снижение их отмечается после 50 лет.
Снижение памяти, обусловленное возрастом, наблюдается почти у 40%
лиц старше 65 лет. У 1% из них подобные нарушения прогрессируют в
течение года до степени деменции, а в течение от 1 до 5 лет такое
прогрессирование отмечается у 12-42%. Наряду с физиологическими
изменениями следует учитывать и такие заболевания, тесно связанные
с возрастом, как атеросклероз, гипертоническая болезнь и
ишемическая болезнь сердца, цереброваскулярная недостаточность,
которые могут значительно усугублять психоневрологические
расстройства, особенно при операционной травме, кровопотере и
других стрессовых ситуациях.
По данным ряда авторов различные неврологические осложнения,
характерные для больных пожилого и старческого возраста,
наблюдаются в послеоперационном периоде у 2-6% больных [2, 4].
В последние годы в литературе стали появляться сообщения о
влиянии препаратов, используемых для проведения общей анестезии, на
некоторые психические функции [5, 6]). Описаны нарушения тонких механизмов деятельности
головного мозга у экспериментальных животных под влиянием
анестетиков. В клинических условиях выявлено изменение перфузии
головного мозга при использовании средств для анестезии,
обуславливающих возникновение различных нарушений в высшей
нервной деятельности в послеоперационном периоде, что существенно
ухудшает качество жизни больных в отдаленном периоде [7].
Это обусловило интерес ученых многих стран мира к проблеме
послеоперационной когнитивной дисфункции (ПОКД) [8]. Кроме того, появились отдельные работы по изучению
состояния когнитивных функций у выживших больных, перенесших
критические состояния в отдаленном периоде [9, 10].
С этой точки зрения изучение когнитивных функций у больных
пожилого и старческого возраста при различных видах анестезии с
целью выбора таких видов, при которых когнитивные функции страдают
в меньшей степени, а также разработка методов профилактики
различных психоневрологических расстройств в послеоперационном
периоде являются актуальными задачами современной
анестезиологии.
1. Гурьянов В.А., Потемкин А.Ю., Ерошин Н.И., Потемкина О.К. Оптимизация предоперационной подготовки и профилактика гемодиамических нарушений во время анестезии у больных пожилого и старческого возраста с сопутствующей гипертонической болезнью // Анест. и реан. - №2.- 2000.- С.7-11.
2. Федоровский Н.М., Косаченко В.М., Корсунский С.Б., Кутина О.А. Мониторирование транскраниального кровотока при регионарной анестезии у лиц пожилого и старческого возраста // Российский медицинский журнал. - №3.- 2003.- С.23-26.
3. Мурашко Н., Панікарський Г. Когнітивні й емоційно-афективні порушення при дисциркуляторній енцефалопатії: клінічна характеристика та лікування // Ліки України. - №11 (88). - 2004.- С.120-121.
4. Давыдова Н.С. Влияние некоторых видов анестезии на состояние мозгового кровотока и гемодинамики у пациентов старше 65 лет // Вестн. Интенсивной терапии.- 2001.- №4.- С.67-70.
5. Давыдов В.В. Неймарк М.И., Состояние высших психических функций у больных, перенесших анестезию с применением дипривана и кетамина // Общая реаниматология. - 2005. - Т.1. - №2. - С.48-52.
6. Conet J., Raeder J., Rasmussen L.S. et all... Cognitive dysfunction after minor surgery in the elderly. Acta Anesth. Scand. - 2003. - vol.47. - №10. - p.1204 - 1210.
7. Исаев С.В., Лихванцев В.В., Кичин В.В. Влияние периоперационных факторов и выбора метода анестезии на частоту когнитивных расстройств в послеоперационном периоде. IX Cъезд Федерации анестезиологов и реаниматологов 27-29 сентября 2004г. Иркутск. С.113-114.
8. Шнайдер Н. А. Роль и место фармакологической церебропротекции в профилактике и коррекции когнитивной недостаточности: гипотезы и доказательства // Здоров'я України, 2007. - №3(160). - С.29-30.
9. Scrobik Y. An overview of delirium in the critical care setting // Geriatrics and aging. - 2003. - Vol.6, Num.10. - P.30-35.
10. Hopkins R.O., Jackson J.C. Long-term neurocognitive function after critical illness // Chest. - 2006. - Num.130. - P.869-878.
Представление
о когнитивных функциях
Когнитивные функции связаны с интегративной деятельностью
головного мозга в целом.
Под когнитивными функциями следует понимать наиболее
сложные функции головного мозга, с помощью которых осуществляется
процесс рационального познания мира [11].
К когнитивным функциям относятся:
- память,
- гнозис,
- речь,
- праксис,
- интеллект
Память – это способность головного мозга усваивать,
сохранять и воспроизводить необходимую для текущей деятельности
информацию, Выраженные нарушения памяти на события жизни принято
обозначать термином «амнезия».
Гнозисом называется функция восприятия информации, ее
обработки и синтеза элементарных сенсорных ощущений в целостные
образы. Нарушения гнозиса принято обозначать термином
«агнозия».
Речь – это способность обмениваться информацией с помощью
высказываний. Нарушение речи обозначается термином «афазия».
Праксис – это способность приобретать, сохранять и
использовать разнообразные двигательные навыки. Нарушение
праксиса обозначается термином «апраксия».
Интеллект – это способность сопоставлять информацию,
находить общее и различия, выносить суждения и умозаключения.
Интеллектуальные способности обеспечиваются интегрированной
деятельностью головного мозга в целом [11, 12, 13].
Недостаточность когнитивных функций проявляется нарушением
памяти, речи, счета, пространственно-временной ориентации,
снижением способности к абстрактному мышлению, признаками
замедления мышления.
Для оценки когнитивных функций используются нейропсихологические
методы исследования, представляющие собой различные тесты и пробы
на запоминание и воспроизведение слов и рисунков, узнавание
образов, решение интеллектуальных задач, исследование движений и
др.
Когнитивные нарушения делятся на легкие, умеренные и
тяжелые.
Под легкими когнитивными нарушениями подразумевают
невыраженные затруднения в повседневной деятельности, связанные в
основном с нарушением запоминания нового материала.
Умеренные когнитивные нарушения характеризуются
значительными затруднениями в повседневной деятельности с
сохранением памяти лишь на хорошо заученную или личную
информацию.
Тяжелые когнитивные нарушения проявляются неспособностью
запоминать новую информацию, а также воспроизводить уже
имеющуюся.
В последнее время среди легких когнитивных нарушений в пожилом
возрасте выделяют нарушения, которые определяются относительно
новым термином – умеренные когнитивные расстройства (УКР).
Под этим термином принято понимать нарушение памяти и других высших
мозговых функций, как правило, у пожилого человека, которые выходят
за рамки возрастной нормы, но не приводят к социальной дезадаптации
(развитию деменции) [14].
Термин «умеренные когнитивные расстройства» (англ.: mild
cognitive impartment) был включен в Десятый пересмотр Международной
классификации болезни, как самостоятельная диагностическая позиция
[14].
Согласно рекомендациям МКБ-10 такой диагноз может быть выставлен
при наличии следующих проявлений [15]:
- снижение памяти, внимания или способности к обучению;
- жалобы больного на повышенную утомляемость при выполнении
умственной работы;
- нарушения памяти и других высших мозговых функций не вызывает
деменцию и не связаны с делирием;
- указанные расстройства имеют органическую природу.
Умеренные когнитивные расстройства, по определению, не связаны
только с возрастными изменениями головного мозга или с
дисметаболическими расстройствами, вторичными по отношению к
соматическим заболеваниям или эндогенным интоксикациям. Этот
термин также не приложим к психогенным когнитивным нарушениям в
рамках депрессии или других психических расстройств, не имеющих
известной органической природы.
По некоторым данным распространенность умеренных когнитивных
расстройств колеблется в пределах от 40 до 80% в зависимости от
возраста [16], но
требует дальнейшего уточнения.
Сведения о частоте встречаемости синдрома УКР в пожилом возрасте
в настоящее время базируются в основном на результатах двух больших
эпидемиологических исследований, проведенных в Канаде и Италии:
Канадское исследование Здоровья при Старении (Canadian Study of
Health and Aging, 1997) и Итальянское Лонгитюдинальное Исследование
Старения (Italian Longitudinal Study of Aging, 2000).
Этими исследованиями были выявлены у 11-17% пожилых и старых
людей когнитивные нарушения, которые выходили за пределы возрастной
нормы, но не достигали выраженной деменции. Согласно полученным
данным риск развития синдрома УКР в возрасте старше 65 лет в
течение одного года составляет 5%, за 4 года наблюдения – 19%. При
этом в большинстве случаев это состояние носило прогрессирующий
характер. Наблюдение за пациентами с выявленным синдромом УКР
показало, что у 15% из них в течение одного года развивается
деменция, что было достоверно чаще, чем в общей популяции пожилых
людей. За 4 года наблюдения синдром УКР трансформировался в
деменцию в 55-70% случаев [17].
Приведенные выше данные указывают на важность оценки когнитивных
функций у больных пожилого возраста, особенно в случаях, когда они
подвергаются оперативному вмешательству или воздействию другого
стрессового фактора. Это может усугублять уже имеющиеся исходные
нарушения и сопровождающиеся развитием послеоперационной
когнитивной дисфункции (ПОКД) в ближайшем послеоперационном периоде
с ухудшением качества жизни больного в отдаленном периоде [8].
Высказанное обуславливает необходимость не только выбора
наиболее оптимальных вариантов анестезии, но и проведения
профилактических мер, направленных на сохранение исходного
состояния когнитивных функций, а также своевременной коррекции их в
случае развития когнитивной дисфункции.
11. Lezak M.D. Neuropsychology assessment // N.Y. University Press. - 1983. - P.768.
12. Лурия А.Р. Высшие корковые функции человека // М.: Изд-во МГУ, 1969.
13. Лурия А.Р. Основы нейропсихологии // М.: Изд-во МГУ, 1973.
14. Яхно Н.Н., Захаров В.В. Легкие когнитивные расстройства в пожилом возрасте // Неврологический журнал. - 2004. - Т.9, №1. - С.4-8.
15. Международная статистическая классификация болезней и проблем, связанных со здоровьем. Десятый пересмотр (МКБ-10). Женева, ВОЗ. - 1995. - 317 с.
16. Larrabee G.J., Crook T.M. Estimated prevalence of age associated memory impartment derived from standartized test of memory function // Int. Psychogeriatr. - 1994. - V.6. - No.1. - P.95-104.
17. DiCarlo A., Baldereschi M., Amaducci L. et al. Cognitive impartment without dementia in older people: prevalence, vascular risk factors, impact on disability. The Italian Longitudinal Study on Aging // J. Am. Ger. Soc., 2000. - V.48. - P.775-782.
Состояние когнитивных функций
у лиц пожилого возраста
Многочисленные экспериментально-психологические исследования и
клинические наблюдения свидетельствуют о том, что в процессе
старения развиваются закономерные обменные, структурные и
функциональные изменения психики и поведения человека.
Неравномерными и разнонаправленными являются изменения обмена
веществ и энергии. Они сопровождаются снижением адаптационных
возможностей стареющего организма.
Первичные механизмы старения связаны с изменениями в процессе
синтеза белка: уменьшается количество метаболически активных
белков, увеличивается масса метаболически инертных белков, что
наряду с другими изменениями в белковом обмене создает основу для
нарушения ряда метаболических циклов.
При старении происходят неспецифические изменения в обмене
углеводов, механизмы которых связаны с изменением активности
гликолитических ферментов.
Нарушения в обмене липидов, возникающие в процессе старения,
способствуют развитию атеросклероза [18].
Неуклонно с возрастом снижается величина основного обмена,
повышается чувствительность и снижается устойчивость к недостатку
кислорода.
Весь этот комплекс изменений в обмене веществ и энергии
ограничивает функциональные возможности клеток, в конечном итоге
приводит к их деструкции и гибели, что обуславливает развитие
недостаточности органов, особенно при повышенной нагрузке.
Старение сопровождается серьезными изменениями со стороны
центральной нервной системы. В отдельных областях коры головного
мозга к старости на 30-40% уменьшается число нейронов. Уменьшение
количества рецепторов в клетках является одной из причин нарушения
межклеточных взаимоотношений.
Анатомически отмечается уменьшение массы и объема головного
мозга, линейных размеров коры и его ганглиев. Нарастает количество
глиальных клеток в сером веществе и снижение их в белом веществе
мозга. Изменяется структура митохондрий.
Предполагается, что в основе физиологических изменений со
стороны высших мозговых функций лежат, прежде всего, изменения
церебральных метаболических процессов, связанных с гормональной
перестройкой [19].
При развитии дисметаболических нарушений в организме,
нейродегенеративных изменений в ЦНС, особенно на фоне мозговой
сосудистой недостаточности, снижается надежность механизмов
саморегуляции, ограничиваются приспособительные возможности
стареющего организма, что и обуславливает развитие когнитивных
расстройств в пожилом возрасте.
Наиболее существенными изменениями в состоянии психики,
вызываемыми старением, является снижение психической активности:
замедление темпа психической деятельности, затруднение восприятия и
сужение его объема, ухудшение способности сосредоточения внимания
и его переключения, замедление психологических реакций.
Ослабевают наиболее сложные стороны психической деятельности –
способность к абстрагированию и интегрированию. Усиливается
психическая ригидность. Появляются возрастные эмоциональные
изменения. Так, у 10% мужчин и у 15% женщин в возрасте старше 65
лет определяется депрессия [20].
Неоднозначный характер имеют нарушения памяти в пожилом
возрасте. Наряду с незначительным возрастным снижением
кратковременной памяти регистрируются довольно значительные
изменения в долговременной памяти, связанные с ухудшением
обработки информации. Появляющиеся с возрастом трудности в
мнестической сфере возникают обычно при оперировании большими
объемами информации или при одновременной работе с несколькими
источниками информации, что затрудняет обучение пожилых людей новым
навыкам [21].
Исследование способности запоминания последовательности слов в
возрастной группе от 50 до 85 лет показывает, что значительное
снижение функции памяти характерно для начального этапа старения
(от 50 до 65 лет). Пожилые люди в возрасте от 65 до 75 лет
обнаруживают лучшие показатели памяти, приближающиеся к уровню
среднего возраста [18]. На разных возрастных этапах пожилые люди
выбирают разные стратегии компенсации снижения мнестических
способностей. В группе от 51 до 60 у испытуемых преобладает
установка на точность воспроизведения, лица старше 81 года
стремятся путем проговаривания устанавливать связь между элементами
словесного ряда и логически структурировать материал.
Снижение памяти в пожилом возрасте сочетается с рядом других
изменений со стороны когнитивных функций. Это, прежде всего, время
реакции, утомляемость при умственных упражнениях и другие.
Пожилые люди практически не отмечают ухудшения в отношении
заданий на концентрацию внимания. В то же время, при исследовании
избирательного и распределенного внимания у пожилых людей
обнаруживалось выраженное снижение этих показателей. Возрастные
различия усиливаются по мере усложнения задания, если требовалось
распределение внимания между двумя и более стимулами [22]. С возрастом снижается
количество правильных ответов в тестах на интеллект.
Таким образом, нарушение когнитивных функций в пожилом возрасте
является одной из актуальных медицинских и социальных проблем,
требующих активного изучения и поиска эффективных средств их
профилактики и лечения. Своевременная профилактика и коррекция
когнитивных расстройств при хирургических методах лечения,
различных критических состояниях позволяет упредить их развитие или
усугубление глубины нарушений. Это не только улучшает течение
раннего послеоперационного или посткритического периода, но и дает
возможность заметно повысить качество жизни больных в отдаленном
периоде, продлить время их функциональной самостоятельности,
уменьшить экономическое и социальное бремя, которое ложиться на
родственников больных и общество [23].
18. Фролькис В.В. Физиологические механизмы старения // Физиологические механизмы старения. Л., 1982.
19. Захаров В.В., Дамулин И.В. Диагностика и лечение когнитивніх нарушений у пожиліх / Метод. реком. под ред. Н.Н.Яхно. М.: ММА им. И.М.Сеченова. - 2000.
20. Чепкий Л.П., Усенко Л.В. Геріатрична анестезіологія та реаніматологія. К.: Здоровя. - 1994. - 256 с.
21. Яхно Н.Н., Лавров А.Ю. Изменения центральной нервной системы при старении // Нейродегенеративные болезни и старение (руководство для врачей) под ред. И.А.Завалишина, Н.Н.Яхно, С.И.Гавриловой. М.: - 2003. - С.242-261.
22. Корсакова Н.К. Нейропсихология позднего возраста: обоснование концепции и прикладные аспекты // Вестник Моск. ун-та. Сер.14, Психология. - 1996. - №2.
23. Захаров В.В., Яхно Н.Н. Нарушение памяти . М.: ГЕОТАР Мед. - 2003. - 150 с.
Влияние различных видов анестезии
на состояние когнитивных функций
В настоящее время изучению влияния различных препаратов и видов
анестезии на состояние когнитивных функций уделяется всё большее
внимание. Это связано с представлением о том, что любые препараты,
оказывающие угнетающее воздействие на деятельность центральной
нервной системы, могут приводить к когнитивной дисфункции той или
иной степени выраженности и продолжительности.
В последние годы в литературе появились публикации о
психоповреждающем действии препаратов, используемых для
проведения общей анестезии [5, 6, 24]. Описаны нарушения тонких механизмов
деятельности мозга у экспериментальных животных под влиянием
анестетиков. В клинических исследованиях выделено ряд причин,
обуславливающих при использовании средств для анестезии,
возникновение различных расстройств высшей нервной деятельности в
послеоперационном периоде: изменение перфузии мозга и
внутричерепного давления [25], гипокапния [26], остаточное действие компонентов общей анестезии и
продуктов их биодеградации, нарушение реологических свойств крови
и др. Среди факторов риска развития нарушений высших психических
функций указываются возраст больных, вид и продолжительность
анестезии [6, 26, 27]. Согласно вышеуказанным исследованиям отмечены ухудшение
памяти и внимания, снижение качества трудовой практики и
способности к обучению, развитие и усиление депрессии. Авторы
сообщают, что эти проявления встречаются у 6,8-19,2% больных и
могут удерживаться в течение 10-90 дней после перенесенной общей
анестезии.
Принципиальное значение при изучении влияния анестетиков на
головной мозг придается поиску таких, которые не только не
оказывали на него повреждающее действие или были индифферентными,
но и обладали церебропротективным действием [28].
При этом следует исходить из того, что мозг является
метаболически очень активным органом. Потребление им кислорода
составляет 3,5-4 мл/100 г/мин. 50% всей энергопродукции расходуется
на обеспечение электрической активности нейронов, оставшиеся 50%
расходуются на поддержание базального клеточного гомеостаза.
Изучение способности анестетиков оказывать церебропротективное
действие основывается на их возможности подавлять спонтанную
электрическую активность нейронов и тем самым уменьшать
энергопотребление, а следовательно, и восприимчивость мозга к
гипоксии с большей вероятностью сохранности его функций, особенно
коры головного мозга.
Одними из первых исследований состояния когнитивных функций в
послеоперационном периоде были исследования при
кардиохирургических операциях [29]. Предполагалось, что когнитивные дисфункции у
больных после таких операций развиваются вследствие церебральной
эмболии и отека головного мозга, однако этот вопрос остается
дискутабельным.
В серии работ В.В. Давыдова и М.И. Неймарка приведены результаты
исследований влияния некоторых общих анестетиков на когнитивные
функции больных при плановых оперативных вмешательствах, не
связанных с нейрохирургическим или кардиохирургическим профилем,
при которых существует значительный риск ишемического повреждения
головного мозга [4, 5, 25]. В одной из них у 434 больных,
перенесших плановую операцию по поводу фибромиомы тела матки, было
изучено влияние тотальной внутривенной анестезии у 3 групп больных:
с включением кетамина, дипривана, нейролептаналгезии. У больных
исследовались типологические свойства нервной системы, баланс и
подвижность нервных процессов; по общепринятым психометрическим
методикам изучались такие характеристики высших психических
функций, как объем, концентрация и переключение внимания, его
избирательность, оперативная и кратковременная память, логическое
мышление, интеллектуальная лабильность.
Выявлены различия во влиянии изучаемых видов анестетиков на
состояние когнитивных функций в зависимости от типа нервной
системы. Наиболее когнитивсберегающим эффектом обладал
диприван.
Ряд авторов указывает на отсутствие разницы в угнетении
когнитивных функций при применении общей и эпидуральной анестезии.
Так, S.Newman с соавторами описали когнитивные дисфункции равной
степени через несколько недель после некардиохирургических операций
в условиях как эпидуральной, так и общей анестезии [30].
В эксперименте на животных Bianchi S.L. с соавторами, исследовав
влияние анестезии ингаляционными анестетиками, пришли к заключению,
что у животных, подвергнутых анестезии изофлюраном или галотаном,
увеличивалась представленность в мозгу І-амилоида, вещества,
связанного с развитием болезни Альцгеймера. У генетически
модифицированных мышей с предрасположенностью к выработке
І-амилоида после повторяющейся общей анестезии имело место
повышение его уровня. У нормальных мышей снижение когнитивных
функций и запоминания проходило без повышения уровня І-амилоида [31].
В то же время другие авторы сообщают об отсутствии влияния
севофлюрана на когнитивные функции [32]. Более того, М.И.Неймарк с соавт. при
анестезии севофлюраном выявили его нейропротекторный эффект при
реконструктивных операциях на сонных артериях [33].
Chen X. с соавторами при изучении влияния дезфлюрана и
севофлюрана на когнитивные функции у пожилых больных при операциях
на коленном суставе и бедре, обнаружили равнозначное угнетение
когнитивных функций в первые 3 часа с полным восстановлением к 6
часу после операции [34].
T.Monk с соавт. (2008) при изучении состояния когнитивных
функций при плановых гинекологических операциях у более, чем 1000
больных различного возраста отметили, что спустя 3 месяца после
перенесенного оперативного вмешательства у больных старше 60 лет
пролонгированная послеоперационная когнитивная дисфункция
развивалась в 2 раза чаще, чем в других возрастных группах, и
ассоциировалась с операционной травмой и анестезией. Одной из
причин ПОКД авторы предполагают развивающееся воспаление в головном
мозге [35].
Таким образом, анализ современного состояния вопроса показал,
что различные общие анестетики оказывают психоповреждающее
действие, проявляющееся в послеоперационном периоде в виде
когнитивных дисфункций.
Согласно определения, данного L.S.Rasmussen в 2001 году,
послеоперационная когнитивная дисфункция (ПОКД) – это когнитивное
расстройство, развивающееся в ранний и сохраняющееся в поздний
послеоперационный период, клинически проявляющееся нарушениями
памяти и других высших корковых функций (мышления, речи), а также
трудностями концентрации внимания, подтвержденное данными
нейропсихологического тестирования (в виде снижения показателей
тестирования в послеоперационном периоде не менее, чем на 10% от
дооперационного уровня), что влечет за собой проблемы обучения,
снижения умственной работоспособности и настроения.
Рядом исследователей показано, что риск развития ПОКД
ассоциируется с нейротоксическим эффектом общей анестезии и
коррелирует с её продолжительностью. Этому риску наиболее
подвержены дети и люди пожилого возраста.
Истинное распространение ПОКД в Европейских странах было изучено
в крупнейшем эпидемиологическом исследовании International Study of
Postoperative Cognitive Dysfunction, проведенное в 2 этапа: в
1994-1998 и 1998-2000 годах. Анализировались случаи рутинных
оперативных вмешательств, выполненных в условиях общей анестезии,
исключая кардиохирургические операции и операции на головном мозге.
В результате было установлено, что ранняя послеоперационная
когнитивная дисфункция имела место у 35% больных моложе 40 лет и у
69% больных старше 60 лет. При этом стойкая ПОКД отмечена у 6,7%
лиц молодого и 24% пожилого возраста.
Развитие когнитивного дефицита на фоне общей анестезии связывают
с повреждениями отделов мозга, отвечающих за функцию памяти, исходя
их того, что при послеоперационной когнитивной дисфункции в первую
очередь появляются нарушения краткосрочной памяти и устойчивости
внимания.
Патофизиологические механизмы ПОКД и идентификация
морфологического субстрата этого состояния изучалась в
многочисленных экспериментах.
При проведении перфузионной магнито-резонансной томографии у 20
здоровых добровольцев, выполненной в состоянии общей анестезии
исследуемых (без оперативного вмешательства), было установлено
снижение перфузии крови во фронтальной коре, височной доли и
гипокампе (цит. по Н.А. Шнайдер, 2007).
На сегодня отмечено, что выраженность послеоперационной
когнитивной дисфункции со временем не уменьшается и может
прогрессировать, что большинство исследователей связывают с
инициацией отсроченного апоптоза нейронов препаратами для общей
анестезии.
К настоящему времени расшифрованы некоторые механизмы влияния
отдельных анестетиков и сопутствующих средств на процесс
жизнедеятельности нервных клеток и когнитивную функцию. Так,
пропофол, барбитураты, бензодиазепины, изофлюран, галотан
подавляют нейрональную активность через гамма-аминомасляную
кислоту. Кроме того, барбитураты вызывают дисфункцию митохондрий,
потенцируя эксайтотоксичность глутамата.
Кетамин, закись азота, ксенон воздействуют на NMDA-рецепторы.
Доказана способность анестетиков модулировать секрецию цитокинов
для системного применения.
Важно помнить, что выживание нейронов зависит от постоянного
присутствия в межклеточном пространстве большого количества
разнообразных сигнальных молекул (нейропептидов, цитокинов,
гормонов и др.). Нейроны, лишенные такого окружения в силу
экзогенных или эндогенных причин, активируют генетическую
программу апоптоза.
Вместе с тем, несмотря на то, что некоторые механизмы развития
послеоперационной когнитивной дисфункции известны, способы защиты
головного мозга при ПОКД в клинической практике не разработаны.
Одним из перспективных направлений в этом отношении является
применение препаратов с нейропротективной и нейротрофической
активностью. Однако это нашло подтверждение лишь в единичных
экспериментальных исследованиях. Так, в эксперименте на белых
крысах, которым в течение 1 часа проводился наркоз кетамином, было
показано, что применение в качестве нейропротектора
церебролизина оказалось эффективным способом профилактики
послеоперационной когнитивной дисфункции.
Отсутствие в доступной литературе клинических работ при
возрастающей потребности практического здравоохранения в методах
защиты головного мозга во время анестезии делают актуальной
разработку методов фармакологической профилактики и коррекции
такого серьезного осложнения, как послеоперационная когнитивная
дисфункция.
24. Шнайдер Н.А., Шпрах В.В., Салина А.Б. Послеоперационная когнитивная дисфункция (диагностика, профилактика, лечение). // Конференция "Новые компьютерные технологии". Красноярск.2005. - 95 с.
25. Давыдова Н.С. Возможные критерии прогноза нарушений мозгового кровообращения при анестезии // Вестн. Интенс. Терап. 2004. - №5. - С.232-234.
26. Rasmussen L.S., Jonson T., Kuipers H.M. et al. Does anesthesia caese postoperative cognitive disfunction? A randomized study of regional versus general anesthesia in 438 elderly patients // Acta Anesth. Scand. 2003. - V.47. - No.9. - P.1188-1194.
27. Кичин В.В., Исаев С.В., Лихванцев В.В. Влияние некоторых препаратов для анестезии на частоту когнитивных расстройств в послеоперационном периоде / Сб. трудов IX съезда Федерации анестезиологов и реаниматологов России. Иркутск. 2004. - С.124-125.
28. Патель Пиюш Защита мозга - клиническая реальность // Актуальные проблемы анестезиологии и реаниматологии. Освежающий курс лекций. Архангельск. - 2006. - С.172-177.
29. Savageau J.A., Stanton B., Jenkins C.D., Klein M.D. Neuropsychological dysfunction following elective cardiac operation. Early assessment // J Thorac Cardiovasc Surg. - 1982. - Vol.84. - P.585-594.
30. Newman S., Stygall J., Hirani S., Shaefi S., Maze M. Postoperative cognitive dysfunction after noncardiac surgery: a systematic review // Anesthesiology. - 2007. - Vol.106(3). - P.572-590.
31. Bianchi S.L., Tran T., Liu C., Lin S., Li Y., Keller J.M., Eckenhoff R.G., Eckenhoff M.F. Brain and behavior changes in 12-month-old Tg2576 and nontransgenic mice exposed to anesthetics. // Neurobiology of Aging. - 2007.
32. Kadoi Y., Goto F. Sevoflurane anesthesia did not affect postoperative cognitive dysfunction in patients undergoing coronary artery bypass graft surgery // Journal of Anesthesia. - Vol.21, N3. - 2007
33. Неймарк М.И., Шмелев В.В., Симагин В.Ю. и др. Оценка степени мозгового повреждения при общей анестезии в реконструктивной хирургии сонных артерий / Сб. докл. IV съезда анестезиологов и реаниматологов Запада России. С-Пб, 2007. - С.138-139.
34. Chen X., Zhao M., White P.F. et al. The recovery of cognitive function after general anesthesia in elderly patients: a comparison of desfluran and sevofluran // Anesth. Analg. - 2001. - No.93. - P.1489-1494.
35. Monk T. Older surgical patients at greater risk for developing cognitive problems // HealthNewsDigest.com, 2008.
Понятие о фармакологической церебропротекции.
Современные церебропротекторные препараты
Со второй половины ХХ века усилился интерес к проблеме нарушений
высших нервных функций. С каждым годом актуальность этой проблемы
возрастает, что вызвано рядом факторов:
- значительным ростом цереброваскулярных заболеваний, в структуре
которых согласно эпидемиологических исследований 67% занимает
дисциркуляторная энцефалопатия (Козачек Н.Н. с соавт., 2006);
- увеличением числа лиц пожилого возраста с проявлением у них
нейродегенеративных изменений;
- всё расширяющимся спектром экстремальных воздействий и других
заболеваний, сопровождающихся развитием нарушений основных
когнитивных функций вплоть до деменции;
- тревожные сообщения о появлении при хирургическом лечении
больных послеоперационной когнитивной дисфункции, значительно
ухудшающей течение раннего послеоперационного периода и качество
жизни больного в отдаленном периоде.
Для защиты головного мозга от экзогенных и эндогенных
повреждающих факторов используется целый арсенал фармакологических
препаратов, имеющих разные точки приложения и обладающих
разнообразными эффектами, объединенными под общим понятием ноотропы
[36]. Основной целью применения этих препаратов
изначально считалась нейропротекция.
В настоящее время представление о препаратах, способных
предотвратить или уменьшить повреждение ЦНС, развивающееся
вследствие воздействия на нервную систему различных токсических
факторов, стало шире, чем нейропротекция. Ряд авторов считают, что
более точным, чем нейропротекция, является термин церебропротекция
[36], так как для сохранения функции мозговой ткани необходима
защита всех клеток, включая глию и эндотелий сосудов (рис.1).
Различают первичную и вторичную церебропротекцию. Первичная
церебропротекция направлена на прерывание или уменьшение
ранних патобиохимических реакций (глутамат-кальциевого,
простагландин-тромбоксанового каскадов, оксидативного стресса), а
вторичная – на коррекцию последствий изменений гомеостаза и
метаболизма клеток нервной системы в остром периоде [37]. В последнее время
вторичную церебропроотекцию стали рассматривать как
цереброресусцитацию и в целом используют следующие термины:
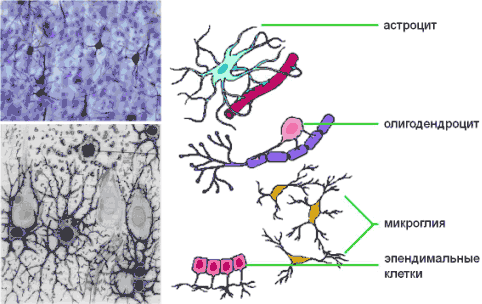
Рис. 1. Глиальные клетки – важная составная часть
мозговой ткани.
Церебропротекция – комплекс мероприятий, направленных на
поддержание метаболизма мозговой ткани на уровне, обеспечивающем
её жизнеспособность и защиту от структурных повреждений вследствие
воздействия повреждающих факторов, конечной целью которого является
предотвращение неврологического дефицита и сбережение когнитивных
функций.
Цереброресусцитация – комплекс мероприятий, направленных
на наиболее полное восстановление всех мозговых структур,
деятельность которых была нарушена в результате воздействия
повреждающих факторов в остром периоде и имеющих конечной целью
ликвидацию или ограничение неврологического дефицита,
восстановление нарушенных когнитивных функций.
Цереброреконвалесценция – комплекс мероприятий,
направленных на устранение неврологического дефицита и когнитивных
дисфункций с использованием медикаментозных, физиотерапевтических,
психофизиологических методов стимуляции высших мозговых функций в
периоде восстановления, конечная цель которого предусматривает
полное восстановление неврологической и когнитивной составляющей
качества жизни больного.
Дальнейшим развитием теории церебропротекции явилась методика
управляемой нейрометаболической цитопротекции, предложенная
В.И. Ершовым и В.В. Бурдаковым (2004), которая состоит в
проведении мероприятий по защите головного мозга под контролем и в
зависимости от значений амплитуды ЭЭГ [38].
Для церебропротекции широко используются ноотропные препараты,
которые оказывают специфическое влияние на высшие интегративные
функции мозга, улучшают память, облегчают процесс обучения,
стимулируют интеллектуальную деятельность, повышают устойчивость к
повреждающим факторам, улучшают кортикально-субкортикальные связи.
Они способны улучшать когнитивные (познавательные) функции как у
здоровых людей, так и в особенности при различных их
расстройствах.
По определению ВОЗ ноотропные препараты – это средства,
оказывающие прямое активирующее влияние на когнитивные функции, а
также повышающие устойчивость мозга к агрессивным воздействиям.
Основы ноотропной концепции сформировались к 80-м годам прошлого
столетия, когда после успешного внедрения в клиническую практику
первого препарата этого класса – пирацетама начали появляться
другие препараты пирролидонового ряда и других семейств
ноотропов, включающих холин-, ГАМК- и пептидергические и другие
вещества, что значительно расширило представление о ноотропах.
Все лекарственные препараты ноотропного действия делят на две
большие группы:
- ноотропы прямого действия с доминирующим мнестическим
эффектом;
- ноотропы смешанного типа с широким спектром действия,
получившие название нейропротекторы [39].
Наиболее полно классификация ноотропныех препаратов представлена
Т.А. Ворониной, С.Б. Середениным (1998):
1. Ноотропные препараты с доминирующим мнестическим эффектом
(cognitive enhancers):
1.1. Пирролидоновые ноотропные препараты (рацетамы),
преимущественно метаболитного действия (пирацетам, оксирацетам,
анирацетам, прамирацетам, этирацетам, дипрацетам, ролзирацетам,
небрацетам, изацетам, нефирацетсил, детирацетам и др.).
1.2. Холинергические вещества:
1.2.1. Активаторы синтеза ацетилхолина и его выброса (холин
хлорид, фосфотидил-серин, лецитин, ацетил-L-карнитин, ДЮП-986,
производные аминопиридина, ZК9346-бетакарболин и др.).
1.2.2. Агонисты холинергических рецепторов (оксотреморин,
бетанехол, пиропиперидины, хинуклеотиды и др.).
1.2.3. Ингибиторы ацетилхолинэстеразы (физостигмин, такрин,
амиридин, эртастигмин, галантамин, метрифонат, велнакрин
малеат).
1.2.4. Вещества со смешанным механизмом (деманол ацеглюмат,
салбутамин, бифемелан, инстенон).
1.3. Нейропептиды и их аналоги (АКТГ 1–10 и его фрагменты,
эбиратид, соматостатин, семакс, вазопрессин и его аналоги,
тиролиберин и его аналоги, нейропептид Y, субстанция Р,
ангиотензин-П, холецистокинин-8, пептидные аналоги пирацетама
(ГВС-111), ингибиторы пролилэндопептидазы).
1.4. Вещества, влияющие на систему возбуждающих аминокислот
(глутаминовая кислота, мемантин, милацемид, глицерин,
Д-циклосерин, нооглютил).
2. Ноотропные препараты смешанного типа с широким спектром
эффектов («нейропротекторы»):
2.1. Активаторы метаболизма мозга (актовегин, ацетил-L-карнитин,
карнитин, фосфатидил, серин, эфиры гомопантотеновой кислоты,
ксантиновые производные пентоксифиллина, пропентофиллин,
тетрагидрохинолины).
2.2. Церебральные вазодилятаторы (инстенон, винкамин,
винпоцетин, оксибрал, ницерголин, винконат, виндебумол).
2.3. Антагонисты кальция (нилюдипин, циннаризин, флунаризин и
др.).
2.4. Антиоксиданты (мексидол, эксифон, пиритинол, тирилазад
месилат, меклофеноксат, атеровит (альфа-токоферол и меклофеноксат)
и др.).
2.5. Вещества, влияющие на систему ГАМК (фенотропил, гаммалон,
гопантеновая кислота, пикамилон, дигам, никотинамид, фенибут,
натрия оксибутират, нейробутал и др.).
2.6. Вещества из разных групп (этимизол, оротовая кислота,
метилглюкооротат, оксиметацил, беглимин, нафтидрофурил,
цереброкраст, препараты женьшеня, лимонника, экстракт гинкго
билоба и др.) [40].
Несмотря на то, что ноотропные препараты являются производными
различных химических групп, все они обладают положительным
ноотропным действием и у них отсутствуют ярко выраженные эффекты
психотропных и кардиотропных препаратов. Для ноотропов также
свойственна низкая токсичность и отсутствие выраженных побочных
эффектов даже в субтоксических дозах, за исключением некоторых
холинергических препаратов.
В основе нейропротекторного терапевтического действия ноотропных
препаратов лежат следующие механизмы:
- коррекция энергетического обмена путем снижения повреждающего
действия гипоксии уменьшения энергетической потребности
нейронов;
- активация пластических процессов в ЦНС за счет усиления синтеза
РНК и белков;
- стимуляция окислительно-восстановительных процессов и усиление
утилизации глюкозы;
- уменьшение интенсивности свободно-радикального перекисного
окисления липидов;
- стимуляция системы нейротрансмиттеров и нейромодуляторов;
- торможение высвобождения возбуждающих медиаторов (глутамат,
аспартат), обладающих эксайтотоксическим действием.
В целом можно сказать, что ноотропные препараты обладают
активирующим действием на церебральный метаболизм и высшие
психические функции.
Именно влияние на биохимические процессы, лежащие в основе
реализации интеллектуально-мнестических функций, является главной
принципиальной особенностью их действия, что обеспечивает
регуляцию познавательных процессов обучения, памяти – основы
высшей нервной деятельности человека. Механизмы реализации
ноотропов близки к естественным и отражают их нейрометаболическое
действие.
Кроме того, они обладают сосудистым действием, обусловленным
улучшением микроциркуляции и реологических свойств крови.
Основная область применения ноотропов у здоровых людей –
профилактика стрессогенных состояний путем поддержания умственной
и физической работоспособности при критических состояниях и в
условиях хронического психоэмоционального воздействия.
Они показаны при различных формах нарушения мозгового
кровообращения (инсульт, дисциркуляторная энцефалопатия,
преходящее нарушение мозгового кровообращения); при поражениях
мозга дегенеративного характера (деменция, ранние стадии болезни
Альцгеймера), в том числе возрастные нарушения интегративной
функции мозга и памяти; последствиях черепно-мозговой травмы и
инфекционно-воспалительных заболеваниях мозга в период
реабилитации; алкогольной энцефалопатии; задержке психического
развития детей и др. [39].
Среди всех ноотропных препаратов наибольшей широтой
фармакологического спектра ноотропной активности обладает
пирацетам, основной механизм действия которого связан с изменением
метаболических и биоэнергетических процессов в нервной клетке,
повышении скорости оборота информационных макромолекул, активацией
синтеза белка [36].
Подавляющее большинство ноотропов – монокомпонентные препараты с
каким-либо преимущественным эффектом. В связи с этим в последнее
время на фармацевтическом рынке появились новые генерации
лекарственных средств с комбинированным ноотропным, вазоактивным,
полинейромедиаторным, нейропротективным, антиоксидантным и иным
позитивным действием.
Эти комбинированные препараты создаются не только на основе
оригинальной химической субстанции, но и в комбинации ноотропа с
препаратами, усиливающими или дополняющими его позитивные
свойства.
Многокомпонентность их действия наряду с улучшением когнитивных
функций расширяет компенсаторные возможности, повышает устойчивость
организма к вредным воздействиям, в том числе и операционной
травме.
В настоящее время в странах СНГ и Евросоюза зарегистрированы
четыре ноотропных препарата, представляющие собой комбинации
пирацетама с диазепамом (диазепам), с оротовой кислотой
(ороцетам), циннаризином (фезам), аминолоном (олатропил), а также
комбинации мелатонина с экстрактом валерианы (юкамен), аминалоном
(бинотропил) и пиридоксином (апик).
Создание комплексных препаратов позволяет в максимальной степени
использовать разнообразные фармакологические эффекты, характерные
для этих лекарственных средств, что позволяет существенно
оптимизировать их клиническое применение.
Высокий эффект по способности предупреждать мнестические и
поведенческие расстройства в сравнении с другими
церебропротекторными средствами проявляет тиоцетам, разработанный
АО «Галычфарм» совместно с НВТ «Фарматрон» компании «Артериум».
Это оригинальный комбинированный препарат, содержащий в своем
составе базовый рацетам – пироцетам и антиоксидант – тиотриазолин.
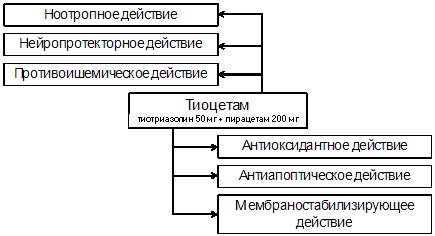
Тиоцетам удачно сочетает в своем действии ноотропное, мнемотропное,
антигипоксантное действие пирацетама с антиоксидантным,
противоишемическим, адаптогенным эффектами тиотриазолина, на основе
чего достигается взаимопотенцирующее действие [41, 42, 43].
Для защиты когнитивных функций от операционной агрессии и
профилактики послеоперационной когнитивной дисфункции необходимо
применение методов, сочетающих церебропротекторные и
цереброресусцитативные свойства. С этой точки зрения наше
внимание привлек ноотропный препарат тиоцетам и сукцинатсодержащий
препарат реамберин.
36. Яворская В.А., Хвисюк В.В., Фломин Ю.В., Гребенюк А.В. Защита мозга в острый период инсульта: новая перспектива // Мистецтво лікування.- 2006. - Вип. 9.
37. Грирогова И.А. Молекулярные механизмы ишемического инсульта (ИИ) и возможности метаболической и нейротрофической терапии при данной патологии / Материалы симпозиума "Актуальные вопросы кардионеврологии". Судак 3-6 мая 2007 г.
38. Ершов В.И., Бурдаков В.В. Управляемая нейрометаболическая церебропротекция в острейшем периоде ишемического инсульта // Вестник Оренбургского государственного университета. - 2004. - №7.
39. Сазонова А. Ноотропные препараты - стремление к разуму // Провизор. - 2005. - №16.
40. Илларионова Т.С. Место Фенотропила среди ноотропных препаратов // Журнал "Трудный пациент"ю - 2006. - №5.
41. Мамчур В.Й., Журавель Н.В., Жилюк В.Н., Кравченко К.О. Аналіз впливу засобів із церебропротективними властивостями на мнестичні процеси та поведінкові реакції щурів в умовах гострої ішемії головного мозку // Мед.перспективи. 2007. - Т.XII. - №1. - С.
42. Дзяк Л.А., Голик В.А. Эффективность тиоцетама в лечении дисциркуляторных энцефалопатий вследствие атеросклеротического поражения церебральных артерий // Кровообіг та гемостаз. - 2006. - №4. - С.112-116.
43. Черний В.И., Колесников А.Н., Колесникова В.В., Попков А.В., Колесников Н.Е. Перспективы применения нейропротекторов в терапии преэклампсии // Новости медицины и фармации. - 2007. - №10 (214). - С.8-10.
Общие сведения о собственных исследованиях,
характеристика обследованных больных
Аналитический обзор печатных работ отечественных и зарубежных
авторов показывает, что не все виды анестезии защищают больного от
последствий хирургической агрессии и более того, сами по себе
отдельные из них могут оказывать негативное влияние, особенно у
пожилых больных, на состояние когнитивных функций в
послеоперационном периоде вплоть до развития ПОКД с опасностью
развития в отдаленном периоде тяжелых хронических повреждений
головного мозга.
Поэтому современная диагностика когнитивных нарушений на ранних
этапах, когда эти изменения еще потенциально обратимы, и разработка
методов упреждающей и корригирующей церебропротективной терапии,
проводимой на фоне адекватной коррекции нарушений гомеостаза,
приобретает важнейшее практическое значение.
Одним из методов выбора общей анестезии при хирургическом
лечении больных пожилого возраста признан метод атаралгезии
[20].
Вышеизложенное послужило основанием для изучения влияния
атаралгезии на состояние когнитивных функций у больных пожилого
возраста при абдоминальных оперативных вмешательствах и разработке
методов профилактики и коррекции их нарушений.
Нами проведено обследование 54 больных, случайным образом
распределенных на три группы: атаралгезия (А), реамберин (Р) и
тиоцетам (Т). Состав больных и их характеристики представлены в
таблице 1.
Практически у всех обследованных больных кроме основного
заболевания была сопутствующая патология. Все больные получали
стандартную предоперационную подготовку, премедикацию и интенсивную
послеоперационную терапию в соответствии с заболеванием, по поводу
которого производилось оперативное вмешательство.
Все обследованные больные перенесли оперативные вмешательства на
органах брюшной полости в условиях обезболивания методом
атаралгезии:
Вводный наркоз: 200 мг тиопентала-натрия;
Основной наркоз: сибазон – 30 мг, фентанил – 10 мкг/кг/час на
первом часу операции, 5 мкг/кг/час на втором часу операции.
Релаксация во время операции поддерживалась ардуаном в дозе 4
мг.
ИВЛ проводилась со стандартными расчетными параметрами
вентиляции.
Инфузионная терапия во время операции проводилась
кристаллоидными и коллоидными растворами, при больших объемах
операции (гемиколектомия) выполнялась гемотрансфузия.
Таблица 1
Исходные данные у больных исследуемых групп
|
Показатель
|
группа А
|
группа Р
|
группа Т
|
|
Всего больных
|
16
|
18
|
20
|
|
Средний возраст, лет
|
61,0±2,91
|
63,9±4,11
|
66,0±3,80
|
|
Пол, мужчин/женщин
|
3/13
|
7/11
|
6/14
|
|
Степень операционного риска по ASA
|
II
|
II
|
II
|
|
Продолжительность операции, мин
|
92,8±10,96
|
89,7±11,7
|
127,0±23,8
|
|
Средний объем операционной кровопотери, мл
|
359,4±54,5
|
319,4±38,1
|
350,0±45,5
|
|
Клинический диагноз основного заболевания
|
Операция на ЖКТ
|
14
|
11
|
10
|
|
Хирургия желчных путей
|
4
|
5
|
7
|
|
Другие абдоминальные операции
|
2
|
2
|
3
|
|
Сопутствующая патология
|
Гипертоническая болезнь I-II ст.
|
15
|
11
|
12
|
|
ИБС, кардиосклероз атеросклеротический
|
12
|
17
|
15
|
|
Другая соматическая патология
|
1
|
2
|
4
|
Больные группы Р дополнительно к стандартной интенсивной терапии
получали реамберин, больные группы Т – тиоцетам по схемам,
описанным в соответствующих разделах ниже.
Течение анестезии во время операций было гладким, осложнений не
было. Выход из наркоза также был без осложнений.
Для оценки адекватности анестезии и исключения влияния различных
видов гипоксии на состояние когнитивных функций у больных всех трех
групп нами проведено исследование показателей, характеризующих
состояние гемодинамики, кислородного режима, внутренней среды
организма.
Анализ данных, характеризующих когорты больных, позволяет
утверждать, что больные всех групп были сопоставимы по возрасту,
основной и сопутствующей патологии, по продолжительности операции
и объему кровопотери.
Исходные данные других клинических и некоторых лабораторных
показателей между группами приведены в таблицах 1 и 2.
Таблица 1
Исходные показатели центральной гемодинамики
исследуемых групп
|
Показатели
|
Группа А
|
Группа Р
|
Группа Т
|
|
АД систолическое, мм рт.ст.
|
149,69±3,41
|
131,67±6,58
|
133,75±6,93
|
|
АД диастолическое, мм рт.ст.
|
83,25±1,75
|
78,06±6,21
|
72,00±3,05
|
|
Среднее АД, мм рт.ст.
|
105,40±1,93
|
95,93±6,09
|
92,58±4,12
|
|
ЧСС, уд. в мин
|
83,31±3,46
|
81,00±2,00
|
84,30±2,90
|
|
Ударный объем, мл
|
67,81±4,36
|
76,11±4,29
|
71,10±3,42
|
|
Минутный объем кровообращения, л
|
5,70±0,58
|
6,15±0,34
|
6,00±0,39
|
|
Сердечный индекс, л/м2
|
3,23±0,28
|
3,67±0,17
|
3,42±0,18
|
|
ОПСС,
|
1540,8±151,5
|
1251,0±58,5
|
1255,2±84,5
|
|
УПСС,
|
894,0±121,5
|
754,4±55,5
|
723,1±63,1
|
|
ЦВД, см вод.ст.
|
6,25±0,44
|
8,39±0,95
|
8,05±0,81
|
Таблица 2
Исходные показатели углеводного обмена исследуемых групп
|
Показатели
|
Группа А
|
Группа Р
|
Группа Т
|
|
Глюкоза, ммоль/л
|
4,62±0,44
|
3,47±0,39
|
4,39±0,68
|
|
Лактат, ммоль/л
|
3,22±0,51
|
3,46±0,79
|
3,68±0,46
|
|
Пируват, ммоль/л
|
0,06±0,04
|
0,09±0,04
|
0,06±0,02
|
|
Лактат/пируват
|
141,12±70,46
|
115,59±70,17
|
201,74±128,29
|
Как видно из представленных таблиц, группы по состоянию
центральной гемодинамики и по показателям, характеризующим
адекватность макро- и микроциркуляции потребностям организма,
исходно были полностью сопоставимыми и соответствовали референтным
значениям, характерным для данной возрастной категории. Имеющиеся
по некоторым показателям отличия статистически недостоверны.
Характеристика
периоперационного гомеостаза
Течение анестезии и операции, а также раннего послеоперационного
периода у всех больных было гладким. В результате анализа было
определено, что в течение операции и раннего послеоперационного
периода гемодинамика больных всех трех групп оставалась в пределах
референтных значений. Кислородно-транспортная система крови
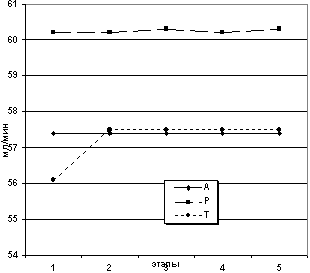
больных не претерпевала существенных отклонений (рис. 2, 3, 4,
5).
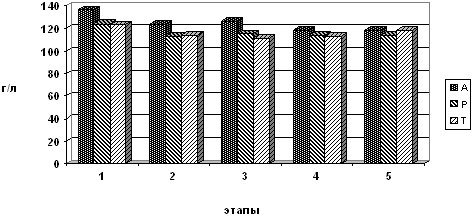
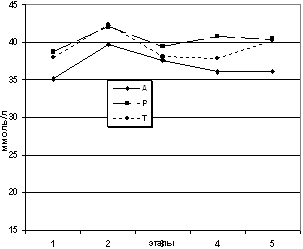
Рис. 2. Динамика содержания гемоглобина на
этапах исследования.
(Примечание: здесь и далее под номерами этапов
подразумеваются:
1 – до операции, 2 – операция, 3 – конец операции, 4 – 1 сутки,
5 – 5 сутки).
В тоже время, в группе А отмечалось некоторое снижение
напряжения кислорода в артериальной крови через сутки и на 5 сутки
после операции с параллельным незначительным снижением напряжения
углекислого газа и увеличением легочного шунта (с исходных 16,3%
до 18,5% на 5 сутки), что может быть объяснено гипервентиляцией с
одновременным нарушением вентиляционно-перфузионного соотношения
в легких из-за снижения легочной перфузии в раннем
послеоперационном периоде. Тем не менее, остальные показатели
кислород-транспортной системы указывали на полную компенсацию
данных отклонений у больных этой группы. В пользу такого вывода
говорит повышение основного обмена, которое наблюдалось до
операции и, начиная с первых суток послеоперационного периода,
сохранялось, как минимум, до пятых суток.
а)
б)
Рис. 3. Динамика напряжения кислорода в
артериальной (а) и венозной крови (б) на этапах
исследования.
а)
б)
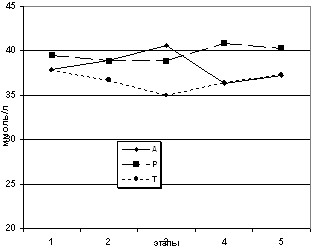
Рис. 4. Динамика напряжения углекислого газа в
артериальной (а) и венозной крови (б) на этапах
исследования.
а)
б)
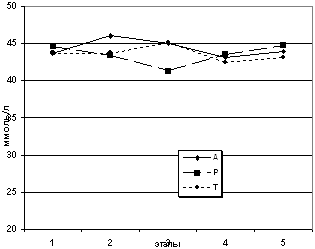
Рис. 5. Динамика показателей системного
транспорта (а) и коэффициента утилизации кислорода (б) на этапах
исследования.
В группе больных, получавших реамберин (группа Р) отмечалось
некоторое снижение насыщения крови кислородом в артериальной крови
во время операции, но в отличие от группы А не наблюдалось снижения
напряжения кислорода в артериальной крови в раннем
послеоперационном периоде.
При стабильности большинства показателей примечательным является
уменьшение выраженности легочного шунтирования в послеоперационном
периоде у больных групп Р и Т, в то время как в контрольной группе
в течение первых 5 суток наблюдалась тенденция к его повышению без
статистически достоверной разницы с исходным уровнем, но с
достоверным отличием от значений этого показателя во время операции
внутри группы и на аналогичных этапах в двух других группах (рис.
6).
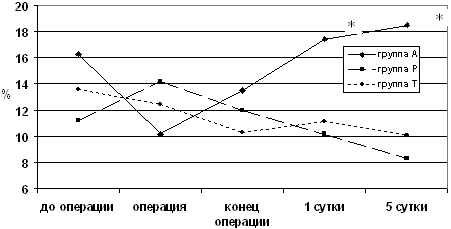
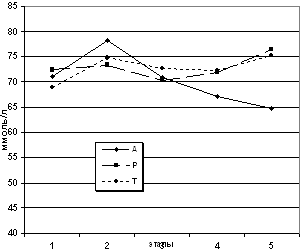
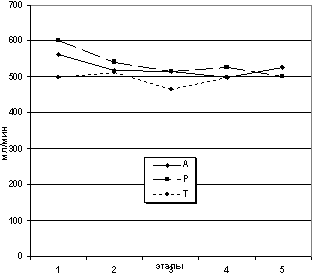
Рис. 6. Динамика легочного шунтирования на этапах
исследования
(* - разница с больными, получавшими реамберин (Р) и
тиоцетам (Т) и с этапом «операция» внутри группы достоверна с
p<0,05).
Анализ выраженности стрессовой реакции во время операции и в
раннем послеоперационном периоде, показал, что применение
реамберина снижает выраженность метаболической реакции на
операционный стресс, о чем свидетельствует снижение уровня
лактата, начиная с этапа операции и в течение всего раннего
послеоперационного периода. На 5 сутки после операции
статистически достоверное по отношению к исходному уровню и
уровню на этапе «операция» снижение лактата отмечалось также у
больных, получавших в послеоперационном периоде тиоцетам (рис.
7).
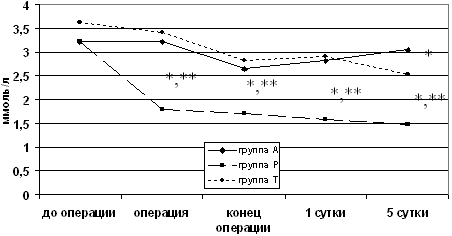
Рис. 7. Динамика уровня лактата на этапах исследования.
(* - разница с исходным уровнем достоверна с p<0,05, ** -
разница с группами А и Т достоверна с p<0,05).
Таким образом, анализ показателей, характеризующих состояние
гомеостаза больных во время операции и в раннем послеоперационном
периоде, позволил нам сделать вывод о том, что использование
атаралгезии в качестве тотального внутривенного обезболивания
является достаточно эффективным для защиты больных пожилого и
старческого возраста от операционного стресса при абдоминальных
оперативных вмешательствах.
Кроме того, определено, что применение реамберина у пожилых
больных способствует улучшению утилизации лактата.
Методы исследования
когнитивных функций у пожилых больных
Для оценки когнитивных функций разные авторы используют
различные методики исследования. Так, для исследования
типологических свойств нервной системы (сила нервной системы,
баланс нервных процессов, подвижность нервных процессов)
применяется методика Е.П. Ильина (1978). Для повышения надежности
диагностики типологических особенностей нервной системы,
исследование повторяют не менее четырех раз и, при отсутствии
разброса в результатах, пациента относят к конкретной
типологической группе.
К общепринятым психометрическим методикам относятся следующие:
объем внимания и концентрация внимания изучаются с помощью
корректурной пробы; переключение внимания – с помощью методики
Шульте; избирательность внимания – с помощью методики
Мюнстерберга; произвольное внимание – методика "расстановки чисел";
оперативная память – метод Векслера; кратковременная память и
память на образы – метод Эббингауза; логическое мышление изучается
с помощью методики "закономерности числового ряда"; для изучения
интеллектуальной лабильности используют "методику
интеллектуальной лабильности", а способность к классификации и
анализу – с помощью методики "исключение понятий". Оценка
астенического состояния проводят по шкале Е.В.Малковой (1980),
нервно-психическое напряжение – по опроснику Т.А.Немчина (1983) [44].
В клинической практике для оценки когнитивных функций у лиц
пожилого возраста наиболее часто используются методики, позволяющие
оперативно и в сжатые сроки определить состояние разных
психических процессов у этой категории больных.
К числу таких методик относятся:
- Методики Е. Крепелина и Шульте для исследования особенностей
внимания, работоспособности, когнитивного темпа;
- Методика А. Лурия для исследования слухоречевой памяти;
- Тест рисования часов для исследования зрительной памяти;
- Методики «Исключения понятий», «Классификации», «Простые и
сложные аналогии» для исследования особенностей мышления.
Эти методики достаточно просты в применении и информативны,
однако существенным недостатком их при работе с лицами пожилого
возраста является отсутствие нормативных показателей для данного
возрастного контингента.
За рубежом определение когнитивных способностей у
геронтологических больных проводится в основном с помощью тех
тестов интеллекта, которые применяются при обследовании и более
молодых возрастных групп, однако, как правило, эти тесты имеют
шкалу оценок для пожилого возраста. Это «Тест интеллекта для
взрослых Векслера», рассчитанный на лиц в возрасте до 74 лет,
«Краткий тест общего уровня переработки информации» со шкалой
оценки результатов до 65 лет, тест «Прогрессивных матриц Равена»,
который широко используется в работе с пожилыми людьми, особенно в
тех случаях когда у них имеются неврологические и речевые
расстройства [45, 46].
Тест «Прогрессивных матриц Равена» был использован в качестве
основного психодиагностического инструмента для оценки когнитивных
функций пожилых людей и в нашей клинике.
Данная методика имеет целый ряд преимуществ по сравнению с теми
методиками, которые традиционно используются в клинике для
диагностики когнитивных характеристик у пожилых людей:
- Эта методика валидна, надёжна, проста в проведении и не требует
специальной подготовки врача-клинициста для проведения
исследования.
- Она стандартизирована для лиц пожилого возраста.
- Эта методика относится к категории невербальных, что даёт
возможность использовать её при обследовании пожилых лиц с любым
языковым и социокультурным фоном.
- При выполнении тестовых заданий проявляются такие психические
процессы как восприятие, внимание, мышление, что позволяет
получить достаточно полную общую картину о состоянии высших
психических функций человека и оценить его невербальный
интеллект.
- Методика даёт возможность получить качественную оценку
когнитивных показателей и их динамику при выполнении заданий
различной категории сложности.
Тест «Прогрессивных матриц Равена» состоит из 60 матриц или
композиций с пропущенными элементами. Тест построен по принципу
«прогрессивности», который заключается в том, что выполнение
предшествующих заданий является как бы подготовкой обследуемого к
выполнению более трудных тестовых программ. В результате
тестирования происходит подготовка и обучение человека решению
сложных тестовых заданий.
Тест состоит из 5 серий, каждая из которых выполняет свою
диагностическую функцию, начиная от оценки особенностей восприятия
человека до оценки его аналитико-синтетических мыслительных
процессов.
Для проведения исследования когнитивных функций у лиц пожилого
возраста в условиях нашей клиники данная методика была разделена на
2 равных по сложности варианта с целью исключения заучивания
заданий и привыкания к ним при повторных исследованиях. Кроме того,
оценочная шкала теста Равена была модифицирована с учетом ряда
особенностей данного контингента больных и для более
дифференцированного анализа состояния когнитивных функций у
пожилых людей в разных послеоперационных периодах.
Таким образом, шкала оценки когнитивных функций у лиц пожилого
возраста получила следующие критерии:
- 90 и более % правильно решенных заданий – очень
высокий уровень показателей психических процессов;
- 75 – 89 % правильно решенных заданий – высокий
уровень;
- 55 – 74 % – уровень показателей психических
процессов выше среднего;
- 45 – 54 % – средний уровень;
- 25 – 44 % – уровень показателей психических
процессов ниже среднего;
- 10 – 24 % – низкий уровень показателей психических
процессов;
- 0 – 9 % – очень низкий уровень.
Кроме того, для оценки характера нарушения психических процессов
и динамики их восстановления нами был проведен качественный анализ
ошибок, сделанных больными при выполнении тестовых заданий.
Были выделены следующие типы ошибок:
- Ошибки на внимание и восприятие, сделанные с визуальной
способностью различать одномерные изменения в изображении.
- Ошибки на сложное восприятие, связанные со способностью
линейной дифференциации и нахождения взаимосвязи между элементами
фигур.
- Ошибки на построение конкретных умозаключений, связанные
со способностью исследования плавных изменений в
пространстве.
- Ошибки на построение абстрактных умозаключений, связанные
со способностью постигать закономерность сложных перемен в
пространстве.
- Ошибки на построение высшей формы абстракции и динамического
синтеза, связанные со способностью к аналитико-синтетической
мыслительной деятельности.
С целью выявления влияния на состояние когнитивных функций у
больных, как самого вида анестезии, так и примененных
фармакологических препаратов для оценки их нейропротективного
действия вышеуказанные критерии определяли до операции (исходный
фон) и после оперативного вмешательства в ранний и ранний
отдаленный послеоперационный периоды:
- До операции
- На 5-е сутки после операции
- На 10-е сутки после операции
- На 30-е сутки после операции.
Нейропротективная терапия начиналась до операции или в первые
минуты после ее окончания в зависимости от используемого
фармакологического препарата.
44. Менделевич В.Д. Клиническая и медицинская психология: Практическое руководство. М.: Медпресс. - 2001. - 522 с.
45. Бурлачук Л.Ф., Морозов С.М. Словарь-справочник по психодиагностике. С-Пб.: Питер. - 1998. - 528 с.
46. Равен Дж.К., Корт Дж.Х., Равен Дж. Руководство для "Прогрессивных матриц Равена" и словарных шкал. Пер. с англ. М.: Когита-центр, 2002. - 80 с.
Исходное состояние когнитивных функций
у больных с заболеваниями желудочно-кишечного тракта
Как было отмечено выше, в пожилом и преклонном возрасте
значительно чаще, чем в предыдущие годы жизни, возникает накопление
эмоционально-психологических перегрузок, которое может быть вызвано
как соматическими или личностно-социальными расстройствами, так и
их последствиями.
Именно накопление таких перегрузок приводит к тому, что к
психологическим ресурсам пожилого человека предъявляются
чрезмерные требования, и когнитивная переработка их может оказаться
затрудненной, особенно при различных стрессовых ситуациях.
Лица пожилого возраста тяжело реагируют на хронические
заболевания, что связано в первую очередь с системой ценностей и
отображает устремленность человека зрелого возраста удовлетворять
такие социальные потребности, как потребность в самостоятельности,
независимости, благополучии, уважении.
При заболеваниях желудочно-кишечного тракта изменения личности
связаны с патологическим развитием болезни (неоднократные и
массивные отрыжки, метеоризм), что, как правило, приводит не только
к сильным эмоциональным переживаниям и соматическим расстройствам,
но и к когнитивным изменениям, к снижению оперативно-технических
возможностей больных.
Для людей с заболеваниями желудочно-кишечного тракта (язвенная
болезнь желужка и двенадцатиперстной кишки, язвенный колит и др.)
характерен внутриличностный конфликт, приводящий к углублению
болезни и развитию когнитивных изменений.
Мышление, как процесс переработки информации, оперирующий
символами, правилами, элементами, сохраняемыми в памяти, и
операциями, а также предполагающий наличие регулирующих и
контролирующих систему инстанций, оказывается нарушенным. При этом
нарушается основополагающая переработка информации (концентрация
внимания, усвоение понятий, хранение информации в памяти,
формирование ассоциативных связей).
Нами изучено состояние уровня высших психических функций у 54
больных с различными заболеваниями желудочно-кишечного тракта с
помощью теста «Прогрессивных таблиц Равена» и качественного
анализа ошибок, совершаемых больными при выполнении тестовых
заданий. Средний возраст больных составил 63,6±3,6 года.
Больные случайным образом были распределены на три группы:
- Группа А – контрольная группа, где был применен во время
оперативного вмешательства метод атаралгезии.
- Группа Р – основная группа, больным которой при том же виде
анестезии с целью профилактики развития послеоперационной
когнитивной дисфункции дополнительно назначался реамберин.
- Группа Т – основная группа, больным которой при том же виде
анестезии с целью профилактики развития послеоперационной
когнитивной дисфункции дополнительно назначался тиоцетам.
Как показало исследование, у больных контрольной группы исходный
уровень высших психических функций соответствовал среднему
(51,03±6.33%) согласно критериальным оценкам.
В группе больных, получавших реамберин, средний уровень
когнитивных функций до операции был несколько ниже, чем в
контрольной группе (48,2±664%), но это различие не было
статистически достоверным (p>0,05).
В группе больных, получавших тиоцетам, показатель исходного
состояния высших психических функций составил 44,16±5,89%, что
соответствовало градации ниже среднего уровня, то есть общий
исходный когнитивный фон этой группы больных был несколько хуже,
чем в других группах.
Анализ ошибок, допущенных больными при выполнении тестовых
заданий показал, что общее количество ошибок на этапе перед
операцией было достаточно велико во всех группах и не имело
статистически значимых отличий между ними (рис.8)
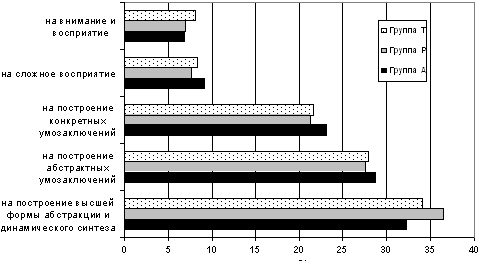
Рис.8. Частота ошибок при выполнении
тестовых заданий больными
Как видно, отмечается увеличение ошибок в соответствии с
усложнением заданий, связанных с построением дискретного или
абстрактного умозаключений, а также на понимание взаимосвязей,
включающих процесс сложного восприятия.
Оперативное вмешательство выступает фактором риска ухудшения
когнитивных функций, что делает необходимым разработку
мероприятий, позволяющих сохранить на исходном уровне и даже
улучшить исходное состояние высших психических функций и тем самым
сберечь достаточный уровень физической и социальной активности
больных в отдаленном послеоперационном периоде.
Состояние когнитивных функций
при атаралгезии
Анализ показателей, характеризующих состояние гомеостаза у
больных во время операции и в раннем послеоперационном периоде
показал, как было отмечено выше, что использование атаралгезии в
качестве тотального внутривенного обезболивания является
достаточно эффективным для защиты больных пожилого и старческого
возраста от операционного стресса при абдоминальных оперативных
вмешательствах.
Вместе с тем отмечались изменения в состоянии когнитивных функций в
послеоперационном периоде (рис.9).
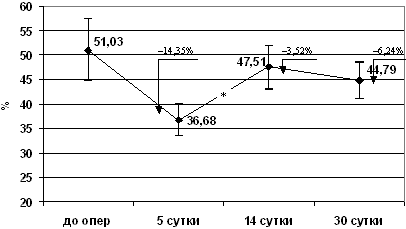
Рис. 9. Динамика когнитивных функций
у больных контрольной группы
(Примечание: * - разница достоверна с p<0,05)
На 5-е сутки после операции наблюдалось значительное
статистически достоверное (p<0,05) снижение результатов
исследования, в среднем до 36,7±3,2% правильно решенных заданий,
что было связано преимущественно со снижением основных психических
процессов (восприятия, внимания и мышления). К 14-м суткам после
операции отмечалось восстановление когнитивных функций до уровня,
статистически не отличающегося от исходного.
Больные правильно решали в среднем 47,5±4,4% тестовых заданий,
однако полного восстановления когнитивных функций до исходного не
происходило. В дальнейшем, в период между 14 и 30 сутками после
операции, выявлено повторное, хотя и статистически недостоверное по
отношению к дооперационным данным, снижение уровня правильно
выполненных заданий (44,8±3,7%), что может быть обусловлено
отсроченной реакцией организма на операционную травму и
анестезию.
Кроме количественной оценки результатов тестирования нами был
проведен качественный анализ при выполнении тестовых заданий на
этапе до операции и в отдаленном раннем послеоперационном периоде –
на 30-е сутки после операции (рис.10).
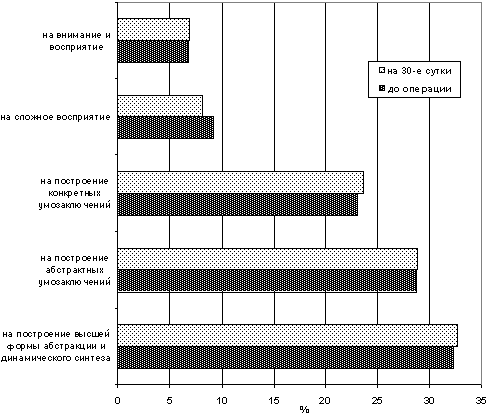
Рис. 10. Частота ошибок при выполнении тестовых заданий
больными контрольной группы в начале и в конце исследования
Из приведенной диаграммы следует, что частота допущенных ошибок
при выполнении тестовых заданий практически соответствовала
дооперационным величинам.
На основании вышеизложенного можно отметить, что при атаралгезии
имеет место снижение проявления высших психических функций
(количество правильно решенных задач меньше, чем до оперативного
вмешательства) с сохранением исходного качественного уровня.
Это послужило основанием для использования фармакологической
протекции когнитивных функций с целью предупреждения их
дисфункции в ближайшем и отдаленном послеоперационном
периоде.
Профилактика и коррекция нарушений когнитивных
функций
при использовании реамберина
Одним из препаратов, который привлек наше внимание, стал
сбалансированный полиионный раствор, содержащий соль янтарной
кислоты (N-метиламмония натрия сукцинат) – реамберин.
Основанием для его применения послужили его фармакологические
свойства с возможным нейропротективным действием [47]. Механизмы действия
реамберина представлены на рисунке 11 [48].
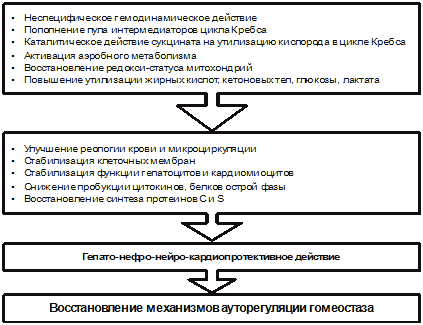
Рис. 11. Механизмы действия реамберина
Реамберин обладает неспецифическим гемодинамическим действием, а
также за счет эффектов сукцината натрия антигипоксантным,
антиоксидантным, детоксикационным,
гепато-нейро-кардиопротективным действием, что способствует
восстановлению механизмов ауторегуляции гомеостаза. Кроме того, он
предотвращает преждевременное старение организма за счет уникальной
нормализации внутриклеточного соотношения АТФ/АДФ.
Главный фармакологический эффект препарата обусловлен
способностью усиливать компенсаторную активацию аэробного
гликолиза, снижать степень угнетения окислительных процессов в
цикле Кребса митохондрий, увеличивать внутриклеточный пул
макроэргических соединений. Активируя антиоксидантную систему
ферментов и тормозя процессы перекисного окисления липидов в
ишемизированных органах, реамберин оказывает мембранопротекторное
действие на клетки головного мозга, миокарда, печени и почек.
Технология применения:
Реамберин вводился внутривенно капельно в составе комплекса
стандартной послеоперационной интенсивной терапии по следующей
схеме:
- насыщающая доза: за день до оперативного вмешательства – 800
мл/сут (12-14 мл/кг/сутки);
- поддерживающая доза: в день операции и в течении 7 дней после
нее – 400 мл/сутки (5-8 мл/кг/сутки).
Скорость введения препарата – не более 90 капель в минуту (1-1,5
мл/мин).
Изучение нейропротективного эффекта реамберина у пожилых больных
при абдоминальных оперативных вмешательствах проведено у 18
пациентов, средний возраст которых составил 63,89±4,11 года.
Все больные, как и контрольной группы, перенесли оперативные
вмешательства на органах брюшной полости в условиях атаралгезии,
получив стандартную предоперационную терапию в соответствии с
заболеванием, по поводу которого проводилась операция.
Инфузионная терапия во время операции проводилась
кристаллоидными и коллоидными растворами, гемотрансфузия
выполнялась в отдельных случаях.
Анализ изменений когнитивных функций у пожилых больных,
перенесших оперативное вмешательство с применением метода
атаралгезии и получавших реамберин, показал, что использование
данного препарата у этой категории больных способствовало
сохранности высших функций на близком к исходному дооперационному
состоянию на всех этапах послеоперационного периода (рис.12).
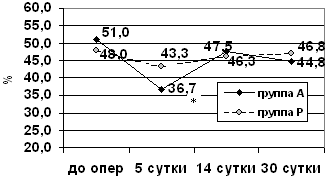
Рис. 12. Динамика когнитивных функций
у больных контрольной группы (А)
и группы, больные которой получали реамберин (Р)
(Примечание: * - разница достоверна с p<0,05)
На 5-е сутки после операции наблюдалось статистически
недостоверное снижение когнитивного показателя (43,3±6,9%). Однако
это снижение когнитивных характеристик не приводило к когнитивным
расстройствам, так как уровень когнитивного фона оставался в
пределах той же средней шкалы оценок, что и перед операцией.
К 14-м суткам отмечалось улучшение показателей высших
психических функций (46,3±6,1%), которые оставались стабильными и к
30-му послеоперационному дню имели тенденцию к дальнейшему
улучшению (46,8±5,8%), приближаясь к дооперационному уровню.
При анализе ошибок, сделанных больными этой группы при
выполнении тестовых заданий, установлено незначительное уменьшение
числа неверных ответов, связанных с дифференциацией и
идентификацией элементов фигуры с образцами на основе таких
психических процессов как внимание и простое восприятие. Кроме
того, уменьшалась частота ошибок на построение абстрактных
умозаключений, которые связаны с аналитико-синтетической
мыслительной деятельностью.
Вместе с тем выявлен незначительный рост ошибок, связанных со
сложным восприятием предметов и построением конкретных
умозаключений (рис. 13).
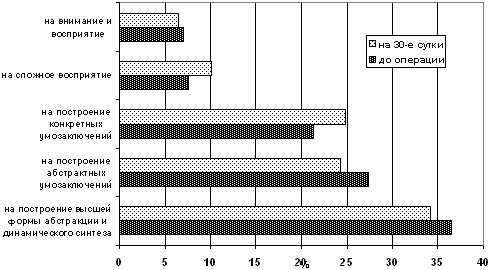
Рис. 13. Частота ошибок при выполнении
тестовых заданий больными, получавшими реамберин в начале и в конце
исследования.
Таким образом, результаты исследования показали, что при
использовании реамберина не выявлено значимого угнетения высших
психических функций в раннем послеоперационном периоде. В раннем
отдаленном периоде происходило восстановление когнитивных функций с
приближением к дооперационному состоянию и сохранностью
когнитивного фона в пределах среднего критериального уровня.
При положительных количественных результатах обнаружены
незначительные без достоверных различий с дооперационным
состоянием качественные изменения в характере допущенных больными
ошибках при тестировании в отдаленном периоде (спустя 1 месяц).
По сравнению с исходными показателями увеличивается частота
ошибок, связанных с восприятием и вниманием пожилых больных, но
уменьшаются ошибки, связанные с аналитико-синтетическими
мыслительными процессами и может быть рекомендован инфузию
реамберина по предложенной схеме для профилактики когнитивных
дисфункций.
47. Усенко Л.В., Мосенцев Н.Ф., Коломоец А.В. Мосенцев Н.Н. Реамберин в комплексе интенсивной терапии полиорганной дисфункции-недостаточности. Метод. реком. Днепропетровск. 2004. - 32 с.
48. Мосенцев Н.Ф., Усенко Л.В., Мальцева Л.А., Мосенцев Н.Н., Коломоец А.В. Альтернативные ккомпоненты коррекции микроциркуляторно-митохондриальной дисфункции у больных с тяжелым сепсисом и септическим шоком. Метод. реком. Днепропетровск, 2006. - 32 с.
Профилактика и коррекция
нарушений когнитивных
функций тиоцетамом
В последнее время прослеживается тенденция к созданию ноотропов
не только на основе оригинальной химической субстанции, но и в
результате комбинирования ноотропа с препаратами, усиливающими
его позитивные свойства. Подобным комбинированным ноотропным
препаратом, является Тиоцетам, разработанный АО «Галычфарм»
совместно с НВТ «Фарматрон» [49, 50, 51].
Этот оригинальный комбинированный препарат, содержащий в составе
базовый рацетам – пирацетам и антиоксидант – тиотриазолин.
Обоснованием для его применения с целью профилактики и коррекции
когнитивных дисфункций явилось удачное сочетание целенаправленного
воздействия препарата одновременно на многие звенья
метаболизма.
Пирацетам проявляет свойства психостимулятора с особым акцентом
действия на интеллектуальную сферу больных и обладает
антидепрессивной активностью, уменьшает экстрапирамидные
дисфункции, повышая корковый контроль над подкорковыми
образованиями у больных инсультом. Препарат повышает интенсивность
альфа-ритма в пораженном полушарии и снижает интенсивность
тета-ритма в здоровом. Улучшает восприятие, особенно зрительное,
способность концентрировать внимание, стимулирует речевую функцию
[45, 49, 52, 53].
Эффекты тиоцетама
Основными эффектами тиотриазолина являются: кардиопротекторный,
антиаритмический, гепатопротекторный, церебропротекторный,
антиоксидантный, противоишемический,
противовоспалительный, иммуномодулирующий. В основе
противоишемического действия тиотриазолина лежит его способность
снижать степень угнетения окислительных процессов в цикле Кребса с
сохранением внутриклеточного фонда АТФ, стабилизировать
метаболизм кардиомицитов.
Тиотриазолин активирует антиоксидантную систему ферментов и
тормозит процессы перекисного окисления липидов в ишемизированных
участках миокарда. Активирует антирадикальные ферменты –
супероксиддисмутазу и каталазу, антиперекисные ферменты –
супероксиддисмутазу, способствует более экономному расходу
эндогенного антиоксиданта – токоферола.
Противовоспалительное действие обусловлено уменьшением явлений
отека в измененных тканях и улучшением процессов микроциркуляции за
счет снижения вязкости крови. Тиотриазолин обладает высокими
гепатопротекторными свойствами. При всех видах патологии печени
показана его высокая антиоксидантная активность. Он быстро
устраняет из крови и тканей продукты свободнорадикального окисления
– главный повреждающий фактор гепатоцитов, устраняет
диспротеинемию, повышает уровень общего белка и альбуминов.
Тиотриазолин улучшает дезинтоксикационную функцию печени, о чем
свидетельствует нормализация уровня белков, мочевины и глюкозы в
крови. Иммуномодулирующее действие выражается в снижении или
нормализации количества больших, средних и малых циркулирующих
иммунных комплексов.
Тиотриазолин обладает высоким церебропротекторным действием. В
острой фазе ОНМК приводит к существенному снижению биохимического
маркера повреждения мозговой ткани – активности ВВ-КФК, снижает
интенсивность анаэробного гликолиза (снижение лактата), активирует
реакции цикла трикарбоновых кислот (увеличивает содержание малата).
Повышает уровень макроэргов в острый период ОНМК. Антиоксидантный
эффект заключается в снижении уровня накопления продуктов
свободнорадикального окисления в ткани мозга – диеновых конъюгатов
и малонового диальдегида, увеличивается активность
супероксиддисмутазы, каталазы, глутатионпероксидазы, содержание
α-токоферола.
Противоотечное действие состоит в снижении явлений
периваскулярного, перицеллюлярного и апикально-дендритного отеков,
уменьшении числа ишемически изменненых нейронов и спавшихся
капилляров, что является ведущим патогенетическим фактором гибели
нейронов в острый период ОНМК.
За счет тиотриазолина тиоцетаму характерен более широкий спектр
ноотропного действия, чем для пирацетама отдельно, так как он
действует только на начальных этапах формирования памяти, а
тиоцетам положительно влияет на процессы первичной обработки
информации, ее фиксацию и консолидацию. Значительно активирует
пролиферацию клеток глии и их функцию, вызывает усиление
сателлитолиза, что является ведущим фактором обеспечения
жизнедеятельности нейронов при развитии ишемических повреждений
головного мозга. Тормозит истощение запасов глюкозы и гликогена в
нейронах в острый период ОНМК и внутримозгового кровоизлияния.
Показатели окислительной продукции энергии (НАД/НАДН, цитохром
С-оксидаза, уровень пирувата, малата и изоцитрата) становятся выше.
Поддержание тиоцетамом углеводного метаболизма определяет
повышение уровня макроэргов (АТФ, креатинфосфат). Пирацетам в этих
условиях оказывает преимущественное влияние на анаэробные пути
образования энергии, а тиоцетам на восстановление аэробных путей
продукции энергии.
Тиоцетам, не оказывая влияния на снижение уровня белка в
цитоплазме и митохондриях ишемизированных нейронов, существенно
тормозит нарастание фонда свободных аминокислот и их
нейродеструктивное действие. Тиоцетам увеличивает уровень РНК в
тканях мозга у больных с ОНМК и внутримозговым кровоизлиянием,
что указывает на активацию процессов протеинсинтеза и является
адаптационной реакцией на гипоксию, обеспечивающей перестройку
метаболизма мозга без повышения потребности в кислороде. Сам по
себе пирацетам не оказывает выраженного влияния на процессы синтеза
РНК в тканях мозга. Проявляет антикоагулянтную и фибринолитическую
активность, усиливает дестабилизацию фибрина [38, 50, 51].
Технология применения тиоцетама
(декларационный патент №23959/2004).
Тиоцетам назначался нами по ступенчатой схеме:
- насыщающая доза – по 25 мл (содержит 2,5 г пирацетама и 0,625 г
тиотриазолина) внутривенно капельно, начиная с первых минут
послеоперационного периода;
- поддерживающая доза – по 25 мл внутривенно капельно на
протяжении 7 суток, затем по 2 таблетки (1 таблетка содержит 1,2 г
пирацетама и 0,3 г тиотриазолина) 3 раза в день в течение 21
дня.
Анализ результатов исследования когнитивных характеристик у
больных, в комплекс интенсивной терапии в послеоперационном периоде
которых был включен тиоцетам, показал, что, несмотря на самый
низкий исходный уровень когнитивных способностей у этих больных (в
дооперационном периоде ниже среднего) на 5-е сутки после операции
мы не наблюдали снижения когнитивного фона, как это имело место у
больных контрольной группы (рис. 14).
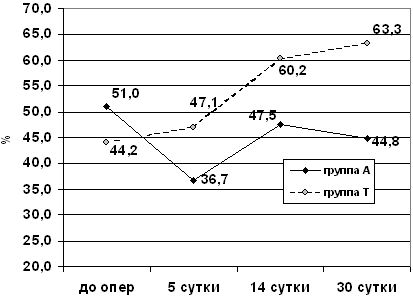
Рис. 14. Динамика когнитивных функцийу больных контрольной
группы и группы больных, получавших тиоцетам
Более того, показатель когнитивных характеристик возрастал до
среднего уровня по отношению к исходному результату этой группы
больных и превышал уровень когнитивного фона в других группах в
этот послеоперационный период (47,1±4,1%).
На 14 сутки после операции выявлено значительное, статистически
достоверное улучшение высших психических функций (р < 0,05).
Больные правильно решали в среднем 60,2±3,8% заданий, что
соответствует согласно критериальным оценкам когнитивных
характеристик уровню выше среднего. Такое повышение когнитивного
фона значительно опережает процессы соматического восстановления
больных, и достоверно значимо превышает результаты, полученные у
больных контрольной группы и группы, где использовался
реамберин.
Это свидетельствует о благотворном влиянии Тиоцетама на
психические процессы в раннем послеоперационном периоде. Применение
его позволяет не только сохранить исходное состояние когнитивных
функций у больных пожилого возраста, но и существенно его
улучшить.
На 30 сутки после операции наблюдалась дальнейшая положительная
динамика состояния высших психических процессов по сравнению с
предыдущим этапом. При этом когнитивные показатели оставались в
пределах оценок выше среднего уровня (63,3±3,2%).
При качественном анализе ошибок, допущенных больными группы с
использованием Тиоцетама при выполнении тестовых заданий в
отдаленном послеоперационном периоде (на 30-е сутки после
операции) установлено, что тенденция, наметившаяся в группе с
применением Реамберина, в этой группе получила более широкое
развитие: увеличивалась частота ошибок второго типа, связанных с
восприятием предметов и нахождением аналогии между парами фигур, с
динамической внимательностью при существенном уменьшении частоты
ошибок 4 и 5-го типов, что свидетельствует о значительном усилении
функции абстрактного и логического анализа после применения
Тиоцетама (рис.15).
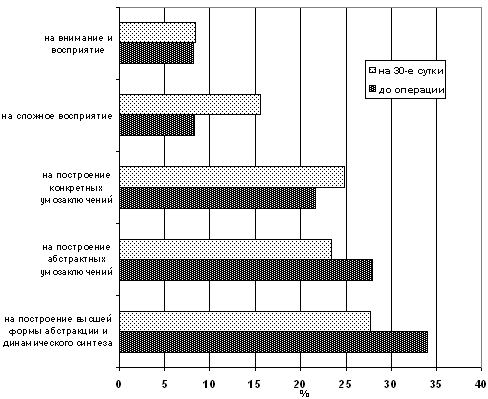
Рис. 15. Частота ошибок при выполнении тестовых заданий
больными группы Т в начале и в конце исследования
При использовании Тиоцетама побочных эффектов не наблюдалось.
Все больные препарат переносили хорошо.
Сравнительная оценка разных вариантов профилактики когнитивных
дисфункций в послеоперационном периоде представлена на рис. 16 и
17.
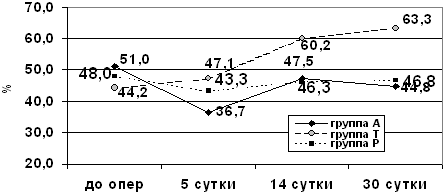
Рис. 16. Сравнение динамики когнитивных функций
у больных обследованных групп
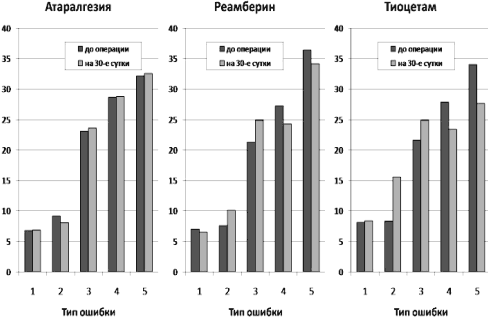
Рис. 17. Сравнение характера ошибок у обследованных
больных
при применении разных вариантов защиты когнитивных функций
Как видно, при применении Реамберина в послеоперационном периоде
удается сохранить количественно и качественно исходный уровень
высших психических функций.
Включение в комплекс интенсивной терапии в послеоперационном
периоде Тиоцетама позволяет не только сохранить когнитивные функции
в пределах исходных величин, но и достоверно их повысить с
улучшением более сложных психических функций, связанных со
способностью к аналитико-синтетической мыслительной
деятельности.
Вышеизложенное доказывает высокую эффективность Тиоцетама как
препарата, обладающего нейропротективным действием, способного
предотвратить нарушения когнитивных функций в послеоперационном
периоде у больных пожилого возраста, риск возникновения которых
связан с оперативным вмешательством и видом анестезии.
Он может быть рекомендован как препарат выбора в комплекс
интенсивной терапии в послеоперационном периоде для предупреждения
развития когнитивных дисфункций, как в раннем, так и в более
отдаленном послеоперационном периоде.
49. Беленичев И.Ф. Сидорова И.В. (2004) Тиоцетам - новый церебропротекторный и ноотропный препарат // Новости медицины и фармации. - 2004. - №13. - С.3-4.
50. Кузнецова С.М., Юрченко Ф.В. Влияние тиотриазолина на функциональное состояние ЦНС у больных, перенесших ишемический инсульт // Здоров'я України. - 2006. - №10. - С.46-49.
51. Середа Д.А. Дейниченко Ю.К., Беленичев И.Ф., Мазур И.А, Бурлай В.З. Терапевтическая эффективность нового церебропротективного и ноотропного препарата тиоцетам в остром периоде тяжелой ЧМТ // Медицина неотложных состояний. - 2006. - №2(3). - С.15-17.
52. Старченко А.А. Клиническая нейрореаниматология. СПб.: Санкт-Петербургское медицинское издательство. - 2002. - 672 с.
53. Стец В.Р., Беленичев И.Ф., Мазур И. А., Сидорова И.В. Ноотропная терапия: прошлое, настоящее и будущее. Здоров'я України. - 2004. - №18. - С.1-3.
Заключение
Когнитивные дисфункции в послеоперационном периоде привлекают
всё большее внимание, особенно у лиц пожилого и старческого
возраста, так как являются серьезной проблемой в виду опасности
развития в отдаленном послеоперационном периоде у таких больных
хронических заболеваний головного мозга.
Накопленные в настоящее время доказательные данные обуславливают
необходимость расширения профилактической нейрозащитной стратегии в
отношении предупреждения развития послеоперационной когнитивной
дисфункции у больных с повышенным риском их возникновения при
оперативных вмешательствах и общей анестезии, каковыми являются
больные пожилого возраста, у которых резервы церебральной
гемодинамики и метаболизма ограничены. Упреждающая
нейропротективная терапия наряду с адекватной коррекцией
гомеостаза, гемодинамики и газообмена имеет важнейшее практическое
значение для предотвращения повреждения нейронов или коррекции уже
возникших нарушений высших психических функций в раннем
послеоперационном периоде, когда эти изменения являются еще
потенциально обратимыми.
Влияя не только на ранних этапах, но и обеспечивая возможность
отсроченной метаболической защиты головного мозга, упреждающая
нейропротекция должна стать обязательным компонентом
анестезиологического пособия больным пожилого и старческого
возраста.
Предложенные нами методики, направленные на защиту
интеллектуальных функций с использованием тиоцетама иреамберина
являются достаточно эффективными, что позволяет нам их
рекомендовать для широкого внедрения в практическую
анестезиологию.
Препаратом выбора является Тиоцетам, который обладает не только
когнитивсберегающим действием, но и когнитиввосстанавливающим
эффектом. Такая стратегия послеоперационной интенсивной терапии
обеспечивает сохранение и даже улучшение соматического и
психического статуса, а, следовательно, и качества жизни пожилых
больных в отдаленном послеоперационном периоде.